Похожие презентации:
Восстановление карбонильных соединений, кетены, поликарбонилы
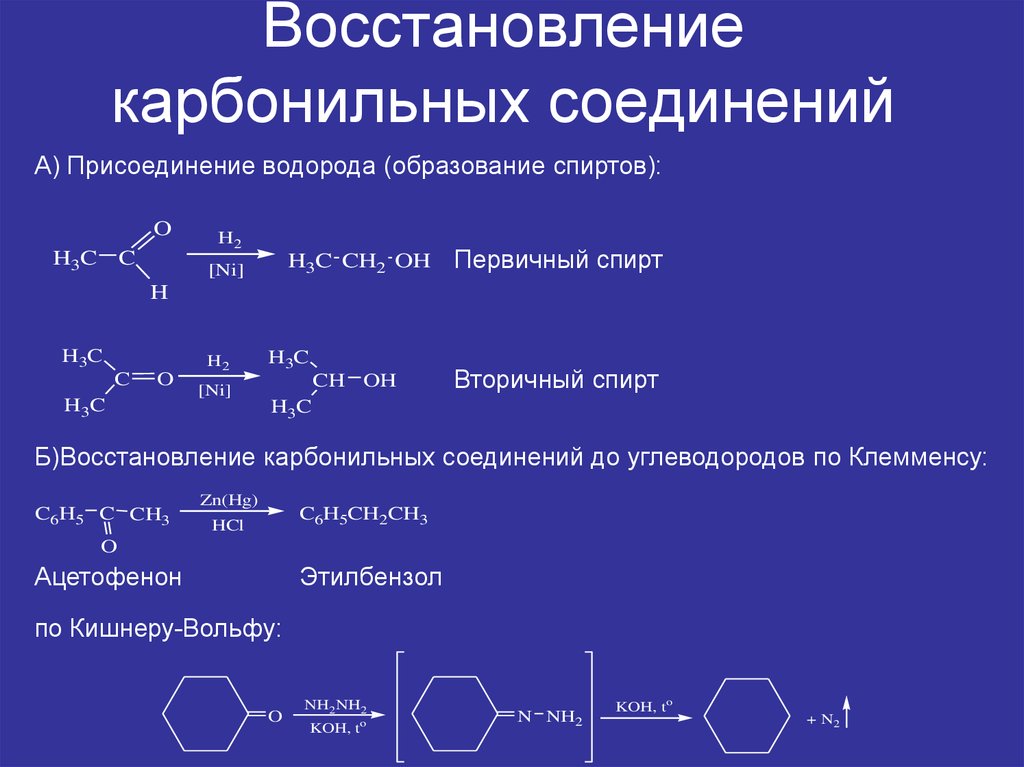
1. Восстановление карбонильных соединений
А) Присоединение водорода (образование спиртов):O
H3C
C
H2
H3C CH2 OH
[Ni]
Первичный спирт
H
H3C
C
O
H3C
H2
H3C
CH OH
[Ni]
Вторичный спирт
H3C
Б)Восстановление карбонильных соединений до углеводородов по Клемменсу:
C6H5 C CH3
Zn(Hg)
C6H5CH2CH3
HCl
O
Ацетофенон
Этилбензол
по Кишнеру-Вольфу:
O
NH2NH2
KOH, to
N NH2
KOH, to
+ N2
2.
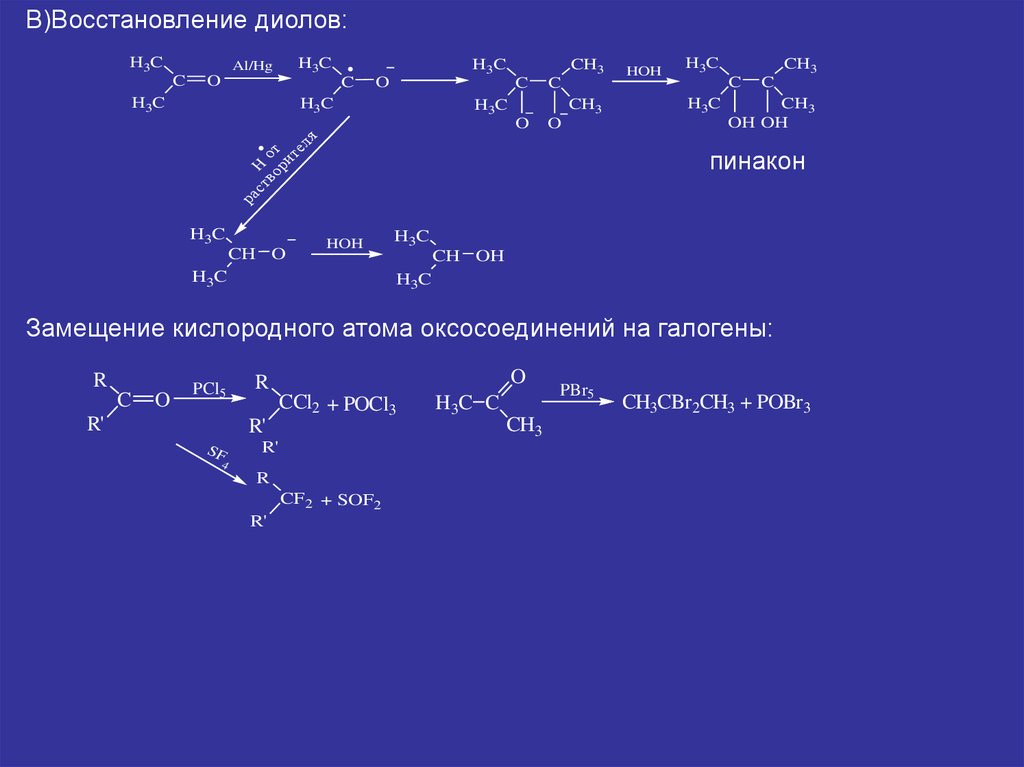
В)Восстановление диолов:H3C
H3C
Al/Hg
C
O
H3C
C
H3C
CH3
O
H3C
C
C
O
O
CH3
H3C
CH3
C
H3C
C
CH3
OH OH
ст H
во от
ри
те
л
я
H3C
HOH
ра
пинакон
H3C
CH O
HOH
H3C
H3C
CH OH
H3C
Замещение кислородного атома оксосоединений на галогены:
R
C
O
PCl5
R'
R'
SF
O
R
CCl2 + POCl3
R'
4
R
CF2 + SOF2
R'
H3C C
CH3
PBr5
CH3CBr2CH3 + POBr 3
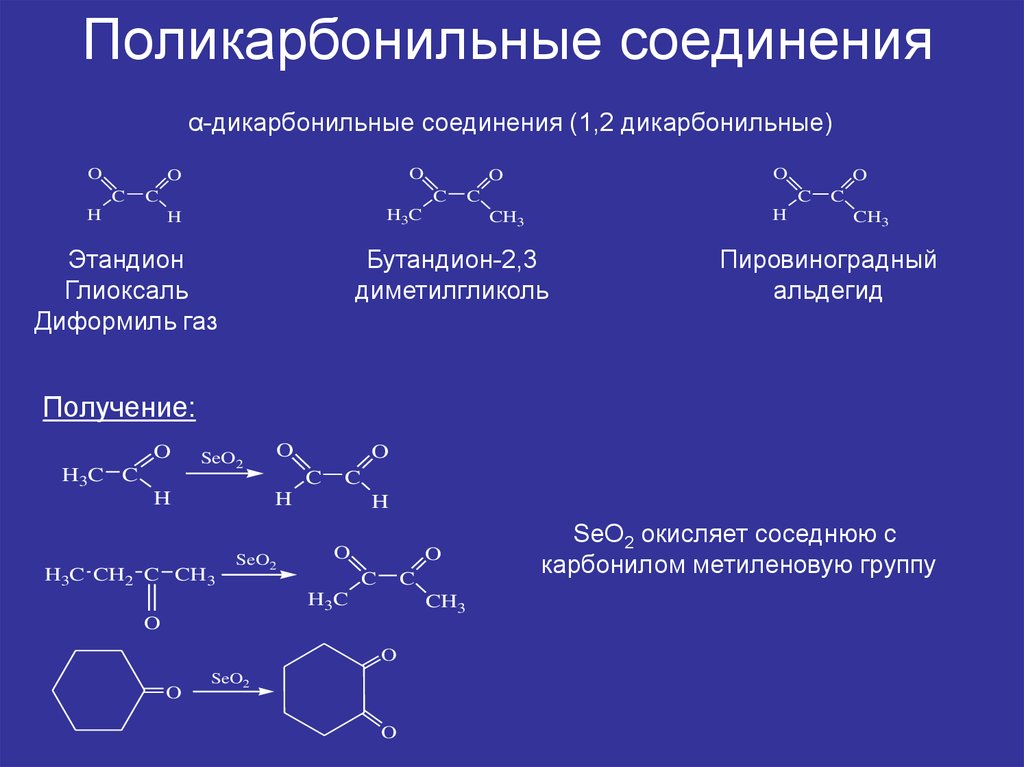
3. Поликарбонильные соединения
α-дикарбонильные соединения (1,2 дикарбонильные)O
C
O
O
H
H3C
C
H
C
Этандион
Глиоксаль
Диформиль газ
O
O
CH3
H
C
O
C
Бутандион-2,3
диметилгликоль
C
CH3
Пировиноградный
альдегид
Получение:
O
H3C C
SeO2
H
O
O
C
C
H
H3C CH2 C CH3
SeO2
H
O
O
C
C
H 3C
CH3
O
O
O
SeO2
O
SeO2 окисляет соседнюю с
карбонилом метиленовую группу
4.
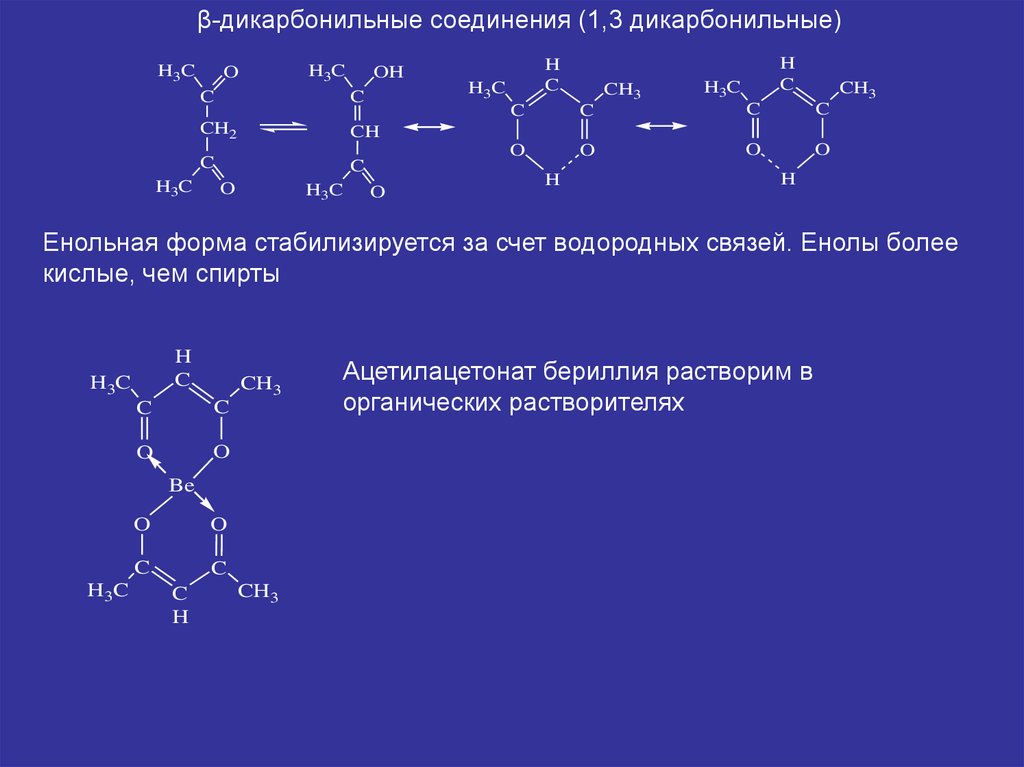
β-дикарбонильные соединения (1,3 дикарбонильные)H3C
H3C
H3C
O
H3C
C
C
CH2
CH
C
C
O
H3C
H
C
OH
O
CH3
H
C
H3C
CH3
C
C
C
C
O
O
O
O
H
H
Енольная форма стабилизируется за счет водородных связей. Енолы более
кислые, чем спирты
H
C
H3C
CH3
C
C
O
O
Be
H3C
O
O
C
C
C
H
CH3
Ацетилацетонат бериллия растворим в
органических растворителях
5.
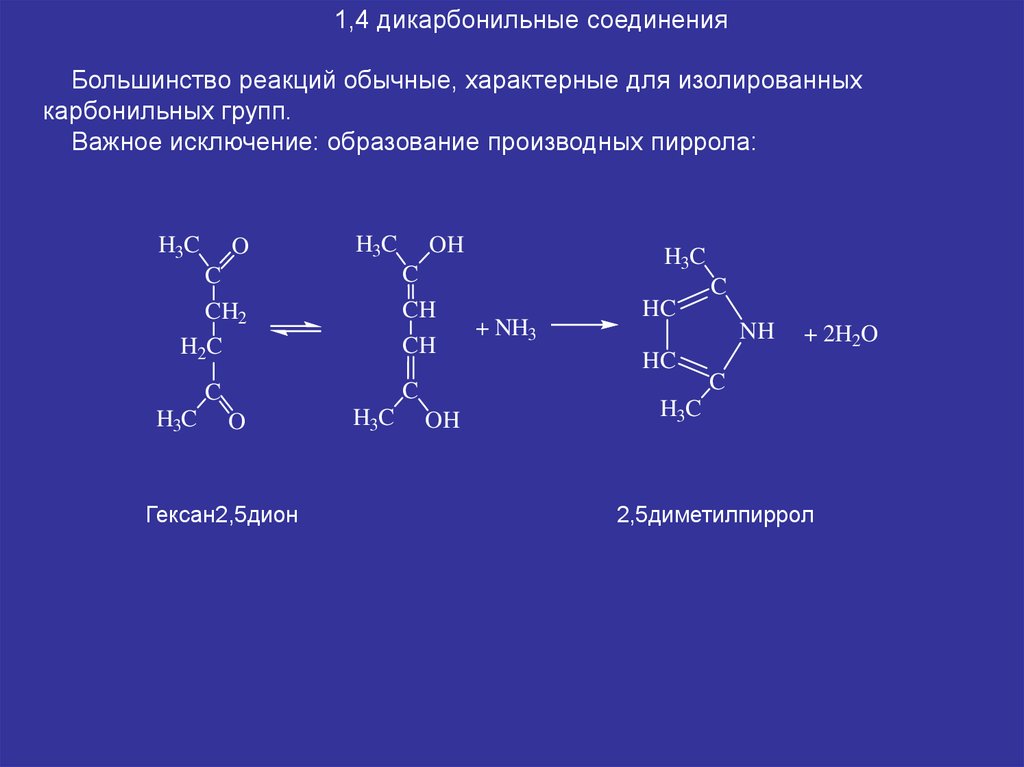
1,4 дикарбонильные соединенияБольшинство реакций обычные, характерные для изолированных
карбонильных групп.
Важное исключение: образование производных пиррола:
H3C
O
H3C
C
CH
CH
C
CH2
H2C
C
C
H3C
OH
O
Гексан2,5дион
H3C
OH
H3C
+ NH3
HC
C
NH
HC
+ 2H2O
C
H3C
2,5диметилпиррол
6.
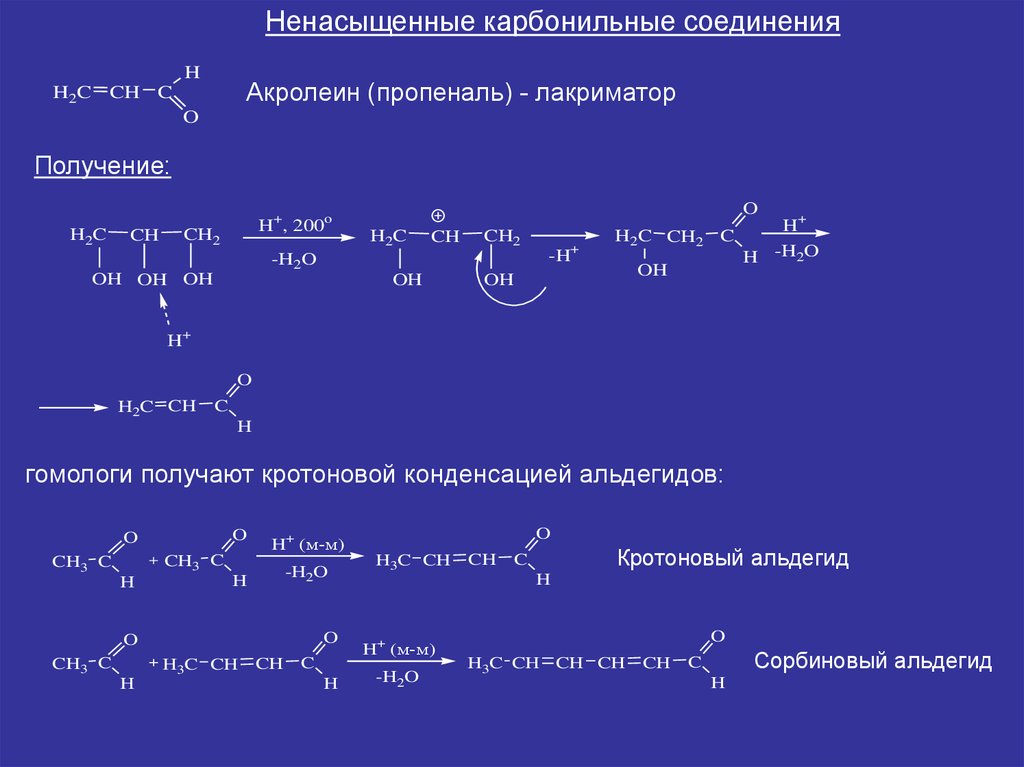
Ненасыщенные карбонильные соединенияH
Акролеин (пропеналь) - лакриматор
H2C CH C
O
Получение:
H2C
CH
H+, 200o
CH2
O
H2C
CH
CH2
-H2O
OH OH OH
OH
-H+
H2C CH2 C
OH
OH
H+
H -H2O
H+
O
H2C CH
C
H
гомологи получают кротоновой конденсацией альдегидов:
O
O
H+ (м-м)
H
-H2O
+ CH3 C
CH3 C
H
O
+ H C CH
3
CH3 C
H
CH
O
H3C CH
Кротоновый альдегид
C
H
O
H+ (м-м)
H
-H2O
C
CH
O
H3C CH CH CH
CH
Сорбиновый альдегид
C
H
7.
OH
C
H3C
C
+
H
O
OH-
HOH2C CH2 C CH3
H3C
to
-H2O
H2C CH2 C CH3
O
Бутен-3-он 2
метилвинил кетон
O
Химические свойства α,β-ненасыщенных карбонильных соединений
1) HCN и галогены с альдегидной группой реагируют быстрее, чем с кратной
С=С-связью
H
O
CH
H3C CH
C
H3C CH
+ HCN
CH
H
C OH
C
Циангидрин кротонового альдегида
N
В кетонах связь С=О прочнее:
H2C CH
C CH3 + HCN
N
C CH2 CH2 C CH3
O
O
Присоединение идет против правила Морковникова по механизму 1,4присоединения (как в диенах):
H2C CH
C CH3 + HCN
O
N
C CH
CH CH CH3
OH
CH2 CH2 C CH
3
CN
O
8.
Аналогично присоединяется реактив Гриньяра, вода (в кислой среде),галогенводороды.
Написать реакции самостоятельно!
Непредельные альдегиды и кетоны легко полимеризуются
Муре объяснил механизм окисления и полимеризации акролеина:
C
CH2 CH
O
O
O
+ Fe
3+
CH2 CH
2+
+ Fe
C
H
H
O
O
CH2 CH C
O
O
+
O O
CH2 CH
C
CH C
O O
O
CH2 CH C
H
акролеин
2CH2 CH COOH
O OH
акриловая
кислота
O
O
H2C
CH2 CH C
+O2
CH2 CH C
CH2 CH C
-H+
+ n CH2
CH
H2C
CH C CH2 CH
C
H
CH2 CH
C
O
H
Ингибиторы окисления – фенолы, гидрохинон
CH2 CH
C
O
H
CH2 CH
C
O
H
C
O
H
O
*
n-1
9.
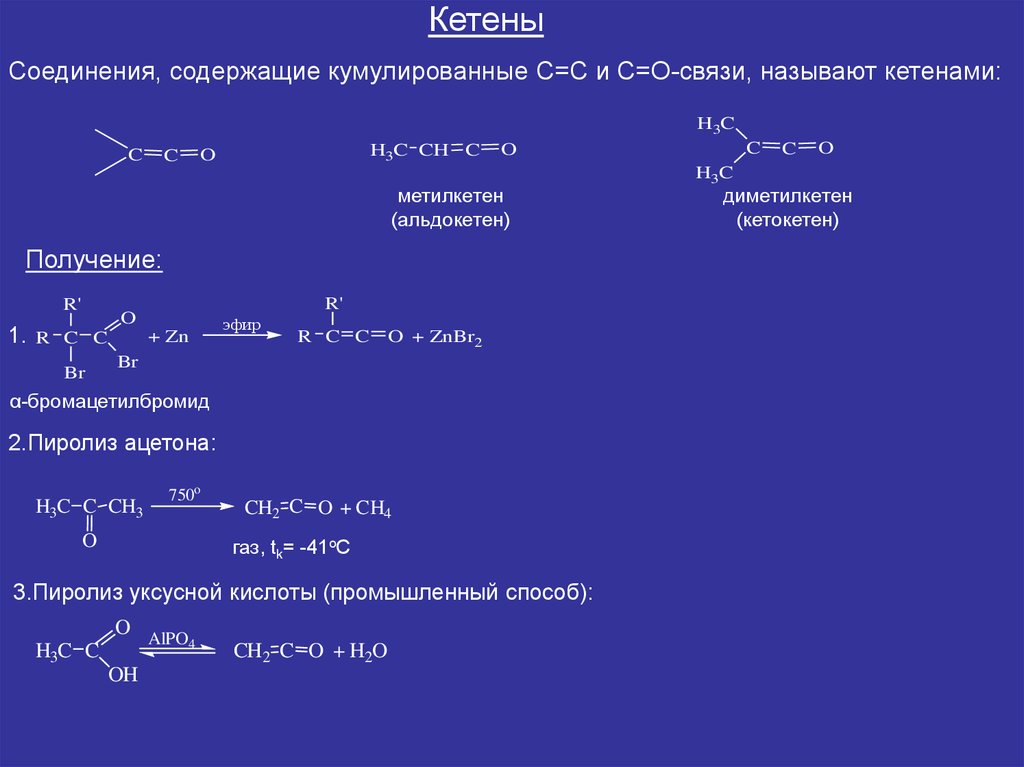
КетеныСоединения, содержащие кумулированные С=С и С=О-связи, называют кетенами:
H3C
C
C
H3C CH C
O
метилкетен
(альдокетен)
Получение:
R'
1.
R'
O
+ Zn
R C C
Br
эфир
R C C
O + ZnBr2
Br
α-бромацетилбромид
2.Пиролиз ацетона:
H3C C CH3
750o
O
CH2 C O + CH4
газ, tk= -41oC
3.Пиролиз уксусной кислоты (промышленный способ):
H3C C
O AlPO
4
OH
CH2 C O + H2O
C
O
H3C
C
O
диметилкетен
(кетокетен)
10.
4. Из галогенангидридов карбоновых кислот:H
O
C
(C2H5)3N
C O + (C2H5)3N+HCl-
эфир
Cl
Хлорангидрид циклопентан
-карбоновой кислоты
Тетраметилкетен
Химические свойства кетенов
Кетены сильные ацилирующие агенты
H2O
CH3 C OH
O
O
H3C C
OH
CH3 C O CCH3
O
CH2 C O
Уксусный ангидрид
O
CH3CH2OH
CH3 C O CH2CH3
Этилацетат
O
CH3NH2
CH3 C NHCH3
O
NH3
CH3 C NH2
O
N-метиламид уксусной кислоты
11.
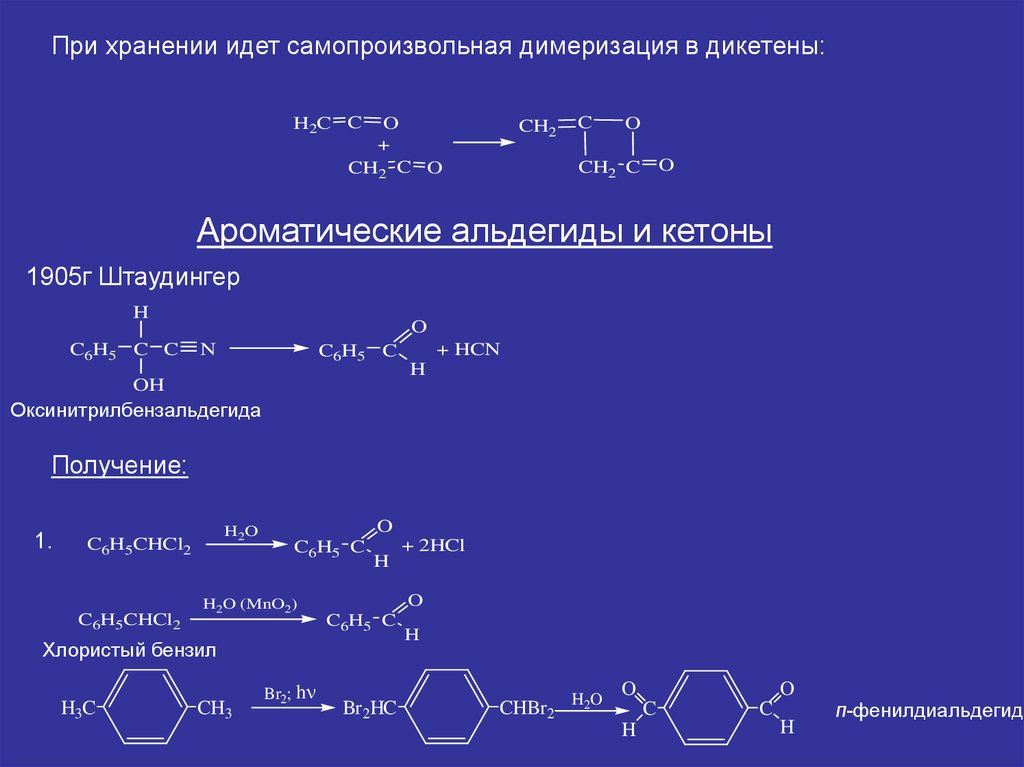
При хранении идет самопроизвольная димеризация в дикетены:H2C C
O
+
CH2 C O
CH2
C
O
CH2 C
O
Ароматические альдегиды и кетоны
1905г Штаудингер
H
C6H5 C C
O
N
C6H5 C
OH
+ HCN
H
Оксинитрилбензальдегида
Получение:
1.
H2O
C6H5CHCl2
C6H5CHCl2
O
C6H5 C
H2O (MnO2)
H
O
C6H5 C
Хлористый бензил
H3C
CH3
Br2; h
+ 2HCl
Br2HC
H
O
CHBr2 H2O
C
H
O
C
H
п-фенилдиальдегид
12.
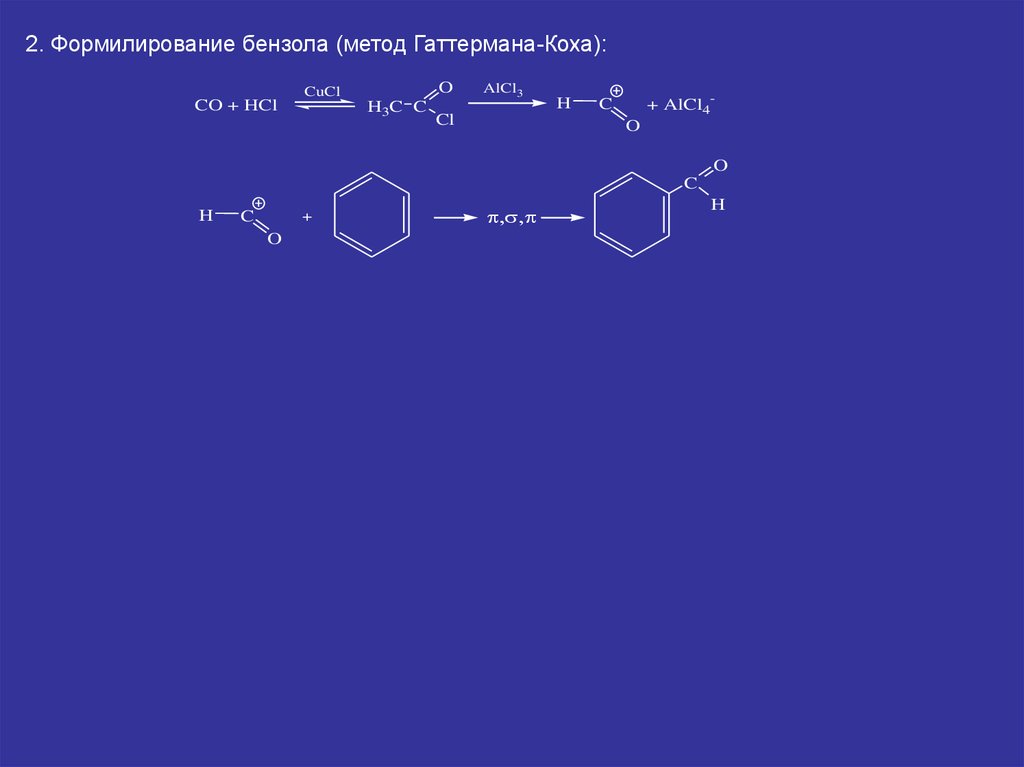
2. Формилирование бензола (метод Гаттермана-Коха):O
CuCl
CO + HCl
H3C C
AlCl3
Cl
H
+ AlCl4-
C
O
O
C
H
C
+
O
H
13.
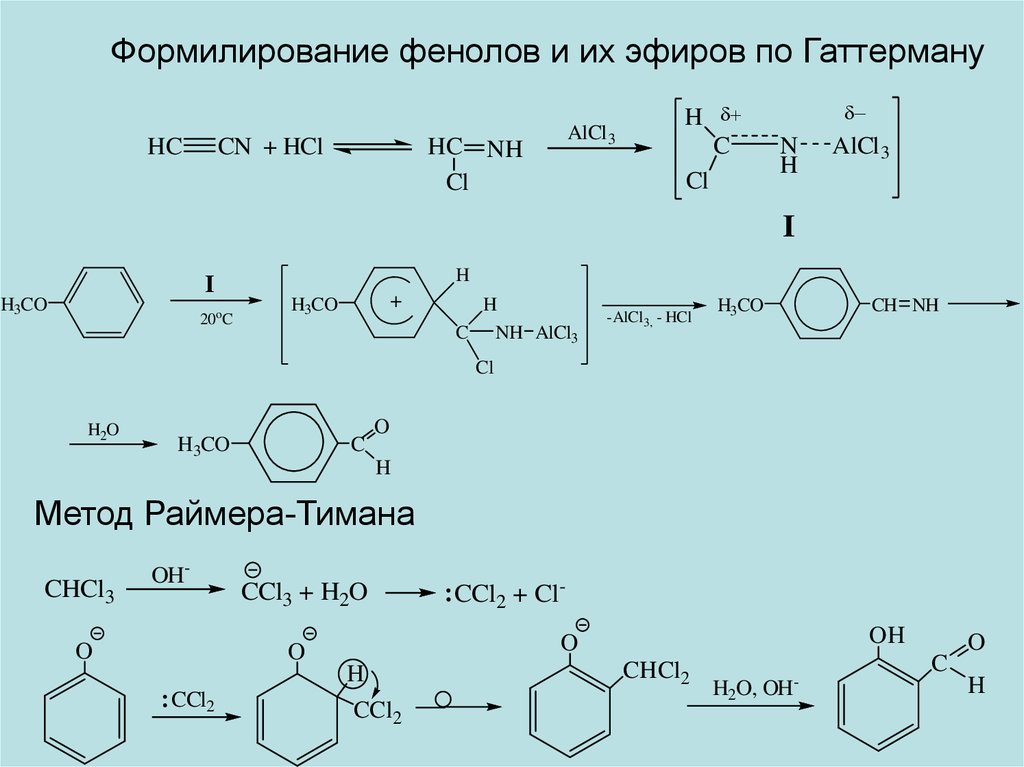
Формилирование фенолов и их эфиров по ГаттермануHC
CN + HCl
AlCl 3
HC NH
Cl
H
C
Cl
N
H
AlCl 3
I
I
H3CO
20oC
H
+
H3CO
H
C NH AlCl3
-AlCl 3, - HCl
H3CO
CH NH
Cl
H2O
H3CO
C
O
H
Метод Раймера-Тимана
CHCl3
OH-
O
CCl3 + H2O
OH
O
O
H
CCl2
CCl2 + Cl-
CCl2
CHCl2
H2O, OH-
C
O
H
14.
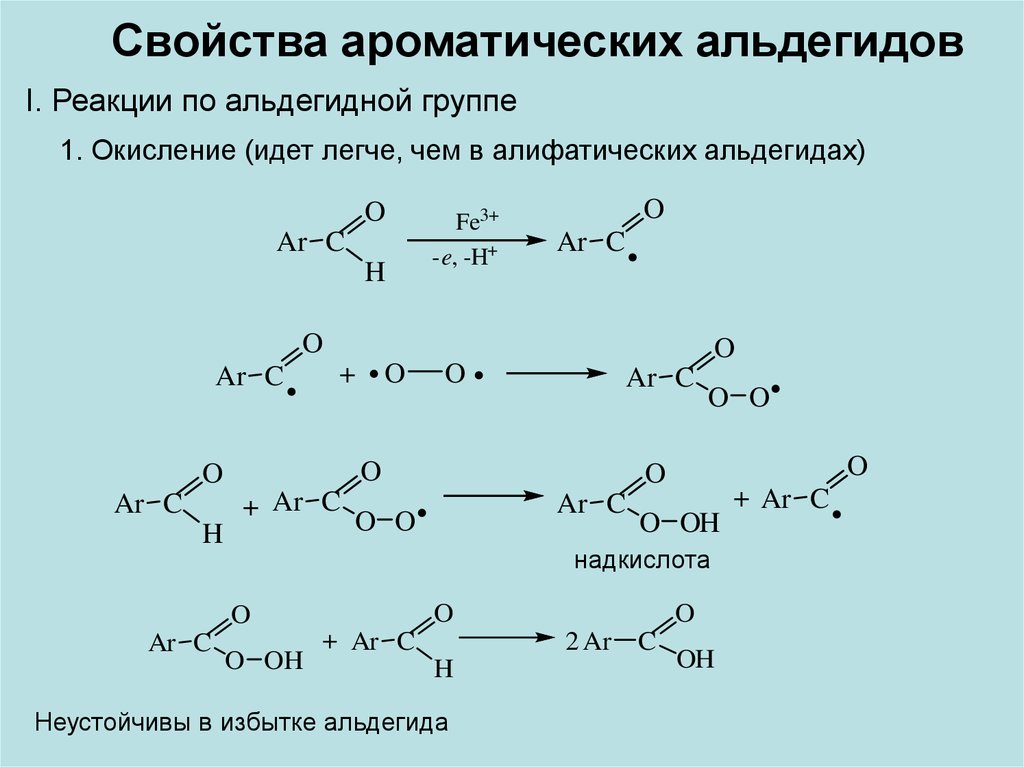
Свойства ароматических альдегидовI. Реакции по альдегидной группе
1. Окисление (идет легче, чем в алифатических альдегидах)
O
Ar C
H
Fe3+
-e, -H+
O
Ar C
O
Ar C
+
+ Ar C
H
Ar C
O O
O
O
Ar C
O O
O OH
надкислота
O
O
Ar C
O
O
O
Ar C
O
O
O OH
+ Ar C
O
2 Ar
H
Неустойчивы в избытке альдегида
C
OH
+ Ar C
15.
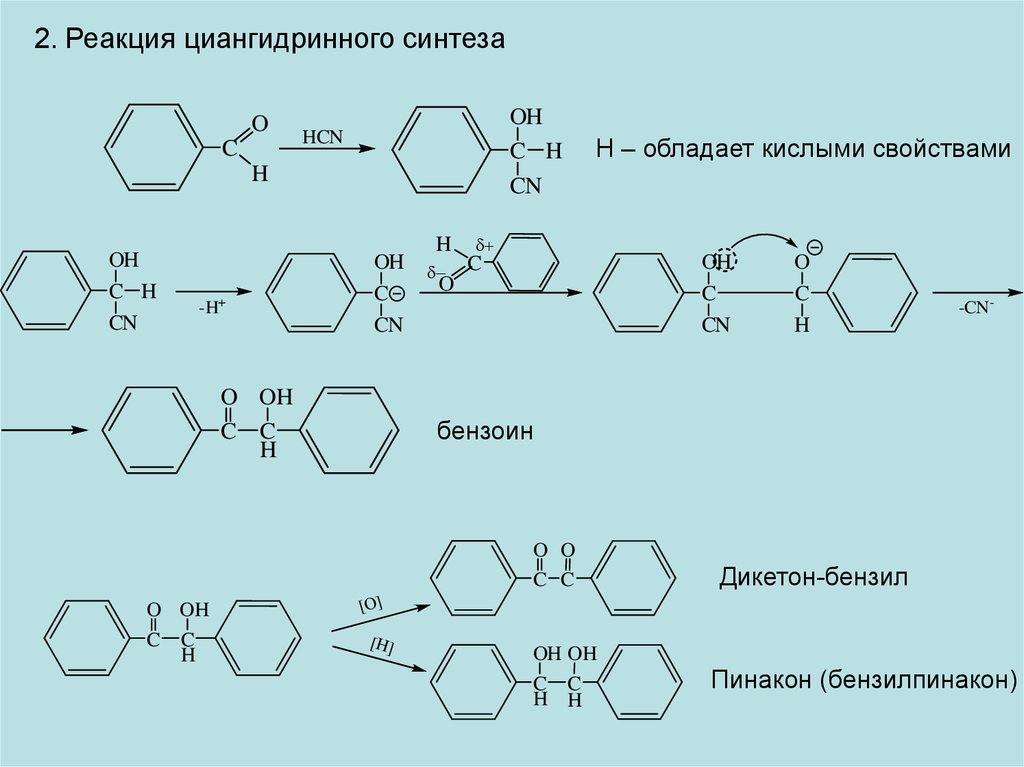
2. Реакция циангидринного синтезаO
C
OH
C H
CN
HCN
H
OH
C H
CN
-H+
OH
C
CN
O OH
C C
H
H
Н – обладает кислыми свойствами
OH
C
CN
C
O
-CN-
бензоин
O O
C C
O OH
C C
H
O
C
H
Дикетон-бензил
[O]
[H]
OH OH
C C
H H
Пинакон (бензилпинакон)
16.
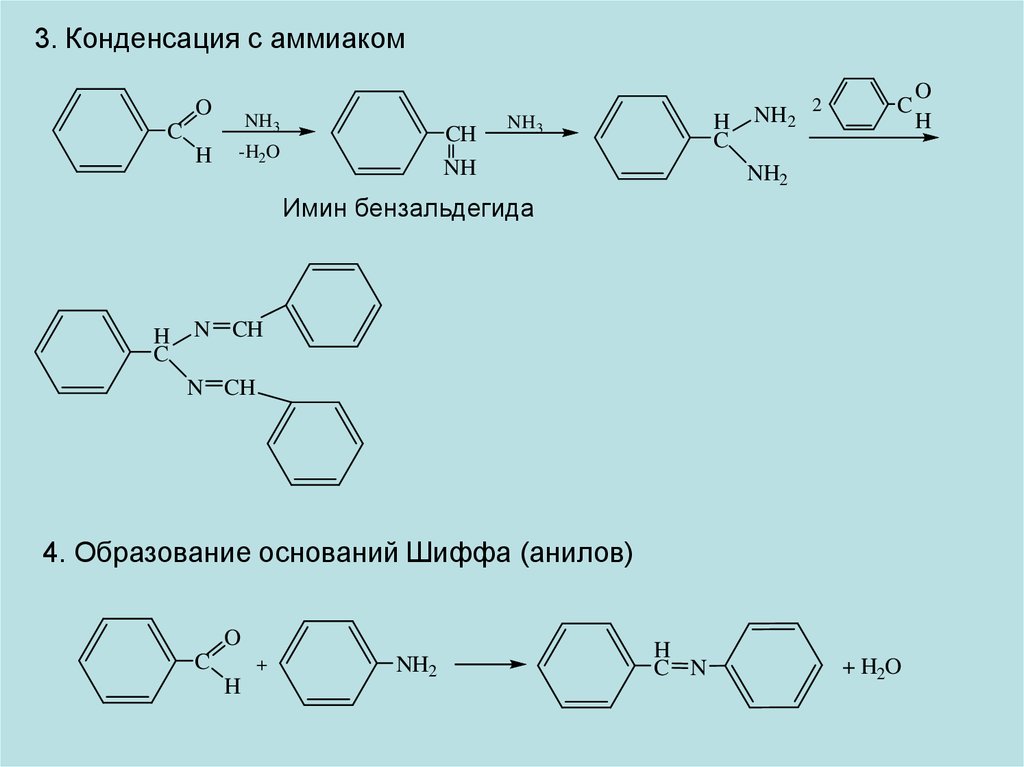
3. Конденсация с аммиакомO
NH3
C
H
CH
NH
-H2O
H
C
NH3
NH2
2
C
NH2
Имин бензальдегида
H
C
N CH
N CH
4. Образование оснований Шиффа (анилов)
O
C
+
H
NH2
H
C N
+ H2O
O
H
17.
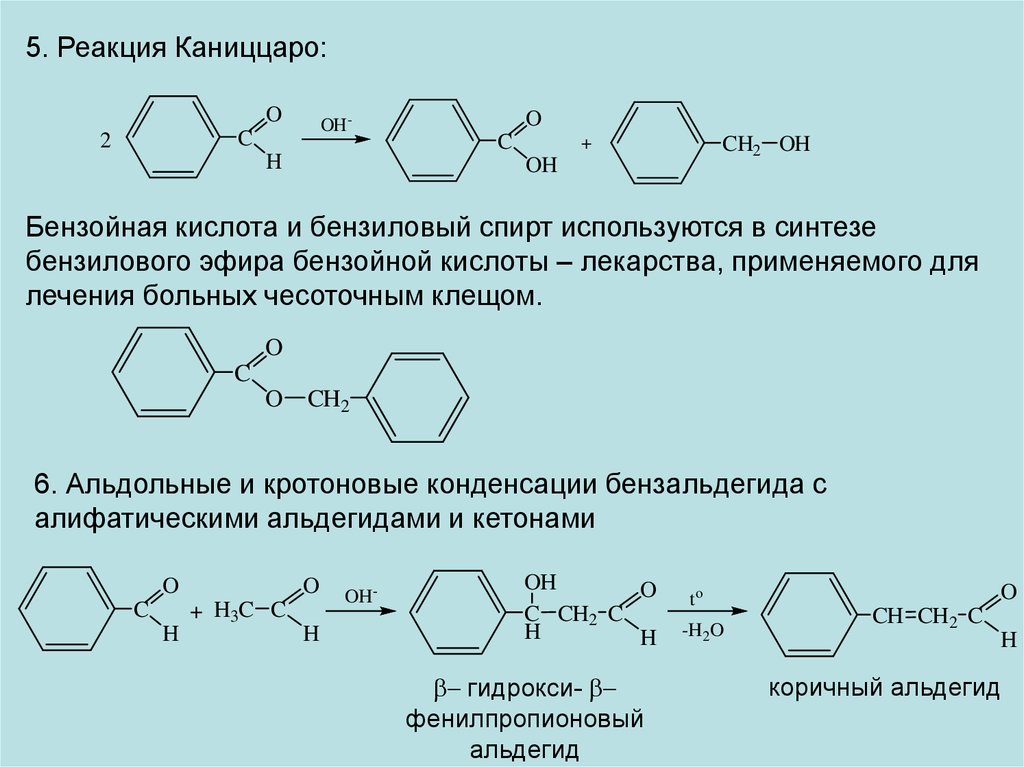
5. Реакция Каниццаро:O
OH-
C
2
H
O
C
CH2 OH
+
OH
Бензойная кислота и бензиловый спирт используются в синтезе
бензилового эфира бензойной кислоты – лекарства, применяемого для
лечения больных чесоточным клещом.
O
C
O
CH2
6. Альдольные и кротоновые конденсации бензальдегида с
алифатическими альдегидами и кетонами
O
C
H
O
+ H3C C
H
OH-
OH
O
C CH2 C
H
H
b гидрокси- b
фенилпропионовый
альдегид
to
-H2O
O
CH CH2 C
H
коричный альдегид
18.
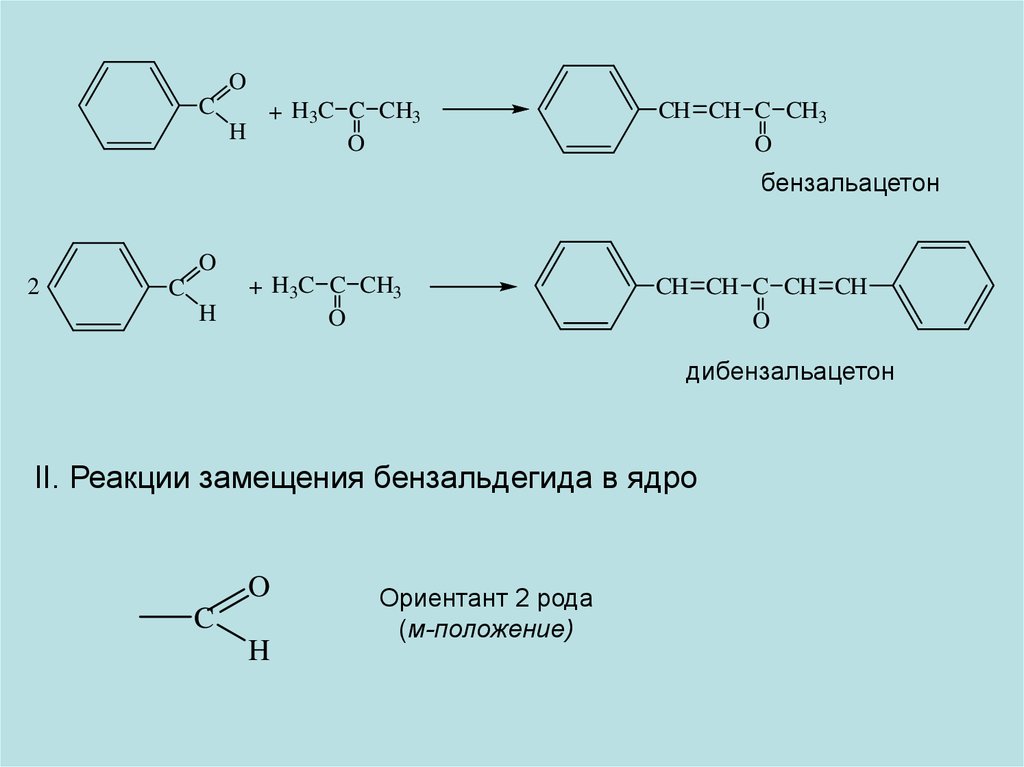
OC
+ H3C C CH3
H
O
CH CH C CH3
O
бензальацетон
O
2
C
H
+ H3C C CH3
O
CH CH C CH CH
O
дибензальацетон
II. Реакции замещения бензальдегида в ядро
O
C
H
Ориентант 2 рода
(м-положение)
19.
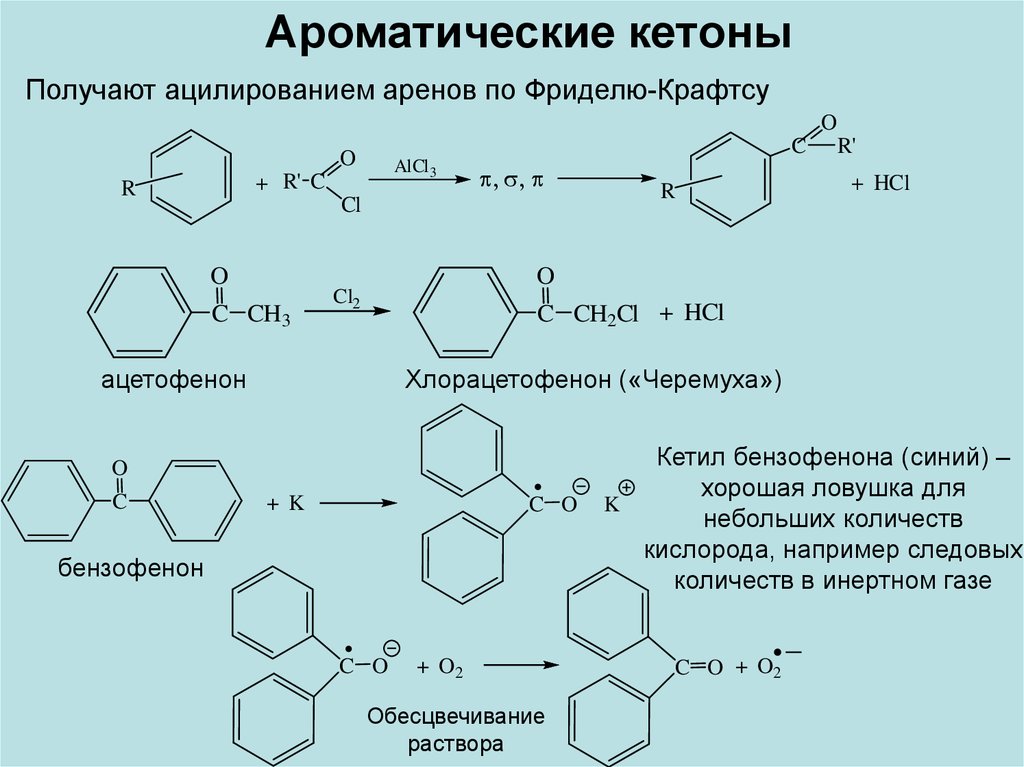
Ароматические кетоныПолучают ацилированием аренов по Фриделю-Крафтсу
O
C
O
AlCl 3
+ R' C
R
Cl
O
C CH3
+ HCl
O
Cl2
C CH2Cl + HCl
ацетофенон
Хлорацетофенон («Черемуха»)
O
C
R
R'
+ K
C O
бензофенон
C O
+ O2
Обесцвечивание
раствора
Кетил бензофенона (синий) –
хорошая ловушка для
K
небольших количеств
кислорода, например следовых
количеств в инертном газе
C O + O2
20.
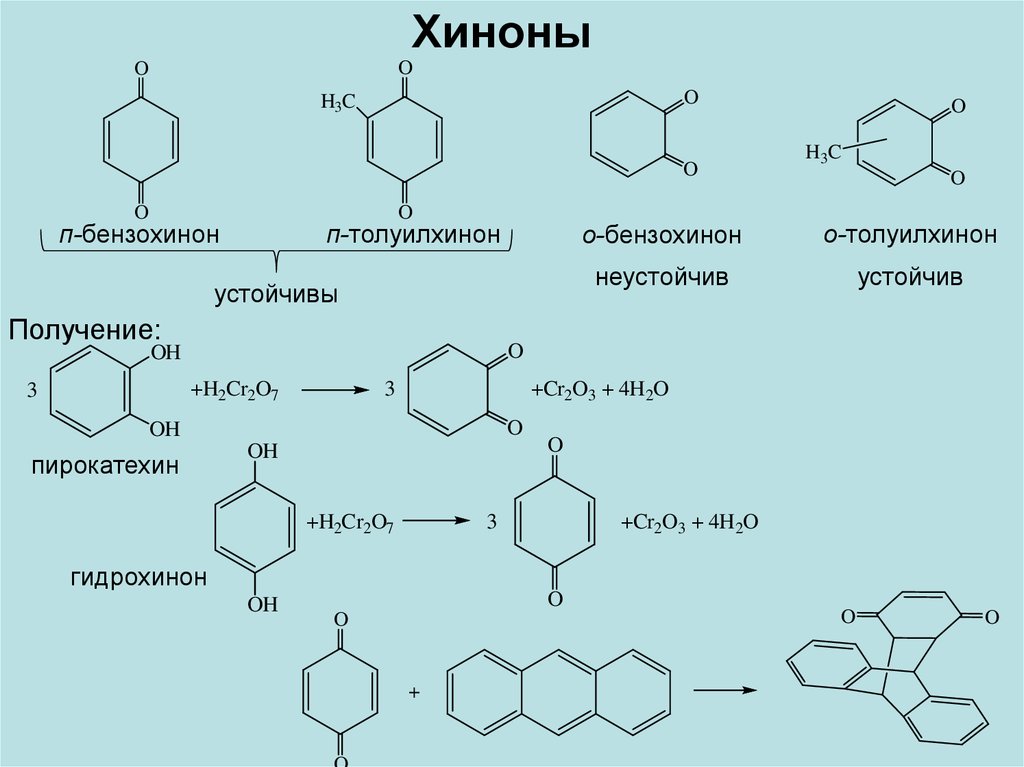
ХиноныO
O
O
H3C
O
O
O
п-бензохинон
п-толуилхинон
устойчивы
Получение:
H3C
O
о-бензохинон
о-толуилхинон
неустойчив
устойчив
O
OH
+H2Cr2O7
3
O
3
+Cr2O3 + 4H2O
O
OH
пирокатехин
OH
+H2Cr2O7
O
3
+Cr2O3 + 4H2O
гидрохинон
OH
O
O
+
O
O
21.
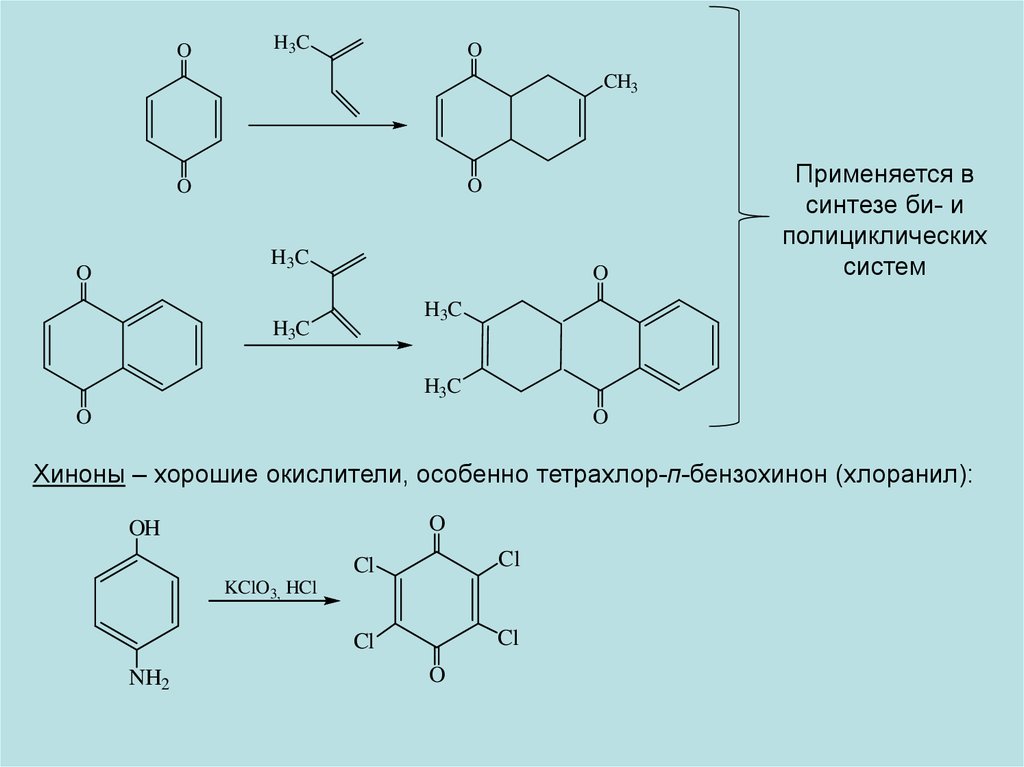
OH3C
O
CH3
O
O
H3C
O
O
Применяется в
синтезе би- и
полициклических
систем
H 3C
H3C
H3C
O
O
Хиноны – хорошие окислители, особенно тетрахлор-п-бензохинон (хлоранил):
O
OH
Cl
Cl
Cl
Cl
KClO3, HCl
NH2
O
22.
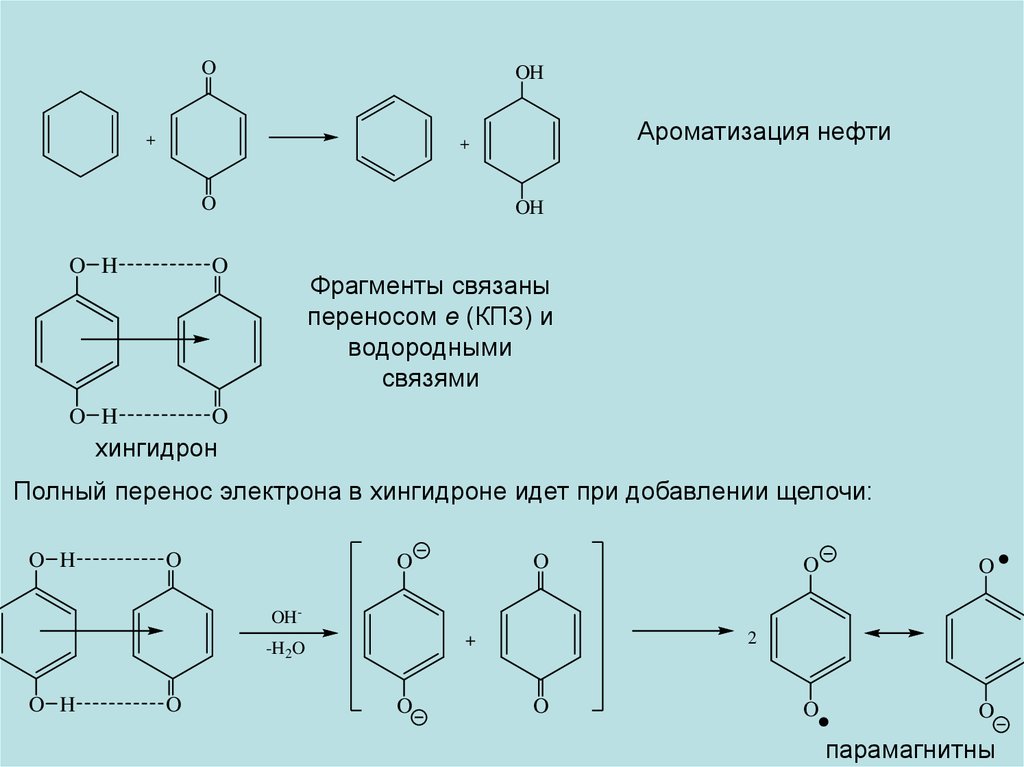
OOH
+
Ароматизация нефти
+
O
O H
O
O H
O
OH
Фрагменты связаны
переносом е (КПЗ) и
водородными
связями
хингидрон
Полный перенос электрона в хингидроне идет при добавлении щелочи:
O H
O
O
O
O
O
O
O
OH-
O H
O
2
+
-H2O
O
O
парамагнитны
23.
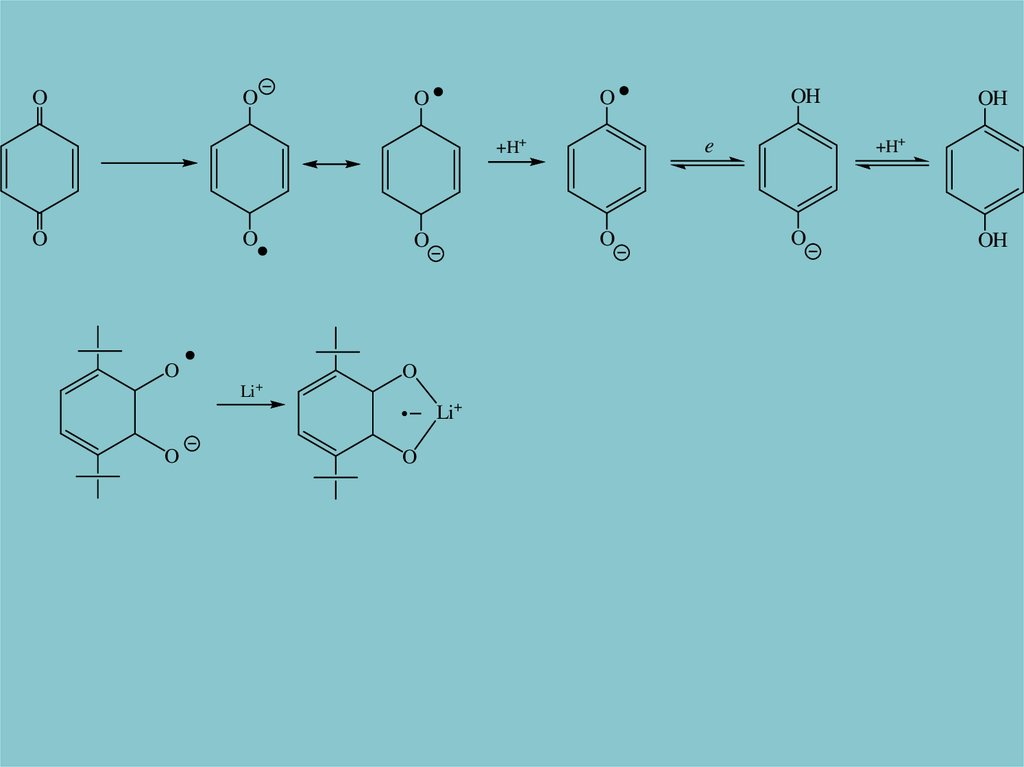
OO
+H+
O
O
O
Li +
O
O
Li+
OH
+H+
e
O
O
O
OH
O
O
O
OH



 Химия
Химия