Похожие презентации:
Теоретические основы применения органических реагентов в качественном анализе. (Лекция 8)
1.
Лекция №8Теоретические основы применения
органических реагентов
в качественном анализе
Для студентов 2 курса фармацевтического факультета
С.Н.Дильмагамбетов
________________________________________________________
Профессор кафедры химических дисциплин
ЗКГМУ им. Марата Оспанова
2. Органические реагенты
Органические реагенты – это органические соединения (мономерныеили полимерные) различных классов, применяющиеся для:
•качественного или количественного определения органических и
неорганических веществ;
•разделения;
•концентрирования;
•маскирования и других вспомогательных или предварительных
операций, предшествующих и сопровождающих определение веществ
любыми методами.
С древнейших времен для обнаружения некоторых веществ (например,
серебра, железа) применяли природные вещества (уксус, отвар
чернильных орешков, винный камень, камфора, яичный желток,
дубовая кора, хмель и др.).
С 30-х гг. ХХ в. органические реагенты становятся основой химических
методов анализа. Синтезируются новые органические реагенты,
например, N-бензоил-N-фенилгидроксиламин, 8-гидроксихинолин,
арсеназо, торон, интенсивно изучается механизм их действия.
3.
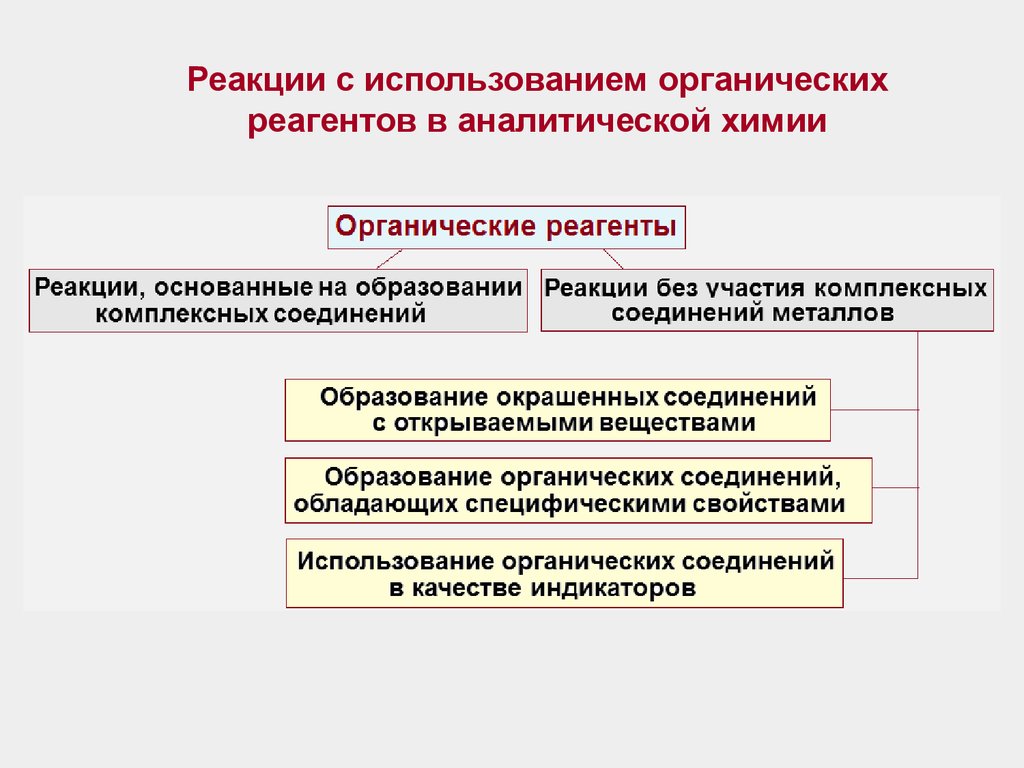
Реакции с использованием органическихреагентов в аналитической химии
4. Реакции, основанные на образовании комплексных соединений
При таких аналитических реакциях преимущественно применяютсяциклообразующие лиганды, способные к построению хелатных комплексов,
особенно – внутрикомплексных соединений и комплексонатов металлов.
Молекулы подобных лигандов должны содержать функциональноаналитические группы (ФАГ), способные образовывать с атомами металловкомплексообразователей относительно прочные координационные связи, чаще
всего – устойчивые металлоциклы.
Функционально-аналитические группировки (в аналитической химии) совокупность групп атомов в органических аналитических реагентах,
обеспечивающая образование комплексного соединения с ионами металла.
5.
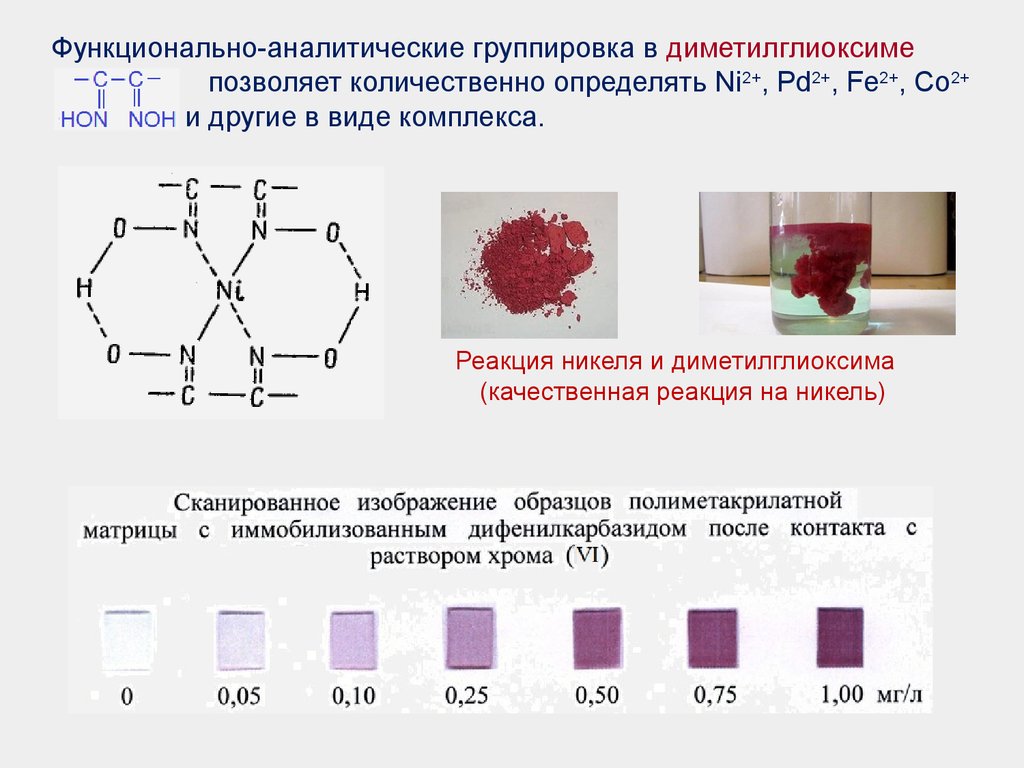
Функционально-аналитические группировка в диметилглиоксимепозволяет количественно определять Ni2+, Pd2+, Fe2+, Со2+
и другие в виде комплекса.
Реакция никеля и диметилглиоксима
(качественная реакция на никель)
6.
Наличие ФАГ в органической молекуле является необходимым, но не всегдадостаточным условием, позволяющим использовать данное органическое
соединение в качестве аналитического реагента.
Требуется во многих случаях также присутствие аналитико-активных групп
(ААГ), обычно не образующих непосредственно координационные связи с
центральным атомом металла-комплексообразователя, но усиливающих
аналитический эффект ФАГ. Сочетание ФАГ, ААГ вместе с центральным атомом
определяемого металла дает «аналитический узел», играющий решающую роль
в соответствующей аналитической реакции.
К некоторым основным критериям применения внутрикомплексных соединений
в химическом анализе относятся:
а) малая растворимость комплексного соединения в тех случаях, когда их
используют для осаждения ионов металлов из растворов;
б) наличие интенсивной характерной окраски образующихся комплексов, если
их используют для открытия или определения ионов металлов по окраске
раствора;
в) достаточно высокая устойчивость образующихся комплексов (большие
значения констант устойчивости).
7.
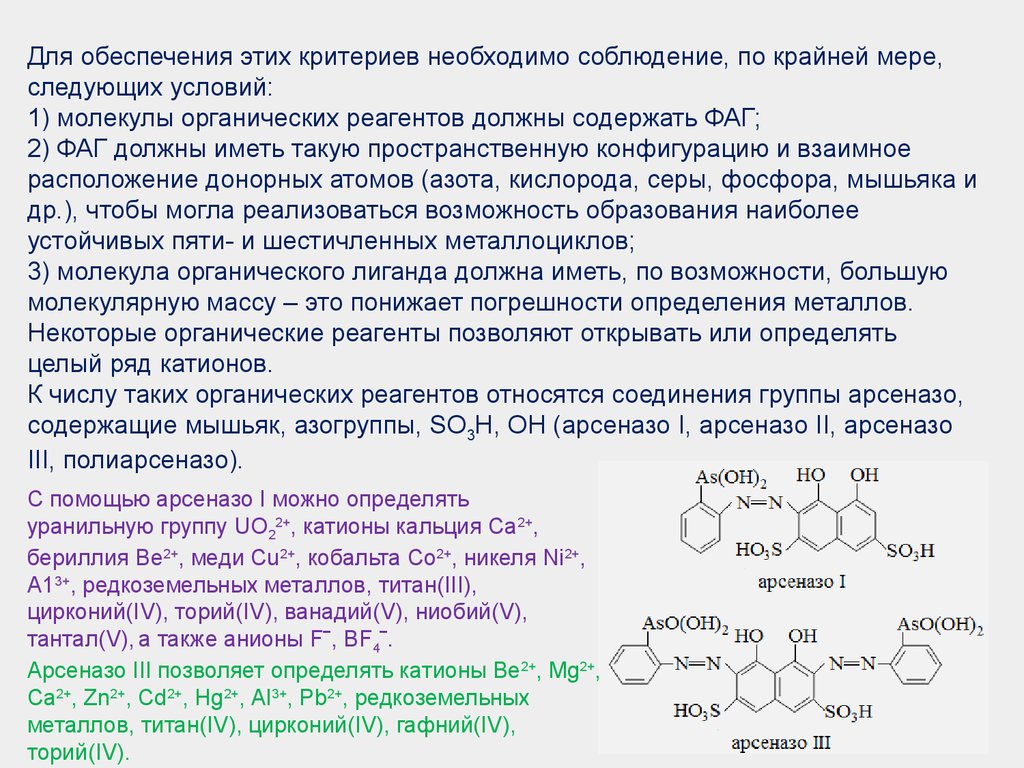
Для обеспечения этих критериев необходимо соблюдение, по крайней мере,следующих условий:
1) молекулы органических реагентов должны содержать ФАГ;
2) ФАГ должны иметь такую пространственную конфигурацию и взаимное
расположение донорных атомов (азота, кислорода, серы, фосфора, мышьяка и
др.), чтобы могла реализоваться возможность образования наиболее
устойчивых пяти- и шестичленных металлоциклов;
3) молекула органического лиганда должна иметь, по возможности, большую
молекулярную массу – это понижает погрешности определения металлов.
Некоторые органические реагенты позволяют открывать или определять
целый ряд катионов.
К числу таких органических реагентов относятся соединения группы арсеназо,
содержащие мышьяк, азогруппы, SO3H, ОН (арсеназо І, арсеназо ІІ, арсеназо
ІІІ, полиарсеназо).
С помощью арсеназо I можно определять
уранильную группу UO22+, катионы кальция Са2+,
бериллия Ве2+, меди Сu2+, кобальта Со2+, никеля Ni2+,
А13+, редкоземельных металлов, титан(III),
цирконий(IV), торий(IV), ванадий(V), ниобий(V),
тантал(V), а также анионы F‾, BF4‾.
Арсеназо III позволяет определять катионы Ве2+, Mg2+,
Ca2+, Zn2+, Cd2+, Hg2+, Al3+, Pb2+, редкоземельных
металлов, титан(IV), цирконий(IV), гафний(IV),
торий(IV).
8.
Реакции без участия комплексных соединений металловОбразование окрашенных соединений с открываемыми
веществами
Дифениламин (С6Н5)2NH при реакциях в кислой среде с соединениями,
содержащими окислители (NO2‾, NO3‾, BrO3‾, CrO42-, MnO4‾, Fe3+ и др.),
окрашивает растворы в синий цвет вследствие необратимого окисления
дифениламина в синий дифенилдифенохинондиимин.
Эта реакция – фармакопейная, используется для открытия, например,
нитратов и нитритов. С нитратами реакция протекает по схеме:
Нитраты образуют с антипирином в сильно кислой среде (концентрированная
серная кислота) ярко-красный нитроантипирин по схеме:
9.
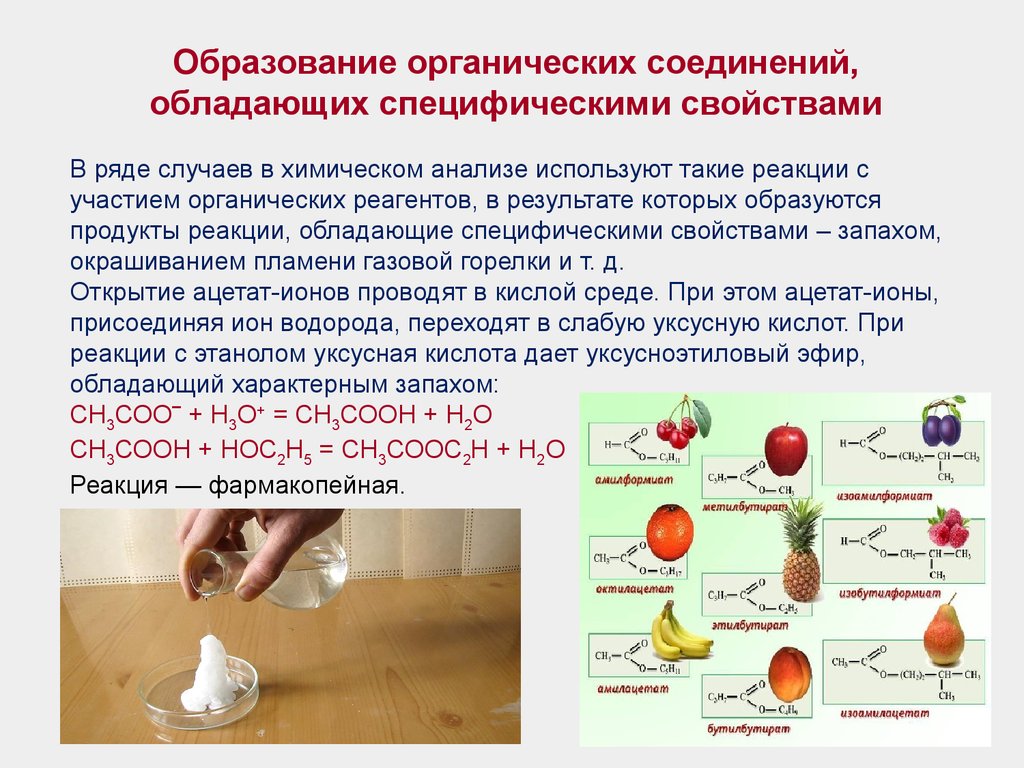
Образование органических соединений,обладающих специфическими свойствами
В ряде случаев в химическом анализе используют такие реакции с
участием органических реагентов, в результате которых образуются
продукты реакции, обладающие специфическими свойствами – запахом,
окрашиванием пламени газовой горелки и т. д.
Открытие ацетат-ионов проводят в кислой среде. При этом ацетат-ионы,
присоединяя ион водорода, переходят в слабую уксусную кислот. При
реакции с этанолом уксусная кислота дает уксусноэтиловый эфир,
обладающий характерным запахом:
СН3СОО‾ + Н3О+ = СН3СООН + Н2О
СН3СООН + НОС2Н5 = СН3СООС2Н + Н2О
Реакция — фармакопейная.
10.
Летучие сложные эфиры борной кислоты окрашивают пламя в зеленый цвет.
В присутствии серной кислоты и этанола борат-ионы образуют
летучие сложные эфиры:
В4О72- + 2Н+ + 5Н2О = 4Н3ВО3
Н3ВО3 + 3C2HSOH → B(OC2H5)3 + ЗН2О
При поднесении пламени к чашке или
тиглю, в которых протекает эта реакция,
продукты сгорания окрашивают пламя в
зеленый цвет.
Реакция – фармакопейная.
11.
Использование органических соединений вкачестве индикаторов
ИНДИКАТОРЫ (от лат. indicator – указатель) – вещества, позволяющие
следить за составом среды или за протеканием химической реакции.
12.
ФенолфталеинМеняет окраску в зависимости от уровня рН среды. Он способен
существовать в нескольких формах, которые превращаются одна в другую
при изменении кислотности среды.
Форма
pH
Реакция среды
Цвет
In
H2In
In2−
In(OH)3−
0-3
4-7
8-10
11-14
сильнокислая
слабокислая и
нейтральная
щелочная
сильнощелочна
я
Оранжевый
Бесцветный
Розовый
или малиновый
Бесцветный








 Химия
Химия








