Похожие презентации:
От простых правил к сложным структурам. Метод валентных связей. Принцип VSEPR
1. От простых правил
к сложным структурамЛекцию подготовил: Шлапаков Никита,
студент 6 курса Химического факультета МГУ.
Вороново, 2019
2. Где начинается химия?..
3. Что нам потребуется?
Умение считатьне более, чем
до 18
Таблица
Менделеева
Основы
геометрии
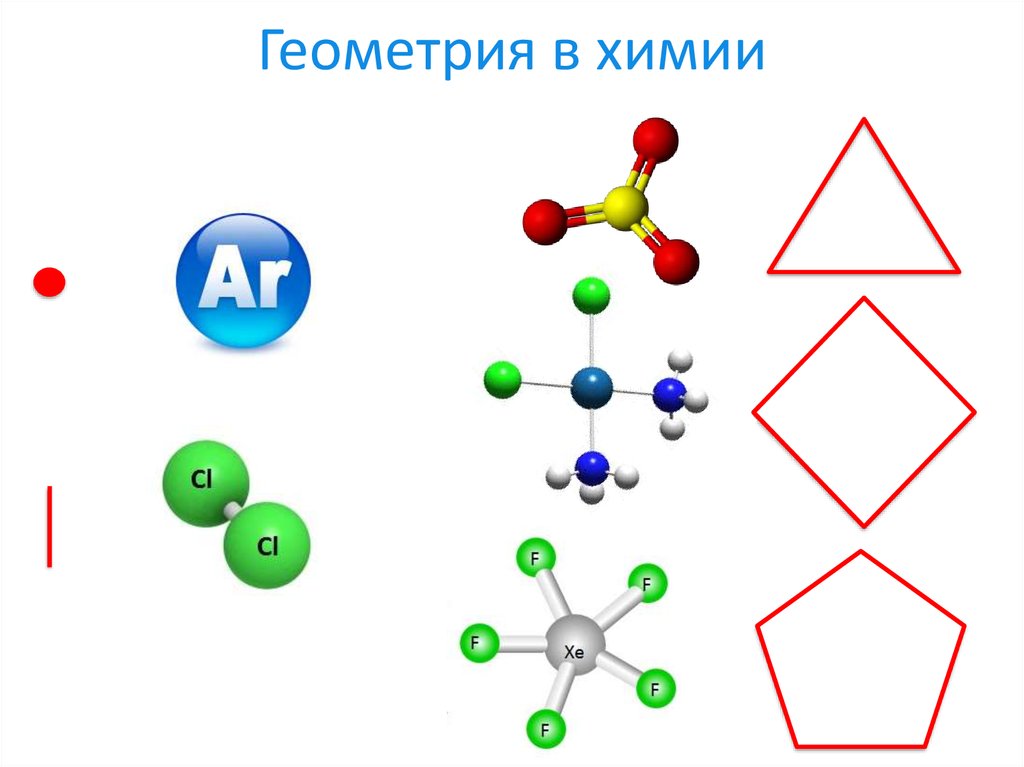
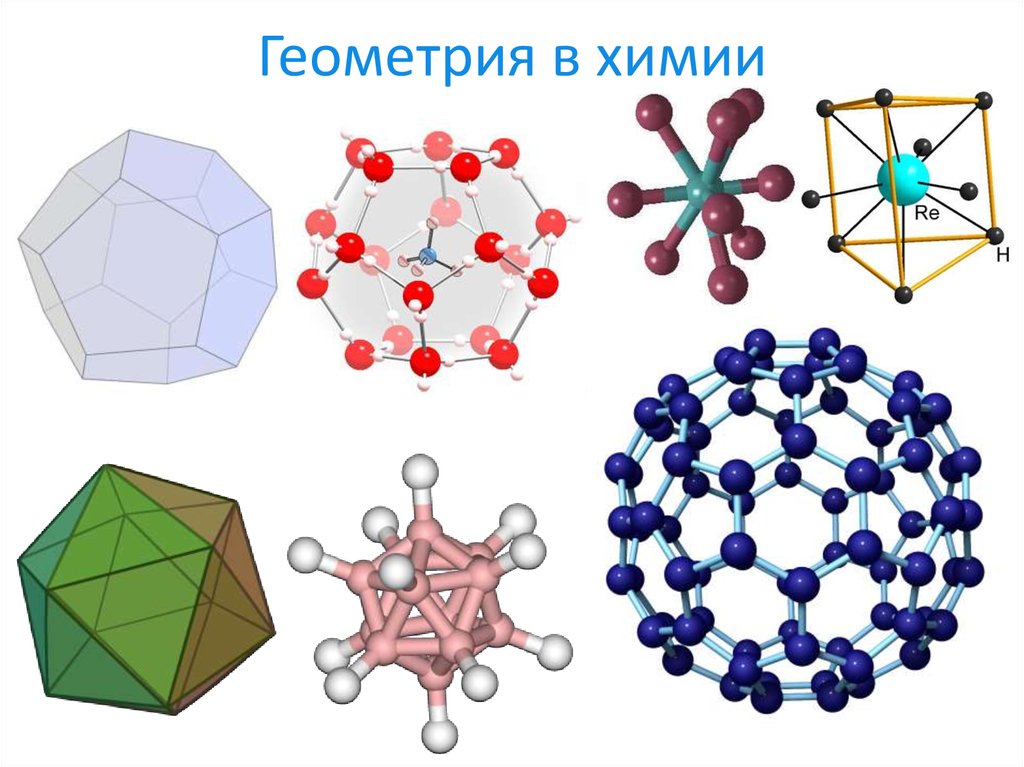
4. Геометрия в химии
5. Геометрия в химии
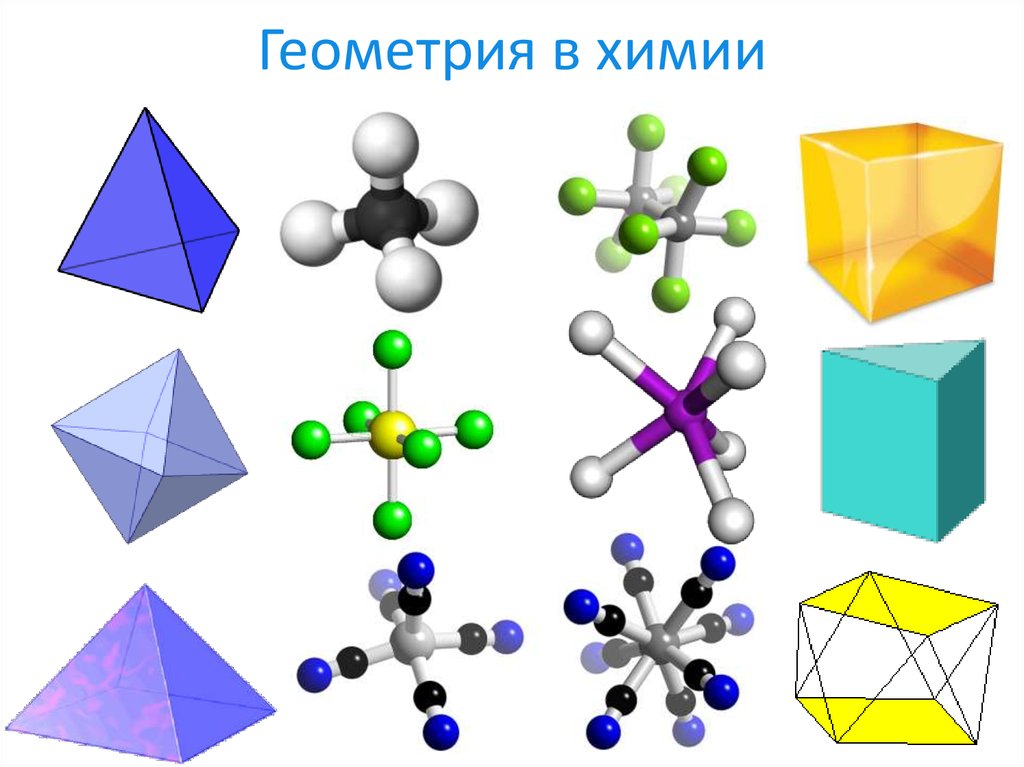
6. Геометрия в химии
7. Метод валентных связей
1e2e
3e
4e
5e
6e
7e
8e
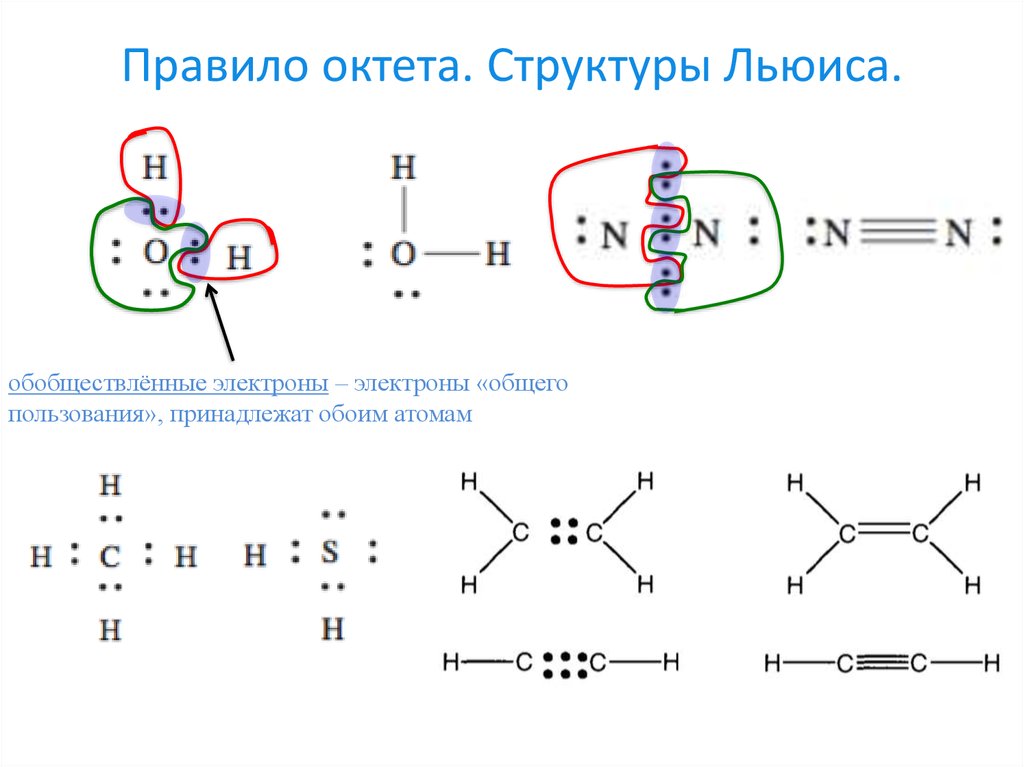
8. Правило октета. Структуры Льюиса.
обобществлённые электроны – электроны «общегопользования», принадлежат обоим атомам
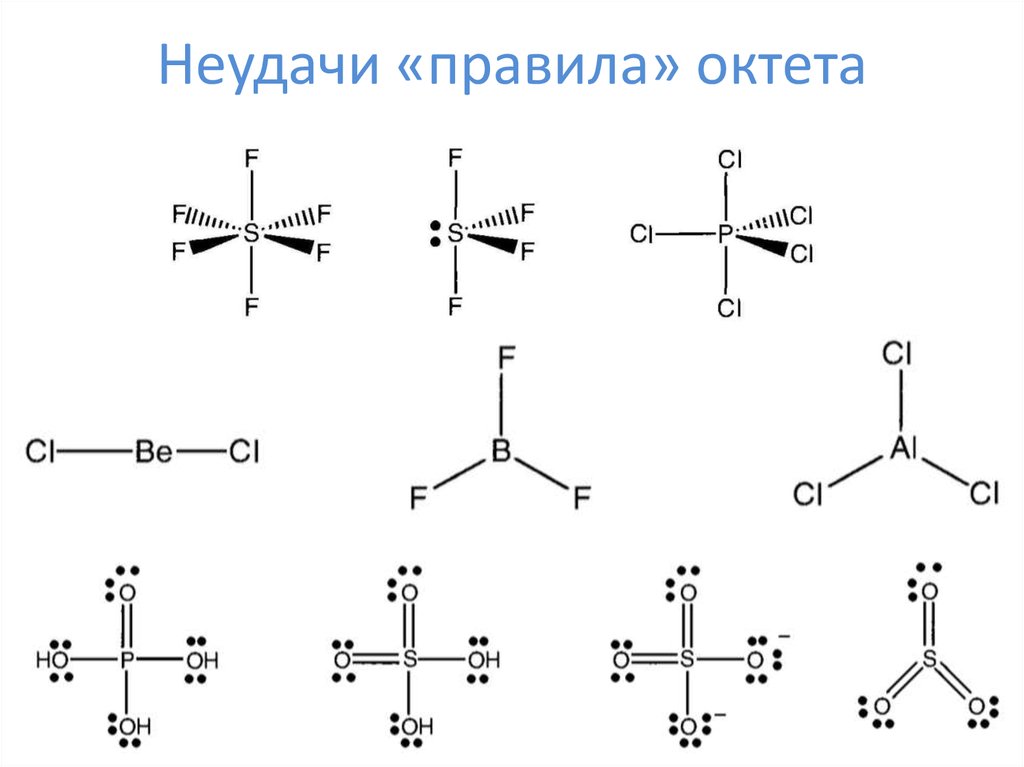
9. Неудачи «правила» октета
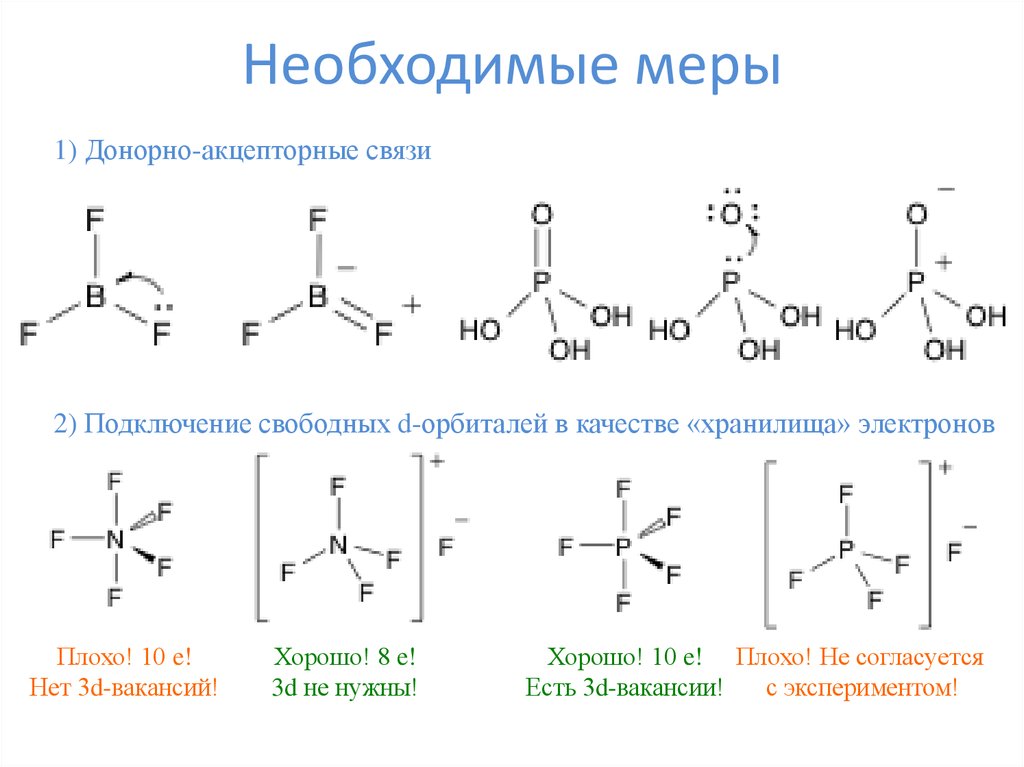
10. Необходимые меры
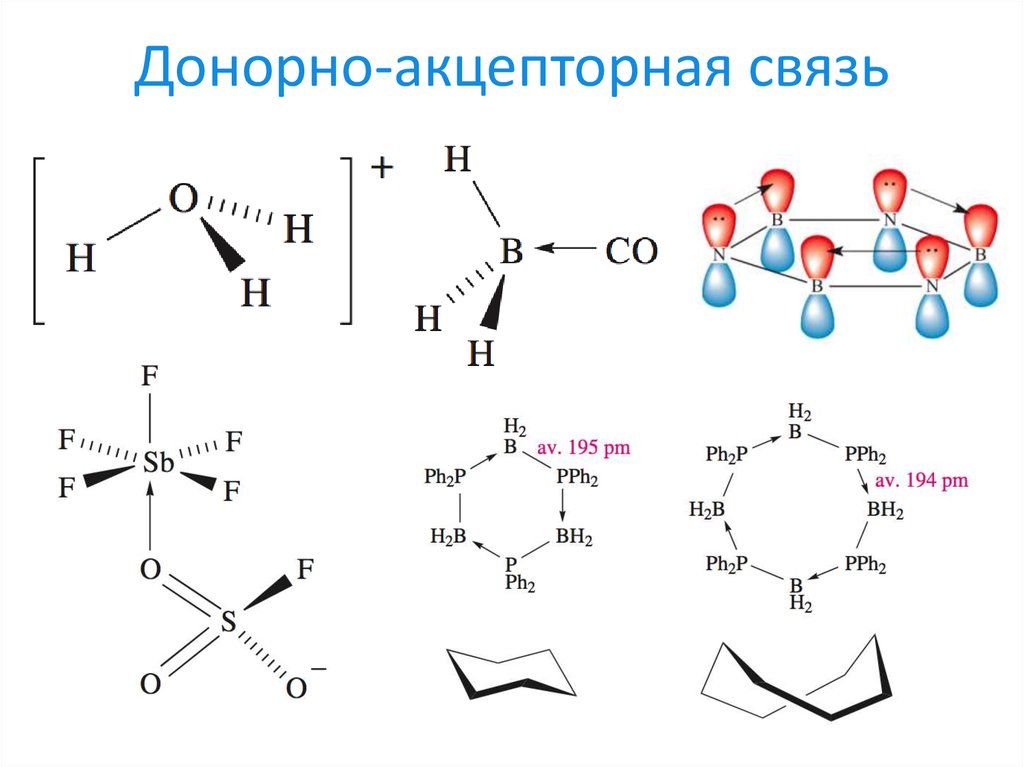
1) Донорно-акцепторные связи2) Подключение свободных d-орбиталей в качестве «хранилища» электронов
Плохо! 10 e!
Нет 3d-вакансий!
Хорошо! 8 e!
3d не нужны!
Хорошо! 10 e! Плохо! Не согласуется
Есть 3d-вакансии!
с экспериментом!
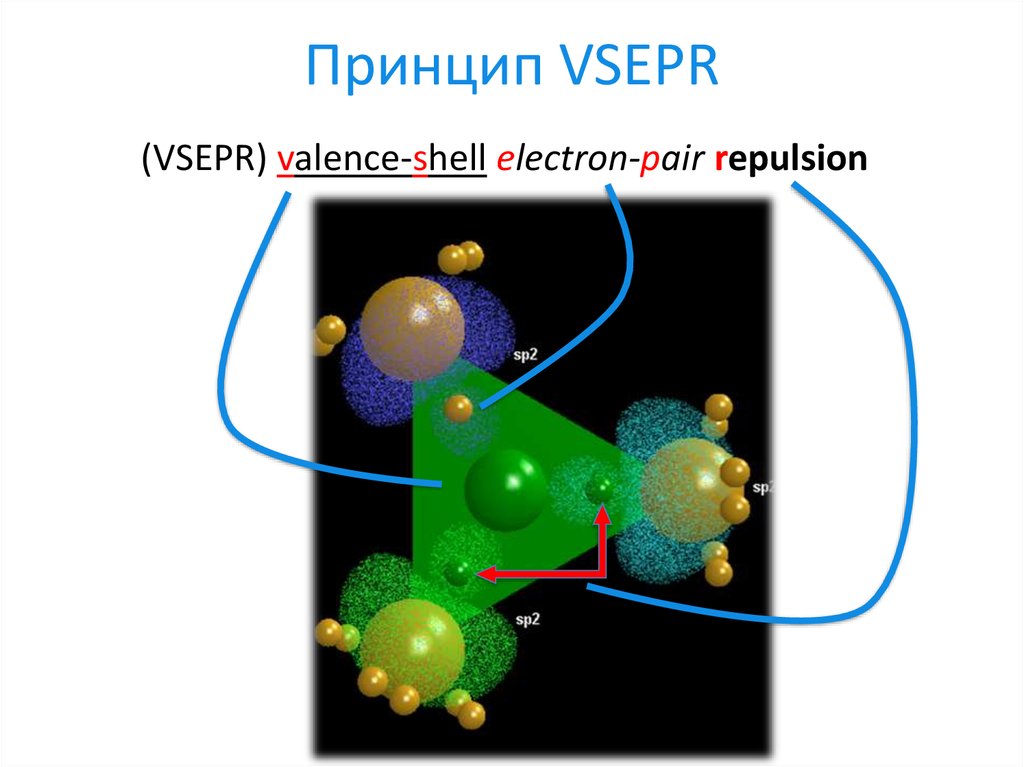
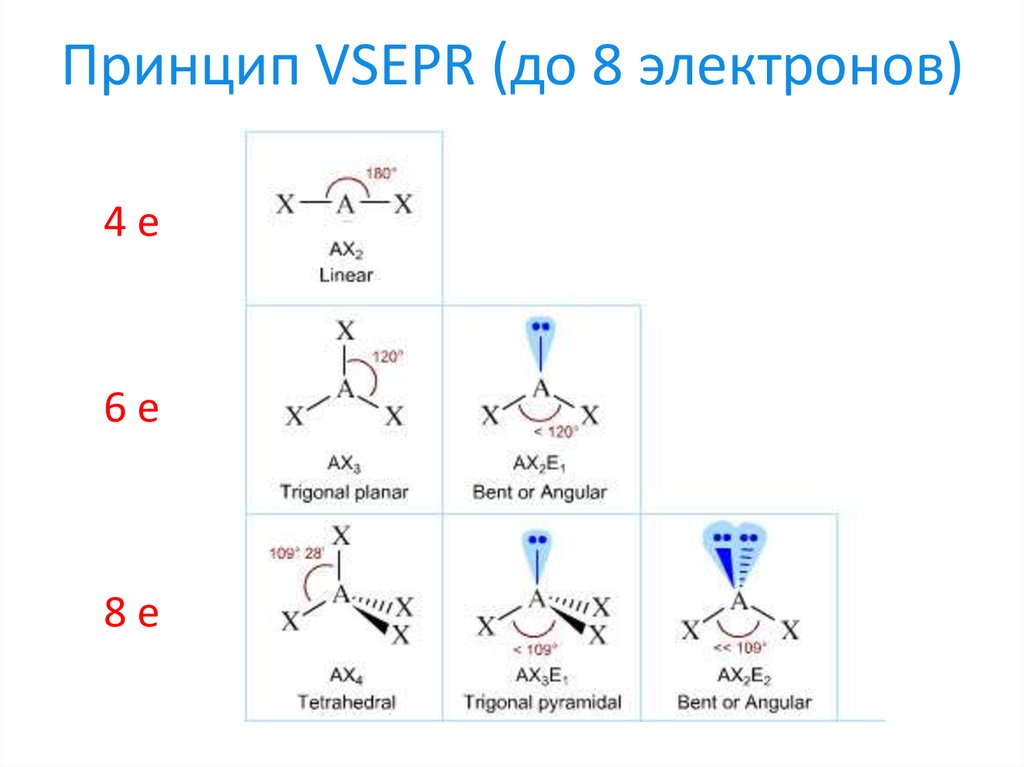
11. Принцип VSEPR
(VSEPR) valence-shell electron-pair repulsion12. Принцип VSEPR
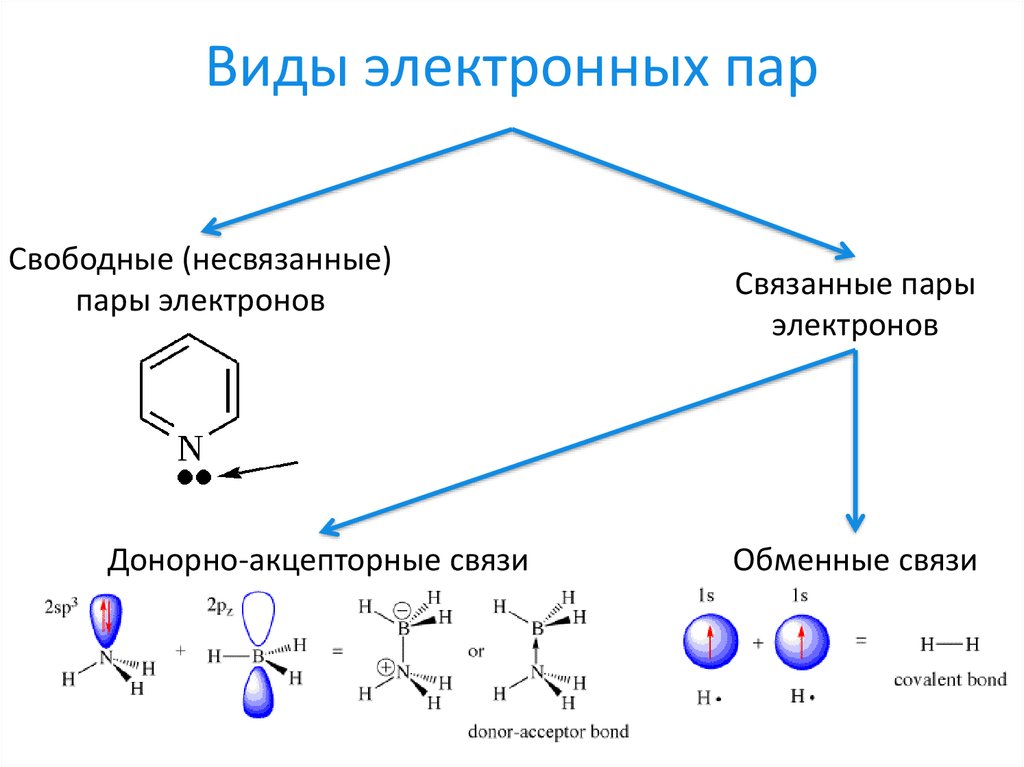
13. Виды электронных пар
Свободные (несвязанные)пары электронов
Донорно-акцепторные связи
Связанные пары
электронов
Обменные связи
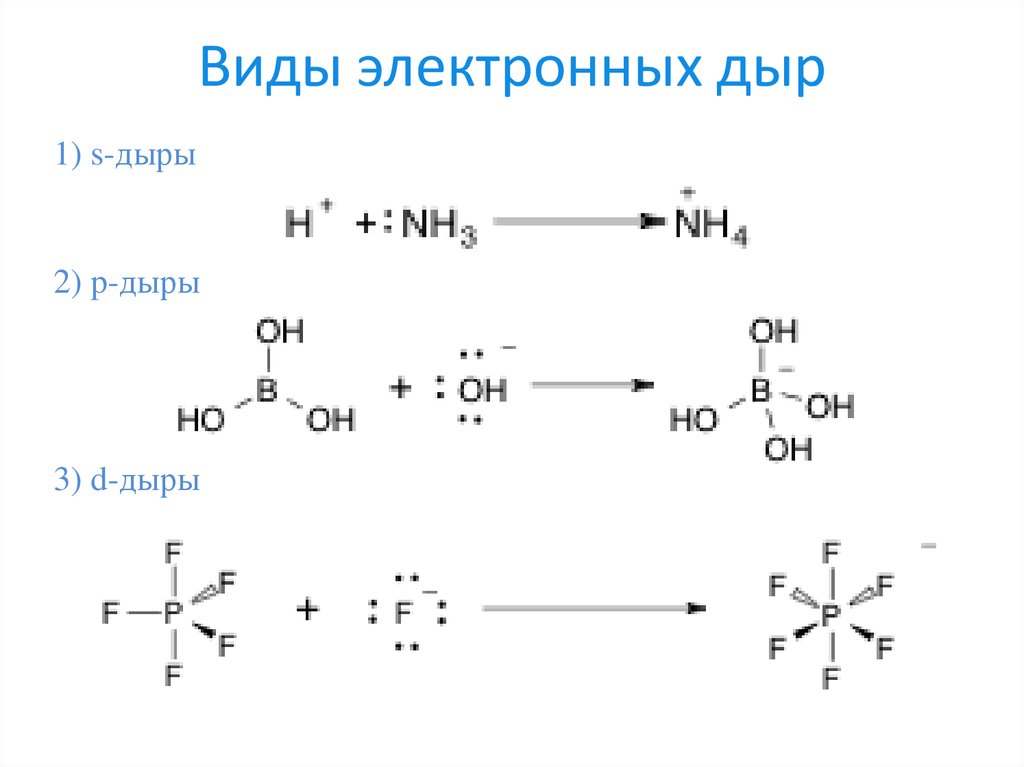
14. Виды электронных дыр
1) s-дыры2) p-дыры
3) d-дыры
15. Донорно-акцепторная связь
16. Принцип VSEPR (правила Гиллеспи)
1. Пары электронов внешней оболочки центральногоатома испытывают взаимное отталкивание;
2. Электронное отталкивание между парами
ослабевает, если электронная плотность связи
уменьшается. Следствия:
– Отталкивание ослабевает при оттягивании электронной
плотности от центрального атома за счёт
электроотрицательности лигандов;
– Отталкивание ослабевает при уменьшении порядка
связи с лигандом;
3. Молекула стремится к такому расположению
окружающих центральный атом лигандов, при
котором отталкивание минимально.
17. Принцип VSEPR (до 8 электронов)
4e6e
8e
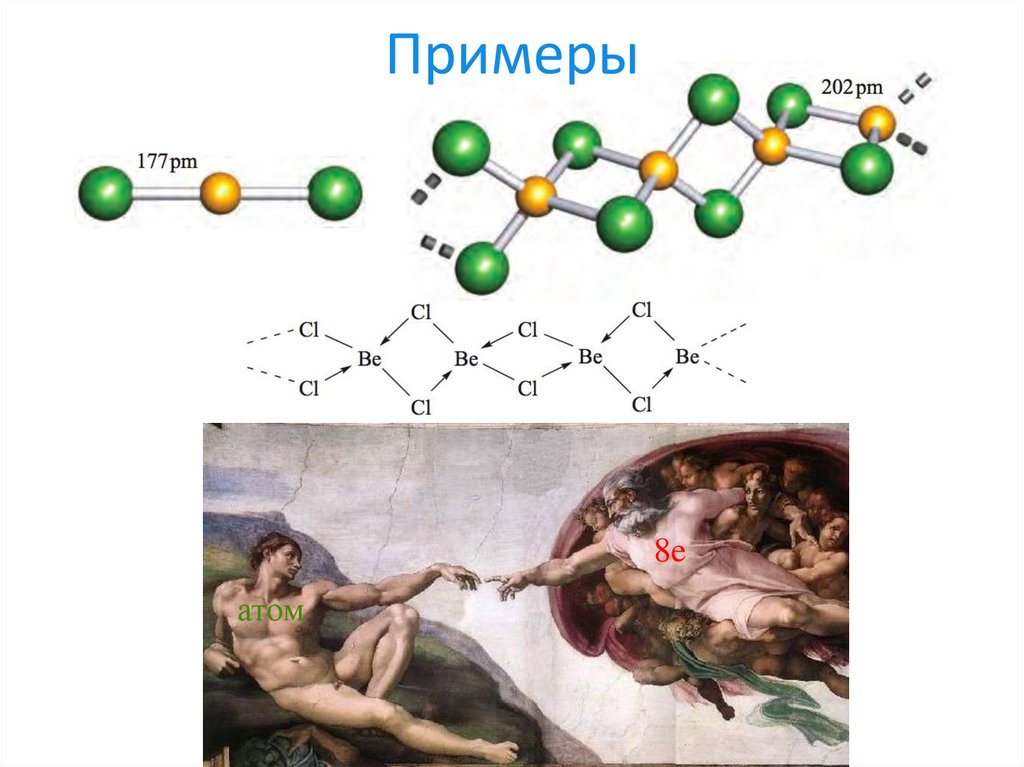
18. Примеры
8eатом
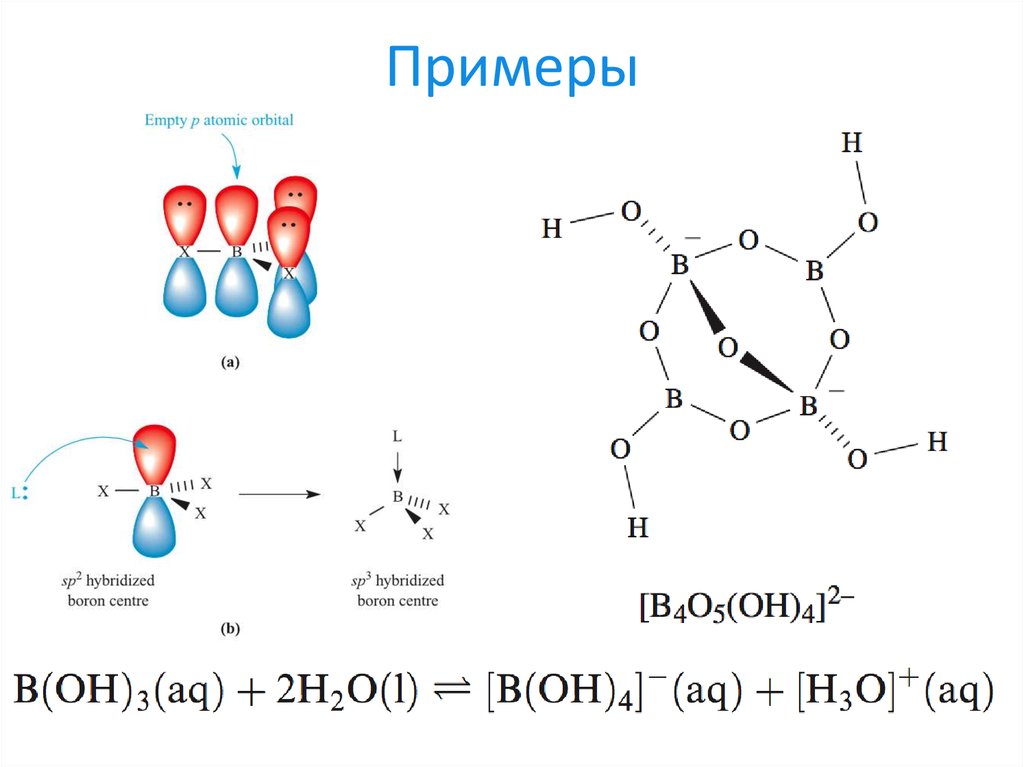
19. Примеры
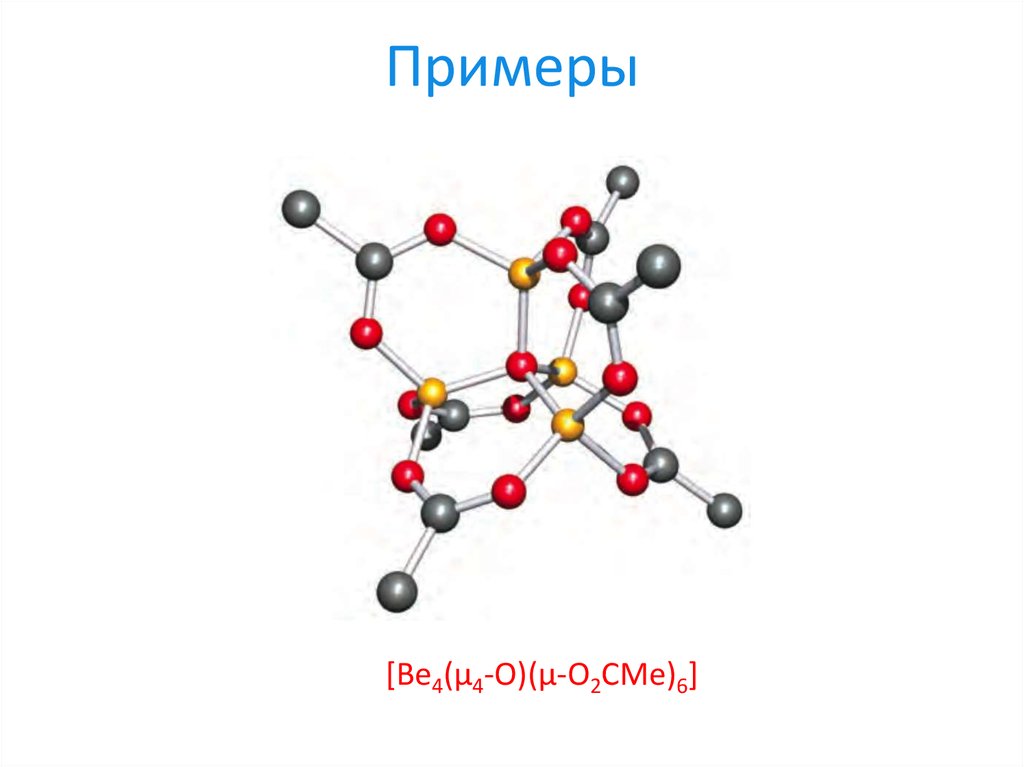
20. Примеры
[Be4(μ4-O)(μ-O2CMe)6]21. Примеры (хитрые)
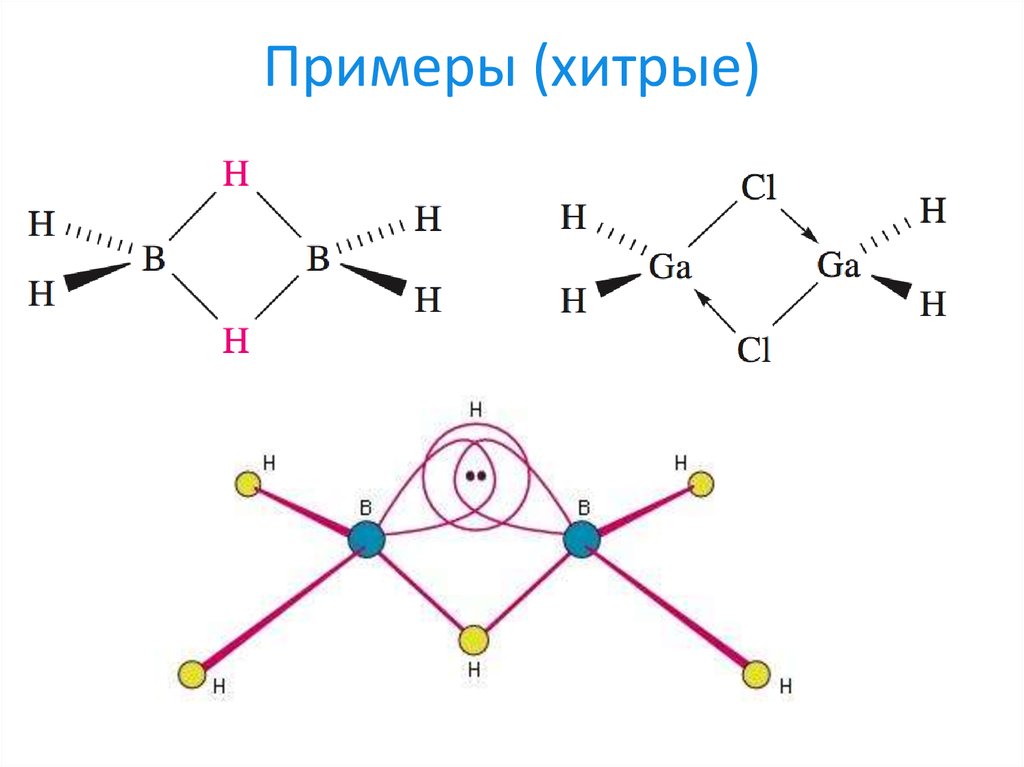
22. Примеры (хитрые)
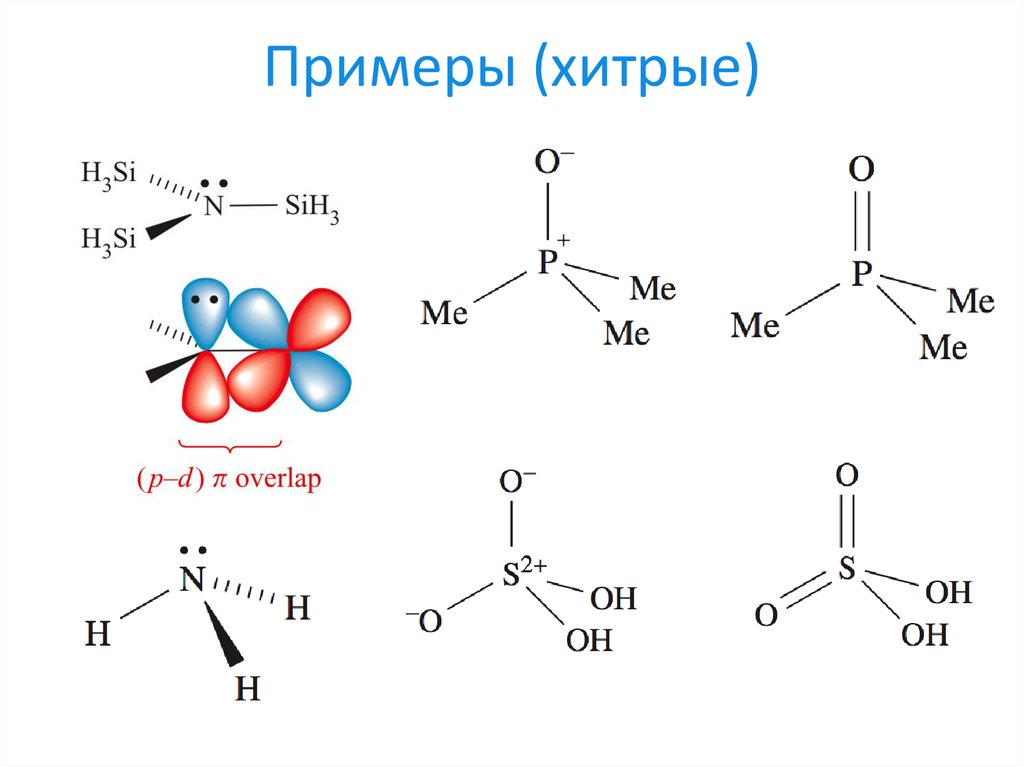
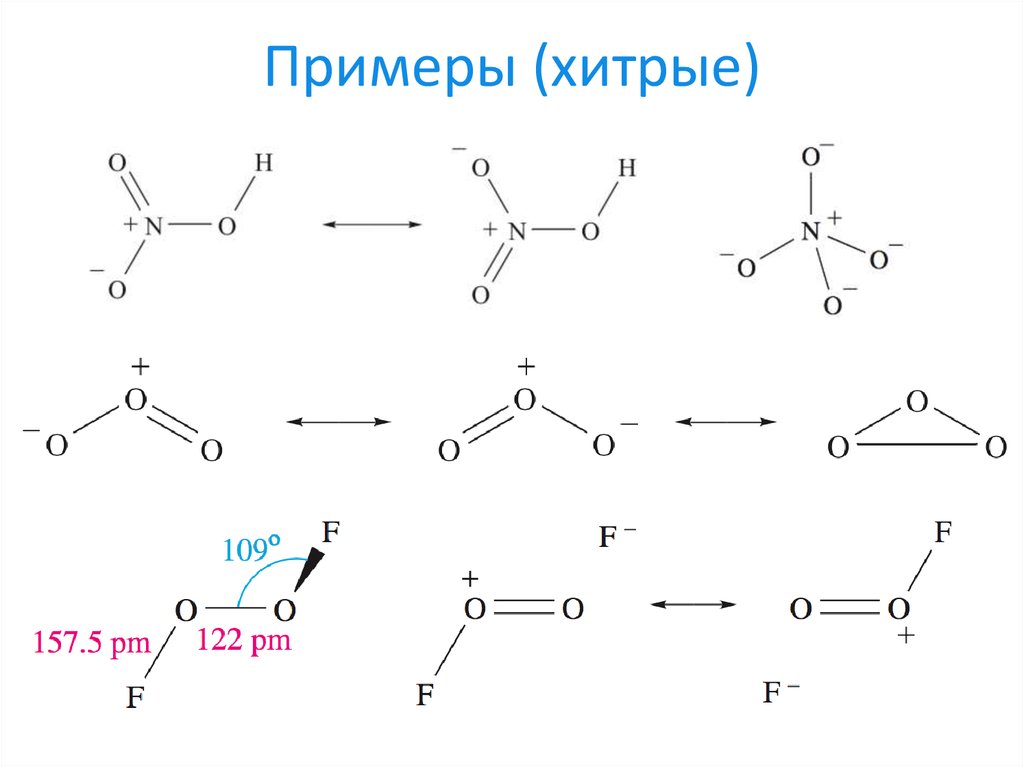
23. Примеры (хитрые)
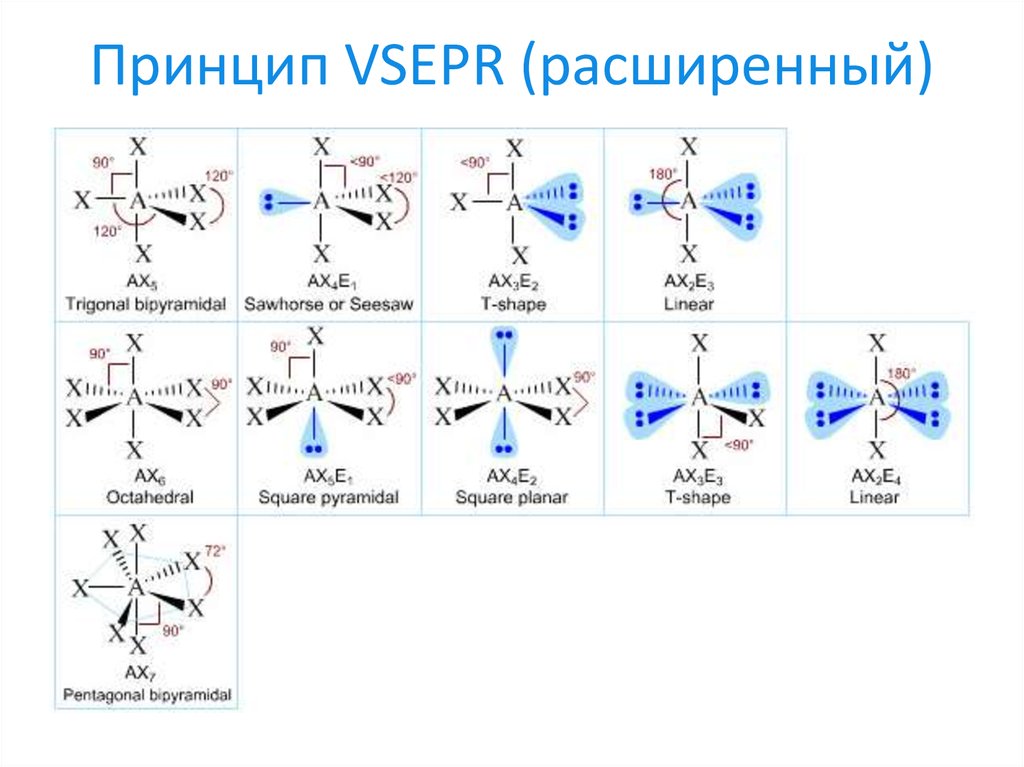
24. Принцип VSEPR (расширенный)
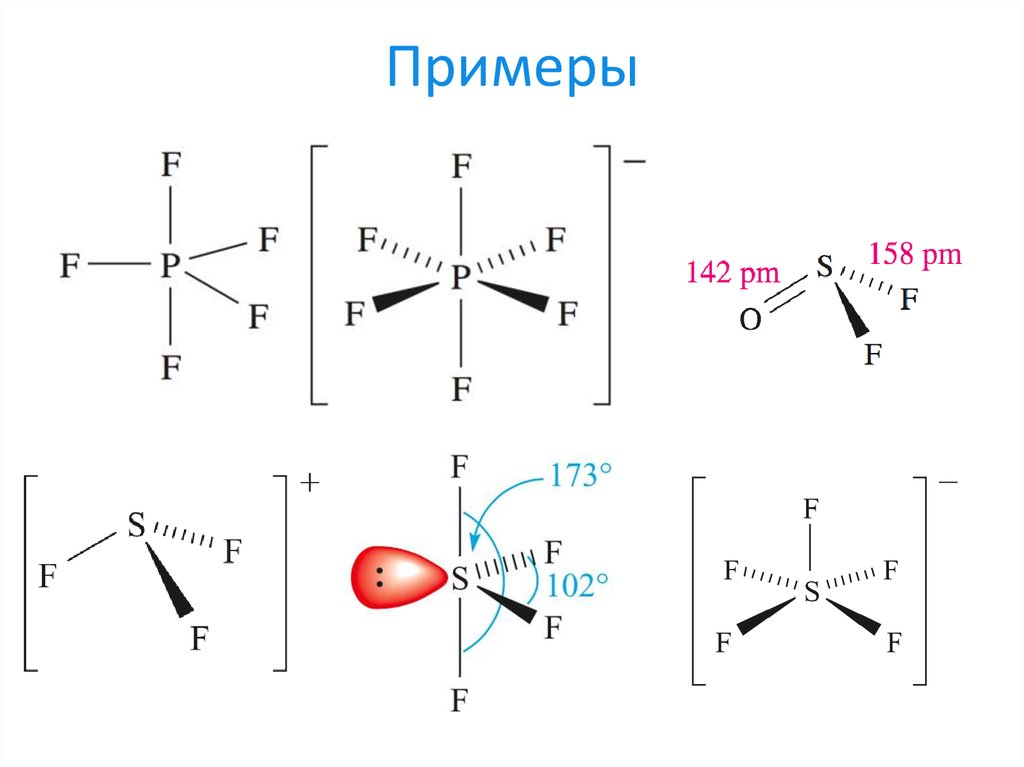
25. Примеры
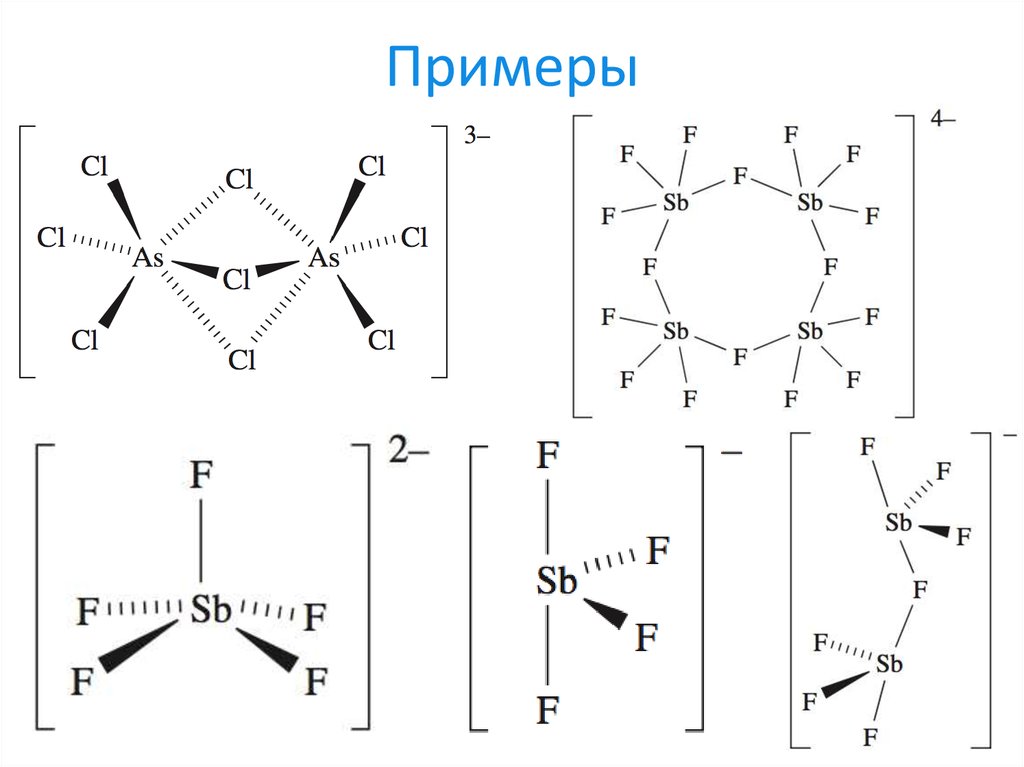
26. Примеры
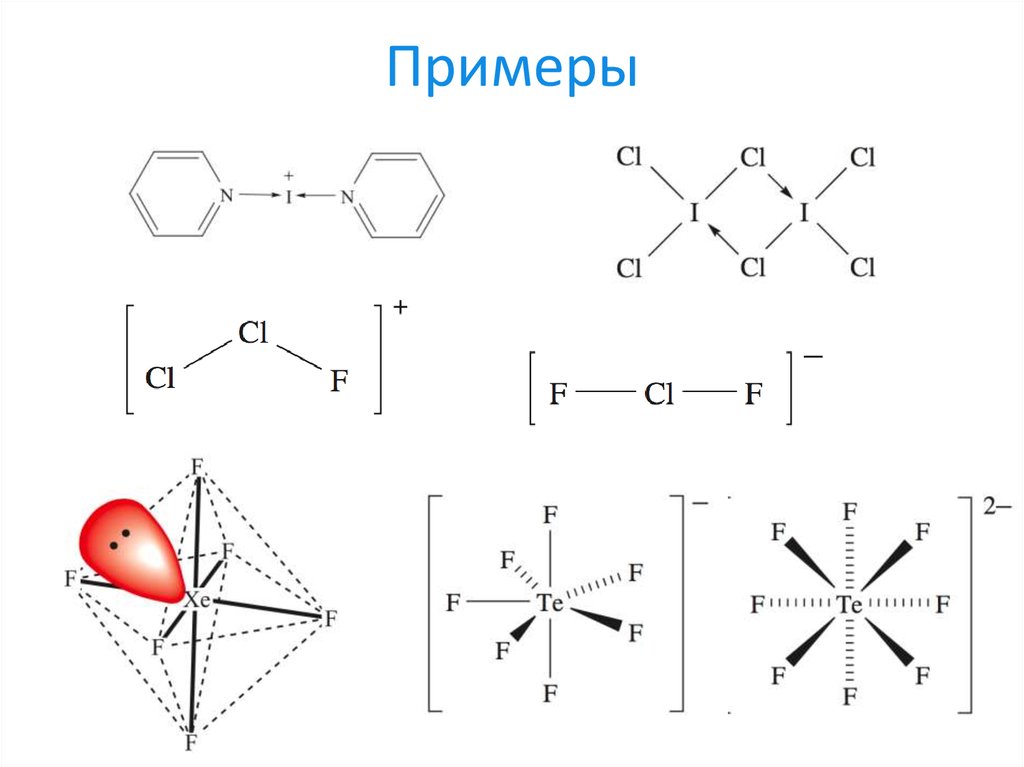
27. Примеры
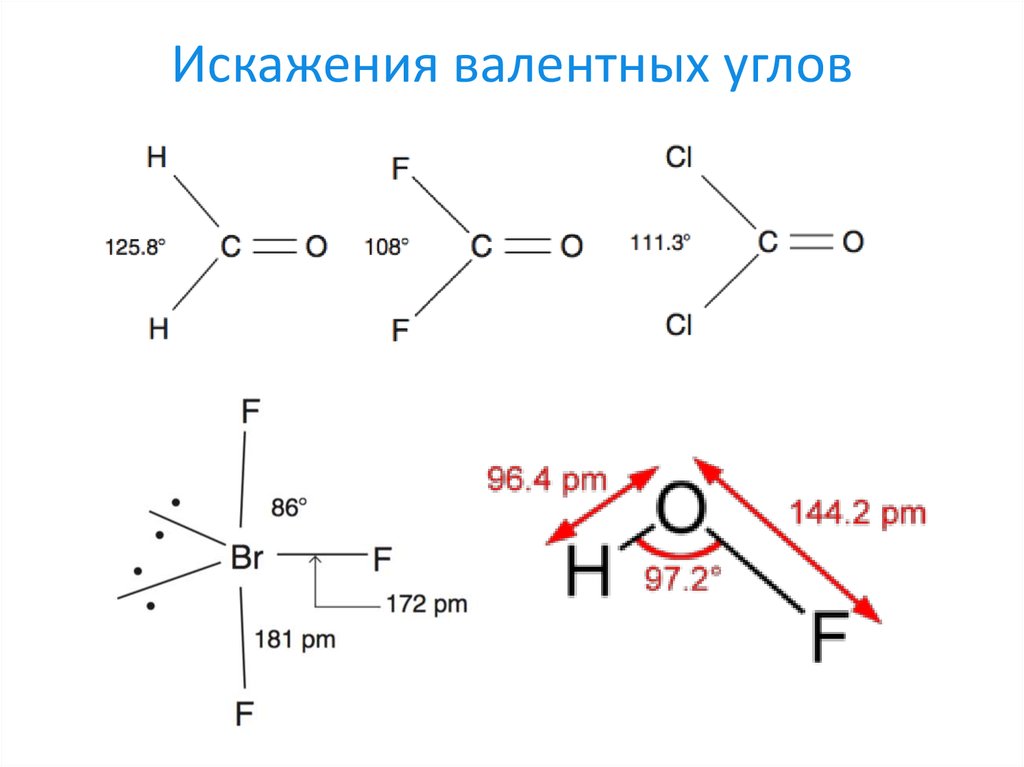
28. Ограничения использования VSEPR
1. Применим только для предсказаниястроения p-элементов
2. Наблюдаются отклонения от правила из-за
наличия стереохимически инертной sпары у тяжёлых элементов с большим
количеством электронов
3. Не учитывает отклонения от планарности
ввиду стерических эффектов
4. Не учитывает специфические
взаимодействия между лигандами





 Химия
Химия








