Похожие презентации:
Исследование электронной плотности в гексафторизопропоксидных комплексах лантаноидов
1. «Теоретическое и экспериментально-теоретическое исследование электронной плотности в гексафторизопропоксидных комплексах
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ НАУКИИНСТИТУТ МЕТАЛЛОРГАНИЧЕСКОЙ ХИМИИ Г.А. РАЗУВАЕВА
РОССИЙСКОЙ АКАДЕМИИ НАУК
«Теоретическое и экспериментально-теоретическое исследование
электронной плотности в гексафторизопропоксидных комплексах
лантаноидов»
02.00.04 – физическая химия
Румянцев Роман Валерьевич
Научный руководитель:
Профессор РАН, д.х.н.
Фукин Г.К.
Нижний Новгород
2019
2.
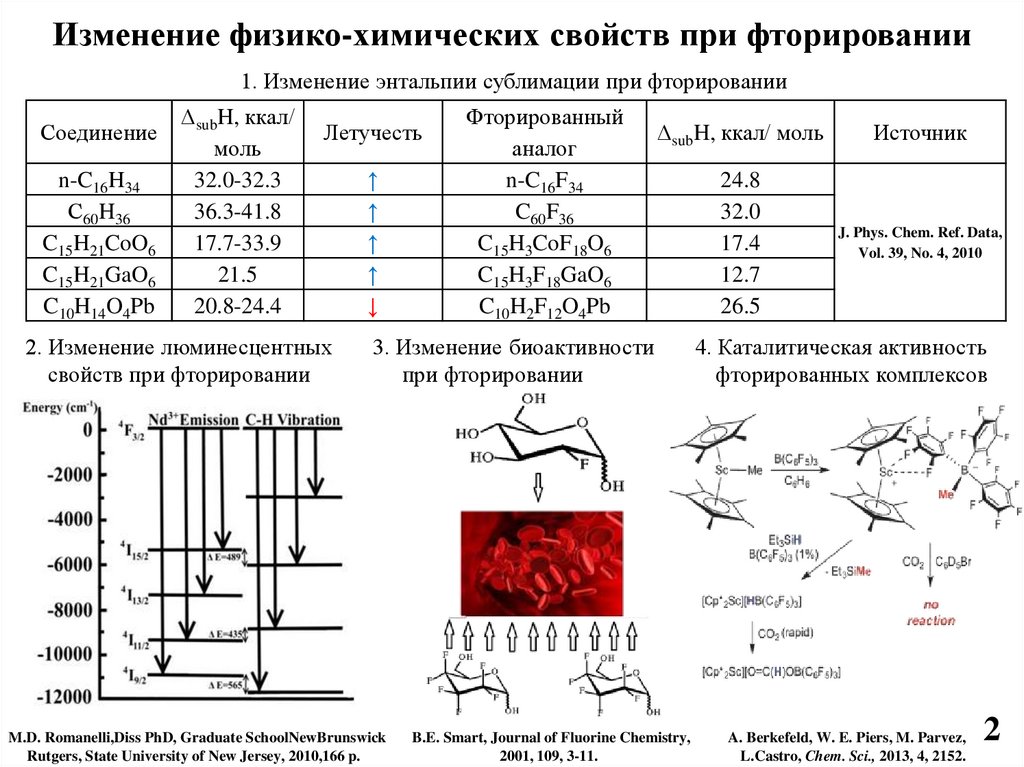
Изменение физико-химических свойств при фторировании1. Изменение энтальпии сублимации при фторировании
Соединение
n-C16H34
С60H36
C15H21CoO6
C15H21GaO6
C10H14O4Pb
ΔsubH, ккал/
моль
32.0-32.3
36.3-41.8
17.7-33.9
21.5
20.8-24.4
Летучесть
2. Изменение люминесцентных
свойств при фторировании
↑
↑
↑
↑
↓
Фторированный
аналог
n-C16F34
C60F36
C15H3CoF18O6
C15H3F18GaO6
C10H2F12O4Pb
ΔsubH, ккал/ моль
Источник
24.8
32.0
17.4
12.7
26.5
J. Phys. Chem. Ref. Data,
Vol. 39, No. 4, 2010
3. Изменение биоактивности
при фторировании
M.D. Romanelli,Diss PhD, Graduate SchoolNewBrunswick
Rutgers, State University of New Jersey, 2010,166 p.
B.E. Smart, Journal of Fluorine Chemistry,
2001, 109, 3-11.
4. Каталитическая активность
фторированных комплексов
A. Berkefeld, W. E. Piers, M. Parvez,
L.Castro, Chem. Sci., 2013, 4, 2152.
2
3.
Цель и задачи исследованияЦелью исследования является: изучение распределения электронной плотности в
гексафторизопропоксидных
комплексах
лантаноидов
теоретическими
и
экспериментально-теоретическими методами и на основе этого исследование
невалентных внутри- и межмолекулярных взамодействий фтора в этих соединениях.
Задачи:
• Поиск
геометрического
критерия
наличия
внутримолекулярных
C-F→Ln
взаимодействий в комплексах лантаноидов с фторированными лигандами.
• Анализ распределения электронной плотности и её топологии по данным квантовохимических расчётов.
• Изучение природы химической связи и оценка энергии внутримолекулярных
взаимодействий фтора в рамках теории Р. Бейдера «Атомы в молекулах».
• Анализ
влияния
различных
факторов
(таких
как
степень
заполнения
координационной сферы и координация нейтральной молекулы растворителя на
металл) на внутримолекулярные C-F→Ln взаимодействия.
• Сравнение экспериментально-теоретического подхода (молекулярный инвариом) к
исследованию электронной плотности в комплексах лантаноидов с теоретическим
(квантовохимические расчеты методом функционала плотности).
3
4.
Геометрический критерий наличия C-F→Ln взаимодействия вкомплексах лантаноидов с фторированными лигандами
(Sm3+)(CN=7) = 1.16Å;
R(F) = 1.40Å
C-F(12A) = 1.364Å
C-C-F(12A) = 110.51º
=˃ Sm..
=> Sm..
..F
..F
Yb(1)…F(1) 3.274Å; SA = 13.88%,
E = 14.14 ккал/моль
Refcode: PACNEP
4
5.
Геометрический критерий наличия C-F→Ln взаимодействия вкомплексах лантаноидов с фторированными лигандами
5
6.
Теоретические молекулярные графы комплексовSm3 (1), Eu3 (2), Eu2Y (3) и Yb3 (4)
1
атом
Sm13+
Sm22+
Sm32+
F
C
O
H
1
2
атом
Y13+
Eu12+
Eu22+
F
C
O
H
заряд, e
2.17
1.67
1.67
-0.65 ÷ -0.63
0.01 ÷ 1.75
-1.24 ÷ -1.07
0.00 ÷ 0.11
3
заряд, e
2.26
1.67
1.67
-0.65 ÷ -0.63
0.44 ÷ 1.74
-1.25 ÷ -1.09
0.02 ÷ 0.11
атом
Eu12+
Eu23+
Eu32+
F
C
O
H
атом
Yb13+
Yb22+
Yb32+
F
C
O
H
2
заряд, e
1.68
2.16
1.67
-0.65 ÷ -0.63
0.44 ÷ 1.74
-1.24 ÷ -1.09
0.02 ÷ 0.11
4
заряд, e
2.24
1.67
1.66
-0.65 ÷ -0.63
-0.02 ÷ 1.75
-1.26 ÷ -1.08
0.01 ÷ 0.12
Атомные AIM-заряды в
структурах 1-4
3
4
6
7.
Энергия связей Ln-О и Ln…F в тримерных комплексах 1-41(Sm3)
|EEML|, ккал/моль
2(Eu3)
3(Eu2Y)
4(Yb3)
Ln-Oterm
(iPrF)
35.53 ÷
37.07
37.29 ÷
37.94
31.41 ÷
32.06
43.69 ÷
44.70
Ln-μ2O(iPrF)
10.64 ÷
18.18
12.24 ÷
18.43
12.17 ÷
17.16
14.90 ÷
23.14
Ln-μ3O(iPrF)
8.63 ÷
11.58
7.16 ÷
12.77
6.73 ÷
13.11
10.41 ÷
15.38
Ln-O(solv)
5.77 ÷
7.28
4.62 ÷
6.07
4.76 ÷
6.25
11.23 ÷
12.17
Ln…F
2.61 ÷
5.88
3.80 ÷
5.42
3.73 ÷
5.60
6.26 ÷
7.90
Связь
7
8.
C-F→Ln взаимодействия в комплексах 1-4Контакт
SA, %
Sm(5)-F(43)
Sm(5)-F(53)
Sm(6)-F(48)
Sm(5)-F(79)
Sm(5)-F(55)
Sm(6)-F(64)
Sm(6)-F(49)
Sm(4)-F(61)
Sm(5)…F(82)
Sm(5)…F(58)
Sm(4)…F(46)
1
10.73
11.12
6.90
6.79
4.27
8.20
6.45
5.83
5.20
2.32
1.52
3
Eu(2)-F(39)
Eu(1)-F(36)
Eu(1)-F(40)
Eu(2)-F(33)
Eu(1)-F(16)
Eu(2)…F(19)
Eu(2)…F(29)
Eu(1)…F(27)
Eu(2)…F(23)
Eu(1)…F(14)
11.40
11.62
8.63
7.23
4.26
4.09
3.72
3.21
1.49
1.16
|EEML|*,
ккал/моль
DI, e
Контакт
SA, %
|EEML|*,
ккал/моль
DI, e
2
5.88
5.08
4.37
4.36
3.84
3.49
3.20
2.61
0.316
0.300
0.280
0.270
0.254
0.243
0.238
0.214
0.130
0.073
0.054
Eu(1)-F(10)
Eu(3)-F(4)
Eu(1)-F(1)
Eu(3)-F(7)
Eu(3)-F(42)
Eu(1)…F(21)
Eu(3)…F(24)
Eu(1)…F(13)
Eu(2)…F(9)
11.11
11.36
8.39
8.28
2.89
3.37
3.21
0.91
0.52
5.42
5.25
3.98
3.97
3.80
0.308
0.306
0.269
0.270
0.260
0.114
0.127
0.096
0.060
Зависимость индексов
делокализации (DI) от телесного
угла (SA) контакта Ln…F в 1-4
4
5.60
5.46
4.17
4.09
3.73
0.314
0.311
0.274
0.272
0.260
0.092
0.124
0.124
0.094
0.110
Yb(3)-F(41)
Yb(2)-F(31)
Yb(3)-F(36)
Yb(2)-F(38)
Yb(3)…F(29)
Yb(2)…F(26)
Yb(2)…F(25)
Yb(2)…F(16)
Yb(3)…F(23)
Yb(2)…F(13)
12.45
12.43
11.68
11.62
4.21
3.02
2.96
2.95
2.81
1.33
7.90
7.50
7.07
6.26
* EML – корреляция Эспинозы–Моллинса–Лекомта
0.376
0.371
0.362
0.345
0.146
0.139
0.133
0.145
0.129
0.056
3d-ДЭП (0.05 а.е.) в 2 для C(5)F(9)→Eu(2). Синий цвет
соответствуют области
концентрации ЭП, красный цвет –
области разрежения ЭП
8
9.
Влияние степени заполнения координационной сферы атомалантаноида на C-F→Ln взаимодействия в 5-8
атом
Ce1
Ce2
q(F)
q(C)
q(O)
q(H)
атом
Tm1
Tm2
q(F)
q(C)
q(O)
q(H)
5
заряд, e
2.22
2.22
-0.64 ÷ -0.63
0.42 ÷ 1.75
-1.22 ÷ -1.09
0.03 ÷ 0.11
7
заряд, e
2.24
2.24
-0.65 ÷ -0.63
0.41 ÷ 1.75
-1.25 ÷ -1.10
0.03 ÷ 0.12
6
атом
заряд, e
Sm1
2.19
Sm2
2.19
q(F) -0.65 ÷ -0.63
q(C) 0.41 ÷ 1.75
q(O) -1.22 ÷ -1.09
q(H) 0.03 ÷ 0.11
8
атом
заряд, e
Yb1
2.25
Yb2
2.25
q(F) -0.65 ÷ -0.63
q(C) 0.41 ÷ 1.75
q(O) -1.25 ÷ -1.10
q(H) 0.04 ÷ 0.12
5 (Ce2)
7 (Tm2)
6 (Sm2)
8 (Yb2)
9
10.
Влияние степени заполнения координационной сферы атомалантаноида на C-F→Ln взаимодействия
Контакт
Ln…FX-Ray, Å
Ce(1)-F(13)
Ce(1A)-F(13A)
2.871(1)
2.871(1)
Sm(1)-F(5A)
Sm(1A)-F(5)
2.852(3)
2.852(3)
Tm(1)-F(5A)
Tm(1A)-F(5)
3.017
3.017
Yb(1)-F(12A)
Yb(1A)-F(12)
3.056
3.056
Ln…FCalc, Å
5
2.924
2.924
6
2.977
2.973
7
3.150
3.152
8
3.379
3.378
|EEML|,
ккал/моль
DI, e
G, %
3.92
3.91
0.249
0.249
92.9(2)
92.9(2)
2.95
2.98
0.227
0.229
94.9(2)
94.9(2)
0.169
0.168
96.9(2)
96.9(2)
0.118
0.118
97.3(2)
97.3(2)
10
11.
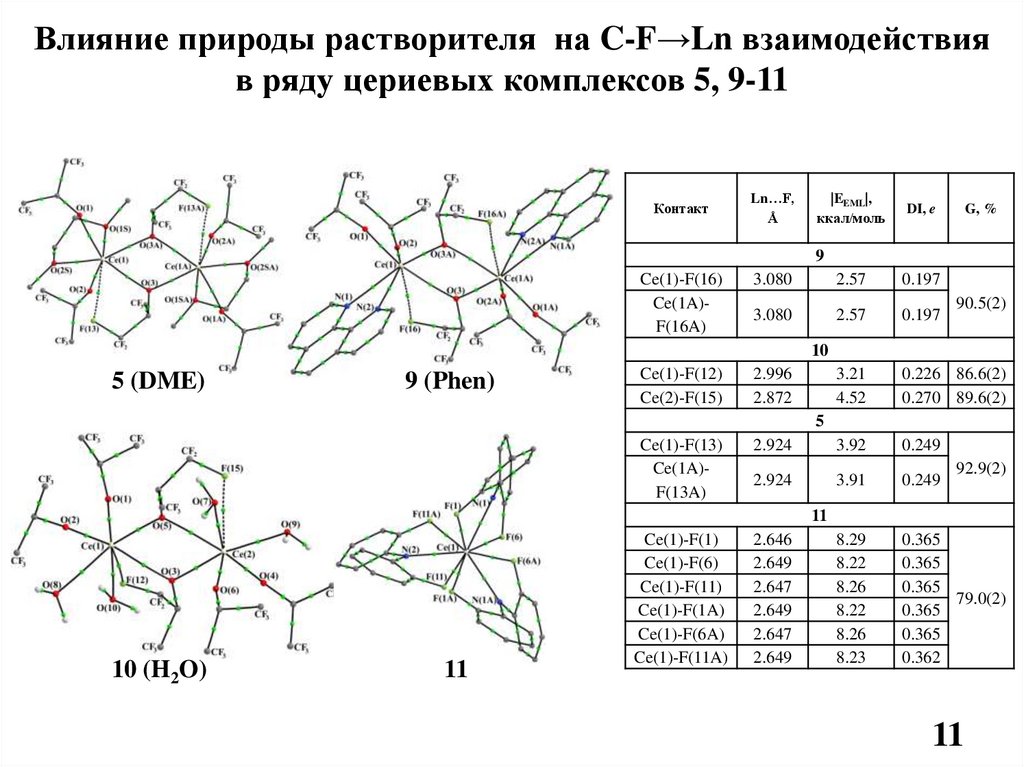
Влияние природы растворителя на C-F→Ln взаимодействияв ряду цериевых комплексов 5, 9-11
Контакт
Ln…F,
Å
|EEML|,
ккал/моль
DI, e
G, %
9
Ce(1)-F(16)
Ce(1A)F(16A)
3.080
2.57
0.197
3.080
2.57
0.197
3.21
4.52
0.226 86.6(2)
0.270 89.6(2)
2.924
3.92
0.249
2.924
3.91
0.249
8.29
8.22
8.26
8.22
8.26
8.23
0.365
0.365
0.365
79.0(2)
0.365
0.365
0.362
90.5(2)
10
5 (DME)
9 (Phen)
Ce(1)-F(12)
Ce(2)-F(15)
2.996
2.872
5
Ce(1)-F(13)
Ce(1A)F(13A)
92.9(2)
11
10 (H2O)
11
Ce(1)-F(1)
Ce(1)-F(6)
Ce(1)-F(11)
Ce(1)-F(1A)
Ce(1)-F(6A)
Ce(1)-F(11A)
2.646
2.649
2.647
2.649
2.647
2.649
11
12.
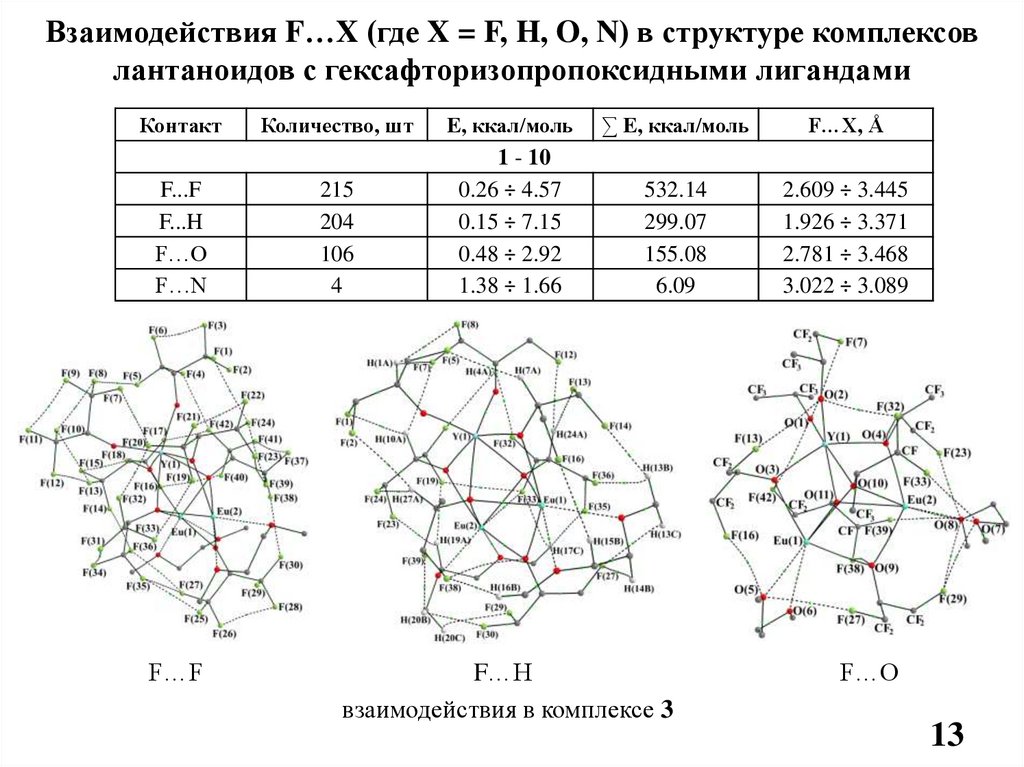
Взаимодействия F…X (где X = F, H, O, N) в структуре комплексовлантаноидов с гексафторизопропоксидными лигандами
Распределение молекулярного
электростатического потенциала
на поверхности ЭП 0.05 ат. ед.
для (CF3)2COH. Синий отрицательный знак ЭСП
3d-ДЭП (0.05 а.е.) в
комплексе 2 в областях,
соответствующих
взаимодействиям F(24).
Синий - область
концентрации ЭП, красный
цвет – область разрежения
ЭП
12
13.
Взаимодействия F…X (где X = F, H, O, N) в структуре комплексовлантаноидов с гексафторизопропоксидными лигандами
Контакт
F...F
F...H
F…O
F…N
F…F
Количество, шт
E, ккал/моль
∑ E, ккал/моль
F…X, Å
215
204
106
4
1 - 10
0.26 ÷ 4.57
0.15 ÷ 7.15
0.48 ÷ 2.92
1.38 ÷ 1.66
532.14
299.07
155.08
6.09
2.609 ÷ 3.445
1.926 ÷ 3.371
2.781 ÷ 3.468
3.022 ÷ 3.089
F…H
взаимодействия в комплексе 3
F…O
13
14.
Экспериментально-теоретическое (молекулярный инвариом)исследование ЭП в комплексах лантаноидов с фторироваными
лигандами
14
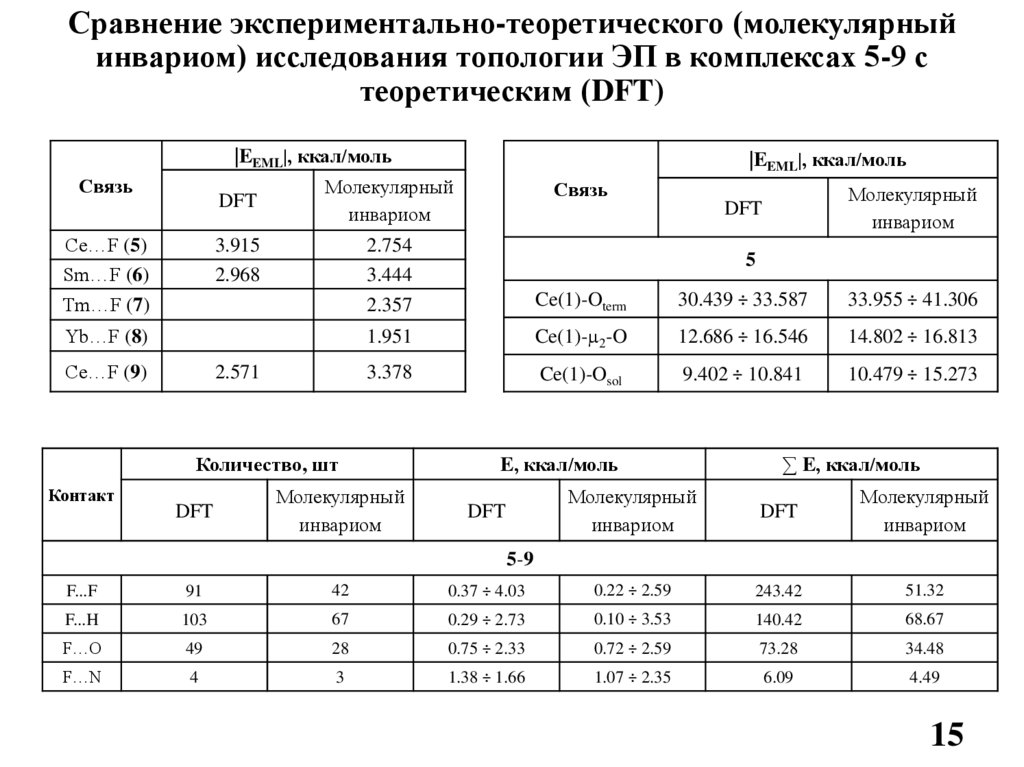
15.
Сравнение экспериментально-теоретического (молекулярныйинвариом) исследования топологии ЭП в комплексах 5-9 с
теоретическим (DFT)
|EEML|, ккал/моль
Связь
Ce…F (5)
Sm…F (6)
|EEML|, ккал/моль
DFT
Молекулярный
инвариом
3.915
2.968
2.754
3.444
Связь
Молекулярный
инвариом
DFT
5
Tm…F (7)
2.357
Ce(1)-Oterm
30.439 ÷ 33.587
33.955 ÷ 41.306
Yb…F (8)
1.951
Ce(1)-µ2-O
12.686 ÷ 16.546
14.802 ÷ 16.813
3.378
Ce(1)-Osol
9.402 ÷ 10.841
10.479 ÷ 15.273
Ce…F (9)
2.571
Количество, шт
Контакт
DFT
Молекулярный
инвариом
E, ккал/моль
DFT
∑ E, ккал/моль
Молекулярный
инвариом
DFT
Молекулярный
инвариом
5-9
F...F
91
42
0.37 ÷ 4.03
0.22 ÷ 2.59
243.42
51.32
F...H
103
67
0.29 ÷ 2.73
0.10 ÷ 3.53
140.42
68.67
F…O
49
28
0.75 ÷ 2.33
0.72 ÷ 2.59
73.28
34.48
F…N
4
3
1.38 ÷ 1.66
1.07 ÷ 2.35
6.09
4.49
15
16.
Внутримолекулярные C-F→Ln и F…X (X = F, H, O)взаимодействия в комплексе Sm3+2(OCH(CF3)2)6(DME)2 (6)
16
17.
Межмолекулярные F…X (X = F, H) взаимодействияв комплексе Yb3+2(OCH(CF3)2)6(DME)2 (8)
Диапазон
Количество изменения Общая энергия
Контакт контактов, энергии
контактов,
шт
контактов,
ккал/моль
ккал/моль
8
F...F
48
0.17 ÷ 2.26
35.38
F...H
18
0.13 ÷ 1.83
12.06
Межмолекулярные F…F и F…H
взаимодействия в комплексе 8
17
18.
Выводы1. Проведено геометрическое исследование 144 комплексов лантаноидов с фторированными
лигандами, потенциально способными к реализации C-F→Ln взаимодействий, 9 из которых были
впервые структурно охарактеризованы.
2. Показано, что для всех комплексов, в которых расстояние Ln…F меньше 3.447 Å, наблюдаются
сильные взаимодействия между этими атомами, при расстояниях Ln…F больше чем 4.060 Å,
химическое взаимодействие отсутствует. В свою очередь, область значений 3.447 < Ln…F < 4.060
Å является переходным интервалом, для которой нельзя точно определить наличие/отсутствие и
силу возможного взаимодействия.
3. Проведены высокоуровневые расчеты методом функционала плотности (B3LYP/ 6-31+G*(O,C,
N,H,F)/ ECP28MWB(Ln)) для тримерных (1-4) и димерных (5-10) комплексов лантаноидов. На
основе этих расчетов изучена топология электронной плотности, природа и энергия химических
связей, а также распределение зарядов. Показано, что:
• Реализация внутримолекулярных аттрактивных Fδ-…Fδ- взаимодействий в этих структурах
обусловлена соответствием области концентрации ДЭП на одном из атомов и области
разрежения ДЭП на другом. Отмечено, что вклад F…F контактов превышает F…H и F…O.
• Увеличение степени заполнения координационной сферы (>93 %) атома Ln в ряду
изоструктурных димерных комплексов 5-8 приводит к увеличению расстояния Ln…F и
уменьшению энергии взаимодействия. Также к уменьшению энергии взаимодействия приводит
координация нейтральных донорных растворителей.
4. Впервые исследована топология ЭП по низкоугловым рентгенодифракционным данным в
кристаллах димерных комплексах (5-9) лантаноидов с использованием модели молекулярных
инвариомов. Отличия в топологических характеристиках ЭП, полученных с помощью
молекулярных инвариомов и DFT расчетов не превышают индекса переносимости.
18
19.
Апробация работы1. Кузяев Д. М., Румянцев Р. В., Фукин Г. К., Бочкарев М. Н. Гексафторизопропоксиды
двух- и трехвалентных лантаноидов. Строение и люминесцентные свойства // Изв. АН.
Сер. хим., 2014, 4, 848-853.
2. Румянцев Р. В., Фукин Г. К. Внутримолекулярные дативные взаимодействия C-F→Ln
в комплексах лантаноидов с фторированными лигандами // Изв. АН. Сер. хим., 2017, 9,
1557-1562.
3. Румянцев Р. В., Фукин Г. К. Внутримолекулярные невалентные взаимодействия в
комплексе EuIII(µ-ORF)2(µ2-ORF)3(µ3-ORF)2(ДМЭ)2 // Координационная химия, 2019, 11,
663-671.
4. Румянцев Р. В. Нековалентные взаимодействия в комплексах лантаноидов с
фторированными лигандами // VIII конференция молодых учёных по общей и
неорганической химии. Тезисы докладов, 2018, 254-255.
5. Румянцев Р. В., Фукин Г. К. Особенности электронного строения тримерных
комплексов лантаноидов с гексафторизопропоксидными лигандами // XXIII
нижегородская сессия молодых учёных (технические, естесственные, математические
науки). Материалы докладов, 2018, 88-89.
19
20.
Благодарности• Коллективу лаборатории ХРЗЭ ИМХ РАН за
предоставленные интересные образцы для
исследования
• Моим коллегам по группе РДИ:
Фукину Г. К.,
Баранову Е. В.,
Черкасову А. В.,
Козловой Е. А.,
Верховых В. А.,
Самсонову М. А.
За неоценимую помощь и поддержку!
20
















 Физика
Физика Химия
Химия








