Похожие презентации:
Физико-химические методы анализа. Лекция 3
1.
Московский технологический университетИнститут тонких химических технологий имени М.В. Ломоносова
кафедра Аналитической химии имени Алимарина И.П.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
АНАЛИЗА
Преподаватель
ассистент, Мартынов Леонид
Москва, 2018 г.
Юрьевич
2.
Лекция 3Косвенная полярография
(вольтамперометрия). Амперометрия.
Амперометрическое титрование
3. Амперометрия и амперометрическое титрование
• Амперометрия–
частный
случай
постояннотоковой
вольтамперометрии, основанной на измерении тока при постоянном
фиксированном значении потенциала в области предельного тока.
Соотношение концентраций
определяемого вещества
Cз > C2 > C1
• Различают прямую и косвенную амперометрию. Прямая амперометрия
положена в основу многих электрохимических (амперометрических)
сенсоров.
• Косвенная амперометрия – используется в индикации к.т.т. в
титриметрии и часто называется амперометрическим титрованием
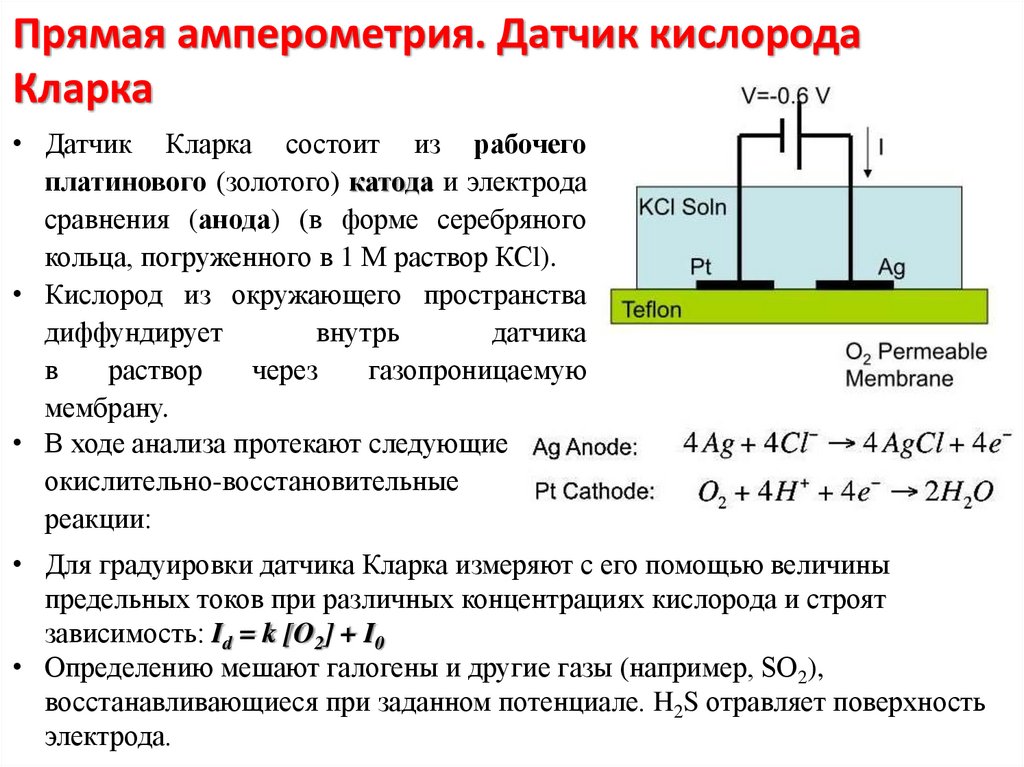
4. Прямая амперометрия. Датчик кислорода Кларка
• Датчик Кларка состоит из рабочегоплатинового (золотого) катода и электрода
сравнения (анода) (в форме серебряного
кольца, погруженного в 1 М раствор КСl).
• Кислород из окружающего пространства
диффундирует
внутрь
датчика
в
раствор
через
газопроницаемую
мембрану.
• В ходе анализа протекают следующие
окислительно-восстановительные
реакции:
• Для градуировки датчика Кларка измеряют с его помощью величины
предельных токов при различных концентрациях кислорода и строят
зависимость: Id = k [O2] + I0
• Определению мешают галогены и другие газы (например, SO2),
восстанавливающиеся при заданном потенциале. H2S отравляет поверхность
электрода.
5. Леланд Клар (1918-2005)
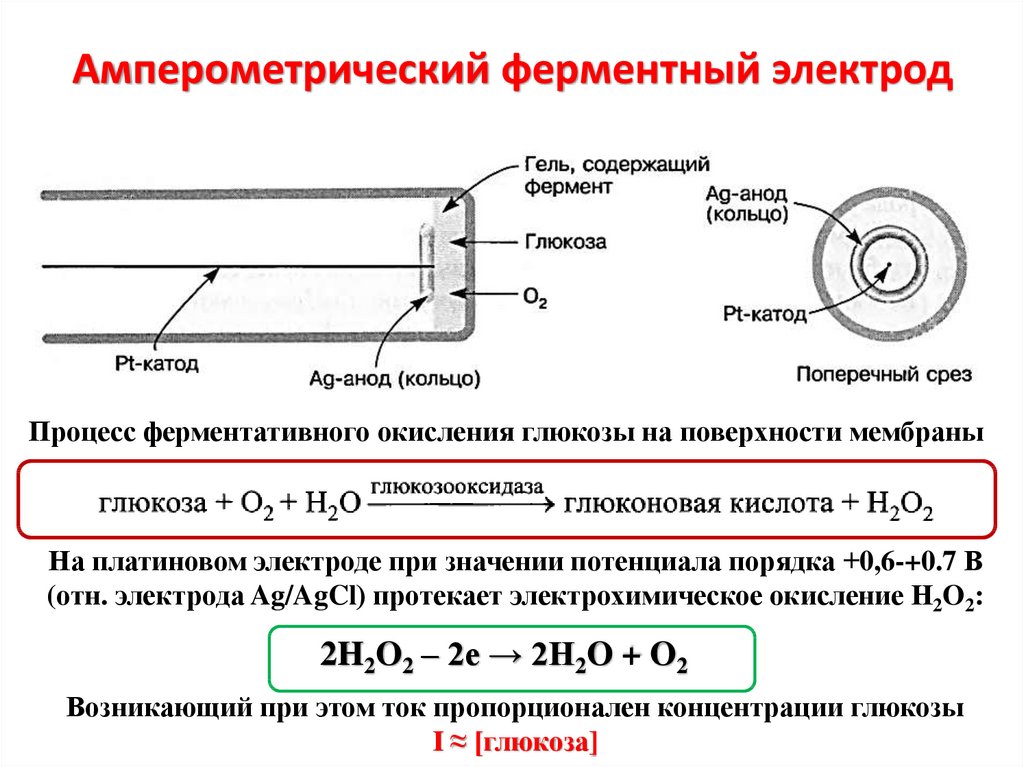
6. Амперометрический ферментный электрод
Процесс ферментативного окисления глюкозы на поверхности мембраныНа платиновом электроде при значении потенциала порядка +0,6-+0.7 В
(отн. электрода Ag/AgCl) протекает электрохимическое окисление Н2O2:
2H2O2 – 2e → 2H2O + O2
Возникающий при этом ток пропорционален концентрации глюкозы
I ≈ [глюкоза]
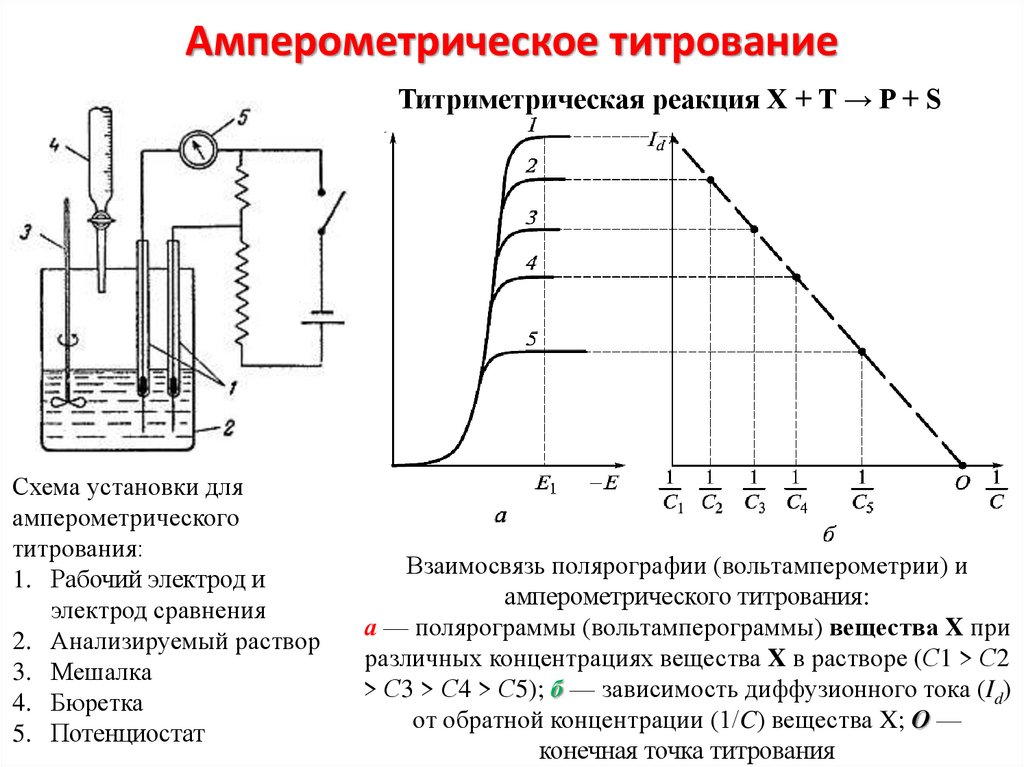
7. Амперометрическое титрование
Титриметрическая реакция X + T → P + SСхема установки для
амперометрического
титрования:
1. Рабочий электрод и
электрод сравнения
2. Анализируемый раствор
3. Мешалка
4. Бюретка
5. Потенциостат
Взаимосвязь полярографии (вольтамперометрии) и
амперометрического титрования:
а — полярограммы (вольтамперограммы) вещества X при
различных концентрациях вещества X в растворе (С1 > С2
> С3 > С4 > С5); б — зависимость диффузионного тока (Id)
от обратной концентрации (1/C) вещества X; О —
конечная точка титрования
8. Практические аспекты амперометрического титрования
Для практического осуществления амперометрического титрованиянеобходимо:
• выбрать химическую (титриметрическую) реакцию:
X + T = P + S,
где X – анализируемое вещество, T – титрант, P – продукт, S –
растворитель
• определить среди участников титриметрической реакции – X, T или P
– электроактивное вещество, т.е. вещество, которое участвует в
электродном процессе и концентрация которого меняется в процессе
титрования.
• выбрать материал рабочего электрода
• определить по экспериментально полученным вольтамперным кривым
потенциал, отвечающий области предельного тока электроактивного
вещества
• подобрать состав фонового раствора, учесть наличие примесей (при
необходимости удалить) и pH раствора, проводить термостатирование
=> для получения воспроизводимых результатов
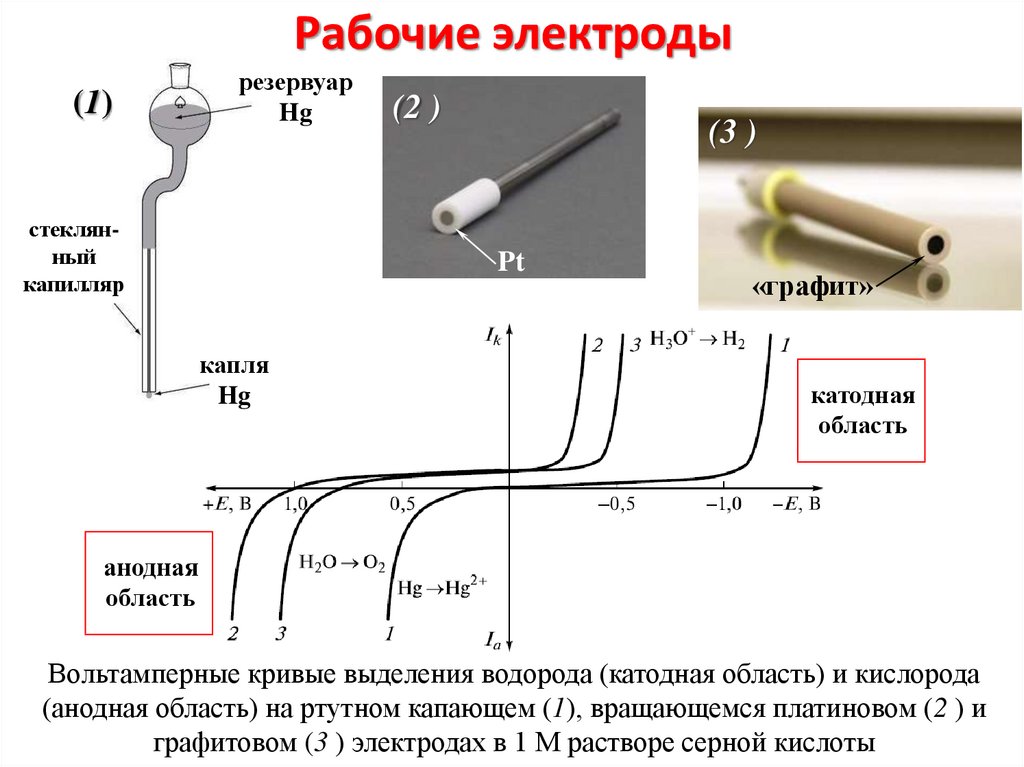
9. Рабочие электроды
(1)резервуар
Hg
стеклянный
капилляр
(2 )
(3 )
Pt
капля
Hg
«графит»
катодная
область
анодная
область
Вольтамперные кривые выделения водорода (катодная область) и кислорода
(анодная область) на ртутном капающем (1), вращающемся платиновом (2 ) и
графитовом (3 ) электродах в 1 M растворе серной кислоты
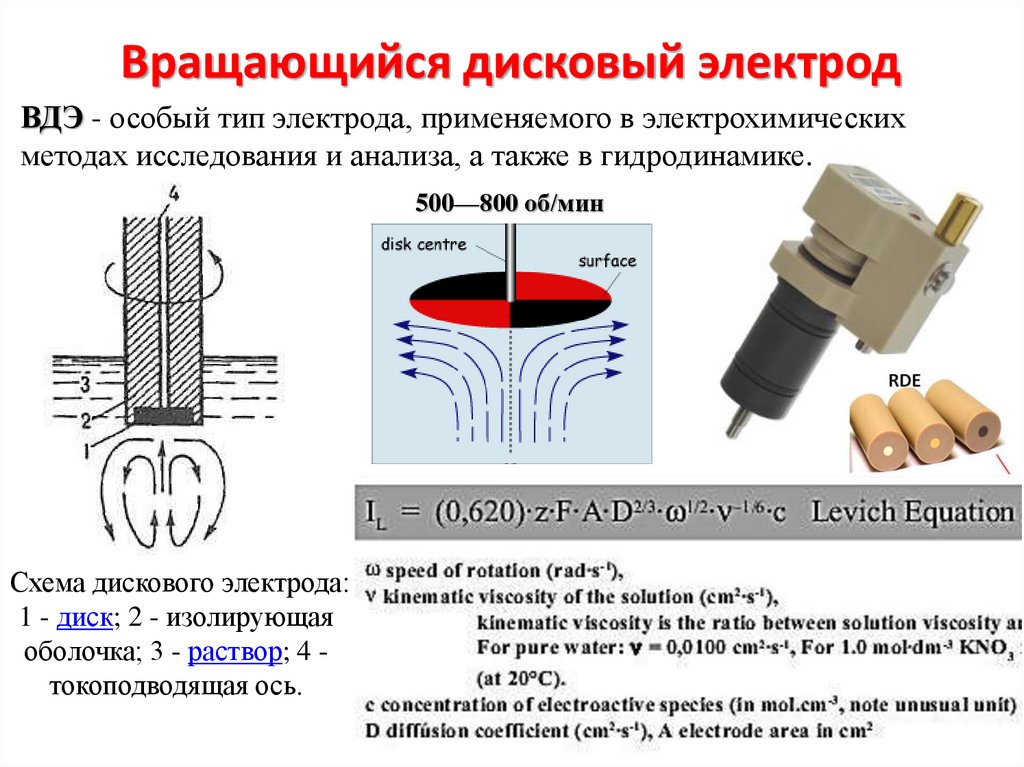
10. Вращающийся дисковый электрод
ВДЭ - особый тип электрода, применяемого в электрохимическихметодах исследования и анализа, а также в гидродинамике.
500—800 об/мин
Схема дискового электрода:
1 - диск; 2 - изолирующая
оболочка; 3 - раствор; 4 токоподводящая ось.
11. Кривые амперометрического титрования
Пусть протекает химическая реакцияА+В↔С
где А — определяемое (титруемое) вещество; В — титрант; С — продукт
реакции.
В зависимости от того, какое из веществ титриметрической реакции является
электроактивным – различают следующие виды кривых титрования:
(1) Титрование по току определяемого вещества: вещество А является при
выбранном потенциале E1 электроактивным (восстанавливается), вещества B и
С – не электроактивные при соответствующем потенциале.
Пример: Титриметрическая реакция: Ag+ + Cl- = AgCl↓
Электродная реакция:
К(-) Ag+ + e- = Ag0
A(+) 2H2O - 4e- = O2 + 4H+
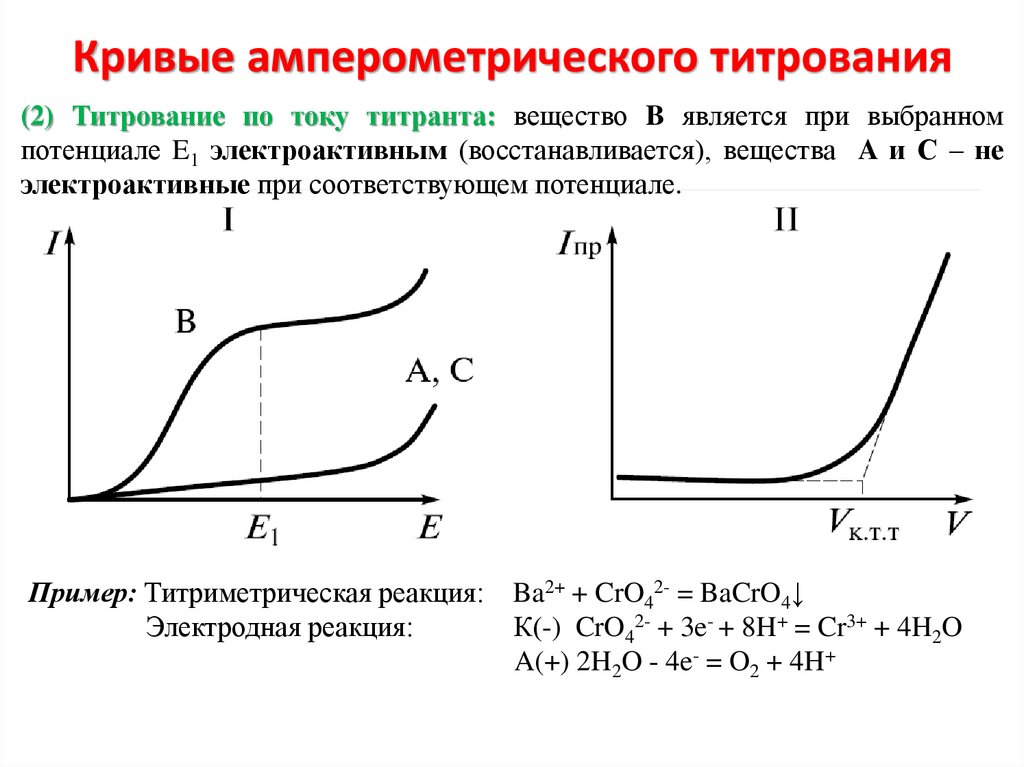
12. Кривые амперометрического титрования
(2) Титрование по току титранта: вещество B является при выбранномпотенциале E1 электроактивным (восстанавливается), вещества A и С – не
электроактивные при соответствующем потенциале.
Пример: Титриметрическая реакция:
Электродная реакция:
Ba2+ + CrO42- = BaCrO4↓
К(-) CrO42- + 3e- + 8H+ = Cr3+ + 4H2O
A(+) 2H2O - 4e- = O2 + 4H+
13.
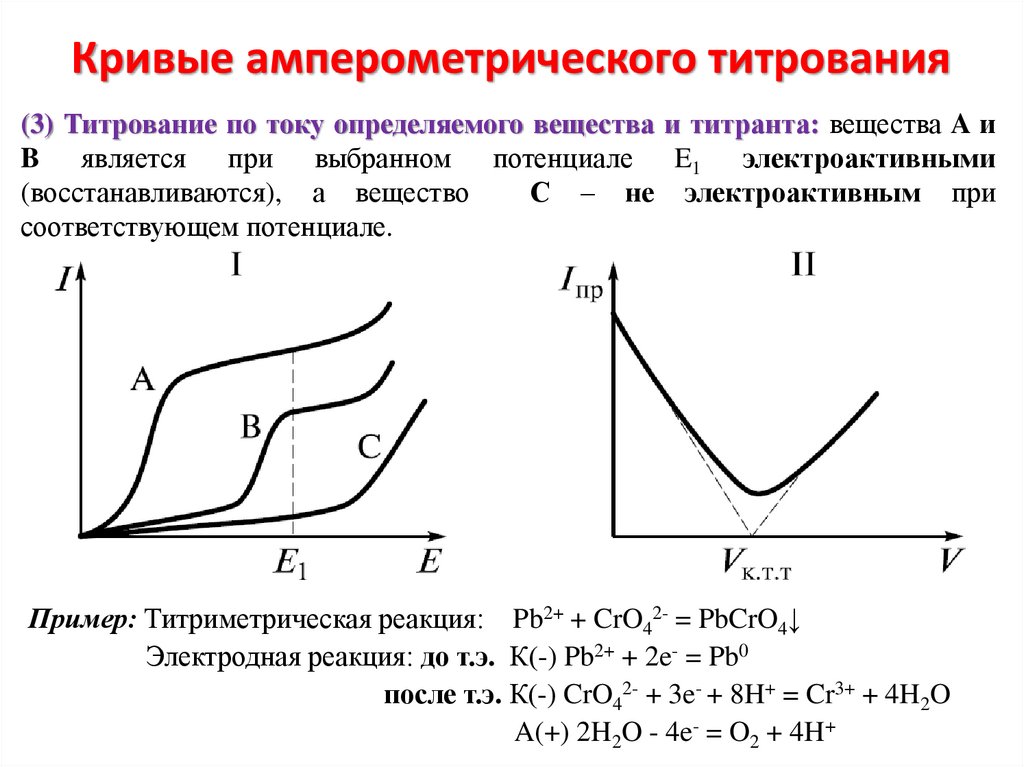
Кривые амперометрического титрования(3) Титрование по току определяемого вещества и титранта: вещества A и
B является при выбранном потенциале E1 электроактивными
(восстанавливаются), а вещество
С – не электроактивным при
соответствующем потенциале.
Пример: Титриметрическая реакция: Pb2+ + CrO42- = PbCrO4↓
Электродная реакция: до т.э. К(-) Pb2+ + 2e- = Pb0
после т.э. К(-) CrO42- + 3e- + 8H+ = Cr3+ + 4H2O
A(+) 2H2O - 4e- = O2 + 4H+
14.
Кривые амперометрического титрования(4) Титрование по току продукта реакции: вещество С является при
выбранном потенциале E1 электроактивным, вещества
A и B – не
электроактивные при соответствующем потенциале.
Пример: Титриметрическая реакция: HAsVO42- + 2I- + 2H+ = HAsIIIO32- + I2 + H2O
Электродная реакция:
K(-) I2 + 2e- = 2IA(+) 2H2O - 4e- = O2 + 4H+
15.
Кривые амперометрического титрования(5) Титрование по току определяемого вещества и титранта с разнородными
электродными реакциями: вещества A и B является при выбранном
потенциале E1 электроактивными, но участвуют в электродных реакциях
разного типа, т. е. одно из них на электроде окисляется, а другое
восстанавливается, вещество С – не электроактивное при соответствующем
потенциале.
Пример: Титриметрическая реакция: Fe2+ + VO3+ = Fe3+ + VO2+
Электродная реакция: до т.э. A(+) Fe2+ - 1e- = Fe3+
после т.э. К(-) VO3+ + 1e- = VO2+
16.
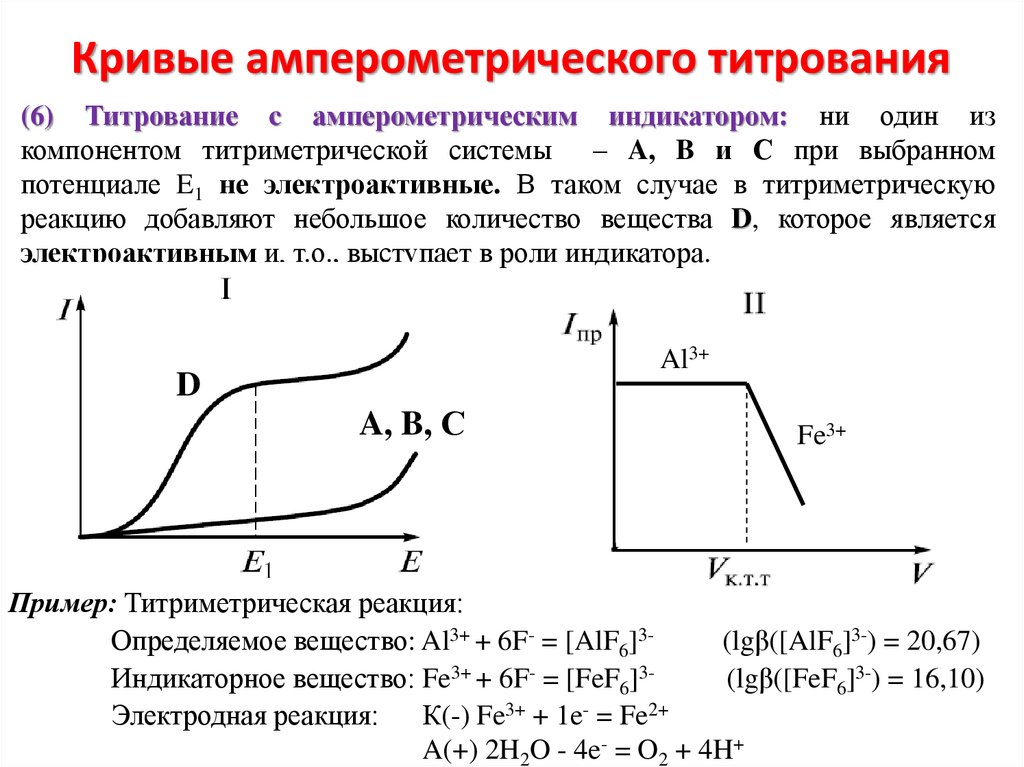
Кривые амперометрического титрования(6) Титрование c амперометрическим индикатором: ни один из
компонентом титриметрической системы – A, B и С при выбранном
потенциале E1 не электроактивные. В таком случае в титриметрическую
реакцию добавляют небольшое количество вещества D, которое является
электроактивным и, т.о., выступает в роли индикатора.
Al3+
D
A,A,B,B,СС
Fe3+
Пример: Титриметрическая реакция:
Определяемое вещество: Al3+ + 6F- = [AlF6]3(lgβ([AlF6]3-) = 20,67)
Индикаторное вещество: Fe3+ + 6F- = [FeF6]3(lgβ([FeF6]3-) = 16,10)
Электродная реакция:
К(-) Fe3+ + 1e- = Fe2+
A(+) 2H2O - 4e- = O2 + 4H+
17.
Кривые амперометрического титрования(7) Титрование cмеси двух веществ (одно из которых электроактивное):
осуществляют дифференциальное (ступенчатое) титрование смеси двух
веществ A и D, одно из которых является при выбранном потенциале E1
электроактивным, а другое - не электроактивным при соответствующем
потенциале; наряду с этим титрант при выбранном потенциале –
электроактивный.
Например, ионы Pb2+ и Ва2+ титруют К2CrO4; при Е(Hg) = –1,0 В активны Pb2+
и CrO42–
Титриметрическая реакция:
Pb2+ + CrO42- = PbCrO4↓ Ks(PbCrO4) = 1,18∙10–14
Ba2+ + CrO42- = BaCrO4↓ Ks(BaCrO4) = 1,18∙10–10
Электродная реакция:
К(-) Pb2+ + 2e- = Pb0
A(+) 2H2O - 4e- = O2 + 4H+
18. Преимущества амперометрического титрования
• экспрессность и простота – для построения кривойдостаточно нескольких точек
• титрование можно проводить в окрашенных и мутных
средах, и даже в присутствии большого количества
примесей
• можно анализировать электрохимически неактивные
вещества
• возможно определение нескольких веществ в смеси
• применяют при анализе разбавленных растворов (10-5
– 10-6 моль/л)
• ошибка метода (Sr) при количествах определяемого
вещества 1-0,1 мг - не превышает обычно ± 2%.
19. Области применения амперометрического титрования
Амперометрическое титрование применяют в анализе:• минерального сырья и продуктов его переработки
• природных вод и промышленных растворов
• фармацевтических препаратов
• продуктов и полупродуктов органического синтеза
• полимеров










 Химия
Химия








