Похожие презентации:
Аминокислоты 2
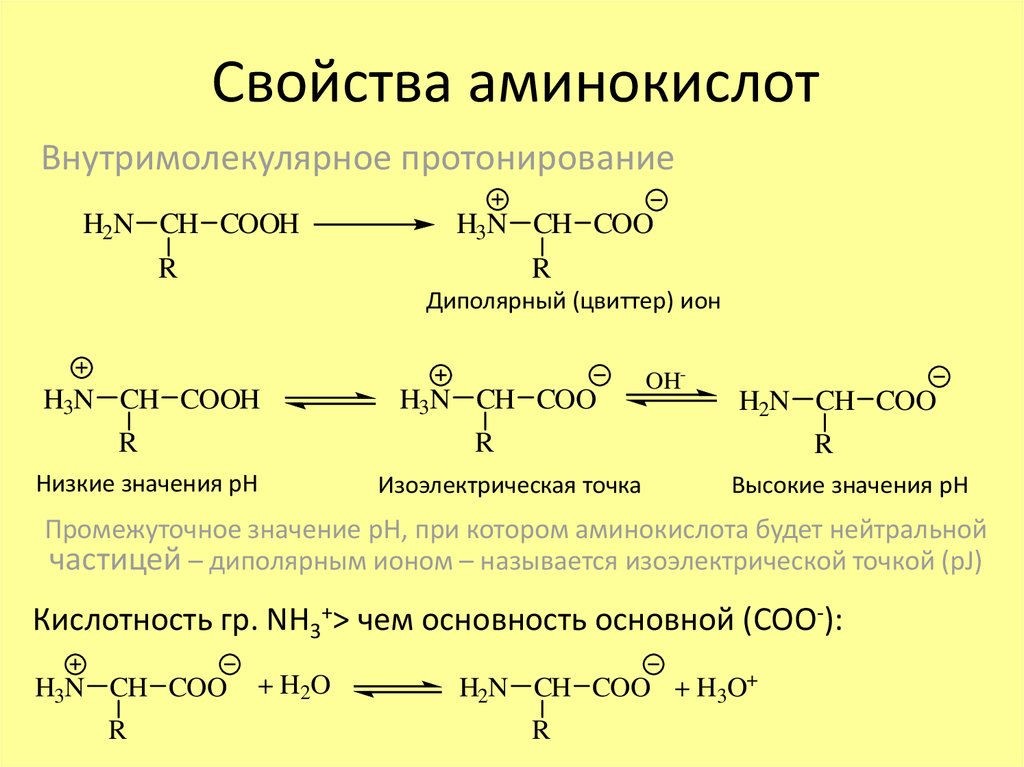
1. Свойства аминокислот
Внутримолекулярное протонированиеH2N CH COOH
H3N CH COO
R
R
Диполярный (цвиттер) ион
H3N CH COOH
R
H3N CH COO
OH-
H2N CH COO
R
Низкие значения рН
R
Изоэлектрическая точка
Высокие значения рН
Промежуточное значение рН, при котором аминокислота будет нейтральной
частицей – диполярным ионом – называется изоэлектрической точкой (pJ)
Кислотность гр. NH3+> чем основность основной (СОО-):
H3N CH COO
R
+ H2O
H2N CH COO + H3O+
R
2.
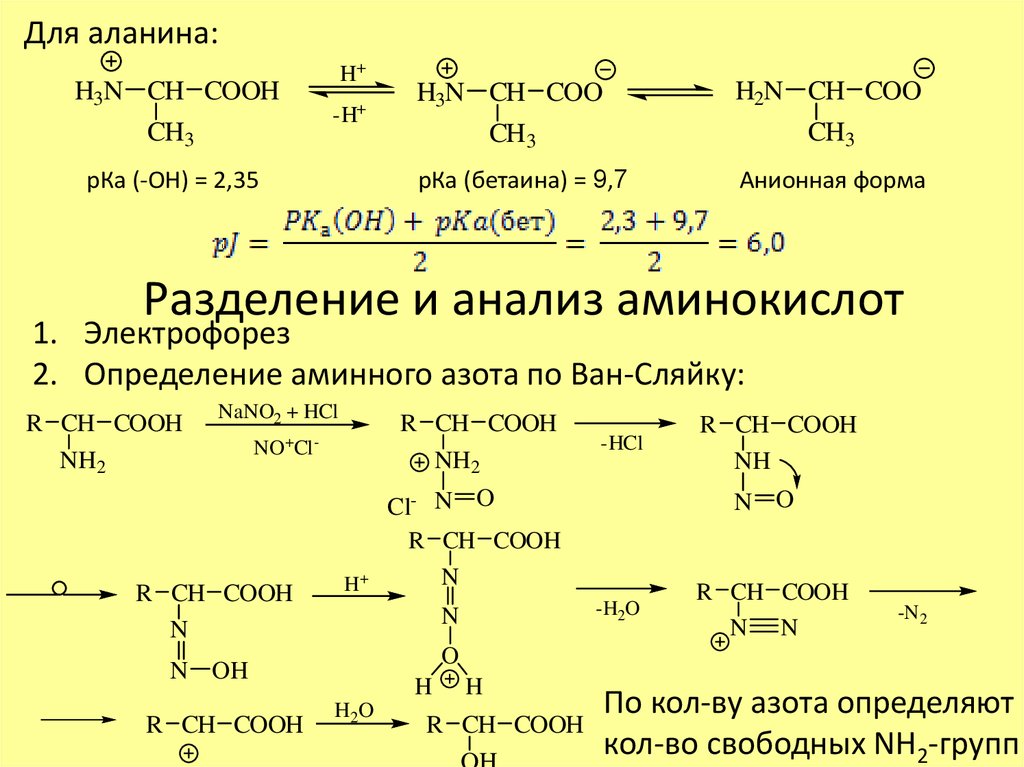
Для аланина:H3N CH COOH
CH3
H+
-H+
рКа (-ОН) = 2,35
H3N CH COO
H2N CH COO
CH3
CH3
рКа (бетаина) = 9,7
Анионная форма
Разделение и анализ аминокислот
1. Электрофорез
2. Определение аминного азота по Ван-Сляйку:
R CH COOH
NH2
NaNO2 + HCl
R CH COOH
NH2
NO+Cl -
R CH COOH
N
H+
Cl- N O
R CH COOH
N
R CH COOH
NH
N O
-H2O
N
R CH COOH
N N
-N2
O
N OH
R CH COOH
-HCl
H
H2O
H
R CH COOH
По кол-ву азота определяют
кол-во свободных NH2-групп
3.
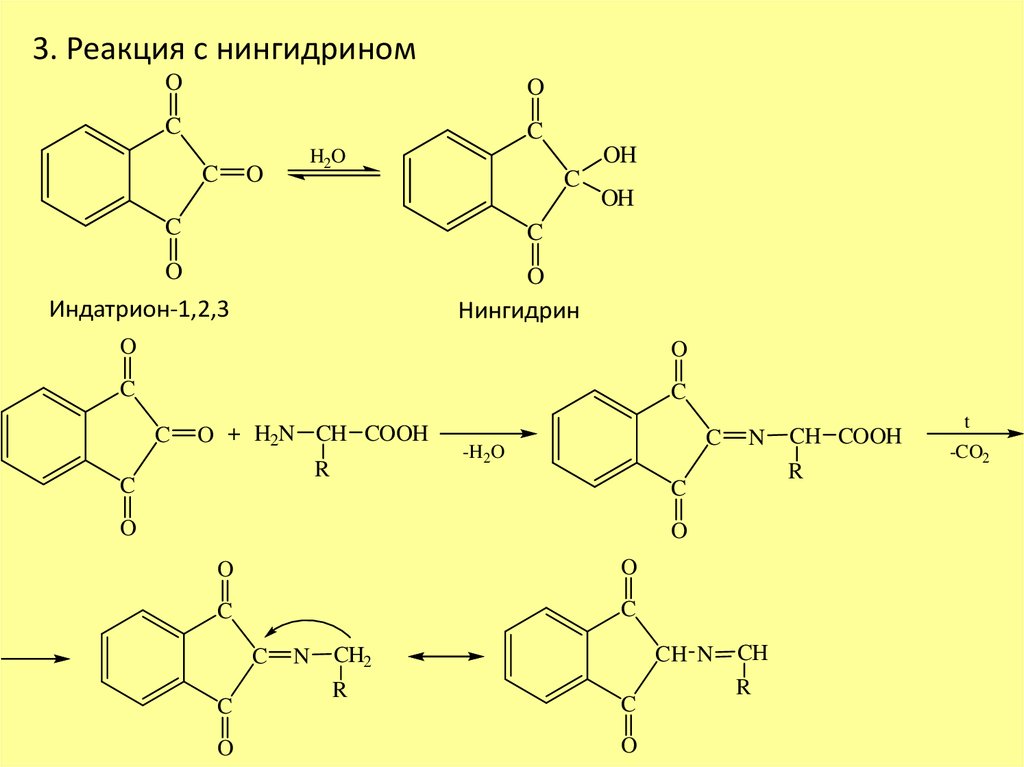
3. Реакция с нингидриномO
O
C
C
C
O
OH
H2O
C
C
C
O
O
Индатрион-1,2,3
OH
Нингидрин
O
O
C
C
C
C
O + H2N CH COOH
R
C
-H2O
N
R
C
O
O
O
O
C
C
C
C
O
N
CH N
CH2
R
C
O
CH COOH
CH
R
t
-CO2
4.
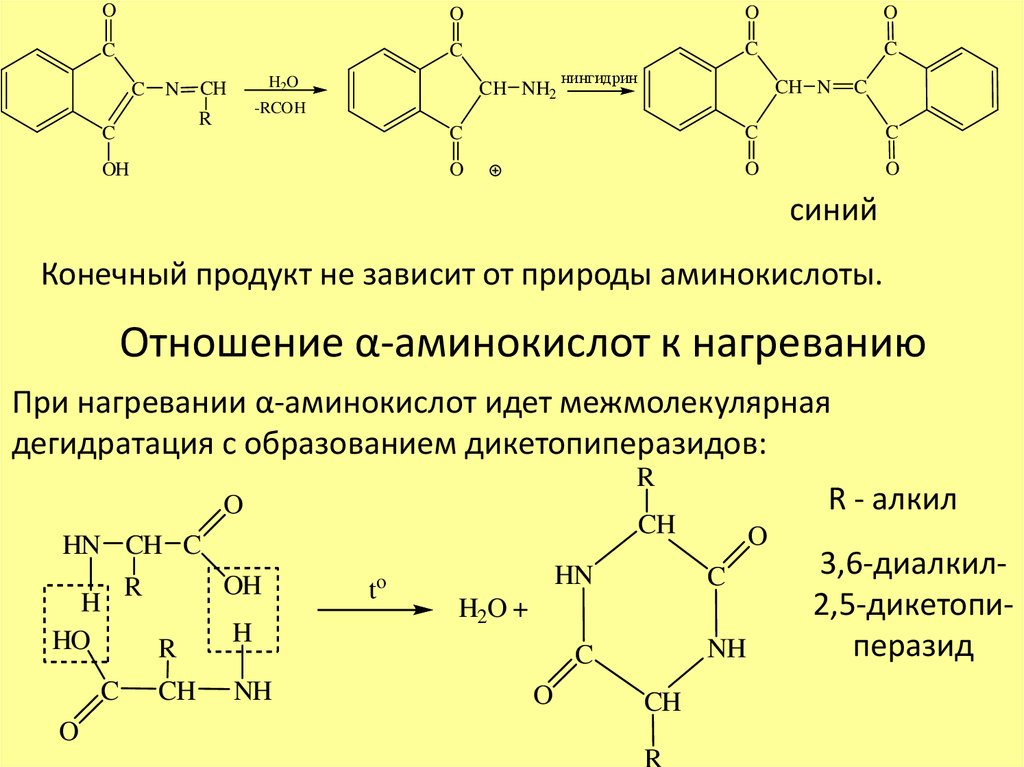
OO
O
O
C
C
C
C
C
N
H2O
CH
-RCOH
R
C
CH NH2
OH
нингидрин
CH N
C
C
C
C
O
O
O
синий
Конечный продукт не зависит от природы аминокислоты.
Отношение α-аминокислот к нагреванию
При нагревании α-аминокислот идет межмолекулярная
дегидратация с образованием дикетопиперазидов:
R
O
CH
HN CH C
OH
R
H
HO
R
C
CH
H
NH
R - алкил
to
HN
O
C
H2O +
NH
C
O
CH
O
R
3,6-диалкил2,5-дикетопиперазид
5.
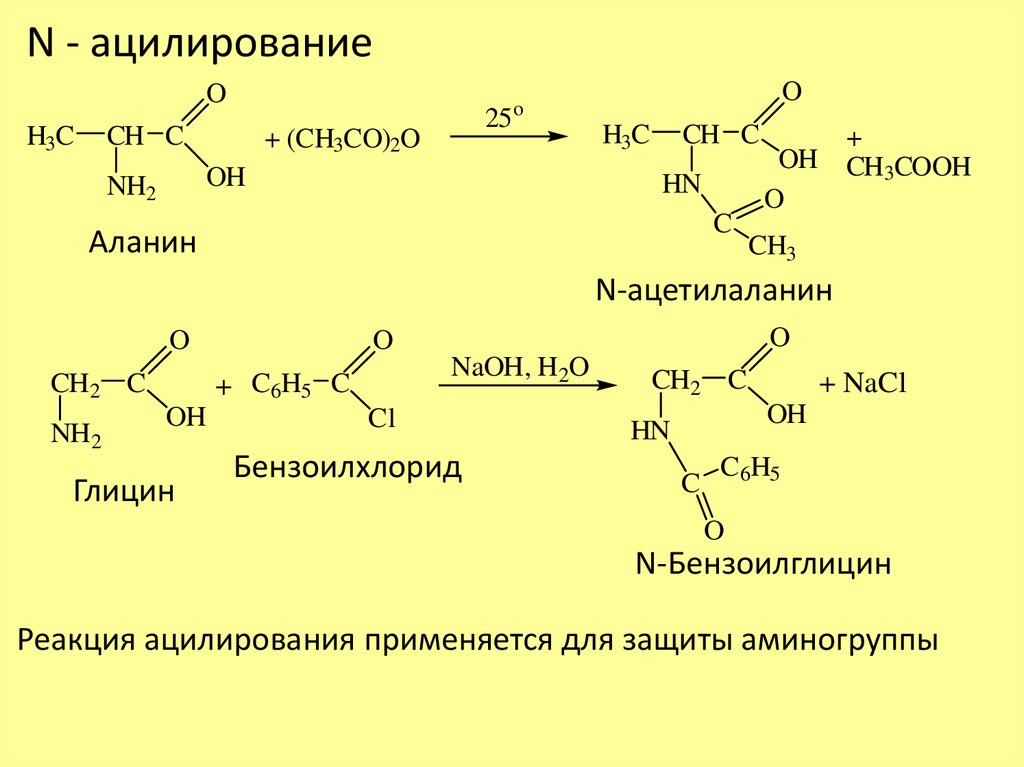
N - ацилированиеO
H3C
CH C
25
+ (CH3CO)2O
OH
NH2
O
o
H3C
CH C
HN
C
Аланин
+
CH3COOH
OH
O
CH3
N-ацетилаланин
O
CH2 C
NH2
NaOH, H2O
+ C6H5 C
OH
Глицин
O
O
Cl
Бензоилхлорид
CH2 C
+ NaCl
OH
HN
C
C6H5
O
N-Бензоилглицин
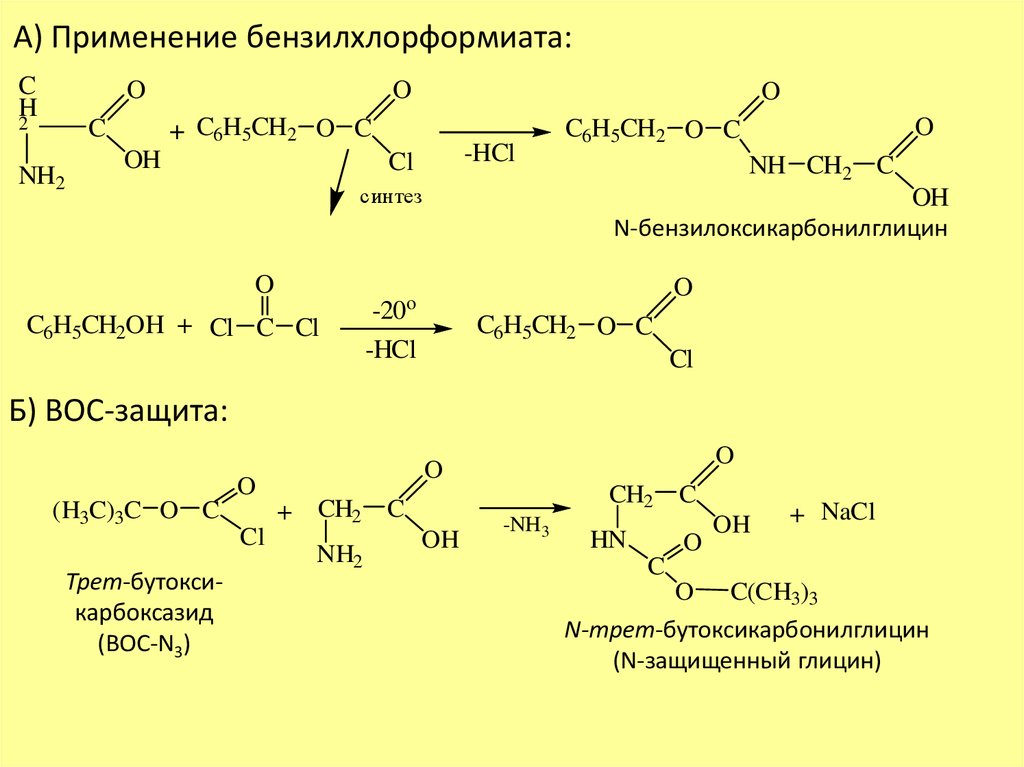
Реакция ацилирования применяется для защиты аминогруппы
6.
А) Применение бензилхлорформиата:C
H
O
2
O
+ C6H5CH2 O C
C
NH2
O
OH
-HCl
Cl
синтез
O
C6H5CH2OH + Cl C Cl
O
C6H5CH2 O C
NH CH2 C
OH
N-бензилоксикарбонилглицин
O
-20o
C6H5CH2 O C
-HCl
Cl
Б) ВОС-защита:
O
(H3C)3C O C
Трет-бутоксикарбоксазид
(ВОС-N3)
Cl
O
O
CH2
+ CH2 C
NH2
OH
-NH3
HN
C
O
OH
+ NaCl
C
O
C(CH3)3
N-трет-бутоксикарбонилглицин
(N-защищенный глицин)
7.
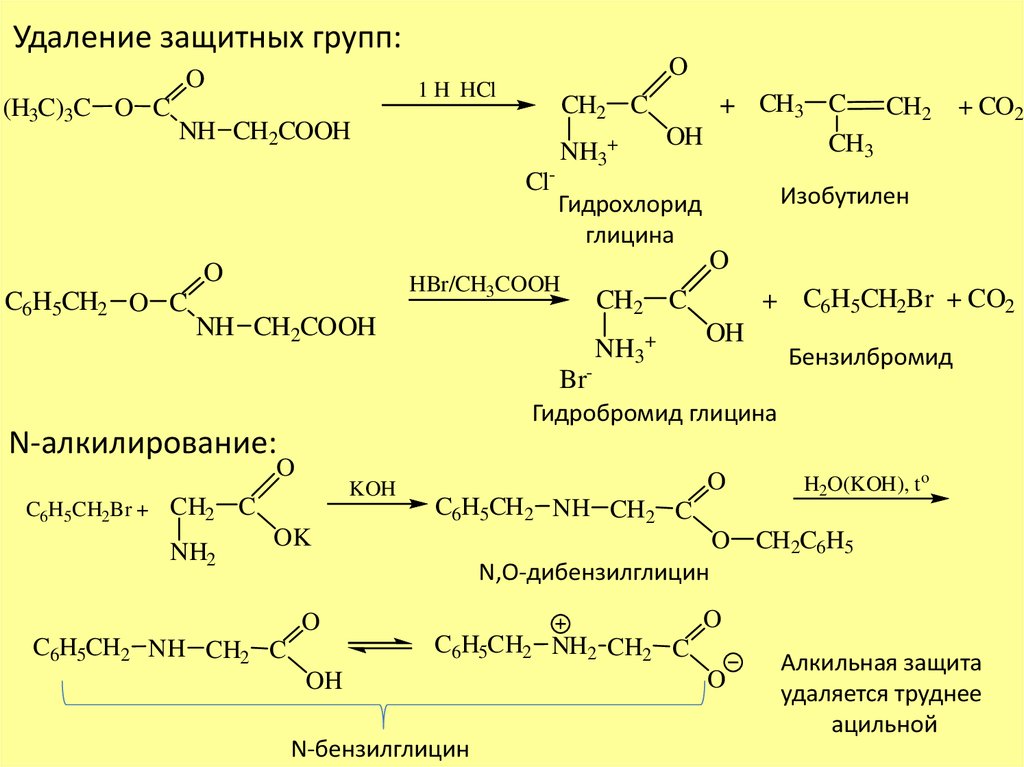
Удаление защитных групп:O
O
(H3C)3C O C
1 H HCl
CH2 C
NH CH2COOH
Cl-
Изобутилен
Гидрохлорид
глицина
O
O
C6H5CH2 O C
NH3+
+ CH3 C CH2 + CO2
OH
CH3
HBr/CH3COOH
NH CH2COOH
Br-
+ C6H5CH2Br + CO2
CH2 C
NH3+
OH
Бензилбромид
Гидробромид глицина
N-алкилирование:
O
C6H5CH2Br + CH2
NH2
KOH
C
O
C6H5CH2 NH CH2 C
OK
O
H2O(KOH), t o
CH2C6H5
N,O-дибензилглицин
O
C6H5CH2 NH CH2 C
O
C6H5CH2 NH2 CH2 C
OH
N-бензилглицин
O
Алкильная защита
удаляется труднее
ацильной
8.
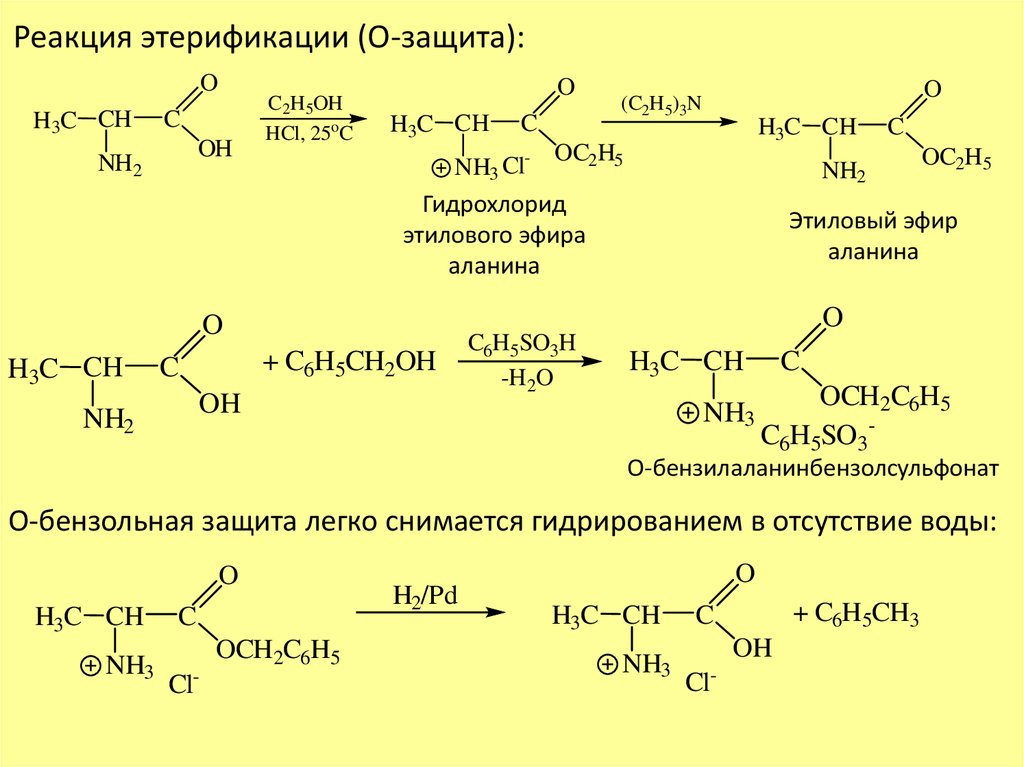
Реакция этерификации (О-защита):O
H3C CH
C
OH
NH2
C2H5OH
HCl, 25oC
O
H3C CH
C
NH3 Cl-
O
(C2H5)3N
H3C CH
OC2H5
NH2
Гидрохлорид
этилового эфира
аланина
+ C6H5CH2OH
C
OH
NH2
OC2H5
Этиловый эфир
аланина
O
O
H3C CH
C
C6H5SO3H
-H2O
H3C CH
NH3
C
OCH2C6H5
C6H5SO3-
О-бензилаланинбензолсульфонат
О-бензольная защита легко снимается гидрированием в отсутствие воды:
O
H3C CH
NH3
C
OCH2C6H5
Cl-
H2/Pd
O
H3C CH
NH3
+ C6H5CH3
C
OH
Cl-
9.
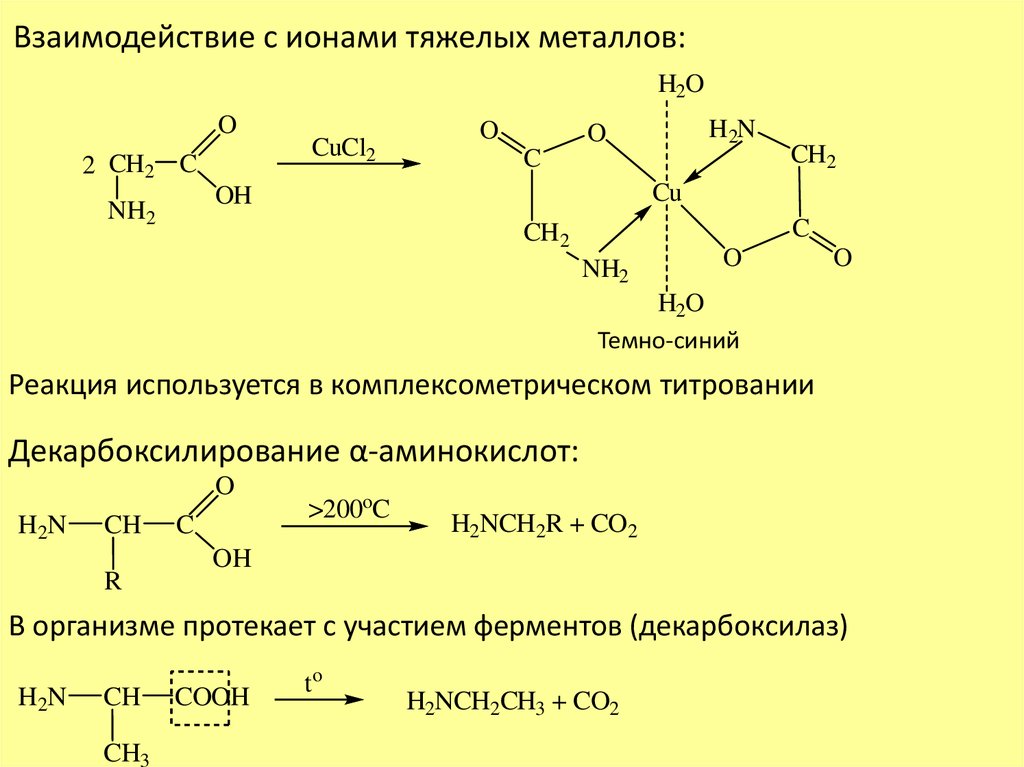
Взаимодействие с ионами тяжелых металлов:H2O
O
2 CH2 C
CuCl2
O
C
CH2
Cu
OH
NH2
H2N
O
C
CH2
NH2
O
O
H2O
Темно-синий
Реакция используется в комплексометрическом титровании
Декарбоксилирование α-аминокислот:
O
H2N
CH
R
C
>200oC
H2NCH2R + CO2
OH
В организме протекает с участием ферментов (декарбоксилаз)
H2N
CH
CH3
COOH
to
H2NCH2CH3 + CO2
10.
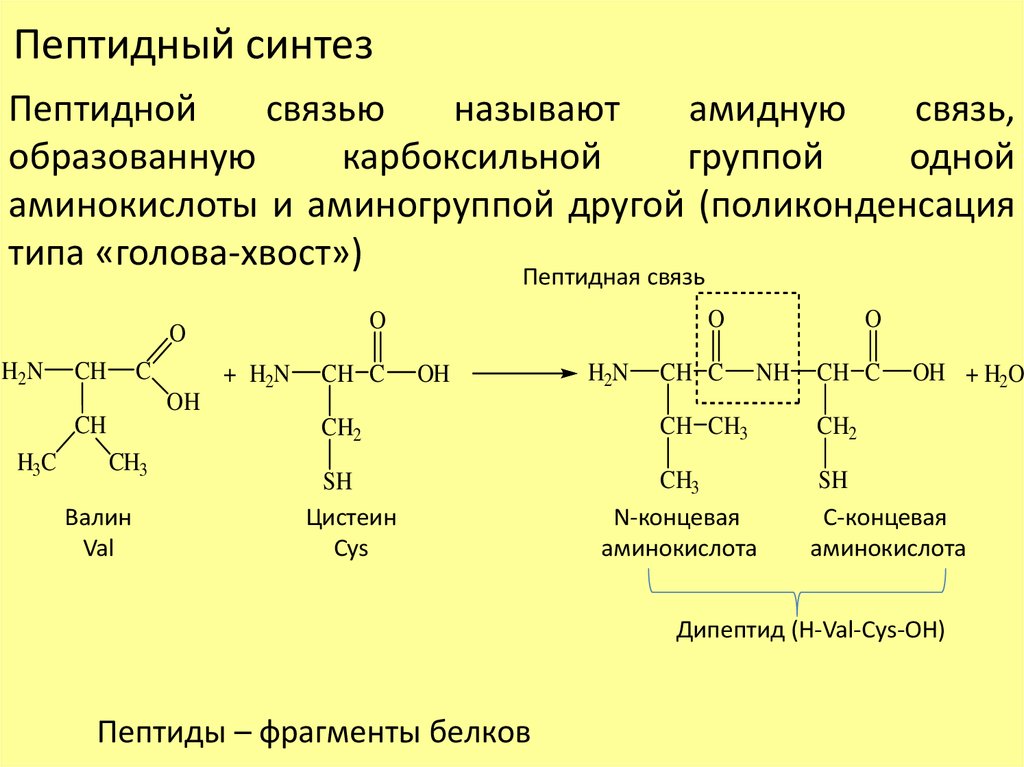
Пептидный синтезПептидной
связью
называют
амидную
связь,
образованную
карбоксильной
группой
одной
аминокислоты и аминогруппой другой (поликонденсация
типа «голова-хвост»)
Пептидная связь
H2N
CH
C
+ H2N
CH C
OH
H2N
CH C
O
NH
CH C
OH + H2O
OH
CH
H3C
O
O
O
CH2
CH3
Валин
Val
SH
Цистеин
Cys
CH CH3
CH3
N-концевая
аминокислота
CH2
SH
С-концевая
аминокислота
Дипептид (H-Val-Cys-OH)
Пептиды – фрагменты белков
11.
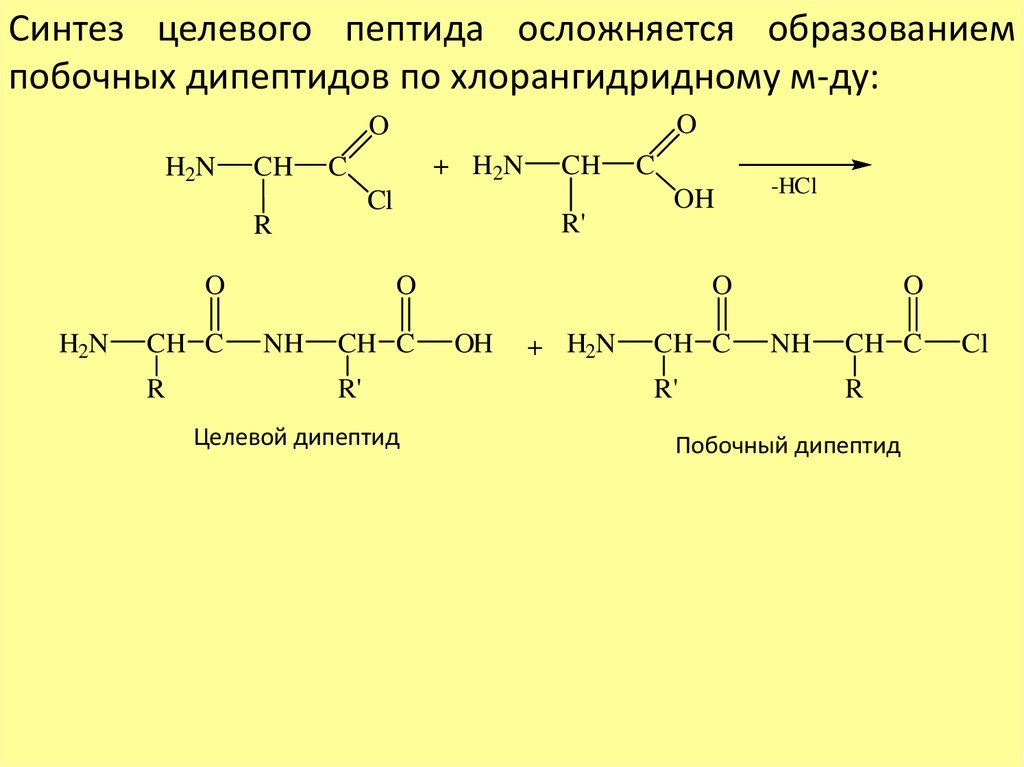
Синтез целевого пептида осложняется образованиемпобочных дипептидов по хлорангидридному м-ду:
O
O
H2N
CH
Cl
R
O
H2N
CH C
R
+ H2N
C
CH
R'
C
OH
O
NH
CH C
R'
Целевой дипептид
-HCl
O
OH
+ H2N
CH C
R'
O
NH
CH C
R
Побочный дипептид
Cl
12.
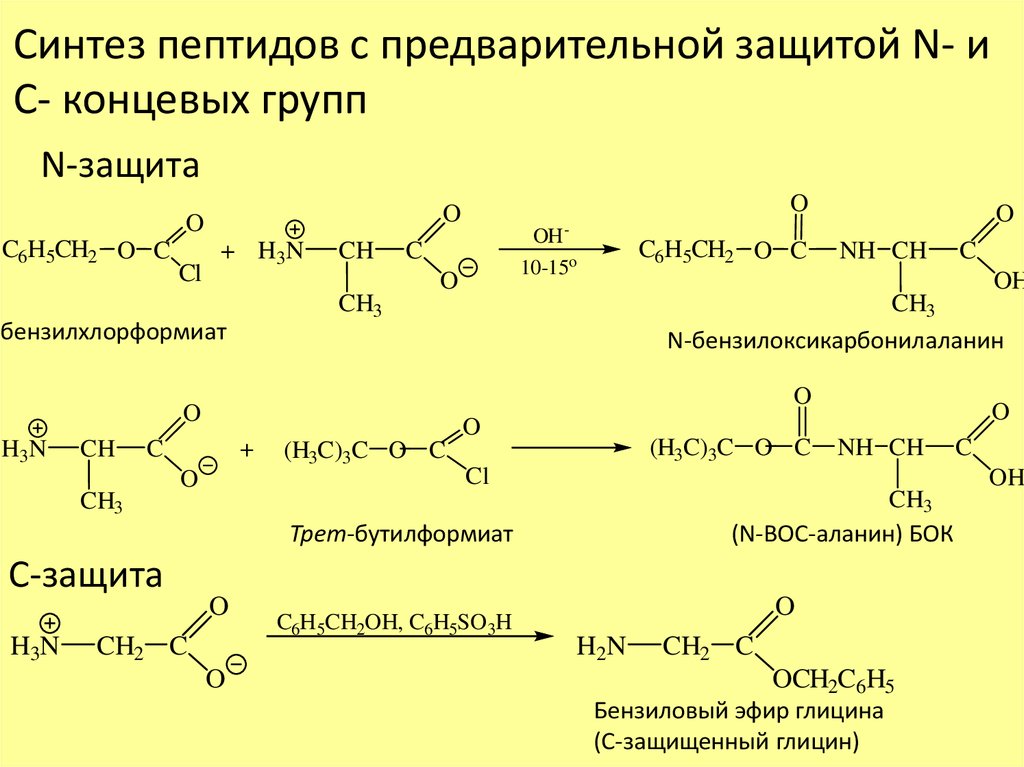
Синтез пептидов с предварительной защитой N- иС- концевых групп
N-защита
C6H5CH2 O C
Cl
+ H3N
CH
CH3
бензилхлорформиат
CH
O
C6H5CH2 O C
+
O
H3N
NH CH
C
OH
CH3
N-бензилоксикарбонилаланин
O
(H3C)3C O C
(H3C)3C O C
O
CH2 C
O
O
NH CH
Cl
CH3
(N-ВОС-аланин) БОК
Трет-бутилформиат
С-защита
O
O
C
CH3
OH10-15o
C
O
H3N
O
O
O
C6H5CH2OH, C6H5SO3H
O
H2N
CH2 C
OCH2C6H5
Бензиловый эфир глицина
(С-защищенный глицин)
C
OH
13.
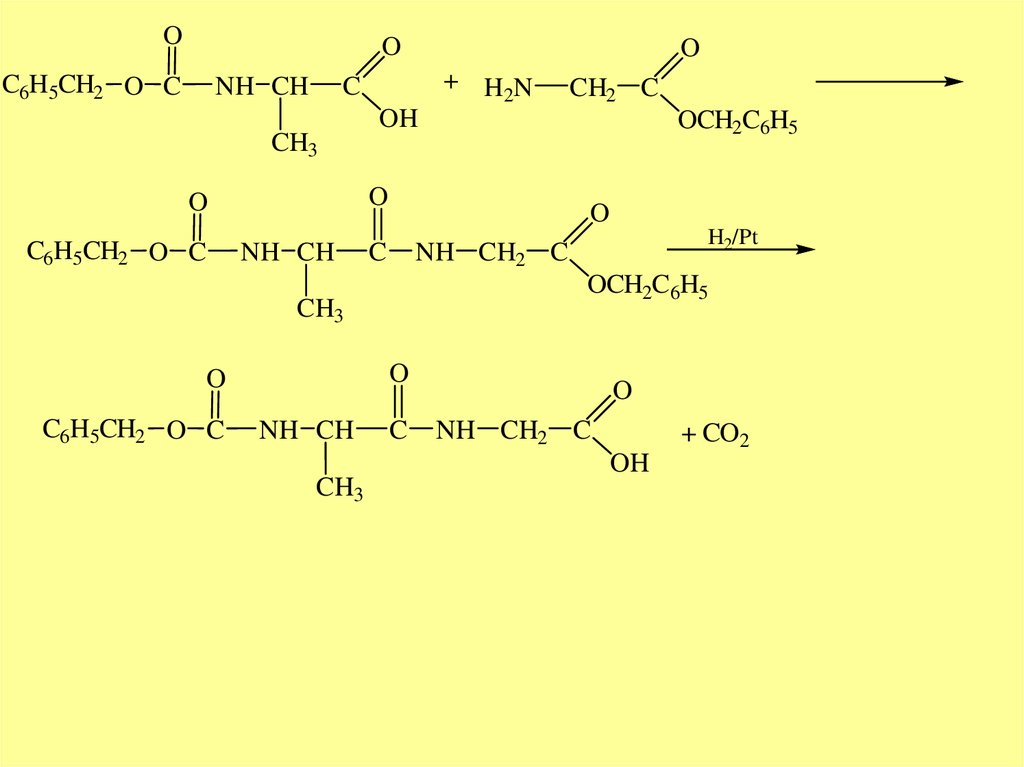
OO
C6H5CH2 O C
NH CH
+ H2N
C
CH3
NH CH
OCH2C6H5
O
C
H2/Pt
NH CH2 C
OCH2C6H5
CH3
O
O
C6H5CH2 O C
CH2 C
OH
O
O
C6H5CH2 O C
O
NH CH
CH3
C
O
NH CH2 C
+ CO2
OH
14.
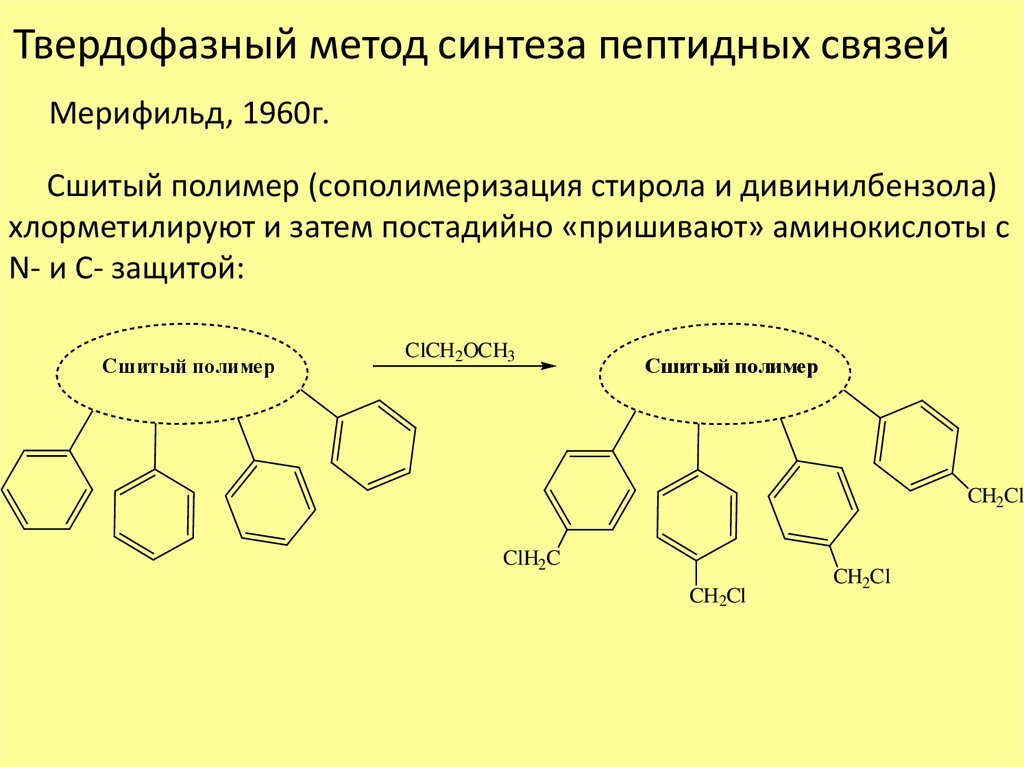
Твердофазный метод синтеза пептидных связейМерифильд, 1960г.
Сшитый полимер (сополимеризация стирола и дивинилбензола)
хлорметилируют и затем постадийно «пришивают» аминокислоты с
N- и С- защитой:
Сшитый полимер
ClCH2OCH3
Сшитый полимер
CH2Cl
ClH2C
CH2Cl
CH2Cl
15.
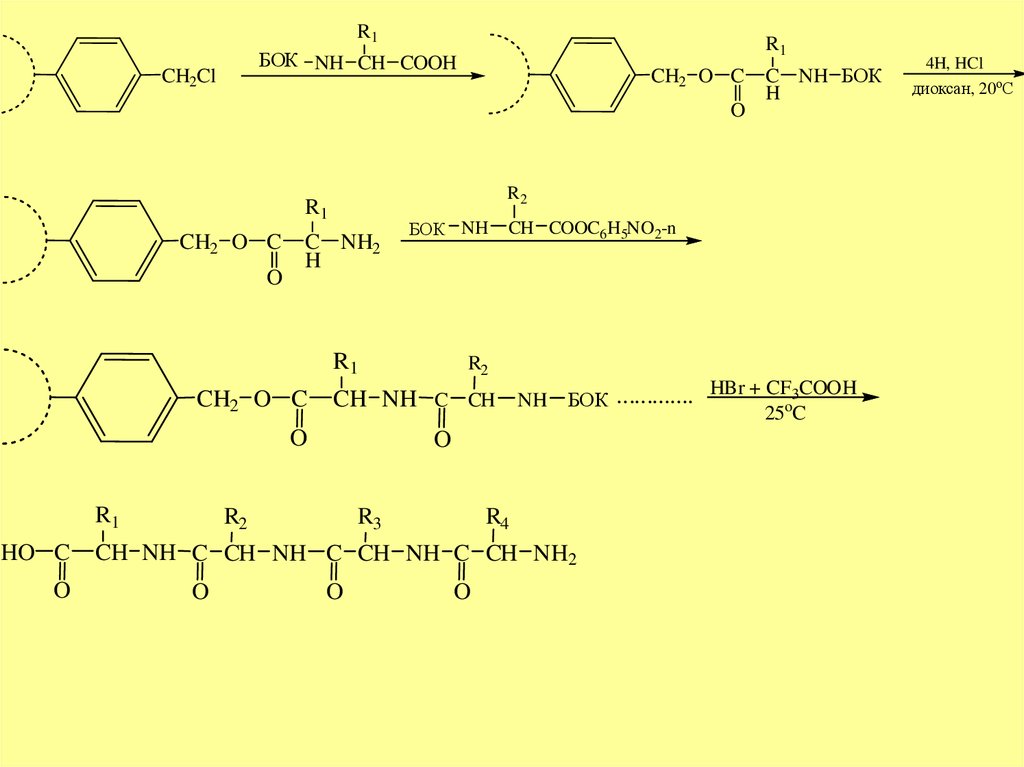
R1R1
БОК NH CH COOH
CH2Cl
CH2 O C
O
R2
R1
CH2 O C
O
C NH2
H
БОК NH
R1
CH2 O C
HO C
O
CH COOC6H5NO2-n
R2
HBr + CF3COOH
CH NH C CH NH БОК .............
o
25 C
O
R1
O
R2
R3
R4
CH NH C CH NH C CH NH C CH NH2
O
C NH БОК
H
O
O
4H, HCl
диоксан, 20оС
16.
Процесс автоматизирован1968г. Мерифильд синтезировал рибонуклеазу
(~1мес, 369 стадий, 124 аминокислоты)
1958г. Сенгер синтезировал инсулин (51
аминокислота)
10 лет работы – Нобелевская премия.

 Химия
Химия