Похожие презентации:
Гетероциклические соединения
1.
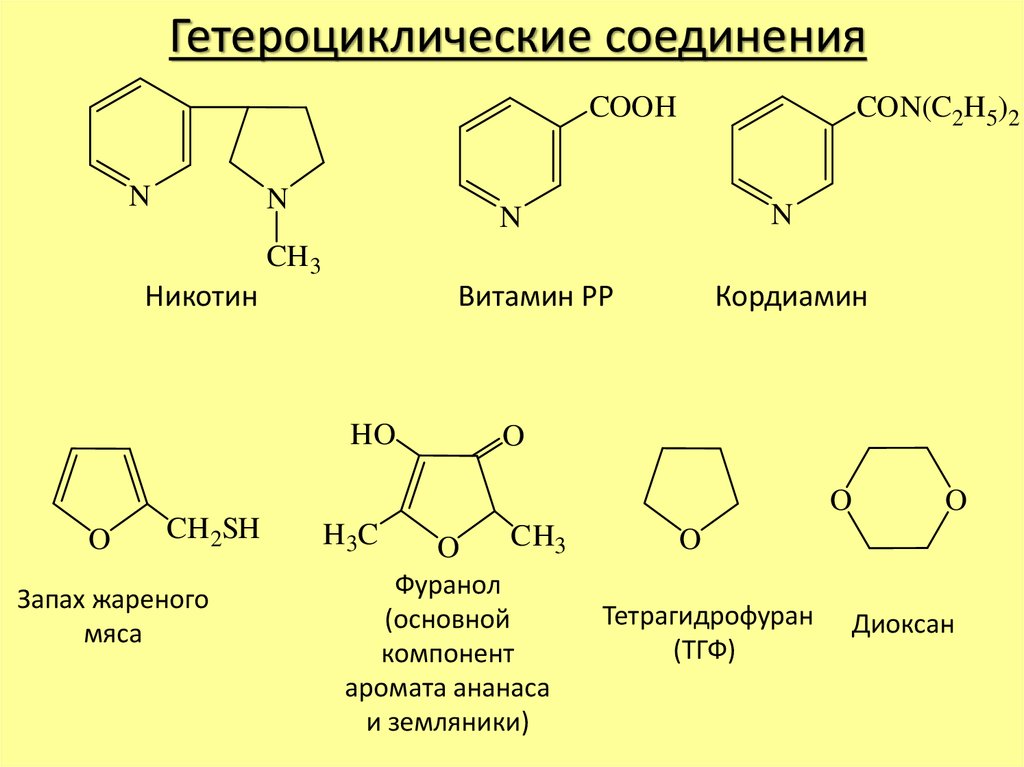
Гетероциклические соединенияCOOH
N
N
CON(C2H 5)2
N
N
CH 3
Никотин
Витамин РР
HO
Кордиамин
O
O
O
CH 2SH
Запах жареного
мяса
H 3C
O
CH3
Фуранол
(основной
компонент
аромата ананаса
и земляники)
O
O
Тетрагидрофуран
(ТГФ)
Диоксан
2.
OS
Фуран
Тиофен
N
H
Пиррол
Индол
N
H
N
Пиридин
O
N
Акридин
N
X-
Соль пирилия
Хинолин
S
X-
Соль тиапирилия
3.
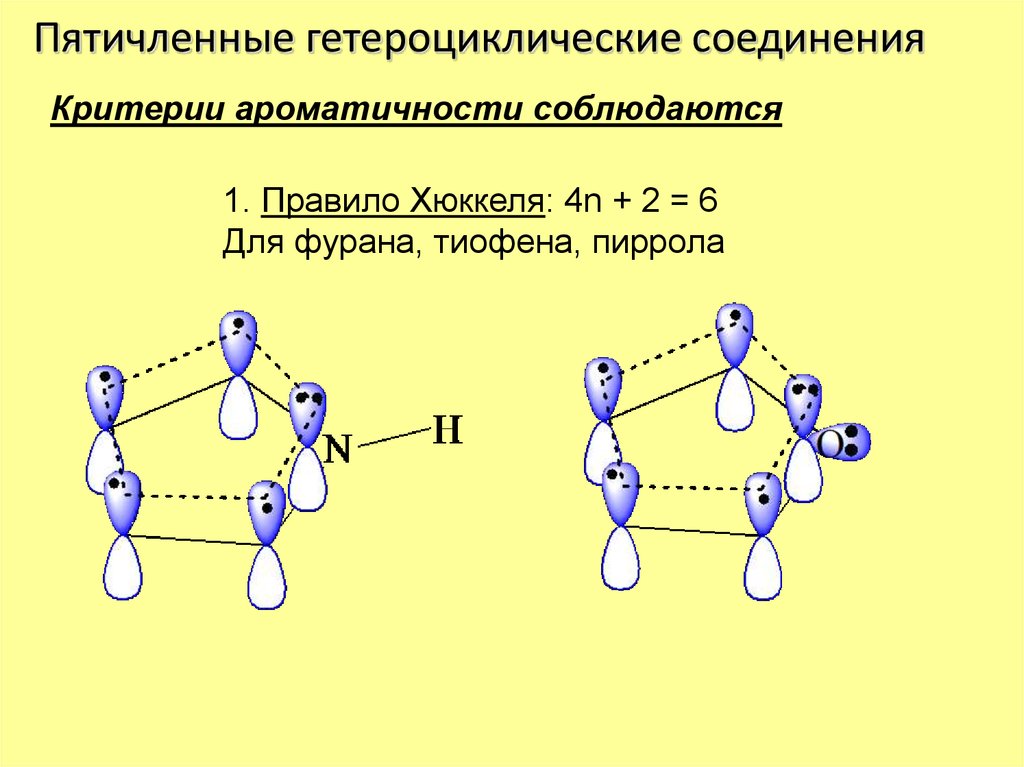
Пятичленные гетероциклические соединенияКритерии ароматичности соблюдаются
1. Правило Хюккеля: 4n + 2 = 6
Для фурана, тиофена, пиррола
4.
2. Системы плоскиеsp2 - гибридизация для всех атомов цикла
3. Теория резонанса подтверждает ароматический характер
N
H
N
H
N
H
N
H
N
H
4. Энергии стабилизации, полученные из экспериментальных
данных и вычисленных теплот сгорания меньше энергии
стабилизации бензола
5.
5. Легкость протекания реакций электрофильного замещения(электроноизбыточные системы)
Фуран менее ароматичен, т.к. электроотрицательность
кислорода максимальна, то есть диеновый характер более
выражен
6.
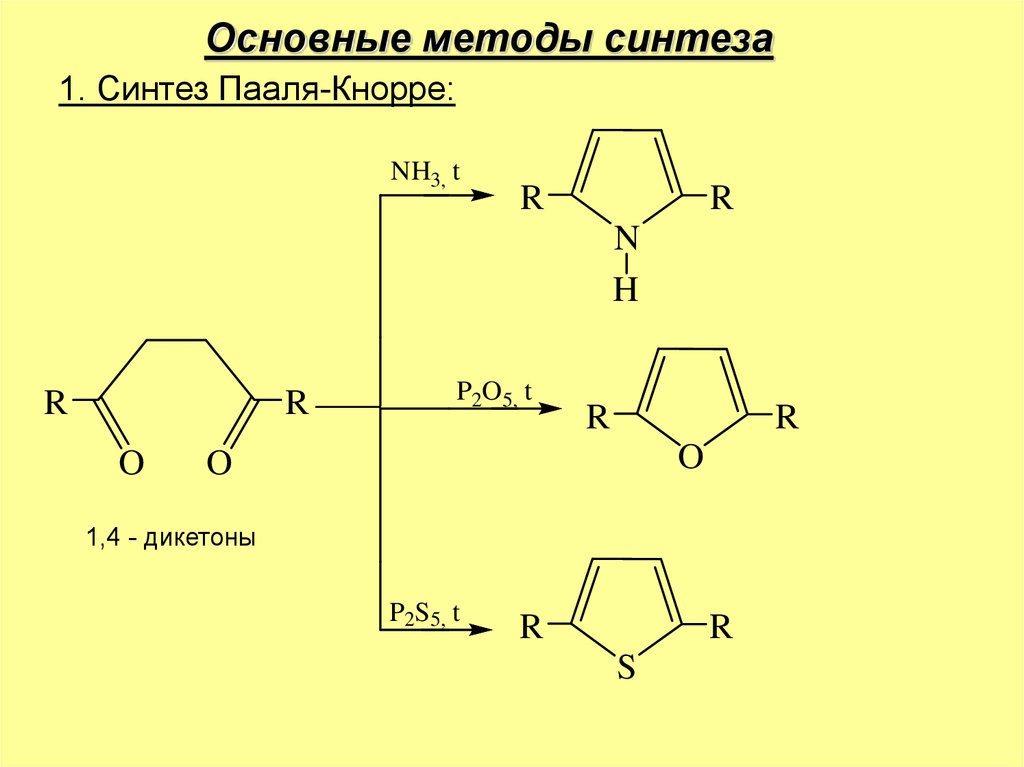
Основные методы синтеза1. Синтез Пааля-Кнорре:
NH3, t
R
R
N
H
R
R
O
P2O5, t
R
R
O
O
1,4 - дикетоны
P2S5, t
R
R
S
7.
Механизм:R
R
O
NH3, pH ~ 4,5
R
-H2O
O
R
NH O
имин
R
R
~ H+
R
R
NH2 O
енамин
R
N
H2
OH
N
H
R
NH3
O
-H2O
R
R
N
H
8.
2. Получение из пентозанов:O
H
C
HC
(C 5H8O4)n
H3O+
1000C
OH
HO
C
H
H
C
OH
Кукурузные
кочерыжки,
отруби
O
H3O+
C
O
Фурфурол
CH 2OH
Ксилоза
O
C
O
OH
α – фуранкарбоновая
кислота
H
t0
-CO 2
O
[O]
9.
3. Получение пиррола из аммонийной соли слизевой кислоты:OH
HO
OH
COO -NH 4+
HO
+H N -OOC
4
t0
-CO2
+ 2CO 2 + 4H2O + NH 3
N
H
Фурана при сухой перегонке слизевой кислоты:
HO
HO
HOOC
OH
OH
COOH
t0
O
C
O
H
+ CO2 + 3H2O
10.
4. Получение тиофена:C4H 10 + 4 S
t ~ 6000C, 1 мин
патент США
C4H 8
+ 3H 2S
S
5. Взаимопревращения гетероциклов (реакция Ю.К. Юрьева):
0
t ~ 400 C, Al2O3
H2S
H2O
NH3
O
H2O
NH3
S
H2S
N
H
11.
6. Реакция Чичибабина Н.Е:CH
HC
HC
+
CH
Al2O3; 400-4500C
+ H2
S
H2S
C
NH 3
N
H
6H
5 NH
2
N
H
Индол
12.
7. Производные тиофена:C6H 5
C6H5CH
C6H 5
CHC6H5 + S
стильбен
C 6H5
S
C6H 5
тиоксаль
8. Из янтарной кислоты:
H2 H2
HOOC C C COOH
P2S5
S
13. Химические свойства фурана, тиофена, пиррола
1. Реакции электрофильного замещения:>
N
H
>
O
>
S
Реакционная способность
14.
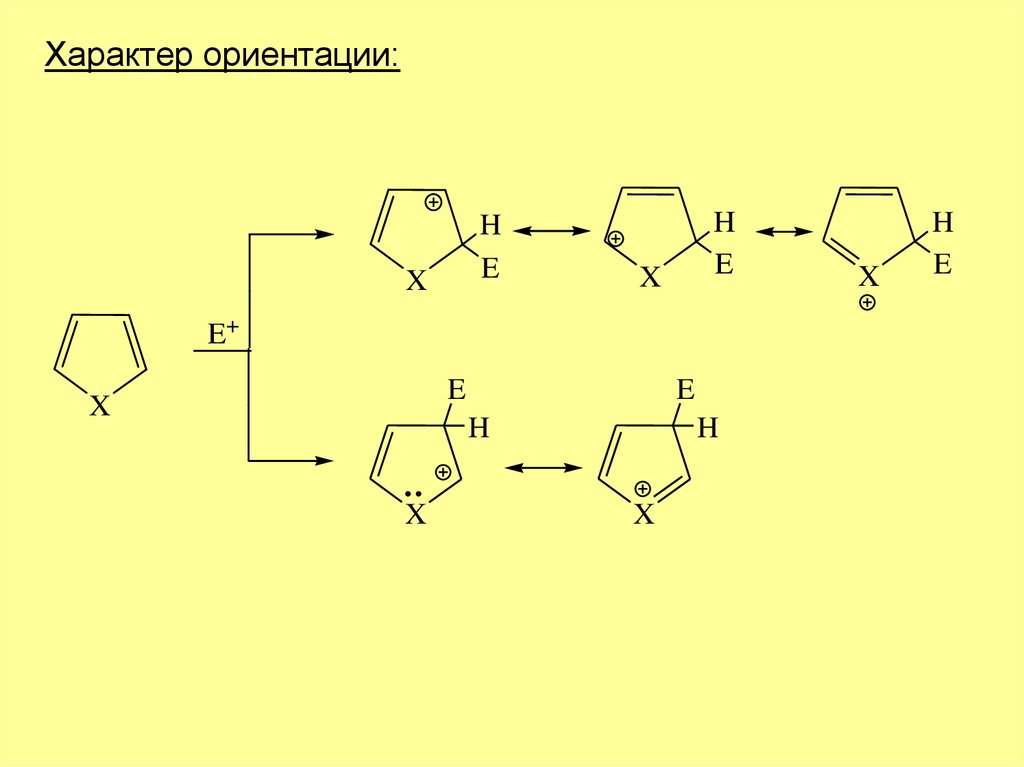
Характер ориентации:H
E
X
H
E
X
E+
E
X
E
H
H
X
X
X
H
E
15.
Фуран и пиррол ацидофобны,в кислоте полимеризуются:
+
H
N
H
N
H
H
H
N
H
H
H
N H
H
Тиофен устойчив в кислой среде
H N
H
и т.д.
16.
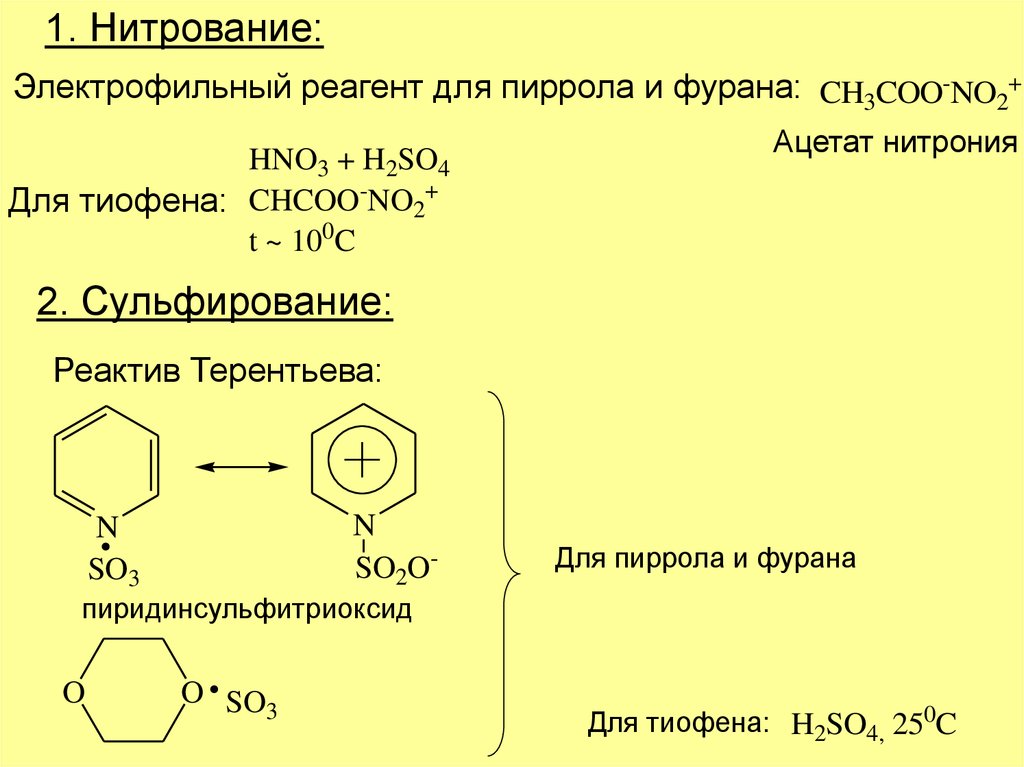
1. Нитрование:Электрофильный реагент для пиррола и фурана: CH3COO-NO2+
HNO3 + H2SO4
Для тиофена: CHCOO-NO2+
t ~ 100C
Ацетат нитрония
2. Сульфирование:
Реактив Терентьева:
N
SO2O-
N
SO3
Для пиррола и фурана
пиридинсульфитриоксид
O
O SO
3
Для тиофена: H2SO4, 250C
17.
++
N
H
N
H
N
SO3
SO3-
3. Бромирование и иодирование:
I
+ I2
KI
I
N
H
+ I2
S
I
HgO
C6H6
N
H
S
I
иодол
I
75%
N
H
18.
4. Ацилирование:(RCO)2O
R C
O
Cl
Для фурана, тиофена, пиррола
+ SnCl4
t ~ 00C
5. Формилирование:
(H3C)2N C
O
H
+ POCl3
O
(H3C)2N C
O
POCl3
O
H
O
C
H
19.
6. Специфические реакции:Отделение тиофена от бензола:
Hg(CH3COO)2
0
Hg, 25 C CH3COONa
S
S
HgOCOCH3
+ CH3COOH
t
HCl
+ Hg(CH3COO)Cl
S
Реакция Димрота:
Hg(CH3COO)2
1100C
HgOCOCH3
20.
SH2SO4, 250C
C6H6
H3O+
S
SO3H
S
Растворяется в воде
(отделение от бензола)
H2SO4 (к), HNO3 (к) 1000C
SO3H
21.
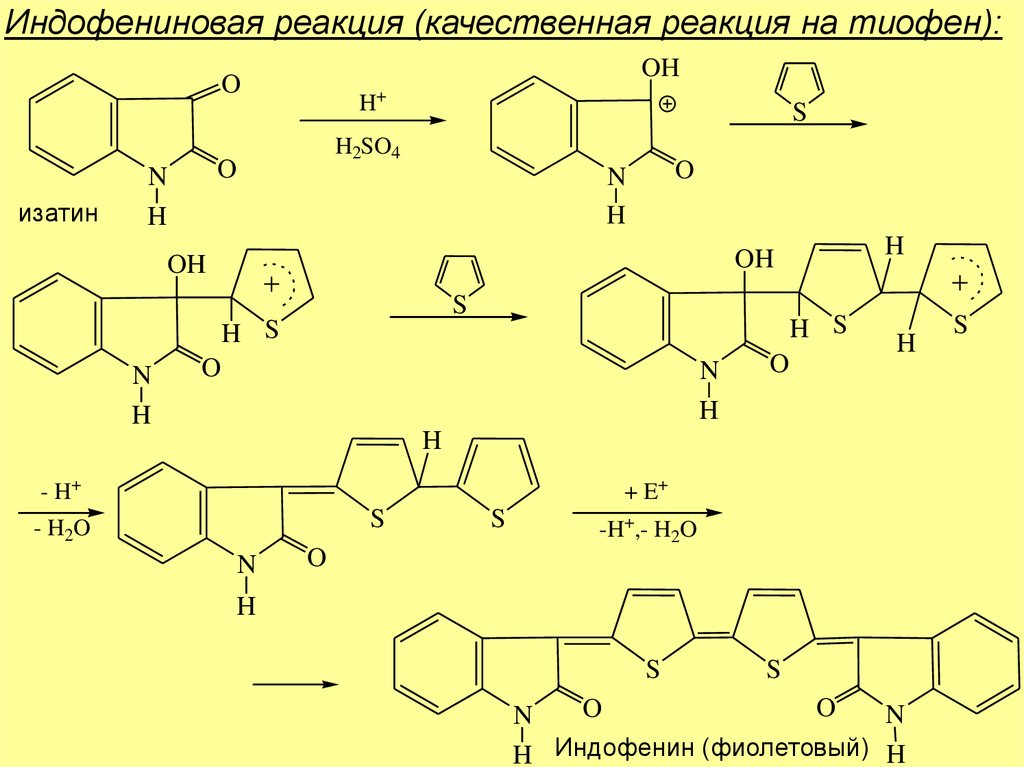
Индофениновая реакция (качественная реакция на тиофен):OH
O
изатин
H+
H2SO4
O
N
H
S
O
N
H
OH
S
H S
H S
N
H
H
OH
O
N
H
O
H
H
- H+
+ E+
S
- H2O
N
S
-H+,- H2O
O
H
S
S
O
O
N
N
H Индофенин (фиолетовый) H
S
22.
Алкилирование фурана, тиофена альдегидами и кетонами:CH2=O
HCl + ZnCl2
CH2
S
S
S
(CH3)2C=O
CH3
H2SO4, 700C
C
S
CH3
S
23.
CH3CH3
H3C
(CH3)2C=O
N
H
N
H
NH
+
H
CH3
HN
H
N
H3C
CH3
CH3
CH3
24.
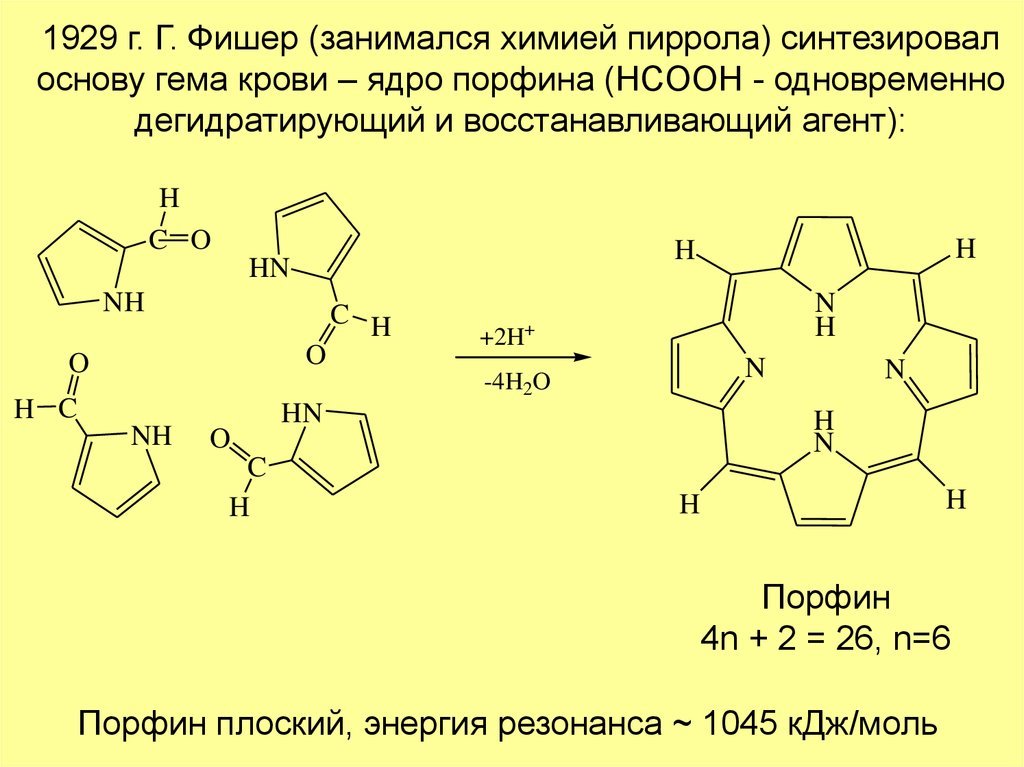
1929 г. Г. Фишер (занимался химией пиррола) синтезировалоснову гема крови – ядро порфина (HCOOH - одновременно
дегидратирующий и восстанавливающий агент):
H
C O
NH
C H
O
O
N
H
+2H+
N
-4H2O
H C
NH
HN
N
H
N
O
C
H
H
H
HN
H
H
Порфин
4n + 2 = 26, n=6
Порфин плоский, энергия резонанса ~ 1045 кДж/моль
25.
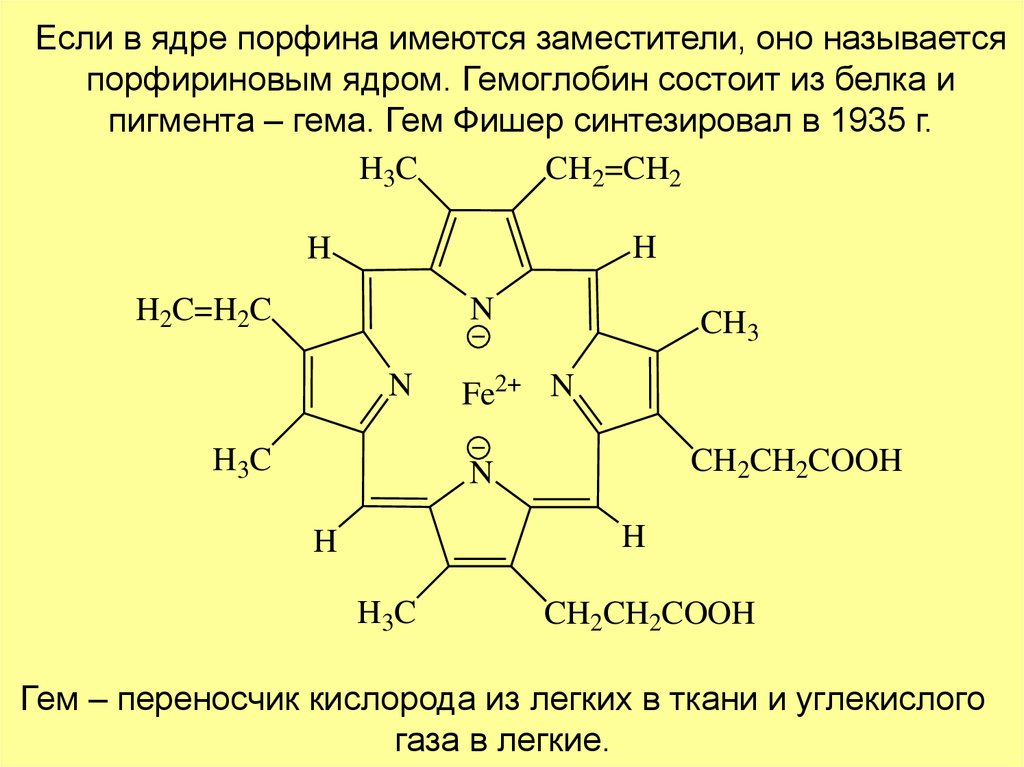
Если в ядре порфина имеются заместители, оно называетсяпорфириновым ядром. Гемоглобин состоит из белка и
пигмента – гема. Гем Фишер синтезировал в 1935 г.
H3C
CH2=CH2
H
H
N
H2C=H2C
N
H 3C
CH3
Fe2+ N
CH2CH2COOH
N
H
H
H 3C
CH2CH2COOH
Гем – переносчик кислорода из легких в ткани и углекислого
газа в легкие.
26.
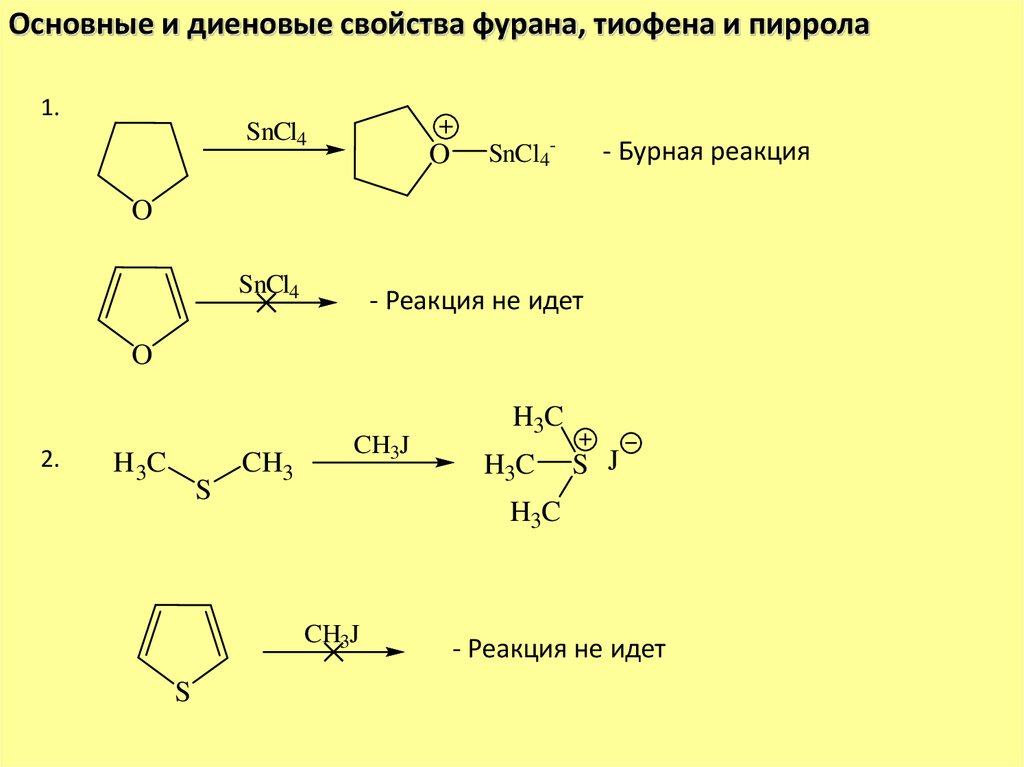
Основные и диеновые свойства фурана, тиофена и пиррола1.
SnCl4
O
SnCl4-
- Бурная реакция
O
SnCl4
- Реакция не идет
O
2.
H 3C
S
CH3
CH3J
H3C
S J
H3C
CH3J
S
H3C
- Реакция не идет
27.
3.H 3C
N
H
H+
CH3
(CH3)2NH2
- не основание, в кислой среде полимеризуется по α-углеродному атому
N
H
Фуран наименее ароматичен, обладает диеновыми свойствами
O
O
O
+
O
O
O
малеиновый
ангидрид
O
O
28.
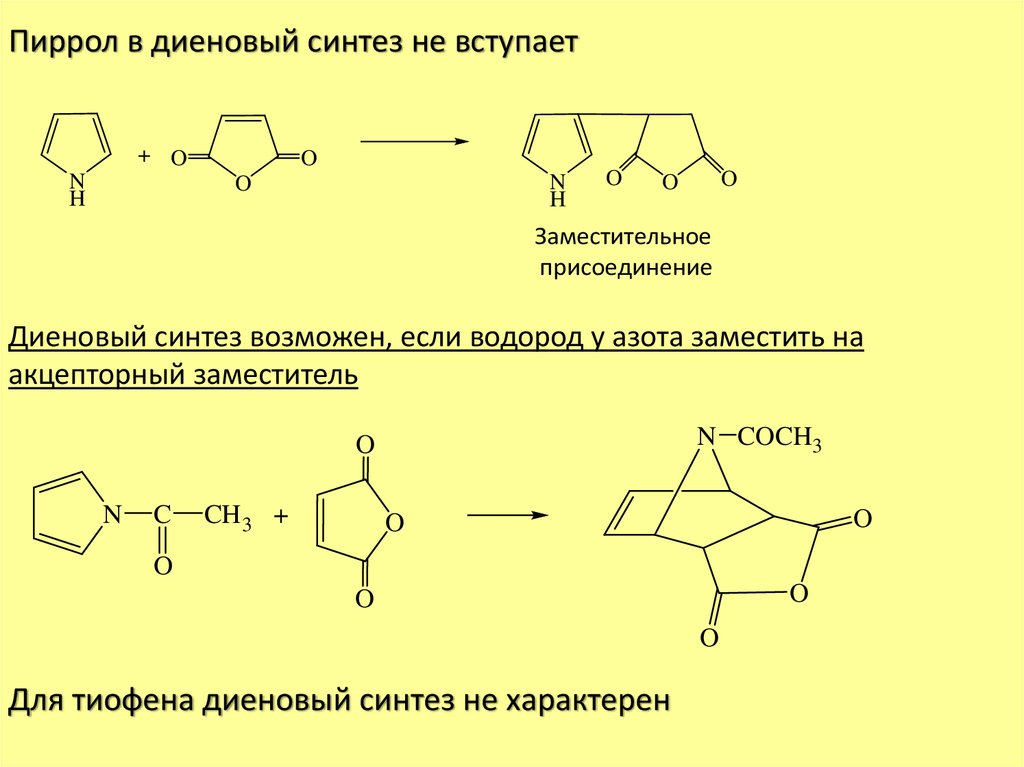
Пиррол в диеновый синтез не вступает+ O
N
H
O
N
H
O
O
O
O
Заместительное
присоединение
Диеновый синтез возможен, если водород у азота заместить на
акцепторный заместитель
N COCH3
O
N
C
CH 3 +
O
O
O
O
O
O
Для тиофена диеновый синтез не характерен
29.
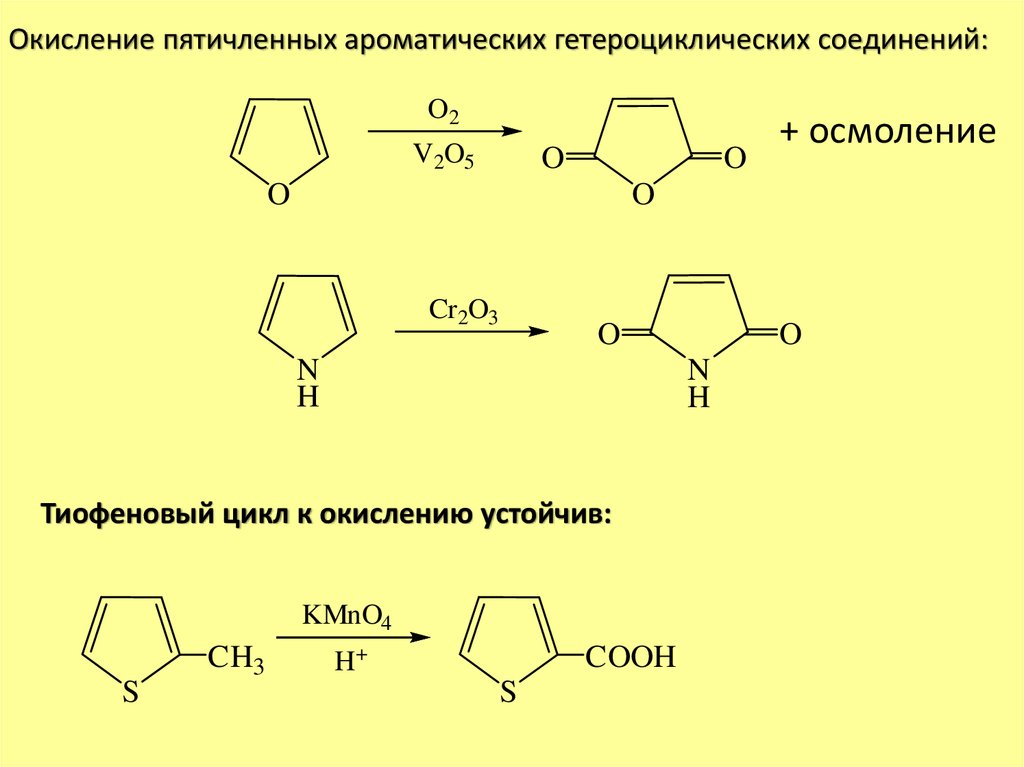
Окисление пятичленных ароматических гетероциклических соединений:O2
V2O5
O
O
O
O
Cr 2O3
O
N
H
KMnO4
S
O
N
H
Тиофеновый цикл к окислению устойчив:
CH3
+ осмоление
H+
COOH
S
30.
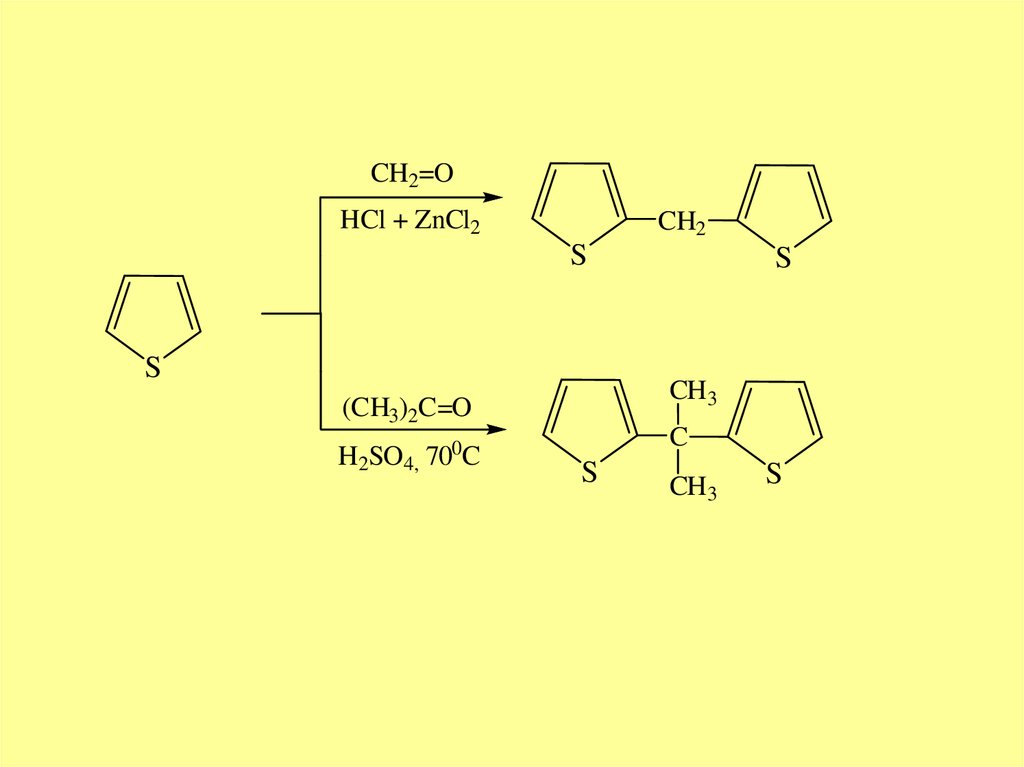
CH2=OHCl + ZnCl2
CH2
S
S
CH3
(CH3)2C=O
H2SO4, 700C
S
C
S
CH3
S
31.
Образование металлорганических производныхПиррол проявляет кислотные свойства:
K (Na)
-H2
N
K (Na)+
N
H
рКа = 17,5
CH3MgJ
-CH4
N
MgJ
Пиррол-калий
(пиррилат калия)
32.
NN
E
N
+
E+
O
H3C C
N
N
MgX
MgX
O
N
H
C CH
3
H
H
Cl
O
N
C CH
3
33.
OH3C C
O
C CH3
t
Cl
N
N
K+
N
H
COCH3
Фуран и тиофен также легко металлируются
бутиллитием (замещение водорода)
C4H9Li
Li
X
X
X = O, S
1. CO2
2. H3O+
COOH
X
34.
ИндолN
H
CH2 CHCOOH
CH3
NH 2
N
H
скатол
N
H
триптофан
35.
23
E+
2
N1
H
H
N
H
E
E
E
H
H
3
N
H
N
H
36.
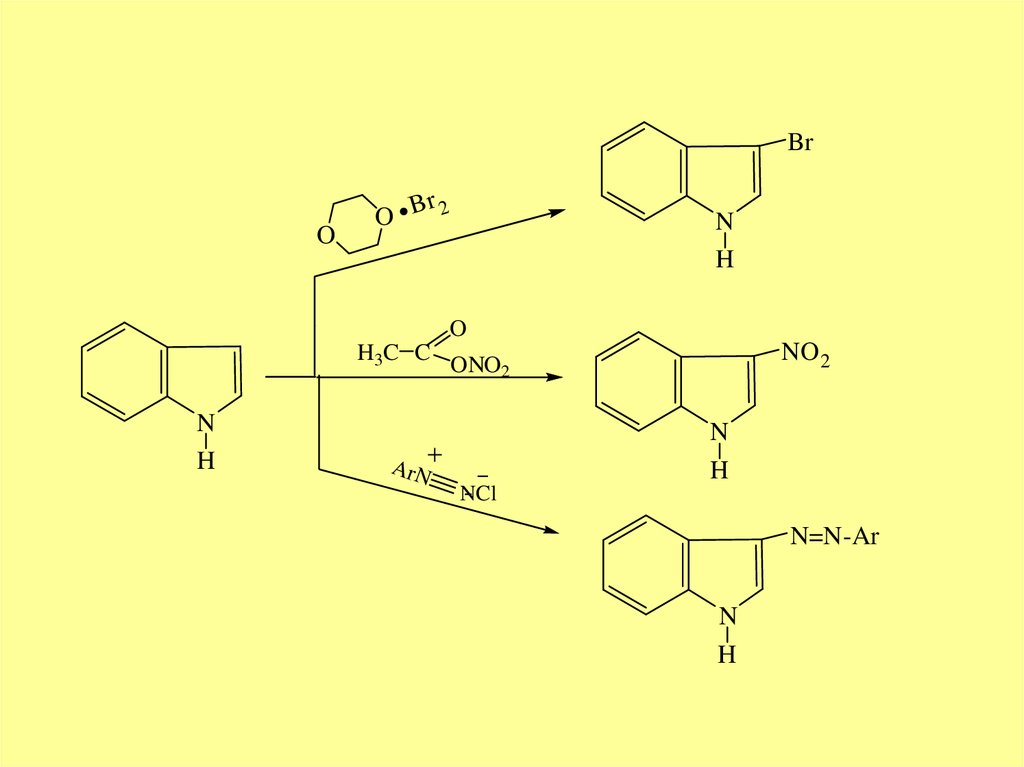
BrO
r
O B 2
N
H
O
H3C C
N
H
ArN
NO 2
ONO2
N
H
NCl
N=N-Ar
N
H
37.
NaC 2H 5O
N
H
N
Na
CH M
3 gJ
N
MgI
38.
Введение заместителя в бензольное кольцо(CH3CO)2O
Na
C2H5OH
C2H5OH
N
H
N
H
Индолин
(аналог анилина)
O 2N
HNO3
N
COCH3
N
COCH3
H3O+, t
O 2N
S, t
O 2N
-H2
N
H
N
H
39. Шестичленные гетероциклические соединения
45
3
6
2
N
N
1
Пиридин (азабензол)
O
X-
S
X-
S
XТиапирилий-ион
O
XПирилий-ион
40.
4n + 2 = 6; n=1Пиридин
С – N - 1,34Å
С – C в бензоле - 1,39Å
Основной характер
41.
NN
N
N
π – электронная плотность понижена в кольце
пиридина, особенно в α- и γ-положениях
Пиридин по реакционной способности
напоминает нитробензол
Пиридин – основание; рКа = 5,23
42.
HClCl-
FeCl
3 +HO
2
+ Fe(OH)3
I
3
CH
N
H
N
H
N ClH
CH2N2,HBF4
N
N BF4CH 3
бесцветный
CH 3
I-
- Внутримолекулярный КПЗ
Желтый
N – метилпиридиний иодид
43.
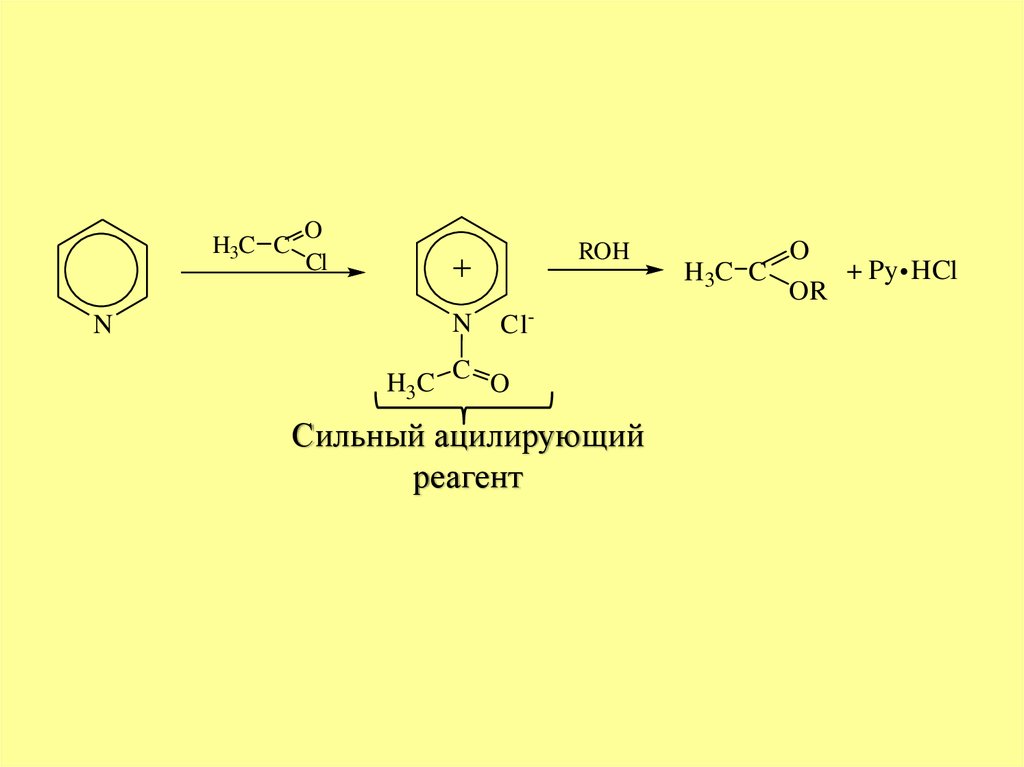
H3C CN
O
Cl
ROH
N
Cl-
H3C C O
Сильный ацилирующий
реагент
O
+ Py HCl
H 3C C
OR
44.
Электрофильное замещение в пиридинеN
+ E+
N
N
E
H
N
E
H
неустойчивая
E
H
N
E
H
E
H
E
H
N
N
E H
E H
E H
N
N
N
неустойчивая
45.
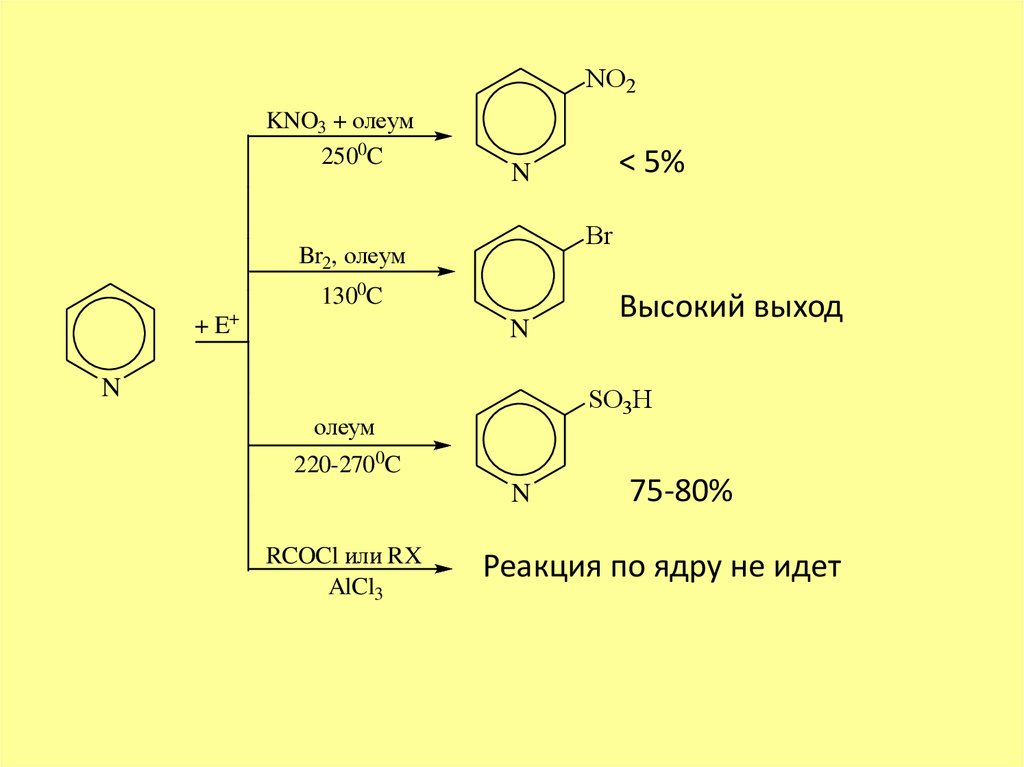
NO2KNO3 + олеум
2500C
Br
Br2, олеум
1300C
+ E+
N
N
Высокий выход
SO3H
олеум
220-2700C
N
RCOCl или RX
AlCl3
< 5%
N
75-80%
Реакция по ядру не идет
46.
NO2BF4N
O N O
N
По углероду реакция с
не
NO2BF
4 идет
Пиридин в 106 менее активен, чем бензол в реакциях электрофильного
замещения
Ден Хертог разработал метод преодоления ориентирующего действия
азота в пиридине:
H2O2 (или R C
WO42-
N
O
O O H
)
N
O
N
O
47.
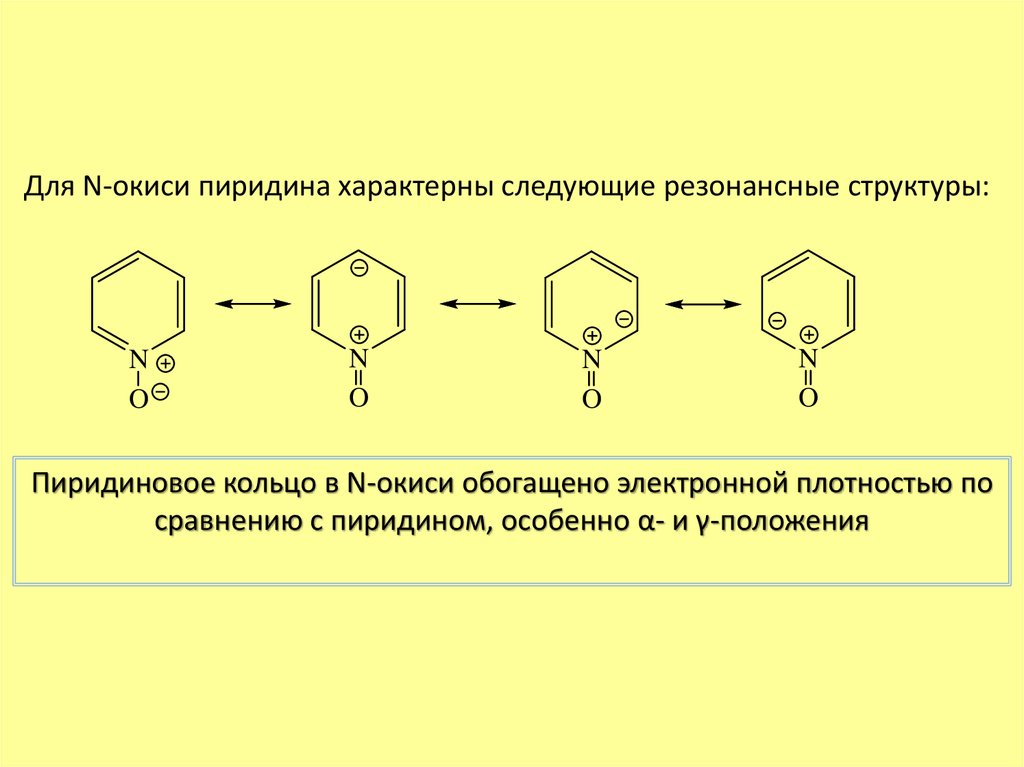
Для N-окиси пиридина характерны следующие резонансные структуры:N
O
N
O
N
O
N
O
Пиридиновое кольцо в N-окиси обогащено электронной плотностью по
сравнению с пиридином, особенно α- и γ-положения
48.
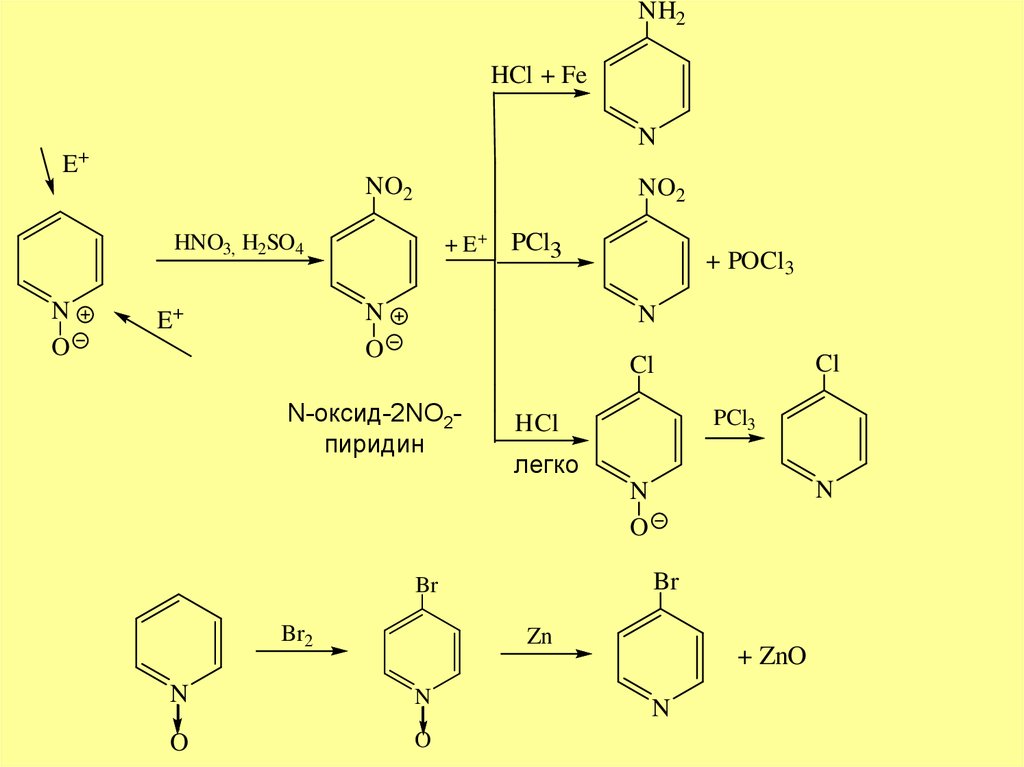
NH2HCl + Fe
N
E+
NO2
NO2
+ E+
HNO3, H2SO4
N
O
PCl
N
O
E+
+ POCl3
N
Cl
Cl
N-оксид-2NO2пиридин
PCl3
HCl
легко
N
N
O
Br
Br
Br2
Zn
N
N
O
O
+ ZnO
N
49.
Пиридин устойчив к окислению:COOH
[O]
N
никотин
N
CH3
N
Никотиновая
кислота
50.
Нуклеофильное замещение в пиридинеИдет легко по механизму присоединения-отщепления
1914г. А.Е.Чичибабин и О.А. Зейде получили -аминопиридин:
+ NaNH2
NH2
H
N
N
Na+
N
NH2
N
H
+ NaOH
N
NHNa
N
NH2
2- аминопиридин,
4-аминопиридин в следовых
количествах
NH
-пиридоимин
51.
Взаимодействие с Li- и Mg-органическими соединениями:+ C6H5Li
N
H
N
C6H5
LiH
N
Li
Пропускание паров пиридина над расплавленной щелочью в
присутствии окислителя:
N
K+OHрасплав
3000
K3Fe(CN)6
H
OH
N
K
N
H
O
-пиридон
N
OH
C6H5
52.
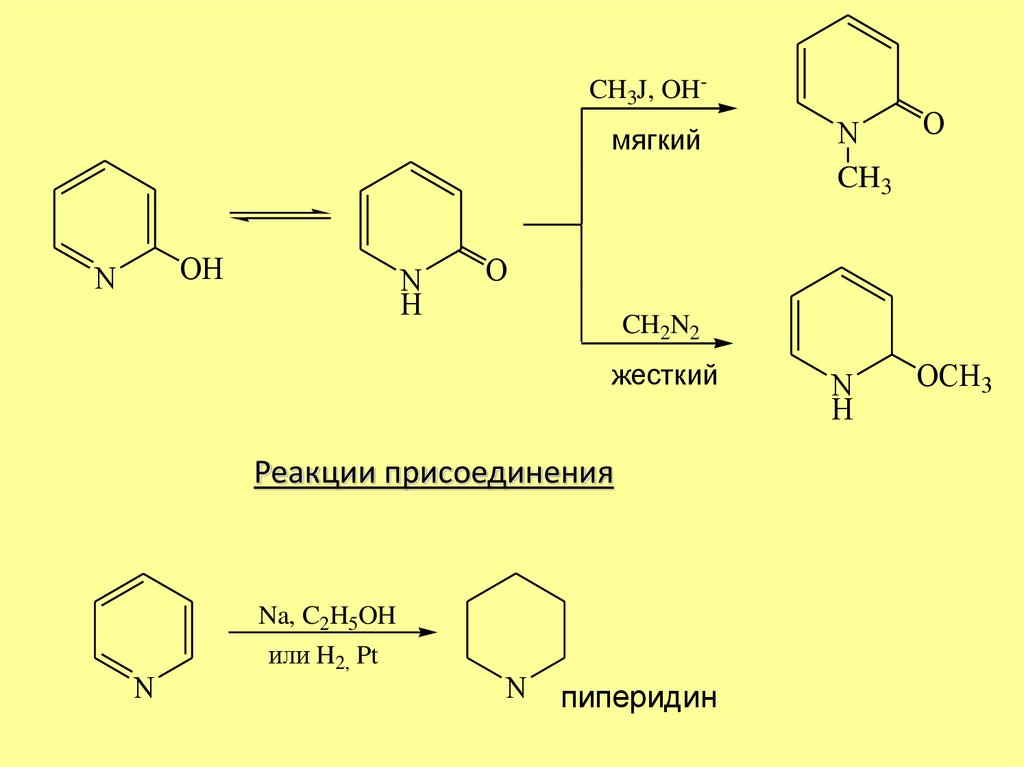
CH3J, OH-мягкий
OH
N
N
H
O
CH2N2
жесткий
Реакции присоединения
N
Na, C2H5OH
или H2, Pt
O
N
CH3
N
пиперидин
N
H
OCH3
53.
ХинолинH2SO4 (конц)
2200C
SO3H
5
6
8
Br
4
3
7
N
N
2
+ E+
Br2, Ag2SO4
+
H2SO4
Br
1
N
N
NO2
HNO3, H2SO4
00C
+
NO2
N
N
54.
Нуклеофильное замещение протекает аналогично пиридину:H
Na N 2
N
N
NH2
N
Ph
Ph
Li




































 Химия
Химия








