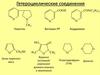
Похожие презентации:
Гетероциклические соединения. Пятичленные гетероциклы
1. МОДУЛЬ Гетероциклические соединения (гетероциклы) Лекция Пятичленные гетероциклы
12. Электронное строение
Пиррол — пятичленный гетероцикл с одним атомом. Атомы углерода иазота в пирроле, находятся в состоянии sp2-гибридизации. На
негибридной р-орбитали атома азота в пирроле находится неподеленная
пара электронов. Она принимает участие в сопряжении с π-электронами
четырех атомов углерода с образованием единого шестиэлектронного
облака. Три sp2 гибридные орбитали образуют три π-связи. Атом азота с
рассмотренным электронным строением называют пиррольным.
В других пятичленных гетероциклах с одним гетероатомом — фуране и
тиофене — неподеленная пара электронов соответственно атомов
кислорода и серы, так же как и пиррольного атома азота, включается в
сопряжение с р-электронам и атомов углерода с образованием единого
электронного облака, по числу электронов отвечающего правилу Хюккеля.
2
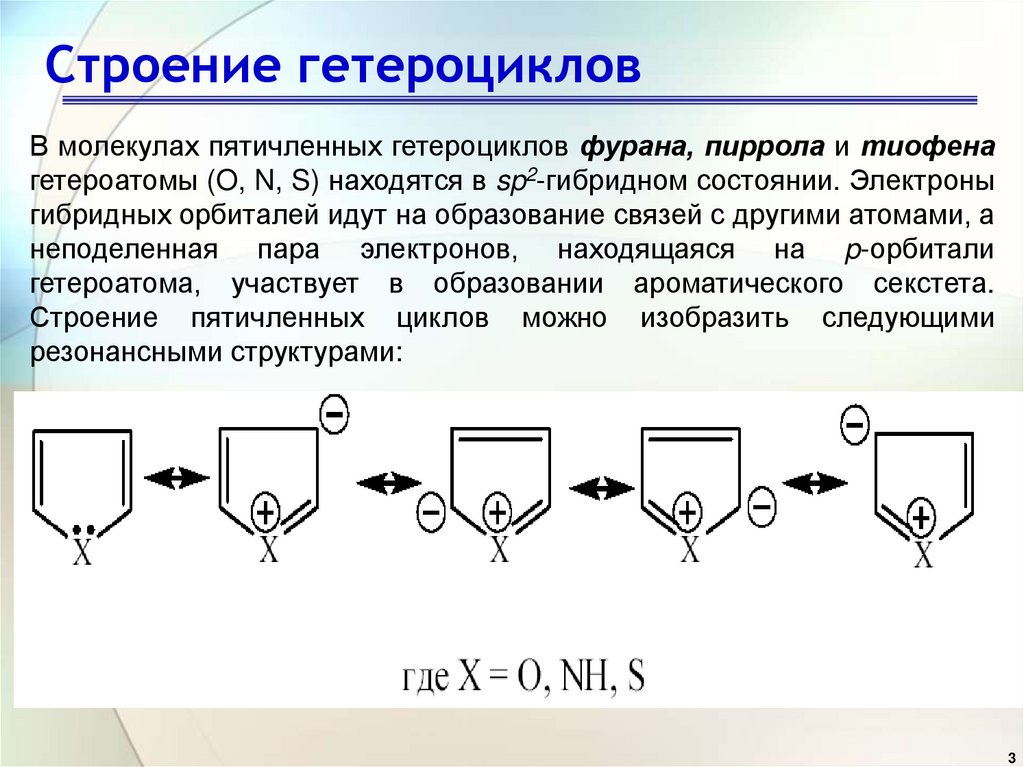
3. Строение гетероциклов
В молекулах пятичленных гетероциклов фурана, пиррола и тиофенагетероатомы (O, N, S) находятся в sp2-гибридном состоянии. Электроны
гибридных орбиталей идут на образование связей с другими атомами, а
неподеленная пара электронов, находящаяся на p-орбитали
гетероатома, участвует в образовании ароматического секстета.
Строение пятичленных циклов можно изобразить следующими
резонансными структурами:
3
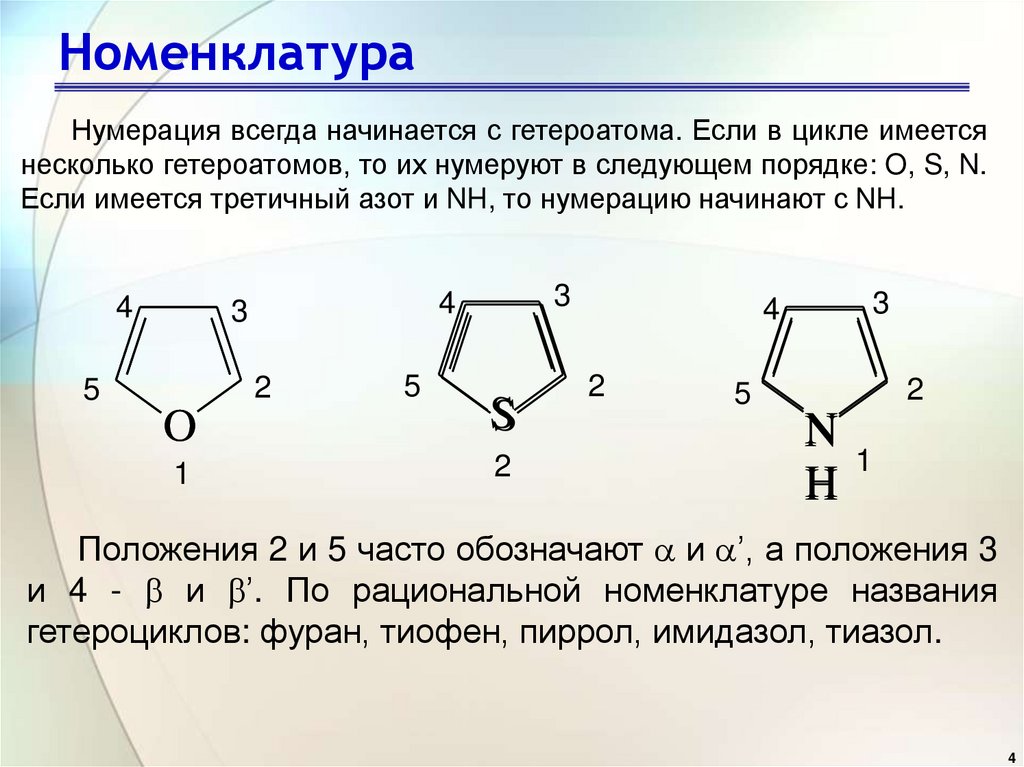
4. Номенклатура
Нумерация всегда начинается с гетероатома. Если в цикле имеетсянесколько гетероатомов, то их нумеруют в следующем порядке: O, S, N.
Если имеется третичный азот и NH, то нумерацию начинают с NH.
4
2
5
3
4
3
5
O
S
1
2
3
4
2
2
5
N
H
1
Положения 2 и 5 часто обозначают и ’, а положения 3
и 4 - и ’. По рациональной номенклатуре названия
гетероциклов: фуран, тиофен, пиррол, имидазол, тиазол.
4
5. Физические свойства
Фуран – бесцветная жидкость, кипящая при 31–32 °С, сзапахом, напоминающим хлороформ.
Свежеперегнанный пиррол – бесцветная жидкость с
температурой кипения 130 °С, темнеет и осмоляется на
воздухе, по запаху напоминает хлороформ. Аномально
высокая температура кипения пиррола объясняется
наличием водородных связей.
Тиофен – жидкость с запахом бензола. Температуры кипения
тиофена (84,1 °С) и бензола (80,4 °С) близки, поэтому
тиофен перегоняется вместе с бензолом. В каменноугольном
бензоле всегда содержится ~ 0,5 % тиофена.Фуран, пиррол и
тиофен хорошо растворяются в органических растворителях
(спирте, эфире), но практически нерастворимы в воде.
Ткип, 0С
М
Фуран
32
68
Тиофен
84
84
Пиррол
131
66
5
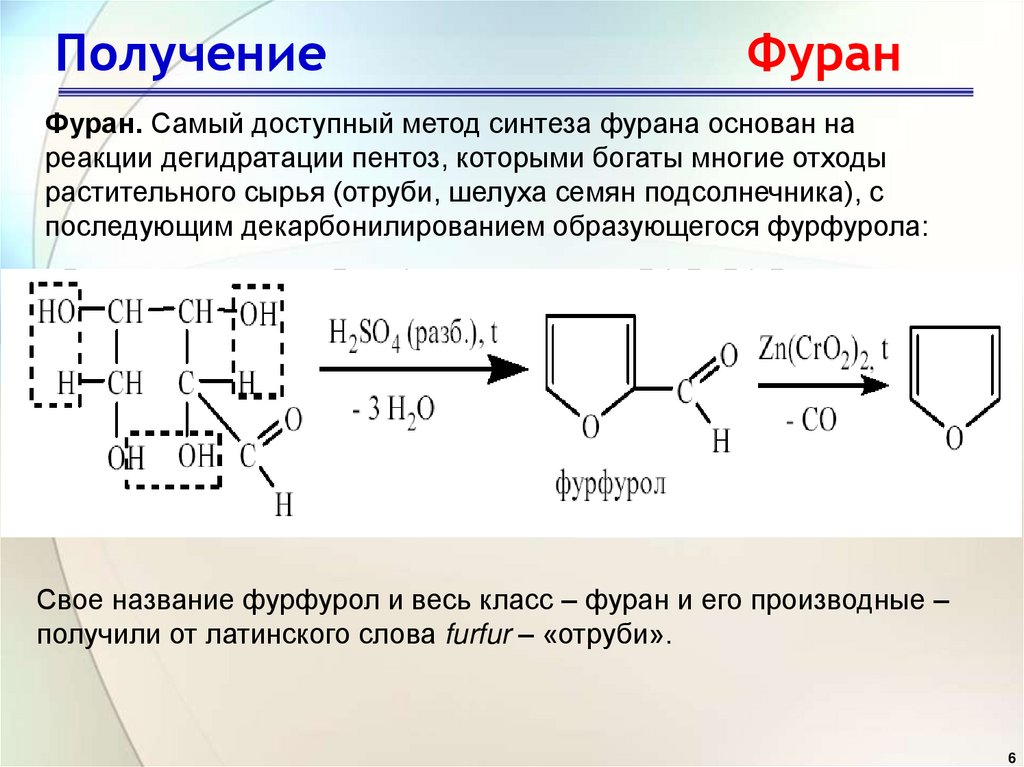
6. Получение Фуран
Фуран. Самый доступный метод синтеза фурана основан нареакции дегидратации пентоз, которыми богаты многие отходы
растительного сырья (отруби, шелуха семян подсолнечника), с
последующим декарбонилированием образующегося фурфурола:
Свое название фурфурол и весь класс – фуран и его производные –
получили от латинского слова furfur – «отруби».
6
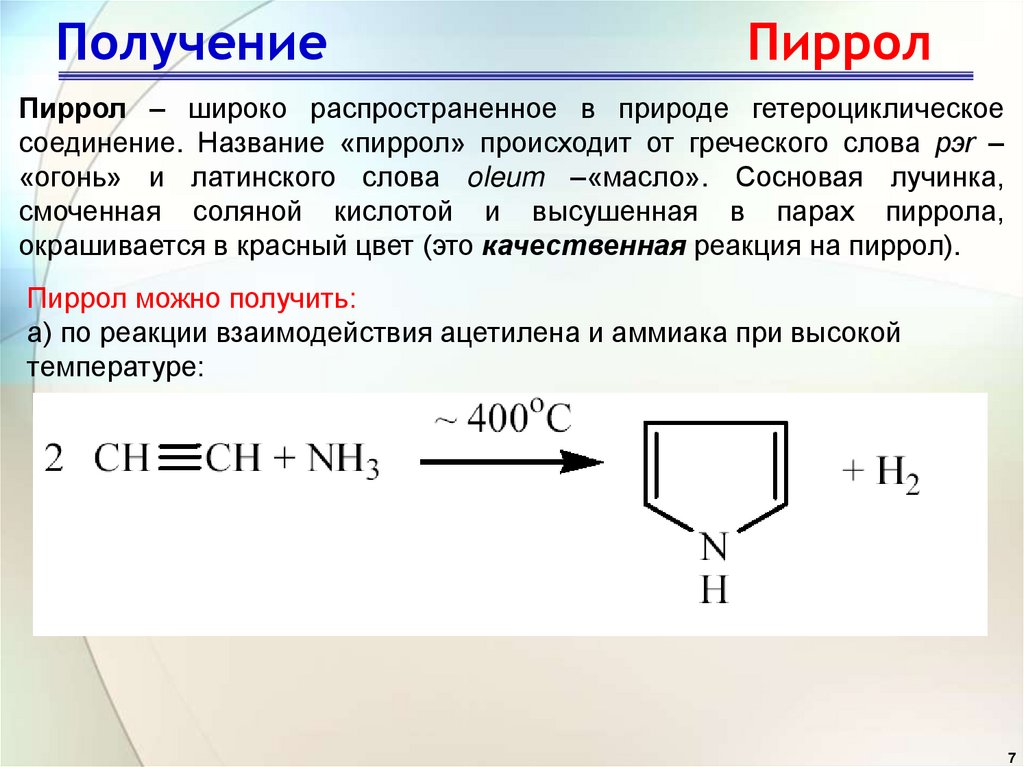
7. Получение Пиррол
Пиррол – широко распространенное в природе гетероциклическоесоединение. Название «пиррол» происходит от греческого слова pэr –
«огонь» и латинского слова oleum –«масло». Сосновая лучинка,
смоченная соляной кислотой и высушенная в парах пиррола,
окрашивается в красный цвет (это качественная реакция на пиррол).
Пиррол можно получить:
а) по реакции взаимодействия ацетилена и аммиака при высокой
температуре:
7
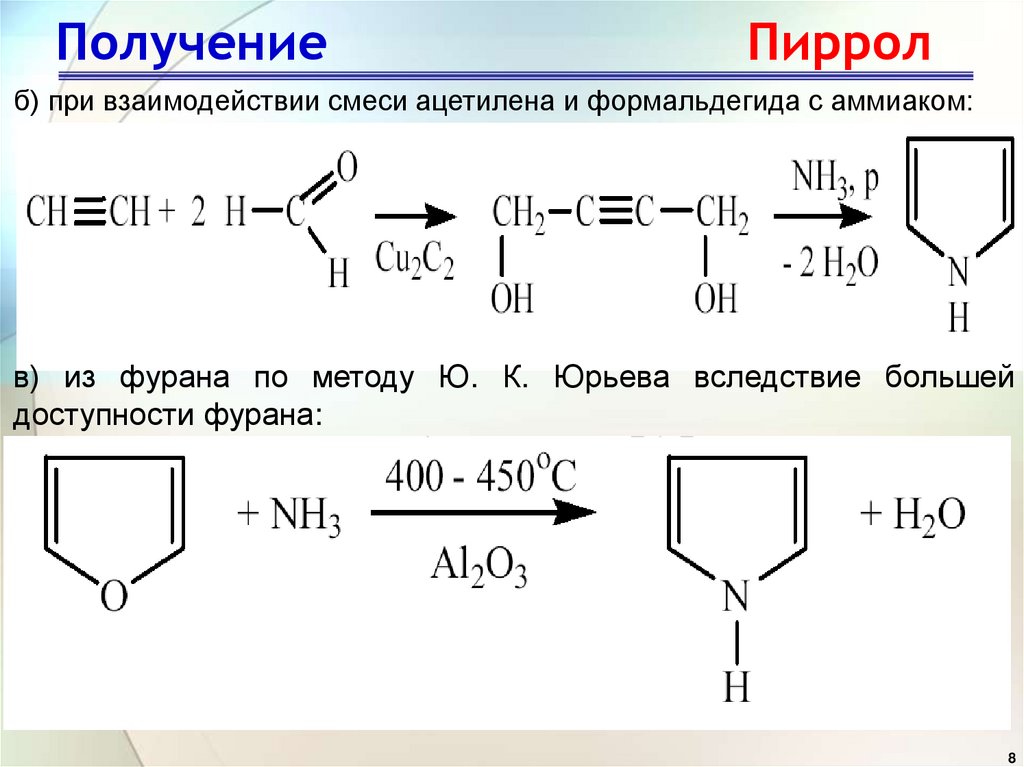
8. Получение Пиррол
б) при взаимодействии смеси ацетилена и формальдегида с аммиаком:в) из фурана по методу Ю. К. Юрьева вследствие большей
доступности фурана:
8
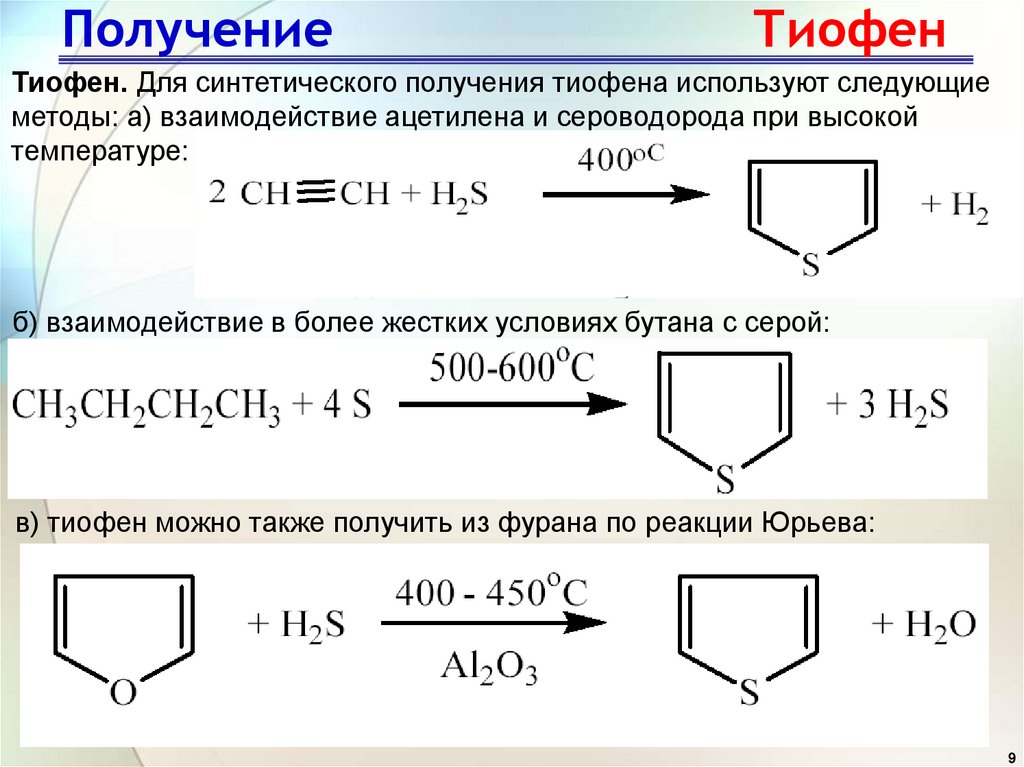
9. Получение Тиофен
Тиофен. Для синтетического получения тиофена используют следующиеметоды: а) взаимодействие ацетилена и сероводорода при высокой
температуре:
б) взаимодействие в более жестких условиях бутана с серой:
в) тиофен можно также получить из фурана по реакции Юрьева:
9
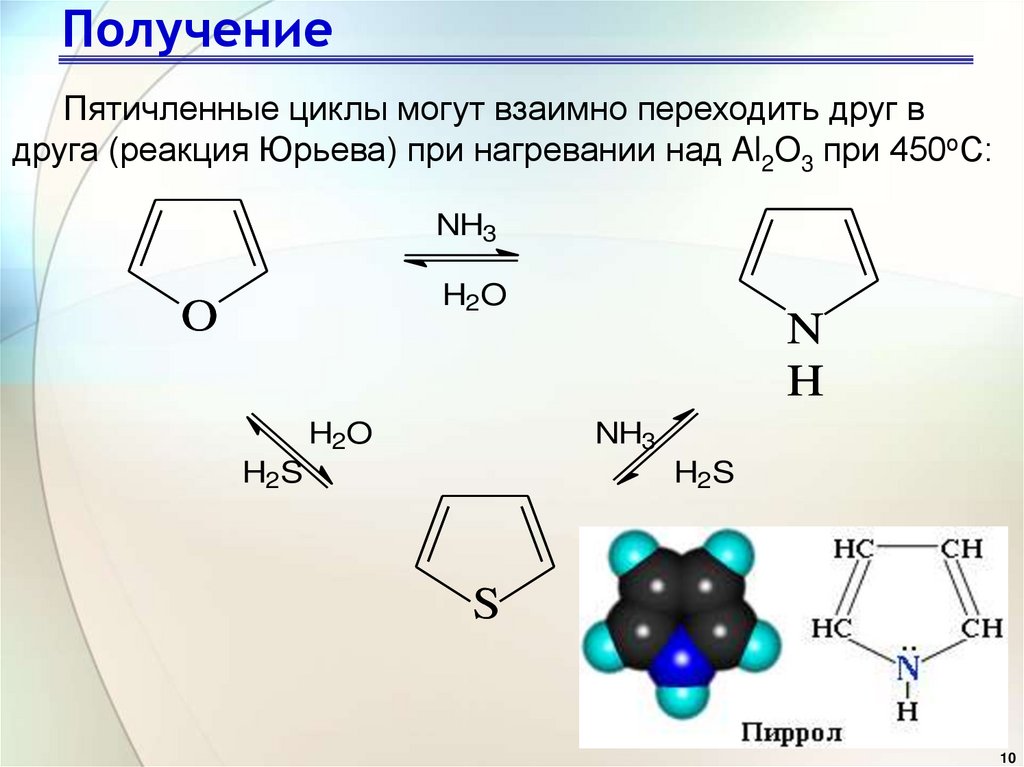
10. Получение
Пятичленные циклы могут взаимно переходить друг вдруга (реакция Юрьева) при нагревании над Al2O3 при 450оС:
NH3
H2O
O
N
H
NH3
H2O
H2S
H2S
S
10
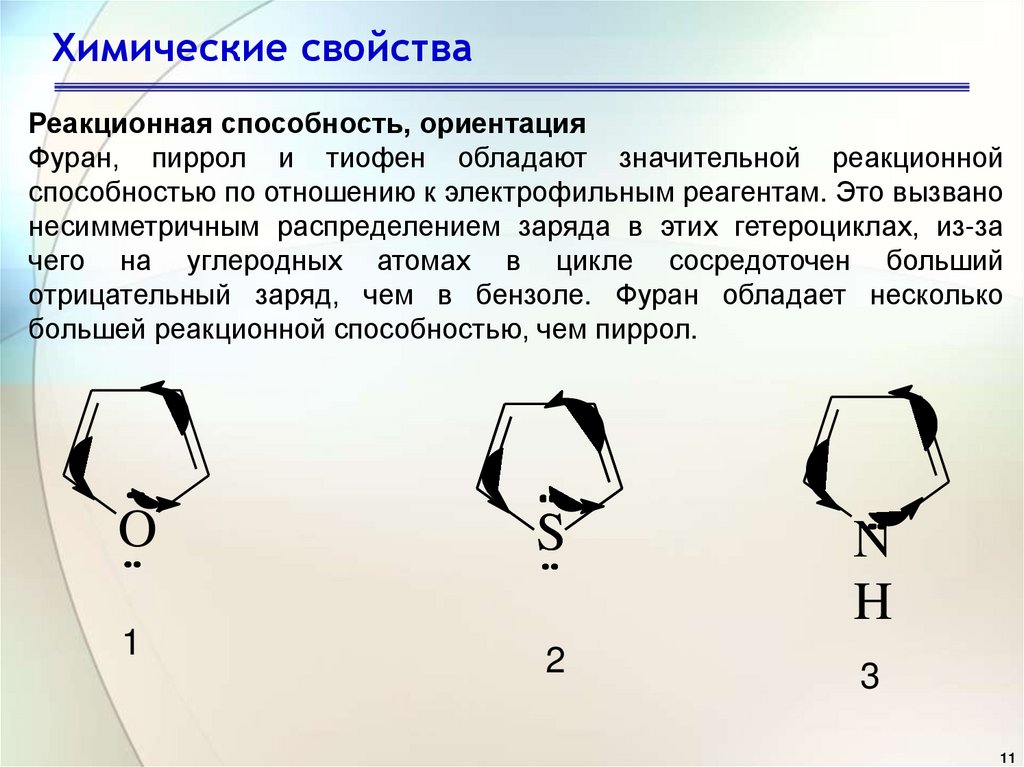
11. Химические свойства
Реакционная способность, ориентацияФуран, пиррол и тиофен обладают значительной реакционной
способностью по отношению к электрофильным реагентам. Это вызвано
несимметричным распределением заряда в этих гетероциклах, из-за
чего на углеродных атомах в цикле сосредоточен больший
отрицательный заряд, чем в бензоле. Фуран обладает несколько
большей реакционной способностью, чем пиррол.
O
S
1
N
H
2
3
11
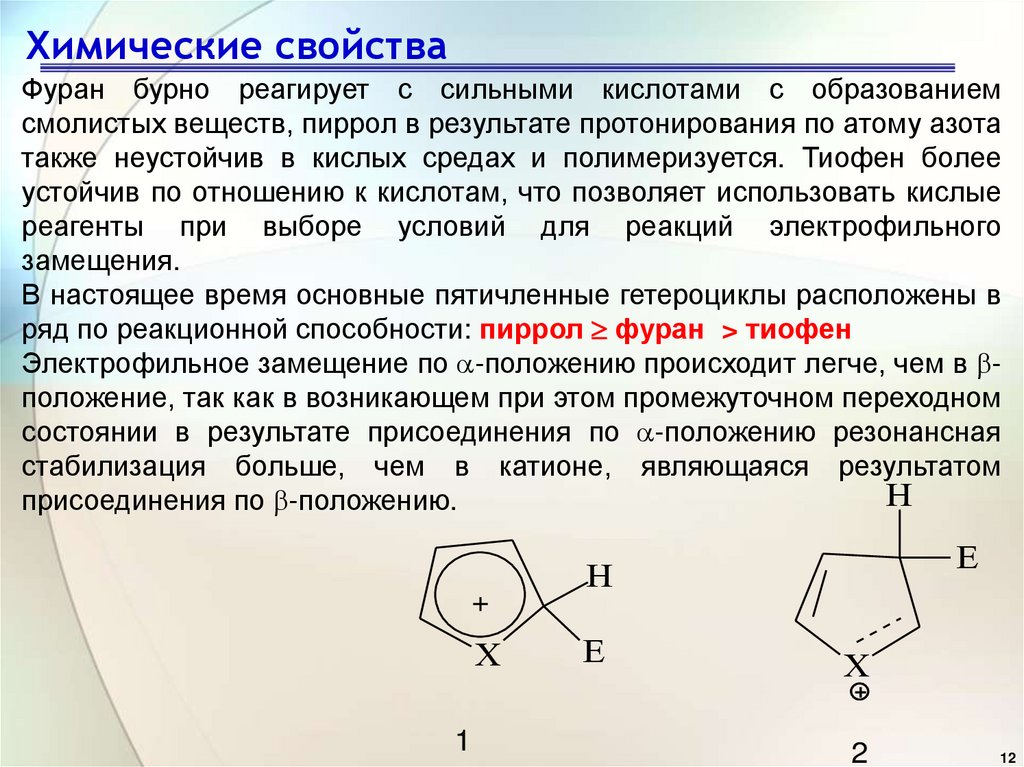
12. Химические свойства
Фуран бурно реагирует с сильными кислотами с образованиемсмолистых веществ, пиррол в результате протонирования по атому азота
также неустойчив в кислых средах и полимеризуется. Тиофен более
устойчив по отношению к кислотам, что позволяет использовать кислые
реагенты при выборе условий для реакций электрофильного
замещения.
В настоящее время основные пятичленные гетероциклы расположены в
ряд по реакционной способности: пиррол фуран > тиофен
Электрофильное замещение по -положению происходит легче, чем в положение, так как в возникающем при этом промежуточном переходном
состоянии в результате присоединения по -положению резонансная
стабилизация больше, чем в катионе, являющаяся результатом
H
присоединения по -положению.
+
X
1
E
H
E
X
2
12
13. Химические свойства
В катионе (2) двойная связь не может участвовать в мезомерной делокализацииположительного заряда.
Скорость замещения зависит от различия энергий основного и переходного
состояний, и более высокую скорость будет иметь тот процесс, который протекает
через более стабильное переходное состояние.
Реакционная способность - и -положений сильно зависит от электрофильного
агента и экспериментальных условий. Чем меньше сила электрофильного агента,
тем выше величина : . Это соотношение зависит также от гетероатома. 2Монозамещенные производные образуют с элктрофильными реагентами смеси
изомеров. Положения 2 и 5 находятся в сопряжении подобно п-положениям в
бензоле, поэтому возможно резонансное взаимодействие реакционного центра в
положении 5 с заместителем в положении 2. Положения 2 и 4 являются
положениями
мета-типа,
между
которыми
невозможно
резонансное
взаимодействие. Если в положении 2 находятся орто-пара-ориентирующие
группы, то замещение протекает в положении 5, которое является -положением
по отношению к гетероатому и пара-положением по отношению к заместителю.
Если мета-ориентирующий заместитель находится в положении 2, возникает
конкуренция между ориентирующим влиянием гетероатома и заместителя. В
фуране и тиофене, для которых соотношение : велико, -ориентирующий
эффект гетероатома преобладает и замещение протекает, главным образом, в
положении 5. В пирроле образуется смесь изомеров с преобладанием 4-изомера.
13
14. Химические свойства
Химические свойства подразделяютсяна:
I. Свойства, в которых проявляется
ароматический характер кольца.
II. Реакции, в которых проявляется
ненасыщенный характер кольца.
III.
Кислотно-основные
свойства,
обусловленные наличием гетероатомов.
14
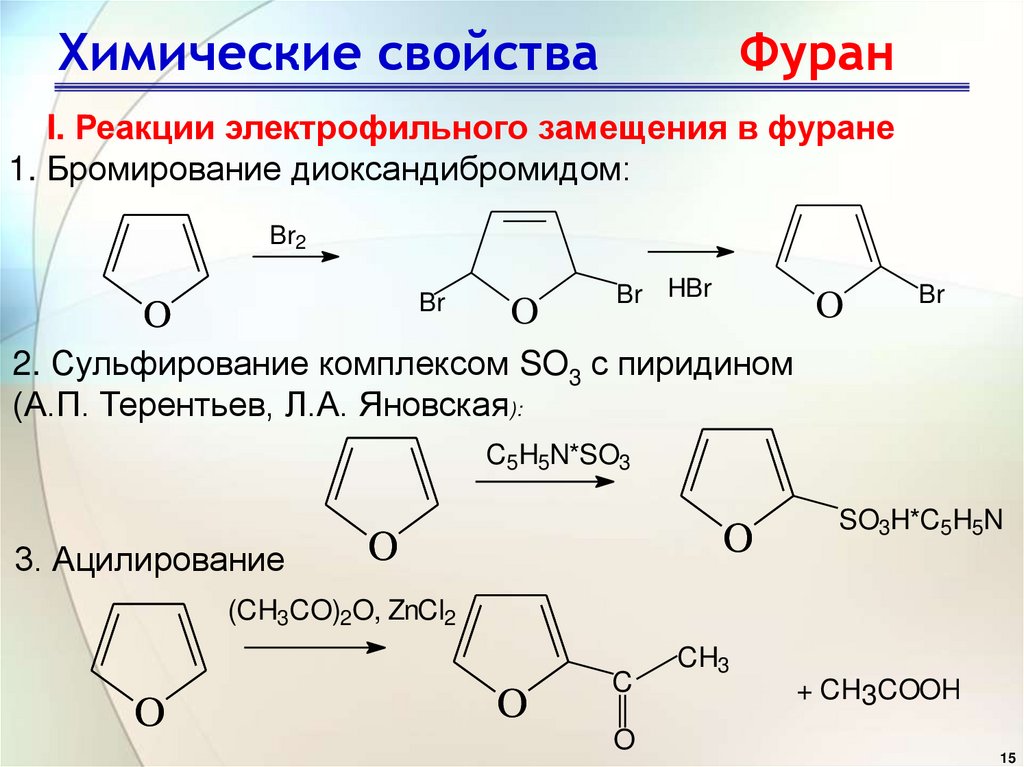
15. Химические свойства Фуран
I. Реакции электрофильного замещения в фуране1. Бромирование диоксандибромидом:
Br2
Br
O
O
Br HBr
O
Br
2. Сульфирование комплексом SO3 с пиридином
(А.П. Терентьев, Л.А. Яновская):
C5H5N*SO3
3. Ацилирование
O
O
SO3H*C5H5N
(CH3CO)2O, ZnCl2
O
O
C
O
CH3
+ CH3COOH
15
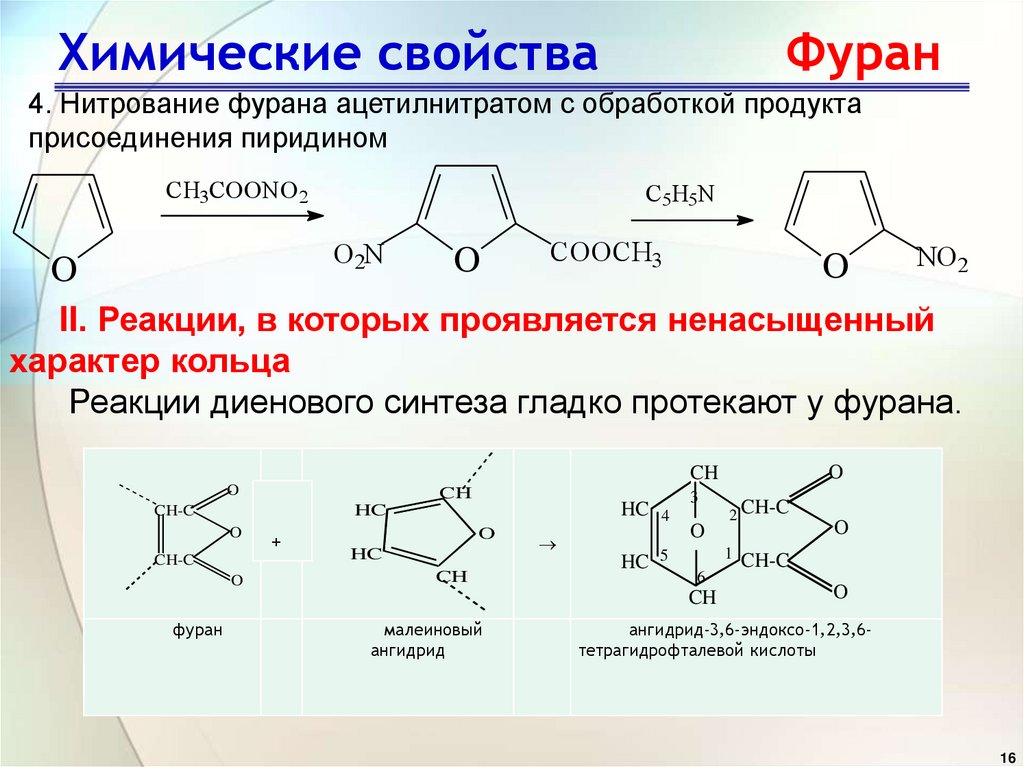
16. Химические свойства Фуран
4. Нитрование фурана ацетилнитратом с обработкой продуктаприсоединения пиридином
CH3COONO2
C5H5N
O2N
O
O
COOCH3
O
NO2
II. Реакции, в которых проявляется ненасыщенный
характер кольца
Реакции диенового синтеза гладко протекают у фурана.
O
CH
O
+
CH-C
O
CH-C
O
+
CH
HC 4
HC
O
HC
CH
HC 5
3
O
1
6
CH
фуран
малеиновый
ангидрид
2 CH-C
O
CH-C
O
ангидрид-3,6-эндоксо-1,2,3,6тетрагидрофталевой кислоты
16
17. Химические свойства Фуран
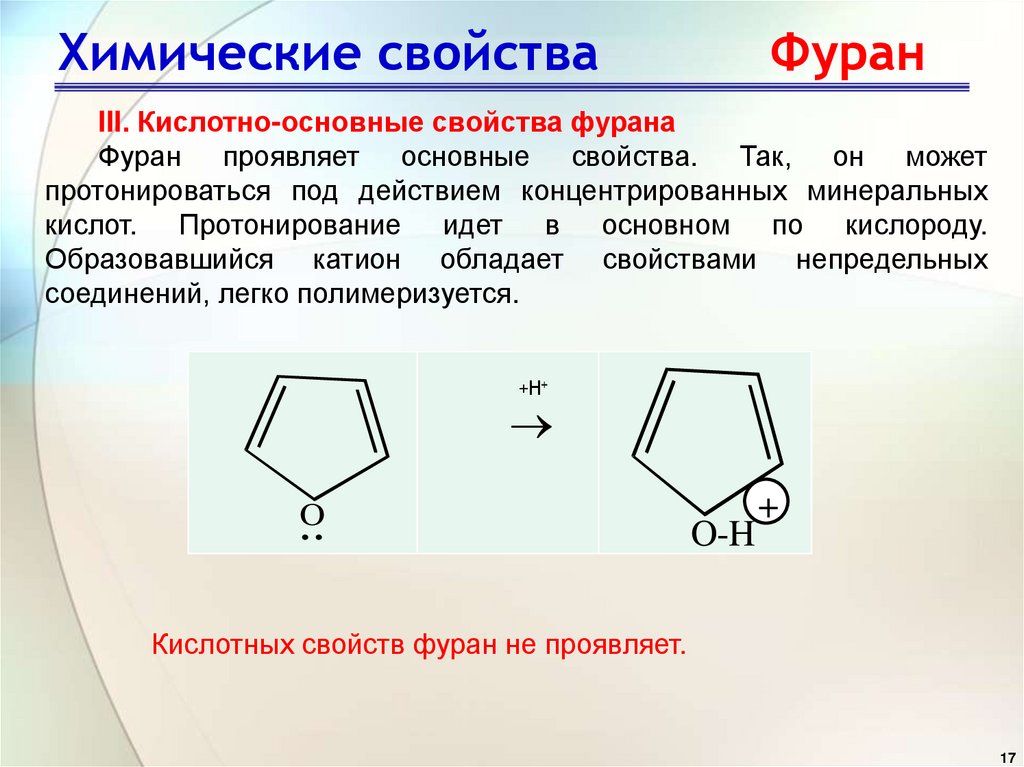
III. Кислотно-основные свойства фуранаФуран проявляет основные свойства. Так, он может
протонироваться под действием концентрированных минеральных
кислот. Протонирование идет в основном по кислороду.
Образовавшийся катион обладает свойствами непредельных
соединений, легко полимеризуется.
+H+
O
..
O-H
+
Кислотных свойств фуран не проявляет.
17
18. Химические свойства Тиофен
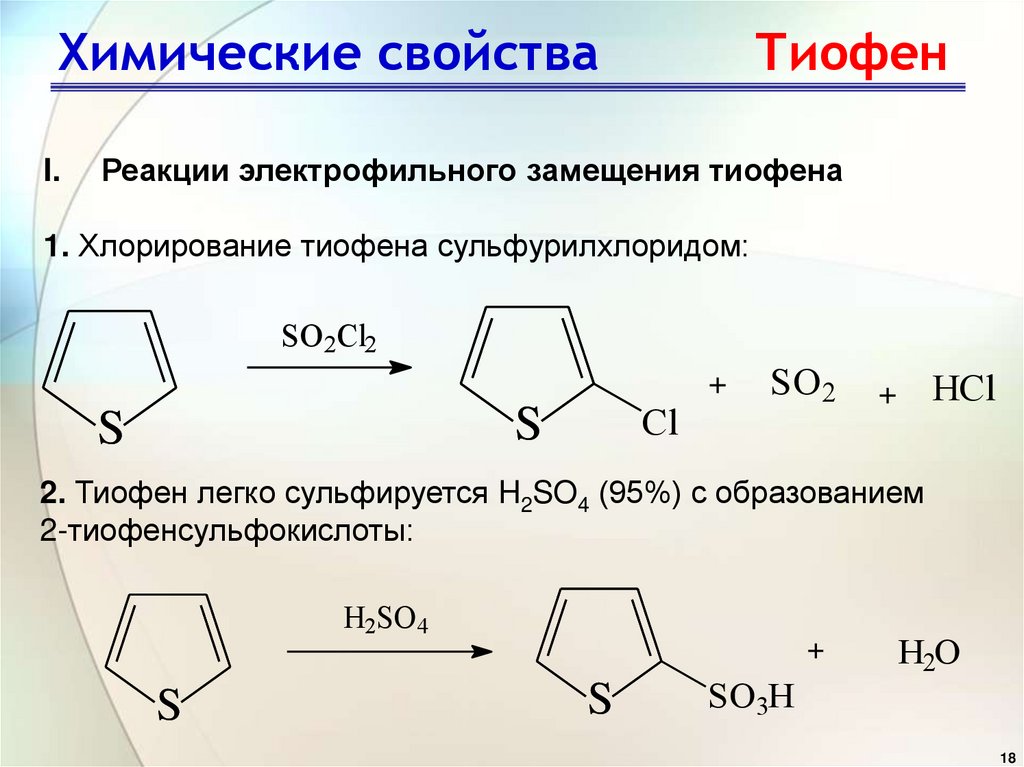
Химические свойстваI.
Тиофен
Реакции электрофильного замещения тиофена
1. Хлорирование тиофена сульфурилхлоридом:
SO2Cl2
+
Cl
S
S
SO2
HCl
+
2. Тиофен легко сульфируется H2SO4 (95%) с образованием
2-тиофенсульфокислоты:
H2SO4
S
+
S
SO3H
H2O
18
19. Химические свойства Тиофен
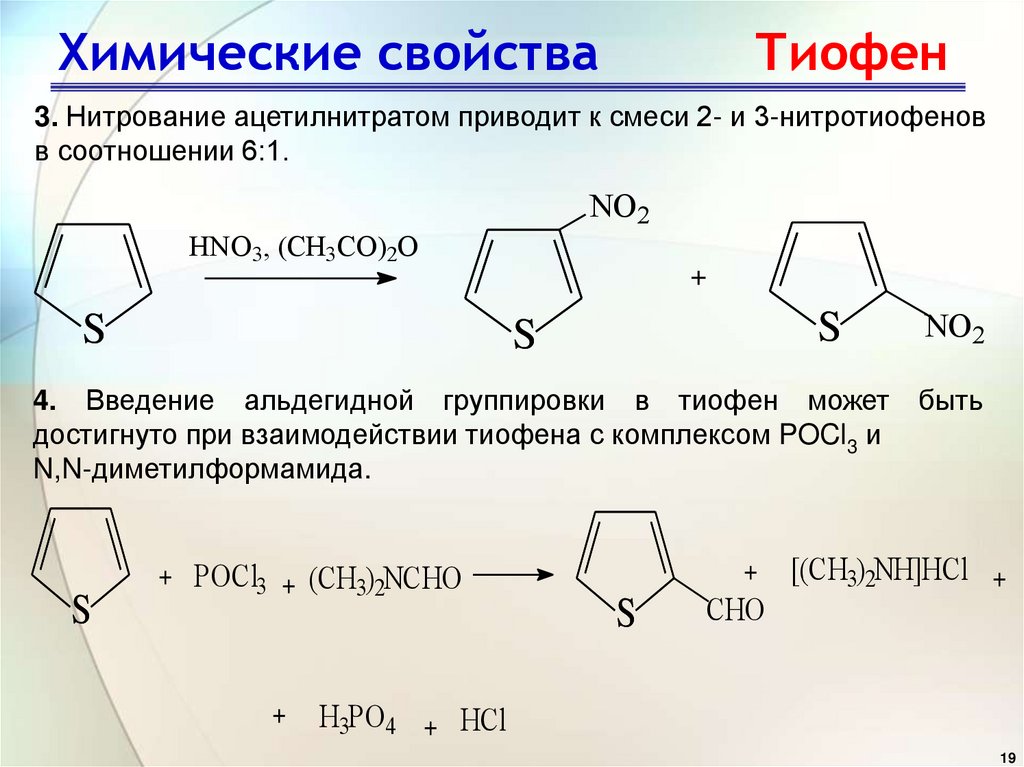
3. Нитрование ацетилнитратом приводит к смеси 2- и 3-нитротиофеновв соотношении 6:1.
NO2
HNO3, (CH3CO)2O
S
+
S
S
4. Введение альдегидной группировки в тиофен может
достигнуто при взаимодействии тиофена с комплексом POCl3 и
N,N-диметилформамида.
S
+ POCl3 + (CH3)2NCHO
+
+
S
CHO
NO2
быть
[(CH3)2NH]HCl +
H3PO4 + HCl
19
20. Химические свойства Тиофен
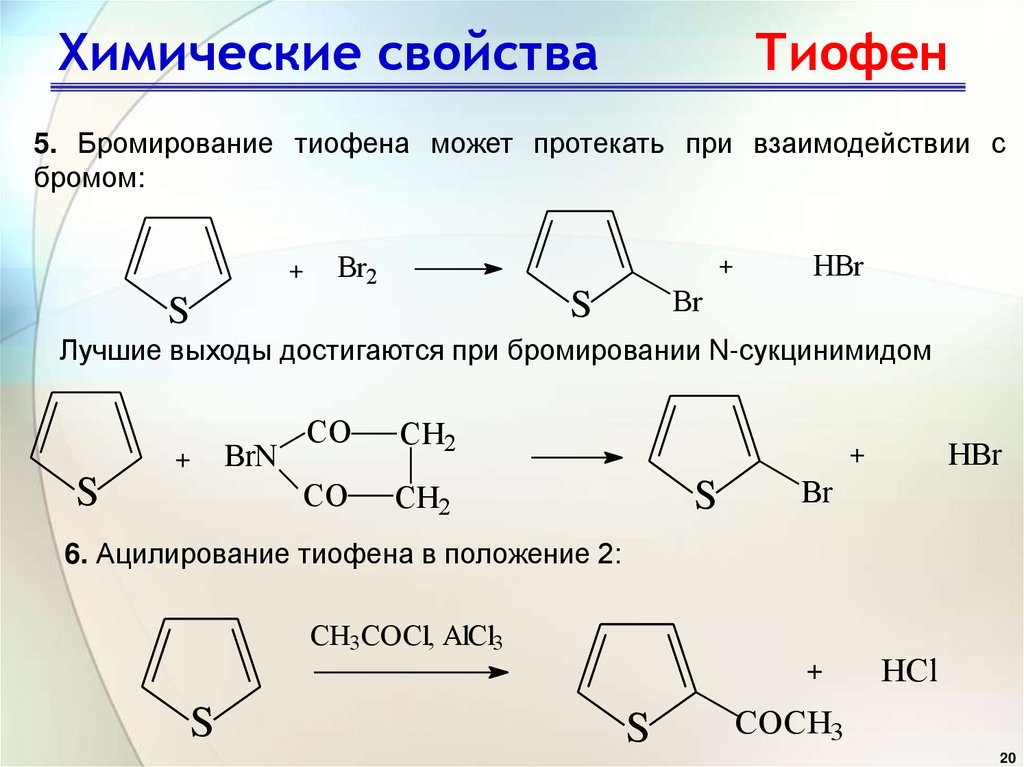
5. Бромирование тиофена может протекать при взаимодействии сбромом:
+
Br2
+
Br
S
S
HBr
Лучшие выходы достигаются при бромировании N-сукцинимидом
+
S
BrN
CO
CH2
CO
CH2
HBr
+
S
Br
6. Ацилирование тиофена в положение 2:
CH3COCl, AlCl3
+
S
S
HCl
COCH3
20
21. Химические свойства Тиофен
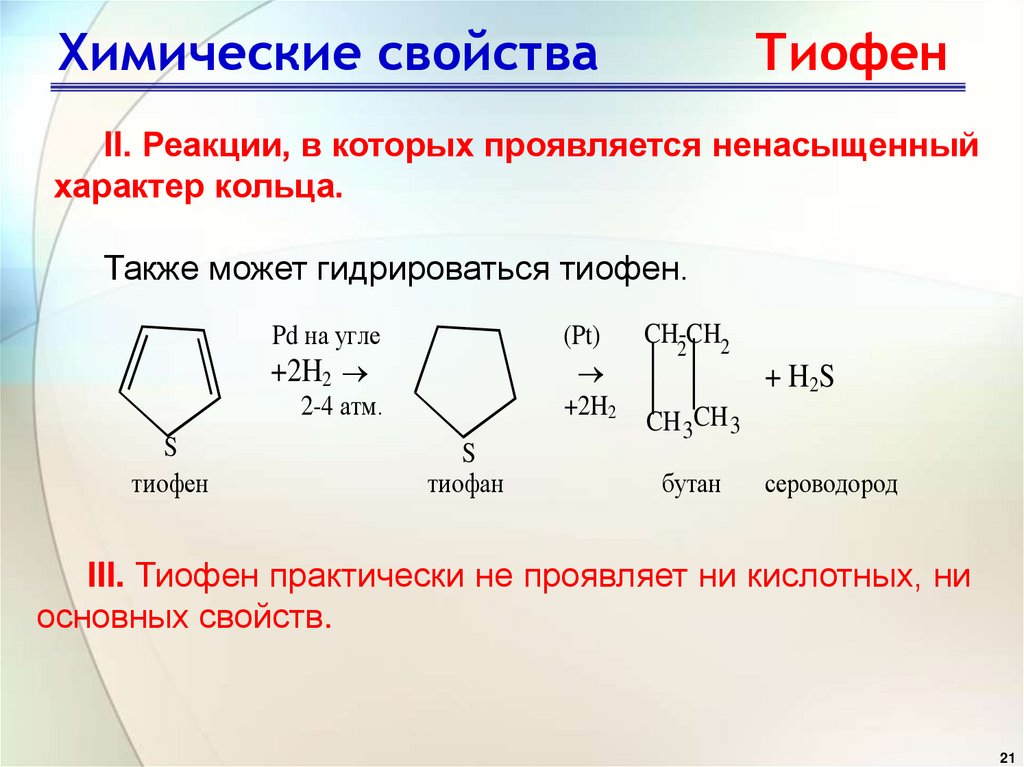
II. Реакции, в которых проявляется ненасыщенныйхарактер кольца.
Также может гидрироваться тиофен.
Pd на угле
+2H2
2-4 атм.
S
тиофен
(Pt)
+2H2
S
тиофан
CH-CH
2
2
+ H2S
CH 3CH 3
бутан
сероводород
III. Тиофен практически не проявляет ни кислотных, ни
основных свойств.
21
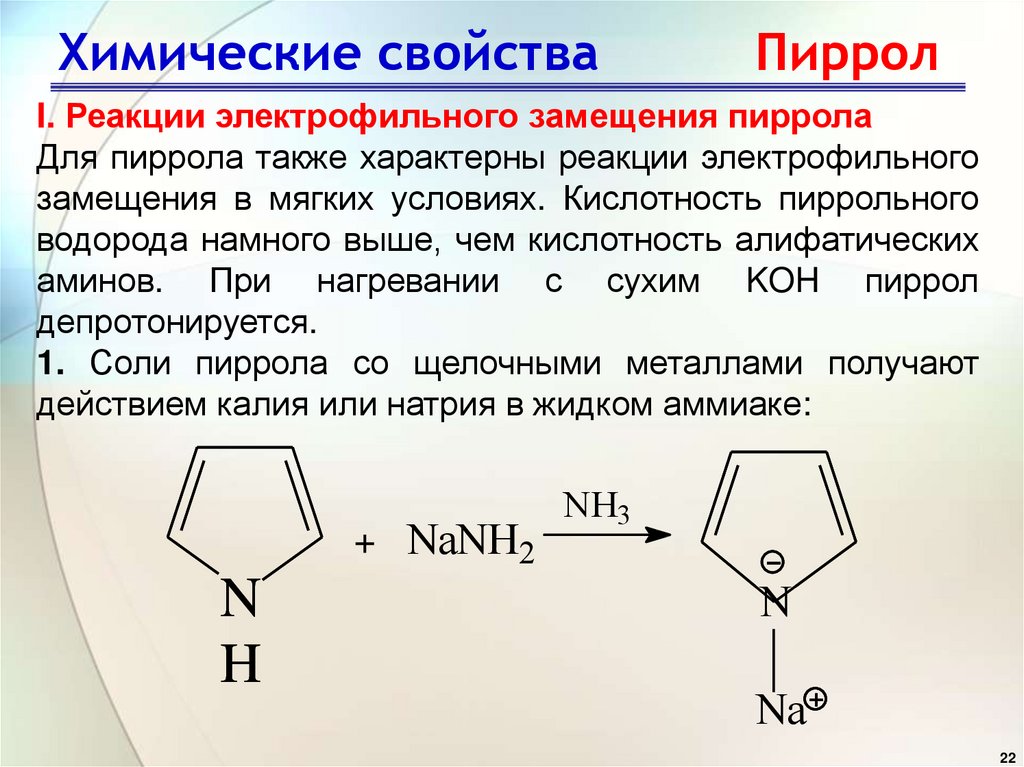
22. Химические свойства Пиррол
I. Реакции электрофильного замещения пирролаДля пиррола также характерны реакции электрофильного
замещения в мягких условиях. Кислотность пиррольного
водорода намного выше, чем кислотность алифатических
аминов. При нагревании с сухим KOH пиррол
депротонируется.
1. Соли пиррола со щелочными металлами получают
действием калия или натрия в жидком аммиаке:
+ NaNH2
N
H
NH3
N
Na
22
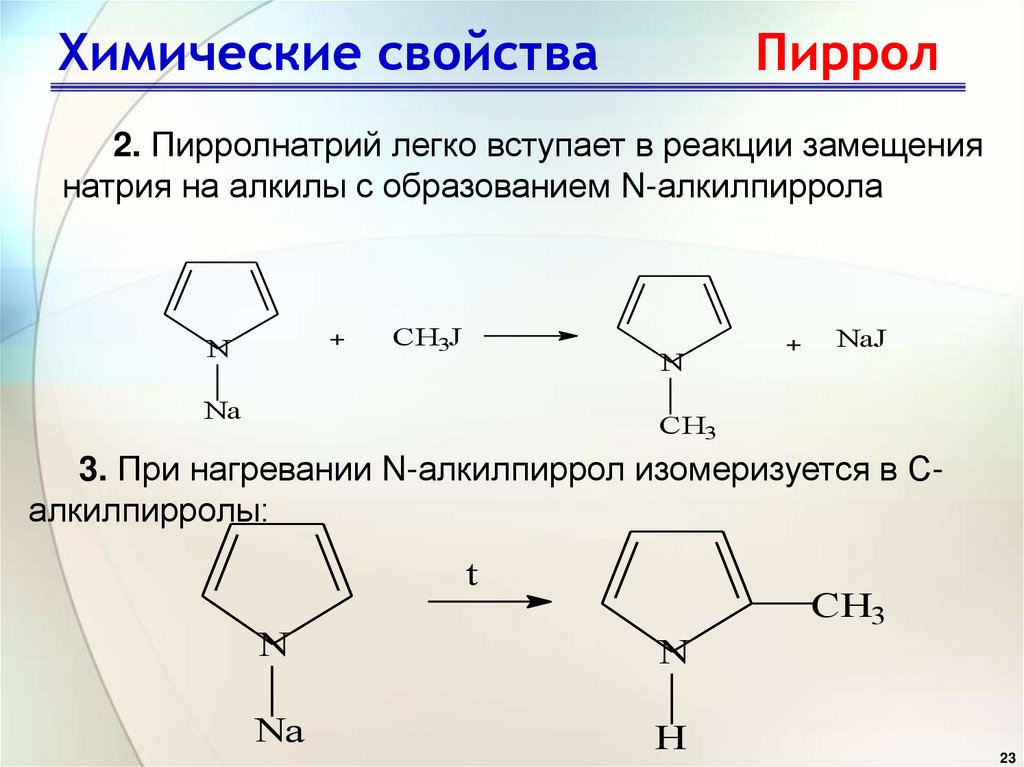
23. Химические свойства Пиррол
2. Пирролнатрий легко вступает в реакции замещениянатрия на алкилы с образованием N-алкилпиррола
+
N
CH3J
N
Na
+
NaJ
CH3
3. При нагревании N-алкилпиррол изомеризуется в Салкилпирролы:
t
CH3
N
N
Na
H
23
24. Химические свойства Пиррол
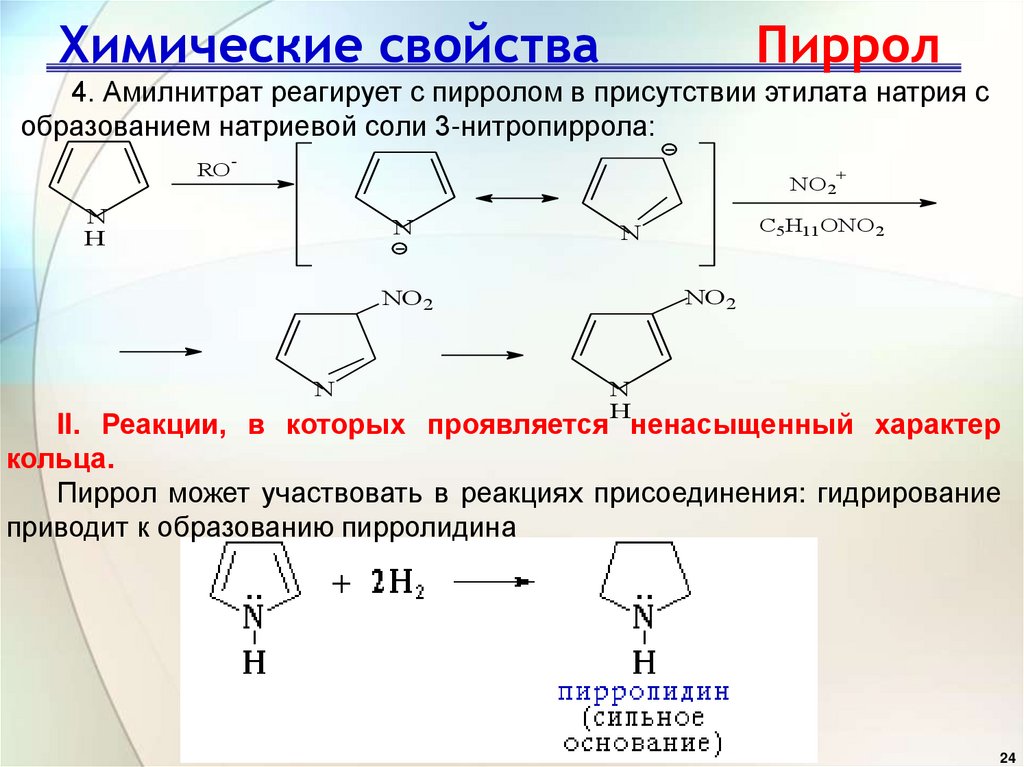
4. Амилнитрат реагирует с пирролом в присутствии этилата натрия собразованием натриевой соли 3-нитропиррола:
RO
-
+
NO2
N
H
N
NO2
NO2
N
C5H11ONO 2
N
N
H
II. Реакции, в которых проявляется ненасыщенный характер
кольца.
Пиррол может участвовать в реакциях присоединения: гидрирование
приводит к образованию пирролидина
24
25. Химические свойства Пиррол
III. 1) Кислотно-основные свойства пирролаа) пиррол, как и все азотистые основания, должен проявлять свойства
оснований за счет наличия аминного азота. Его основные свойства
чрезвычайно слабы, т.к. неподеленная пара электронов азота входит в
состав ароматического секстета. Пиррол может образовывать соли только
с очень сильными кислотами. Атака протона приводит к нарушению
ароматического секстета, образующийся катион пиррилия ведет себя как
сопряженный диен и вступает дальнейшее превращение –
полимеризацию и осмоление.
б) пиррол проявляет вполне ясные кислотные свойства, которые тоже
определяются участием неподеленной пары электронов азота в
ароматическом секстете, т.к. оттягивание неподеленной пары азота в
кольцо приводит к понижению электронной плотности у азота и
увеличению полярности связи N-Н
:
N
H
25
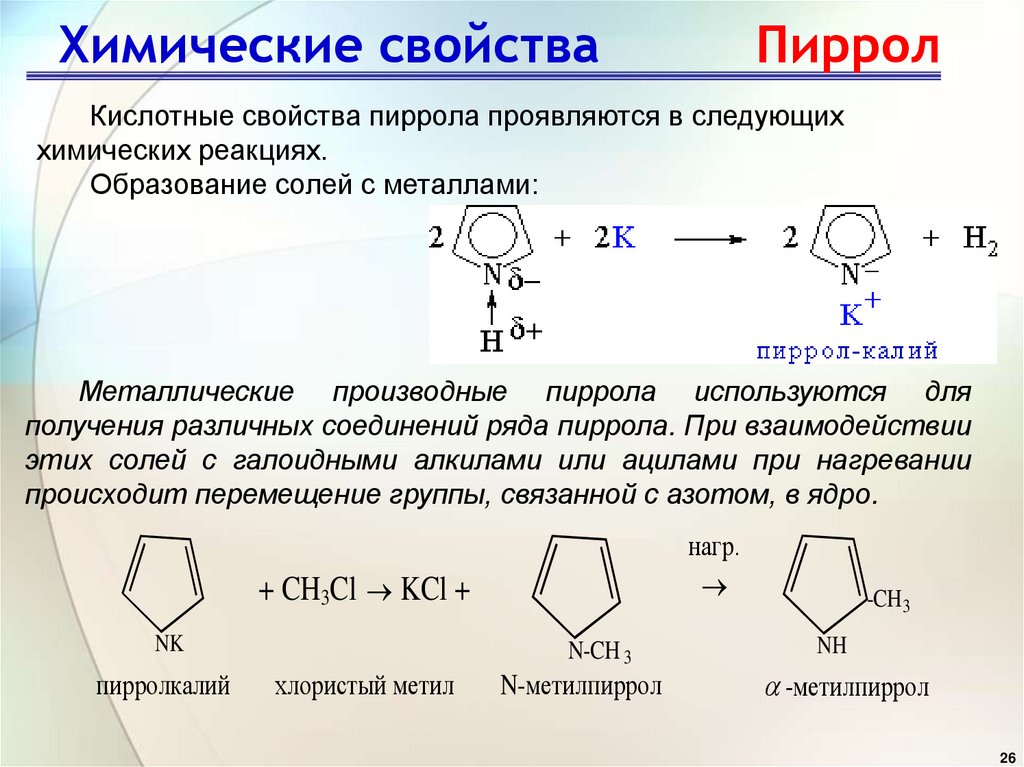
26. Химические свойства Пиррол
Кислотные свойства пиррола проявляются в следующиххимических реакциях.
Образование солей с металлами:
Металлические производные пиррола используются для
получения различных соединений ряда пиррола. При взаимодействии
этих солей с галоидными алкилами или ацилами при нагревании
происходит перемещение группы, связанной с азотом, в ядро.
нагр.
+ CH3Cl KCl +
NK
пирролкалий
N-CH 3
хлористый метил
N-метилпиррол
-CH 3
NH
-метилпиррол
26
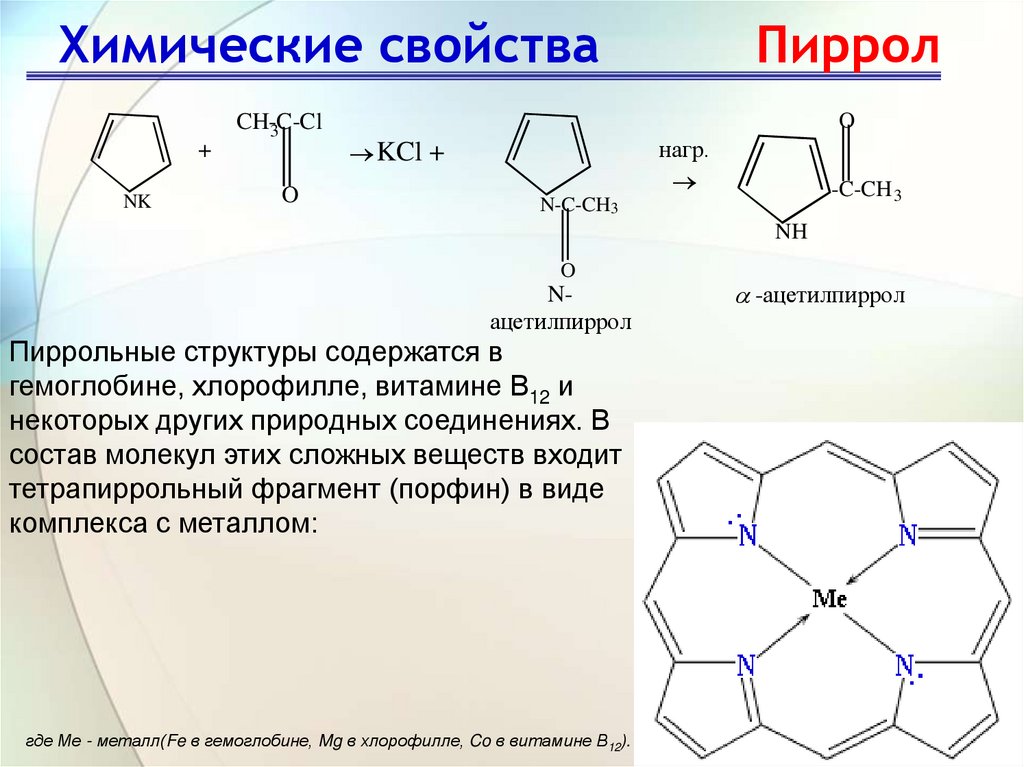
27. Химические свойства Пиррол
Химические свойстваCH-C-Cl
3
+
NK
O
Пиррол
O
нагр.
KCl +
-C-CH 3
N-C-CH3
NH
O
Nацетилпиррол
-ацетилпиррол
Пиррольные структуры содержатся в
гемоглобине, хлорофилле, витамине В12 и
некоторых других природных соединениях. В
состав молекул этих сложных веществ входит
тетрапиррольный фрагмент (порфин) в виде
комплекса с металлом:
где Ме - металл(Fe в гемоглобине, Mg в хлорофилле, Co в витамине В12).
27
28. Применение
Применение и значение пятичленных гетероциклическихсоединений
Пиррол – входит в состав гемоглобина, хлорофилла.
Пирролидин – входит в состав аминокислот (пролин, оксипролин).
Фуран – ТГФ.
Фурфурол фуриловый тетрагидрофуриловый спирт.
спирт
Фурфурол – селективный растворитель, в нефти, производство
пластмасс (фенолальдегидных), получение фумаровой кислоты,
лекарственных препаратов.
Тиофен – производные используются как лечебные препараты.
Имидазол – входит в состав аминокислот, белков, получение
ускорителей вулканизации.
Тиазол – входит в состав пенициллина, используется для получения
лекарственных препаратов.
Пиразол – получение лекарственных препаратов (антипирин,
амидопирин), красящих веществ, фотореактивов.
Индол – входит в состав гетероауксина, аминокислот, белков.
Используется для получения индиго, пурина.
28
29. Значение гетероциклов
Многочисленные гетероциклические соединения играют важную рольв биологии, медицине, сельском хозяйстве и других областях.
Они входят в состав важнейших природных продуктов: красящих
веществ крови и растений (гемина и хлорофилла), нуклеиновых
кислот, многих витаминов, антибиотиков и алкалоидов.
Можно без преувеличения считать, что почти вся фармацевтическая
химия является химией гетероциклических соединений.
Многие яркие красители (индиго, индантрен) также содержат
гетероциклические кольца. В сельском хозяйстве используются
инсектициды,
вещества
для
ускорения
роста,
имеющие
гетероциклическую природу.
В зависимости от числа атомов, образующих гетероциклы, различают
трех-, четырех-, пяти-, шестичленные гетероциклические соединения,
содержащие один, два и более гетероатомов, одинаковых или разных.
Трех- и четырехчленные гетероциклические соединения обычно
неустойчивы. Класс гетероциклических соединений составляют
преимущественно
пятии
шестичленные
гетероциклические
соединения.
29









 Химия
Химия