Похожие презентации:
Карбоновые кислоты. (Лекция 6.3)
1.
Уральский государственныйаграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
Органическая химия
Карбоновые кислоты (ч.3)
Екатеринбург, 2019-2020
Л-6
2.
План1. Классификация
2. Номенклатура и изомерия
3. Методы получения
4. Физические свойства
5. Химические свойства
2
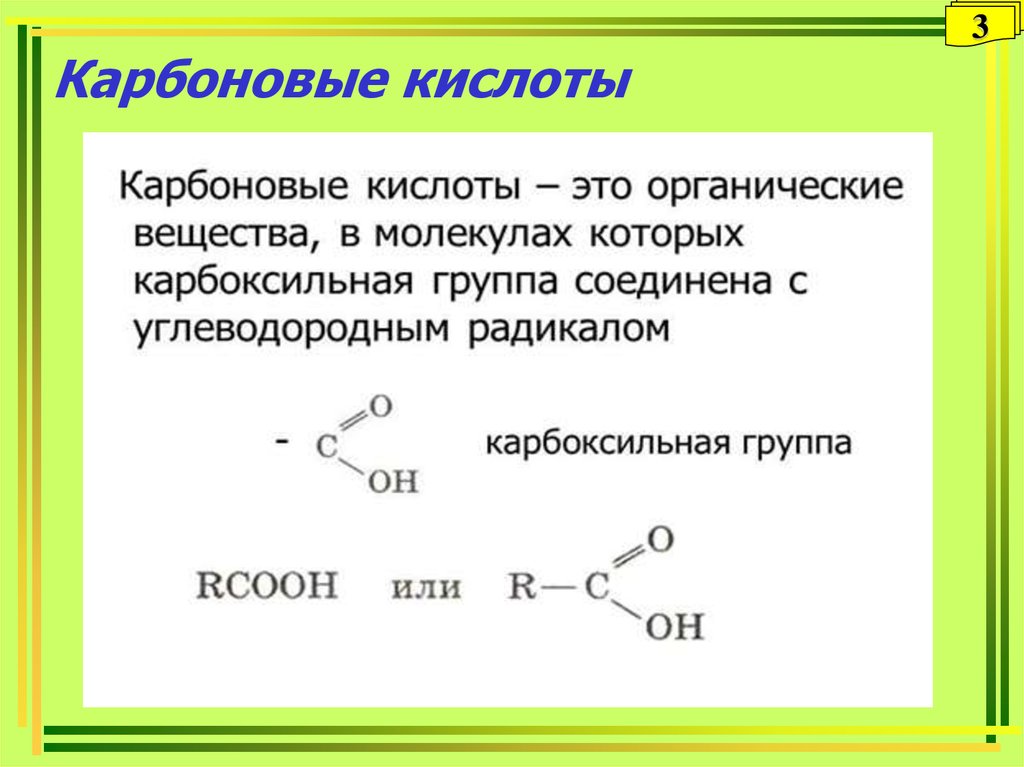
3. Карбоновые кислоты
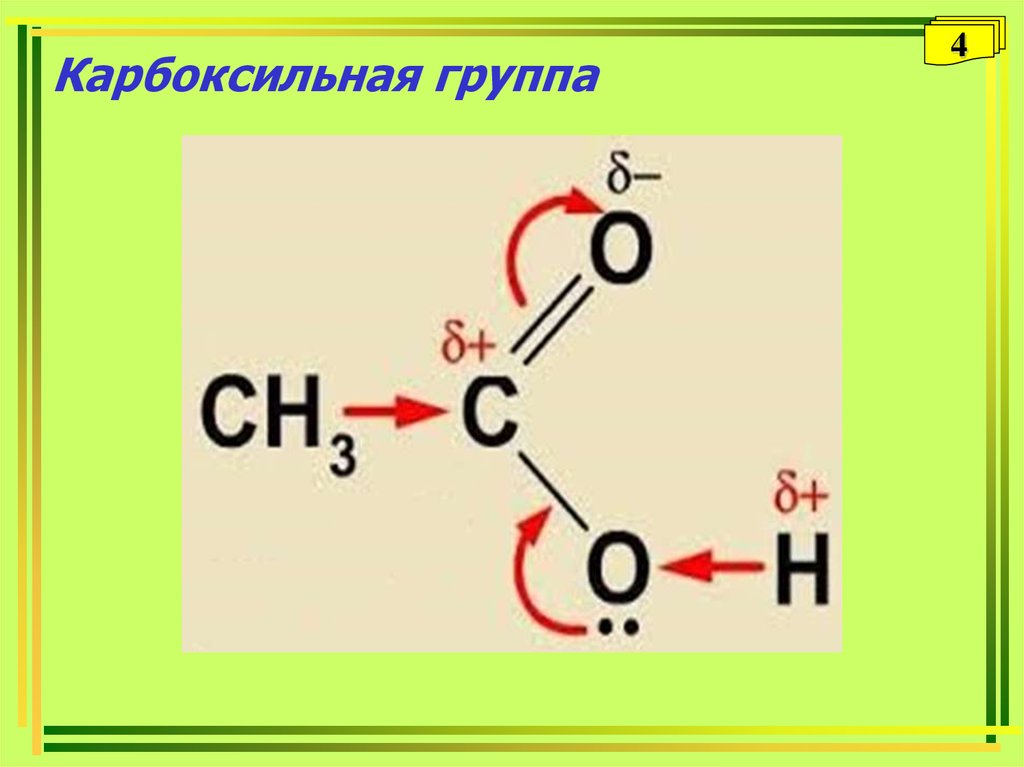
34. Карбоксильная группа
45. Классификация
5• Одноосновные, двухосновные,
трехосновные - в зависимости от числа
карбоксильных групп в молекуле.
• Алифатические, алициклические,
ароматические – в зависимости от строения
углеводородного радикала.
• Предельные, непредельные - в зависимости от
строения углеводородного радикала.
• А также: полифункциональные карбоновые
кислоты: гидроксикислоты, оксокислоты
• Высшие (жирные кислоты) (cвыше шести
атомов C) и низшие кислоты
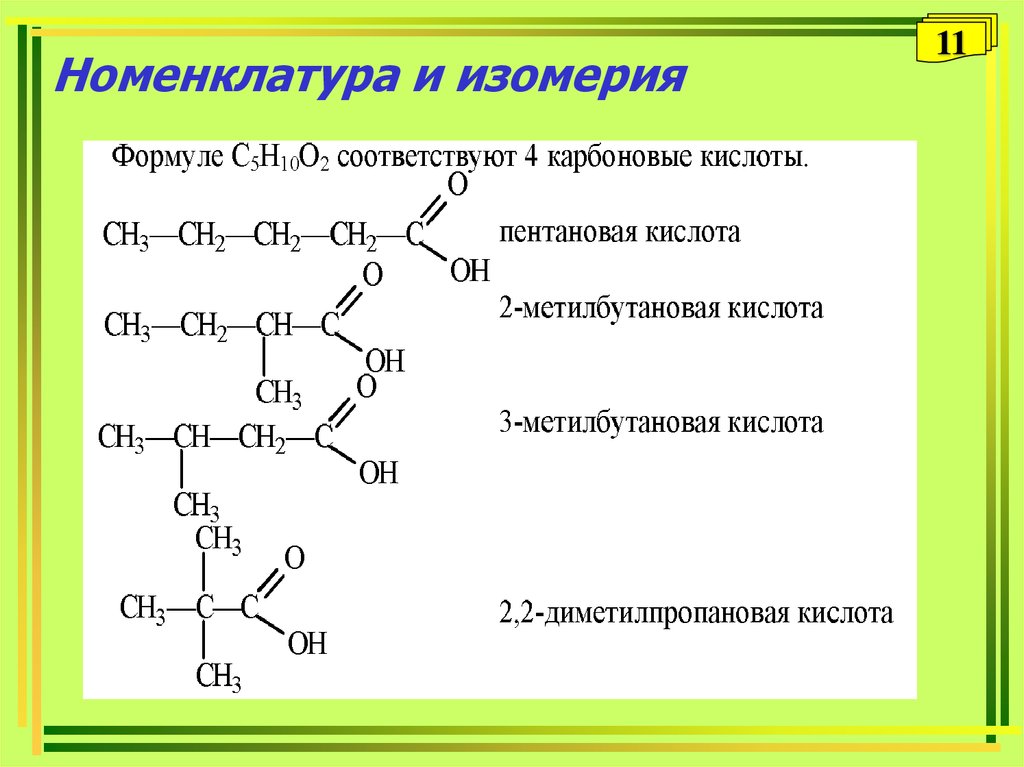
6. Номенклатура и изомерия
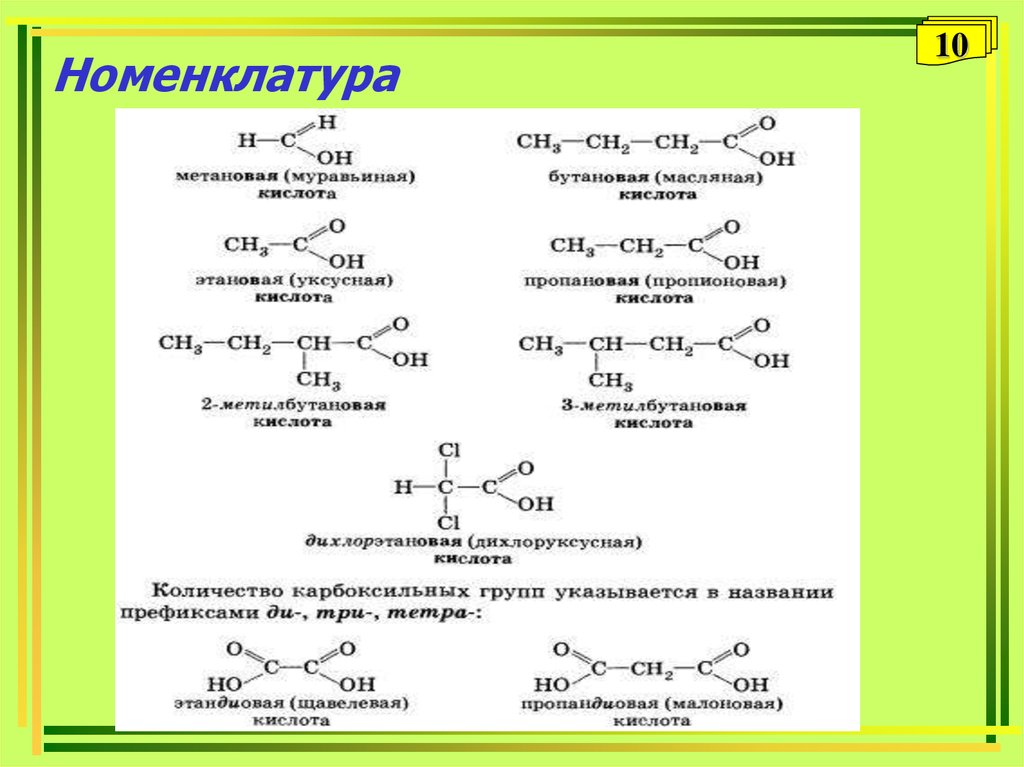
6• Название карбоновой кислоты образуется от названия
соответствующего алкана с добавлением суффикса – ов,
окончания – ая и слова – кислота.
Пример: этан – этановая кислота (CH3-COOH)
• Нумерация атомов углерода начинается с карбоксильной
группы.
Пример: CH3-CH=CH-COOH бутен-2-овая кислота
• Количество карбоксильных групп указывается в
названии префиксами – ди-,три, тетра. Так, названия
дикарбоновых кислот имеют окончания – диовая.
Пример: HOOC-COOH - этандиовая кислота
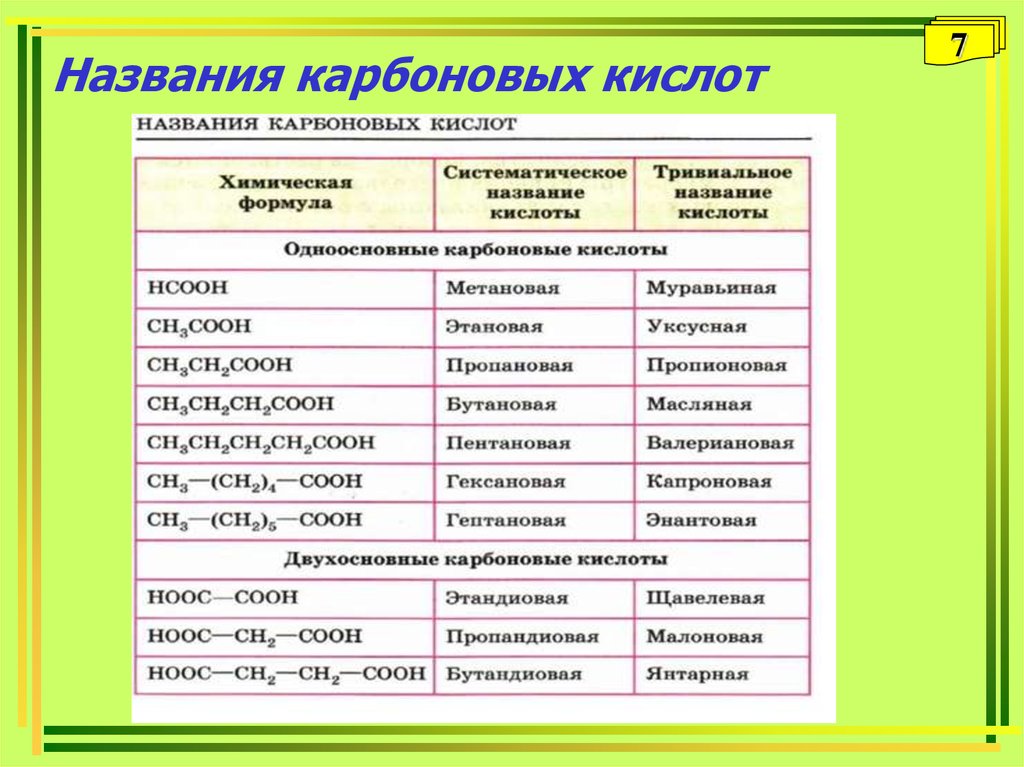
• Многие кислоты имеют исторически сложившиеся
(тривиальные названия): муравьиная, уксусная,
щавелевая и т.д.
7. Названия карбоновых кислот
78.
89. Изомерия
9Изомерия
• Изомерия углеводородного радикала
СН3-СH2-CH2-COOH
СН3-СH-COOH
бутановая (масляная) кислота
|
CH3
2-метилпропановая (изомасляная)кислота
• Межклассовая изомерия со сложными эфирами
СН3-СH2-COOH
СН3СOOСН3
пропановая кислота
метиловый эфир уксусной кислоты
10. Номенклатура
1011. Номенклатура и изомерия
1112.
1213.
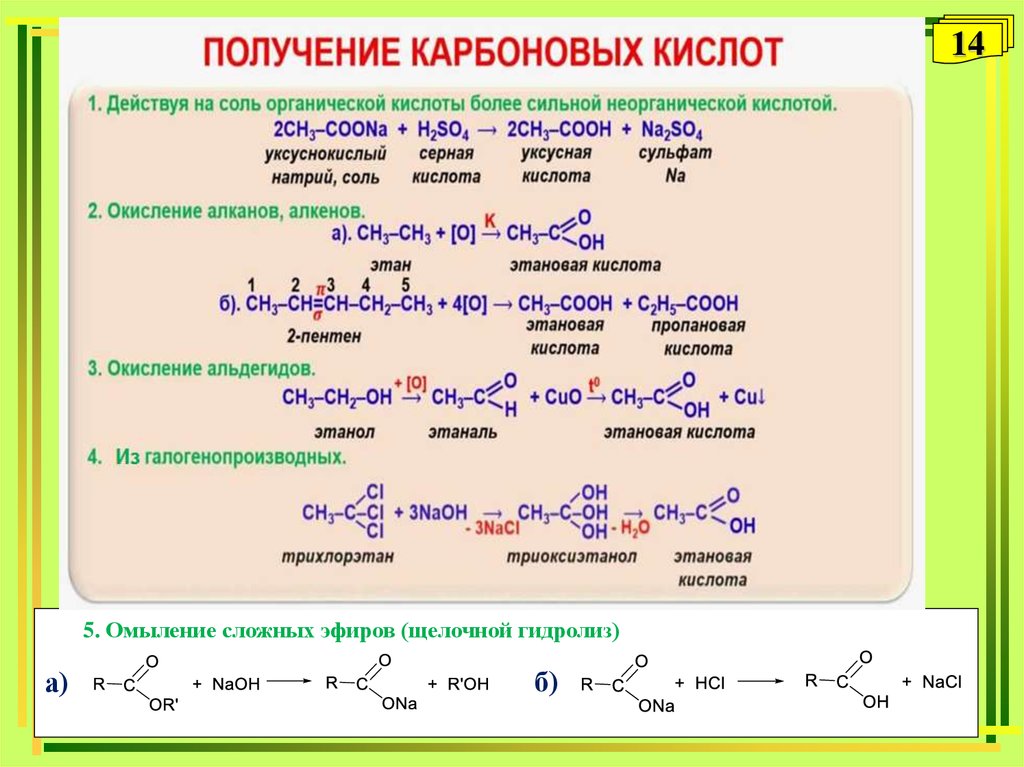
1314.
145. Омыление сложных эфиров (щелочной гидролиз)
а)
б)
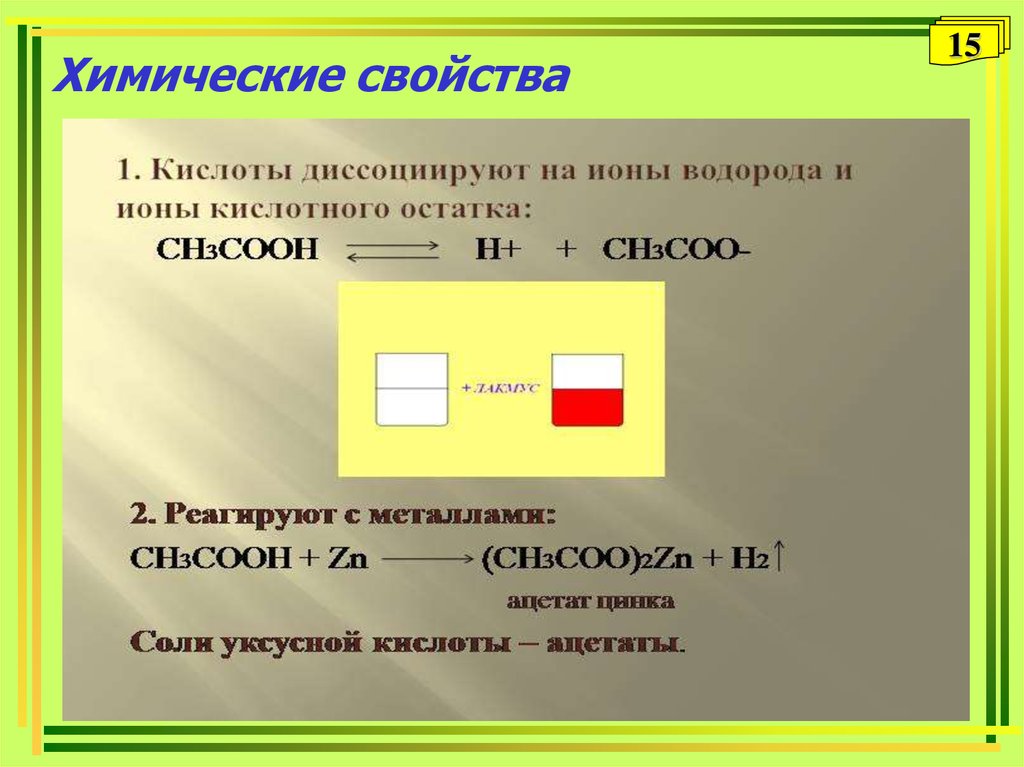
15. Химические свойства
1516. Химические свойства (прод.)
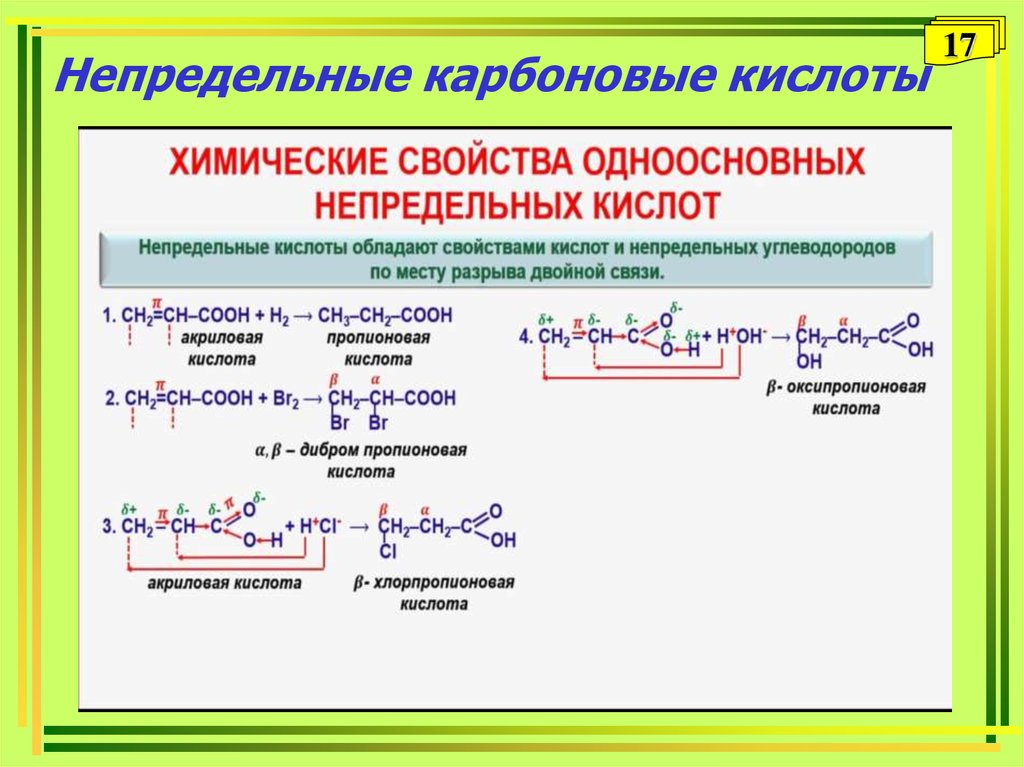
1617. Непредельные карбоновые кислоты
1718.
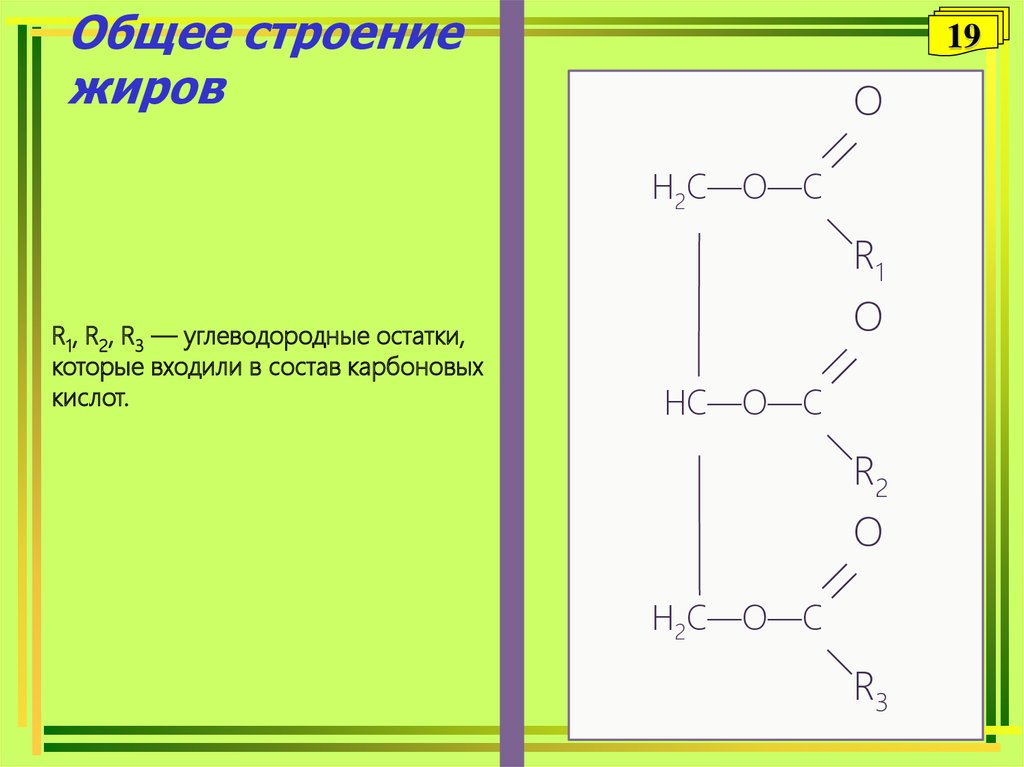
18Жиры — это природные
соединения, которые представляют
собой сложные эфиры трёхатомного
спирта глицерина и жирных кислот.
19.
Общее строениежиров
19
O
H2С—O—C
R1
R1, R2, R3 — углеводородные остатки,
которые входили в состав карбоновых
кислот.
O
HС—O—C
R2
O
H2С—O—C
R3
20.
20Кислоты в составе жиров:
С15H31СOOH — пальмитиновая кислота
С17H35СOOH — стеариновая кислота
С17H33СOOH — олеиновая кислота
С17H31СOOH — линолевая кислота
С17H29СOOH — линоленовая кислота
21.
21В воде жиры не растворяются,
так как их плотность меньше,
чем у воды.
Это легко проверить, если в
воду налить растительное масло.
22.
22Жиры не имеют постоянной
температуры плавления
или застывания, т.к. представляют
собой многокомпонентные смеси.
23.
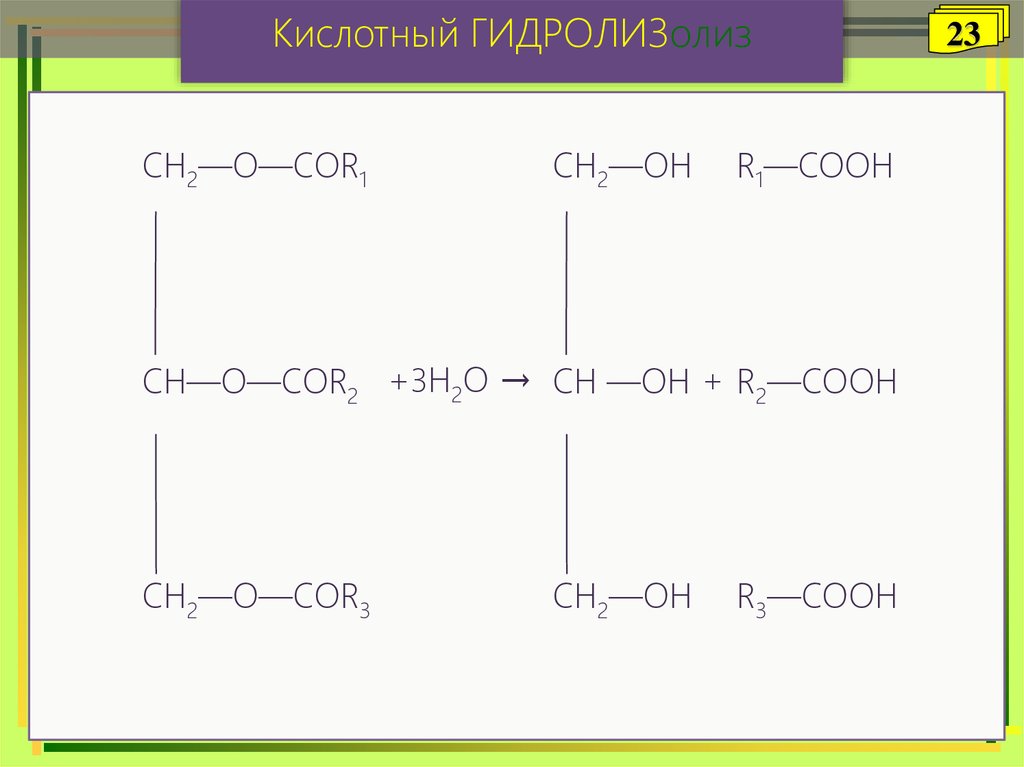
Кислотный ГИДРОЛИЗолизСH2—O—СOR1
СH2—OH
R1—COOH
СH—O—СOR2 +3H2O → СH —OH + R2—COOH
СH2—O—СOR3
СH2—OH
R3—COOH
Жир
Глицерин
Карбоновые
кислоты
23
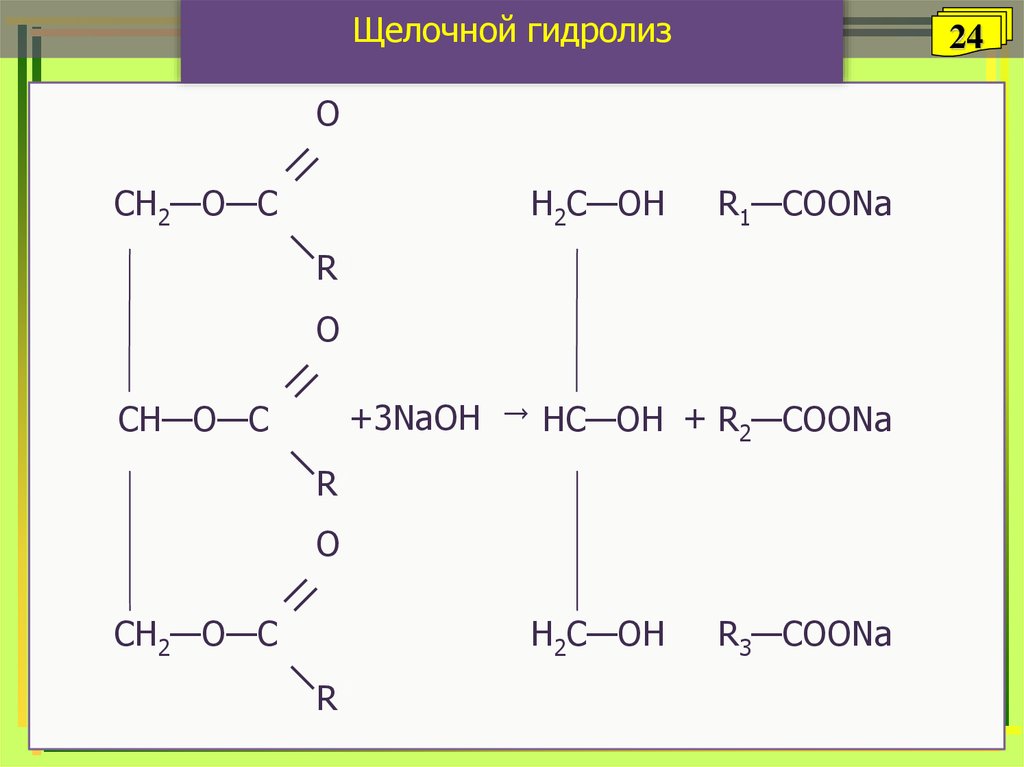
24.
Щелочной гидролиз24
O
СH2—O—C
H2С—OH
R1—COONa
R1
O
+3NaOH → HC—OH + R2—COONa
СH—O—C
R2
O
СH2—O—C
H2С—OH
R3
R3—COONa
Соли высших
Глицерин Карбоновых кислот
25.
25Жиры являются очень важной
составной частью пищевого рациона
человека. Физиологическая роль
жиров в организме велика.
Прежде всего жир — это ценный
энергетический материал.
Калорийность жира в 2,5 раза выше,
чем белков и углеводов.
Жирные кислоты (наряду с глюкозой)
являются источником энергии для
работающих мышц.
Жиры и жироподобные вещества, как
и белки, входят в состав клеток
органов
и тканей.














 Химия
Химия








