Похожие презентации:
Функциональные производные карбоновых кислот
1. ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
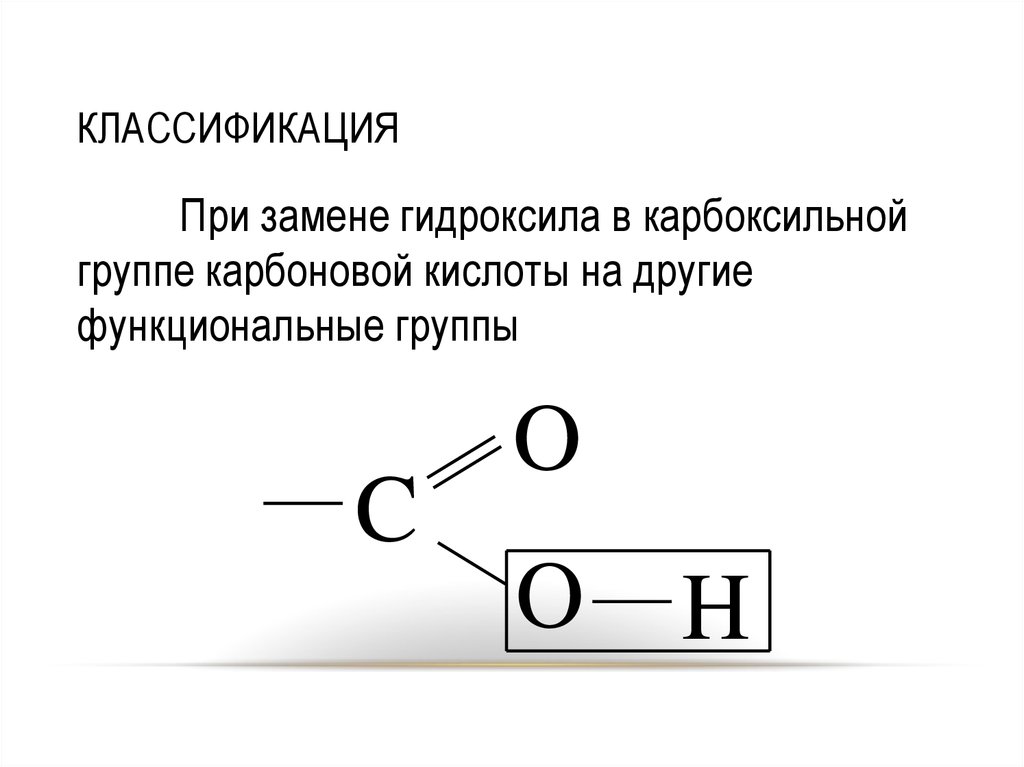
12. КЛАССИФИКАЦИЯ
При замене гидроксила в карбоксильнойгруппе карбоновой кислоты на другие
функциональные группы
C
O
O
H
2
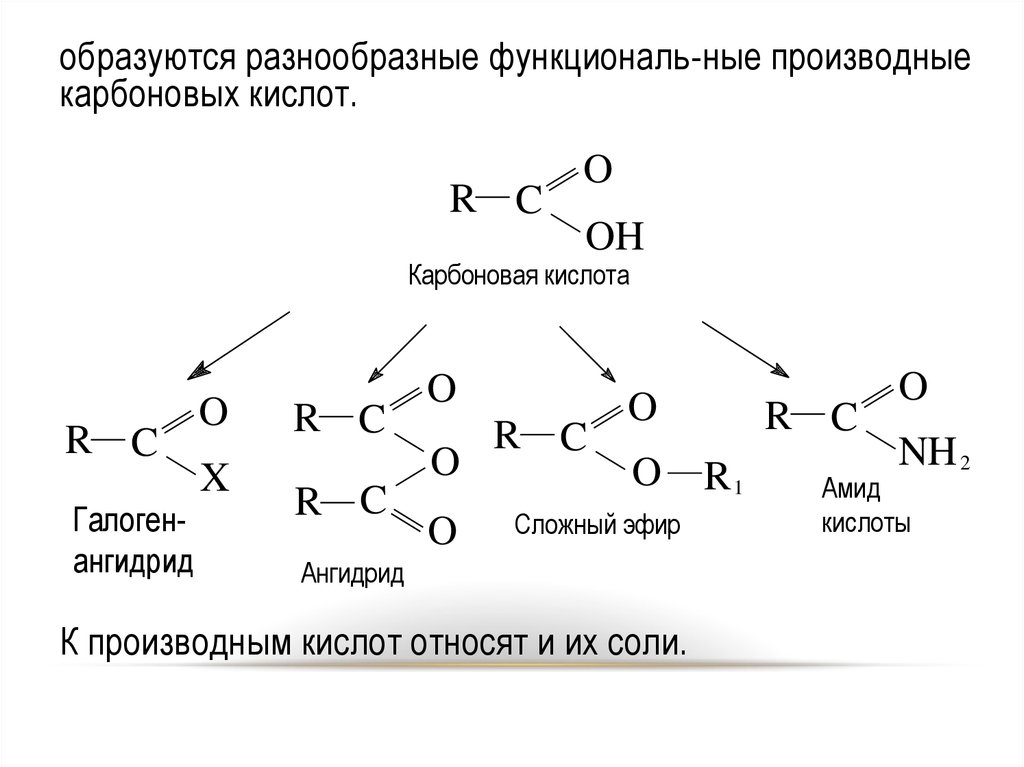
3.
образуются разнообразные функциональ-ные производныекарбоновых кислот.
R C
O
OH
Карбоновая кислота
R C
Галогенангидрид
O
X
R C
O
O
R C
O
R C
O
O
Сложный эфир
R C
R1
O
NH 2
Амид
кислоты
Ангидрид
К производным кислот относят и их соли.
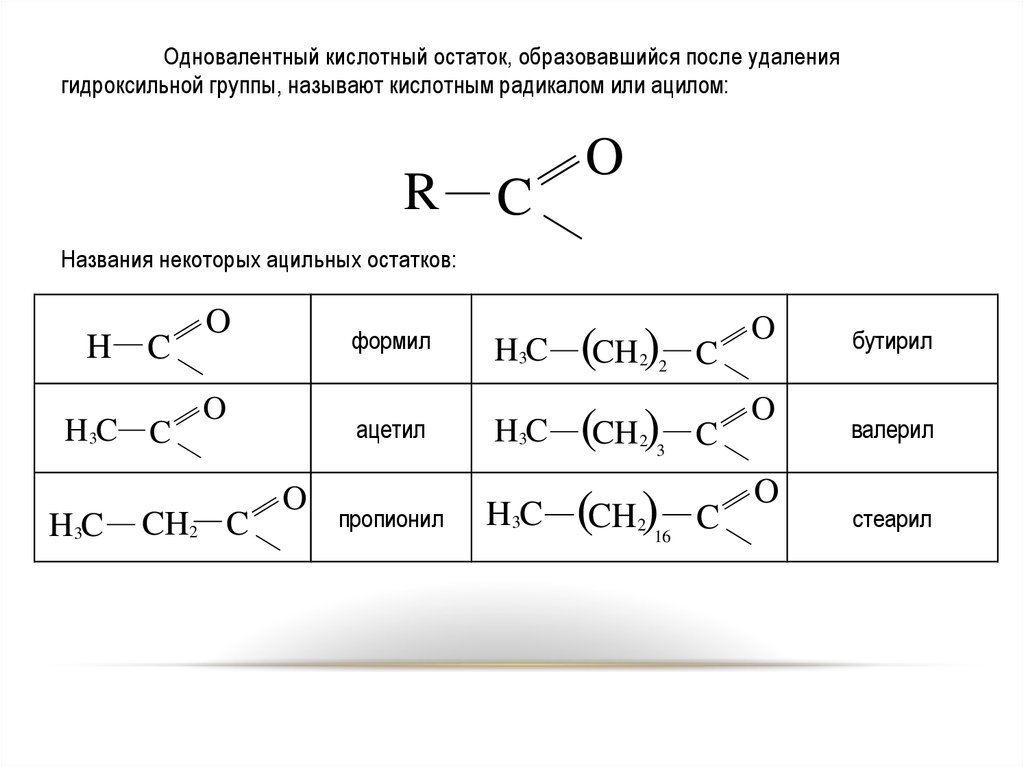
3
4.
Одновалентный кислотный остаток, образовавшийся после удалениягидроксильной группы, называют кислотным радикалом или ацилом:
R
C
O
Названия некоторых ацильных остатков:
H
C
H3C C
H3C
O
формил
O
CH2 C
ацетил
O
пропионил
H3C
H3C
H3C
(CH )
2 2
(CH )
2
3
(CH )
2
16
C
C
C
O
O
O
бутирил
валерил
стеарил
4
5. АНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
56. ПОЛУЧЕНИЕ
• Из карбоновых кислот при их термическойангидридизации или при взаимодействии с сильными
водоотнимающими реагентами (P2O5, ангидрид
трифторуксусной кислоты, карбодиимиды). При
нагревании легче всего образуются циклические
ангидриды дикарбоновых кислот (см. химические
свойства карбоновых кислот).
• При взаимодействии ацилхлоридов с карбоновыми
кислотами или их солями (см. свойства карбоновых
кислот).
Первый представитель гомологического ряда – ангидрид муравьиной кислоты –
нестабилен.
6
7. ФИЗИЧЕСКИЕ СВОЙСТВА
Ангидриды карбоновых кислот являютсябесцветными жидкостями или
кристаллическими веществами. Первые
представители гомологического ряда имеют
острый раздражающий запах. В воде
растворяются мало и с ней постепенно
взаимодействуют.
7
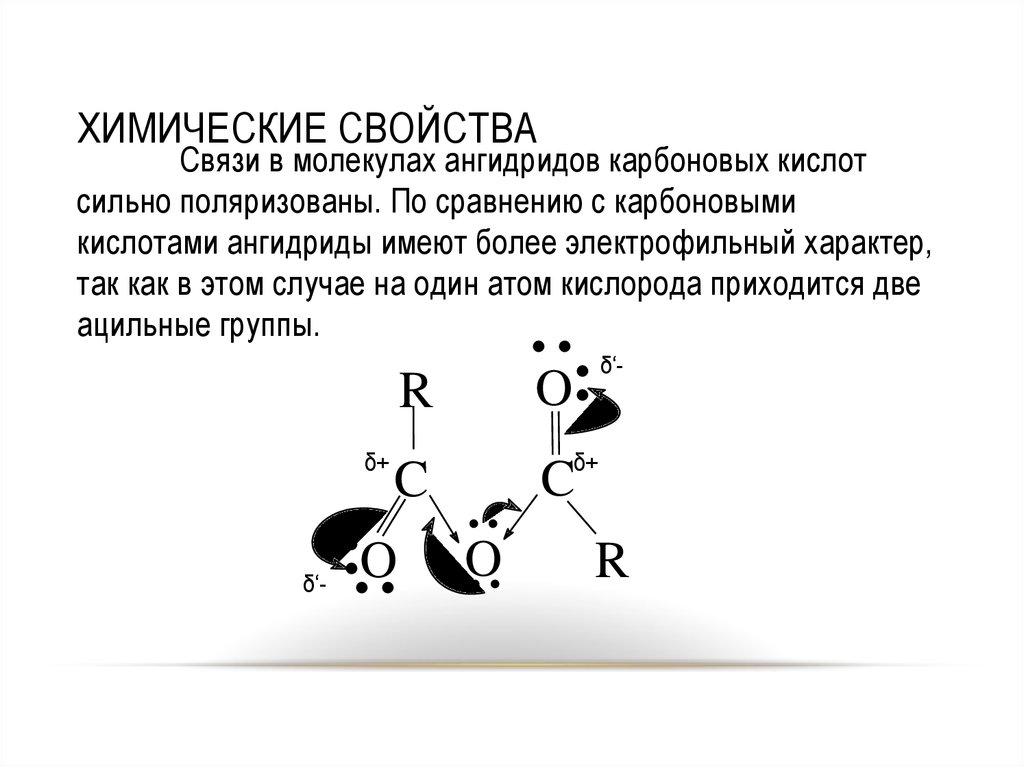
8. ХИМИЧЕСКИЕ СВОЙСТВА
Связи в молекулах ангидридов карбоновых кислотсильно поляризованы. По сравнению с карбоновыми
кислотами ангидриды имеют более электрофильный характер,
так как в этом случае на один атом кислорода приходится две
ацильные группы.
....
O
R
δ+
δ‘-
C
....O
..
O
..
δ‘-
δ+
C
R
8
9.
• Реакции ацелированияo Взаимодействие с водой (гидролиз)
H3C
C
O
O
H3C
C
O
Уксусный ангидрид
+H O
2
2 H3C
C
O
OH
Уксусная кислота
9
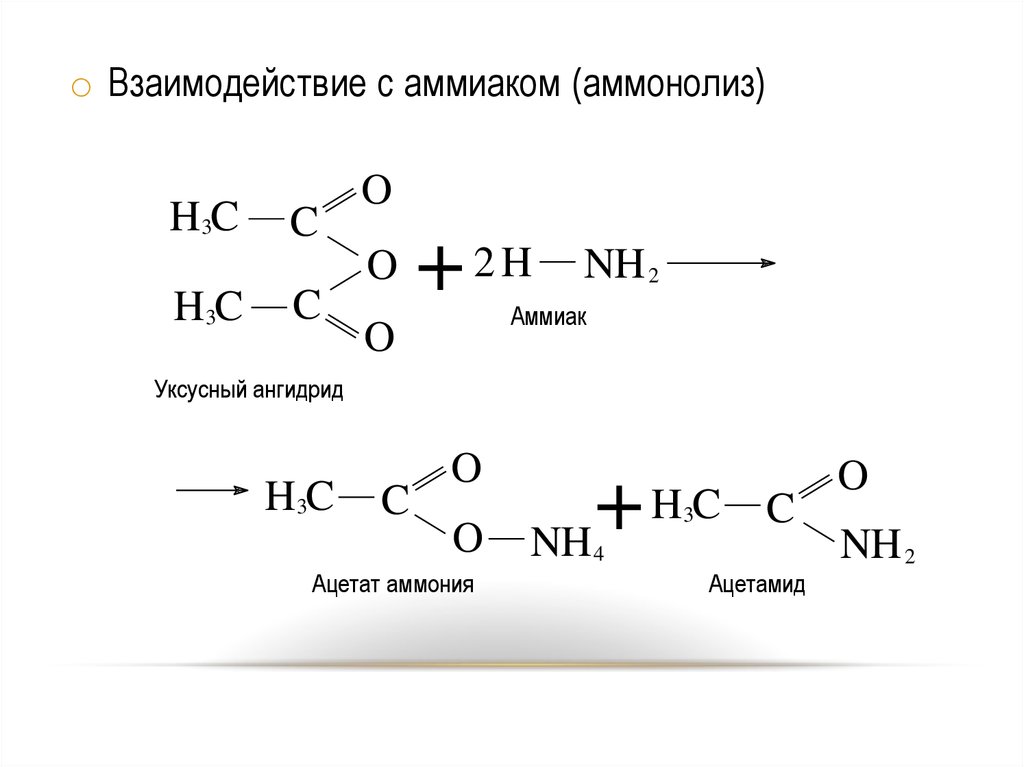
10.
o Взаимодействие с аммиаком (аммонолиз)H3C
C
O
O
H3C
C
+ 2H
NH 2
Аммиак
O
Уксусный ангидрид
H3C
C
O
O
Ацетат аммония
HC
+
NH
3
C
4
O
NH 2
Ацетамид
10
11.
o Взаимодействие со спиртами (алкоголиз)H3C
C
O
O
H3C
C
O
+ HO
CH3
Метиловый спирт
Уксусный ангидрид
H3C
C
O
O
Метилацетат
HC
+
CH
3
3
C
O
OH
Уксусная кислота
11
12.
• Реакции α-водородного атомаВ присутствии оснований (соли карбоновых кислот,
третичные амины) ангидриды карбоновых кислот,
имеющих связь C–H в α-положении, конденсируются с
аренкарбальдегидами, образуя ненасыщенные
аренкарбоновые кислоты.
H3C
C
O
O
H3C
C
O
+Na
O
O
H3C
C
CH3
-
C
O
O
H2C C
O
+
Na
+H C
3
C
O
OH
12
13.
CH3C
O
H + HC
- ..
2
O
C
O
C
O
+
Na
H H 3C C O
O
C CH2
C
+
O
O Na
H3C
C
H 3C
- H3C
CH
C
CH
C
H
O
OH
C
O
O
H3C
CH2
C
O
C
-
O
OH
O Na
H2O
O
O
CH
C
H 2O
O
CH
C
O
HC
+
OH
3
C
O
OH
13
14. ПРИМЕНЕНИЕ
• В качестве ацилирующих агентов (получениеацетилцеллюлозы, лекарственных средств)
(уксусный ангидрид)
• Для получения полимеров (сополимеры со
спиртами, полиэфирные смолы), синтез гербицидов
(малеиновый)
• Для получения термостойких полимеров
(тримеллитовый и пиромеллитовый)
14
15. ГАЛОГЕНАНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
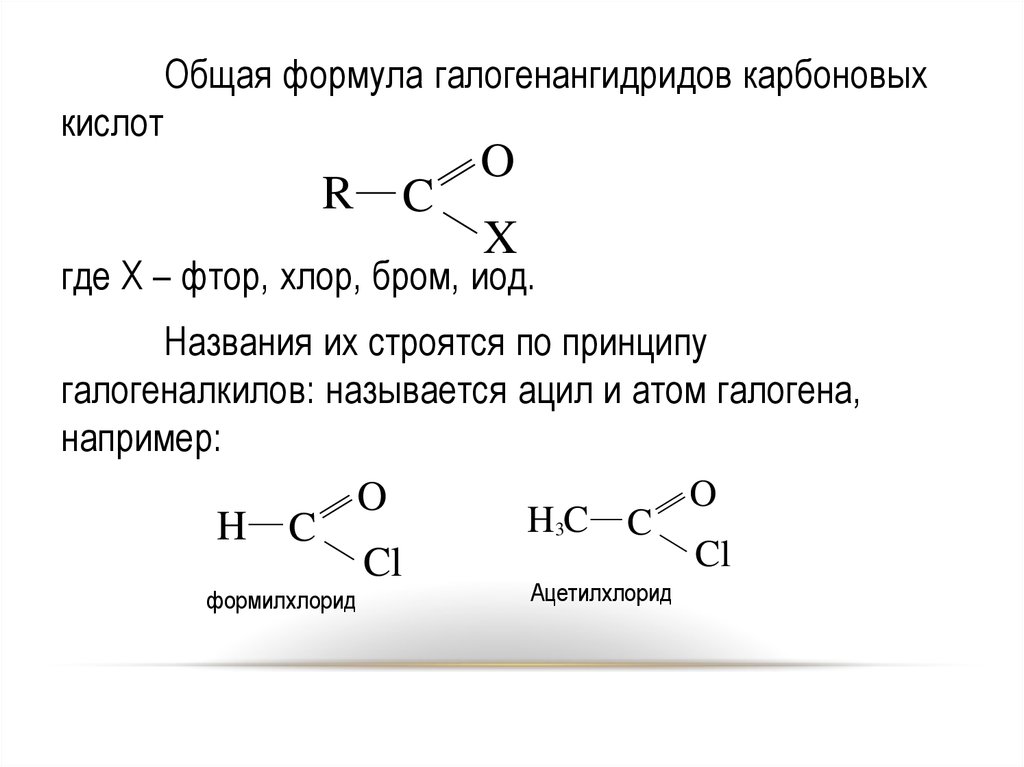
1516.
Общая формула галогенангидридов карбоновыхкислот
R
C
O
X
где Х – фтор, хлор, бром, иод.
Названия их строятся по принципу
галогеналкилов: называется ацил и атом галогена,
например:
O
O
H3C C
H C
Cl
Cl
формилхлорид
Ацетилхлорид
16
17. ПОЛУЧЕНИЕ
Галогенангидриды карбоновых кислотобразуются при действии галогенидов фосфора
(PCl3, PCl5) и тионилхлорида (SOCl2) на кислоты
и их ангидриды (см. химические свойства карбоновых кислот)
17
18. ФИЗИЧЕСКИЕ СВОЙСТВА
Галогенангидриды карбоновых кислот(ацилгалогениды) представляют собой
бесцветные жидкости или кристаллические
вещества с острым запахом, легколетучи – на
воздухе «дымят». Простейшие ацилфториды
газообразны.
В воде галогенангидриды растворяются
мало, но быстро реагируют с ней.
18
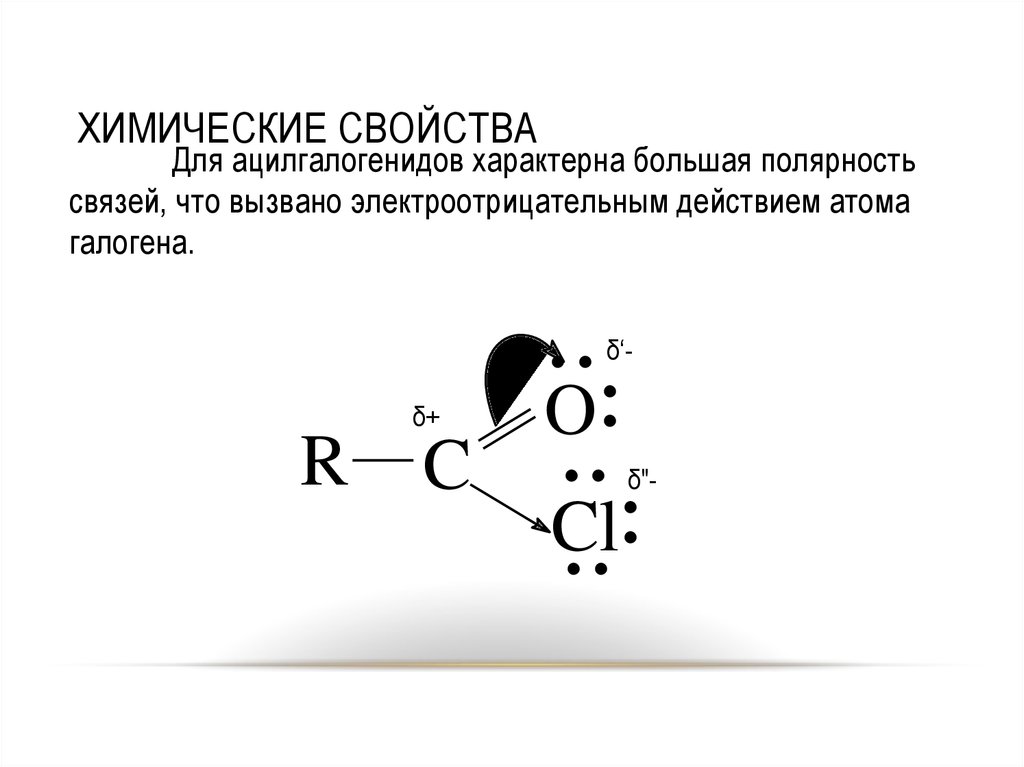
19. ХИМИЧЕСКИЕ СВОЙСТВА
Для ацилгалогенидов характерна большая полярностьсвязей, что вызвано электроотрицательным действием атома
галогена.
...
O.
.. .
.
Cl
..
δ‘-
δ+
R
C
δ"-
19
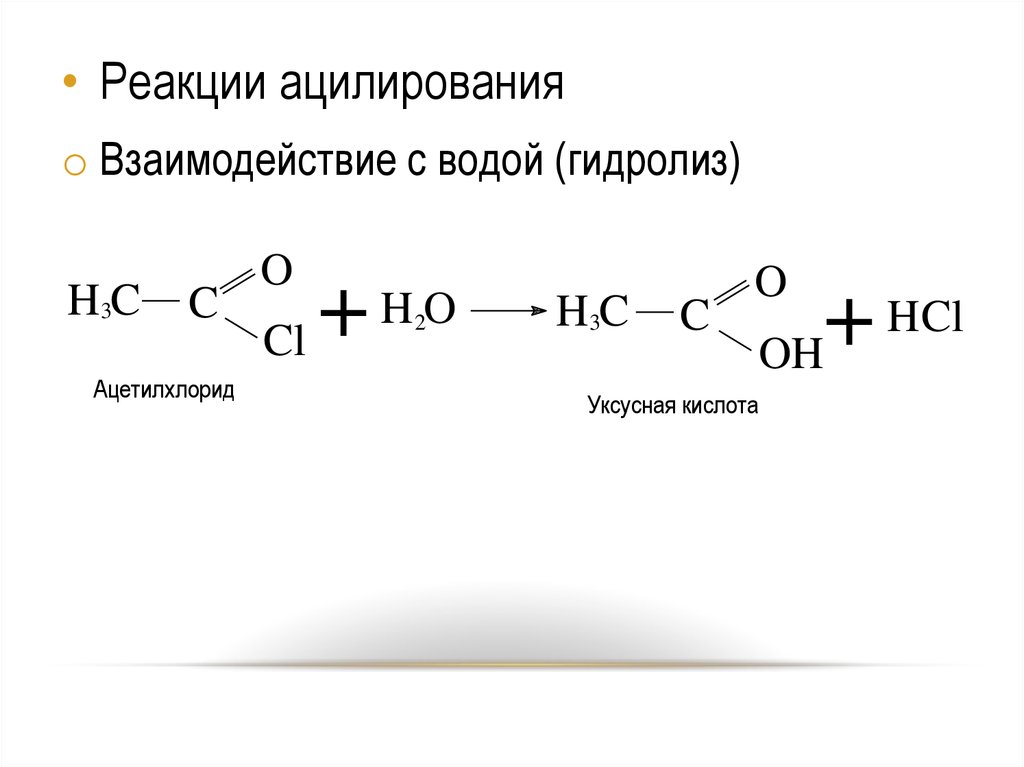
20.
• Реакции ацилированияo Взаимодействие с водой (гидролиз)
H3C
C
Ацетилхлорид
O
HO
+
Cl
2
H3C
C
O
HCl
+
OH
Уксусная кислота
20
21.
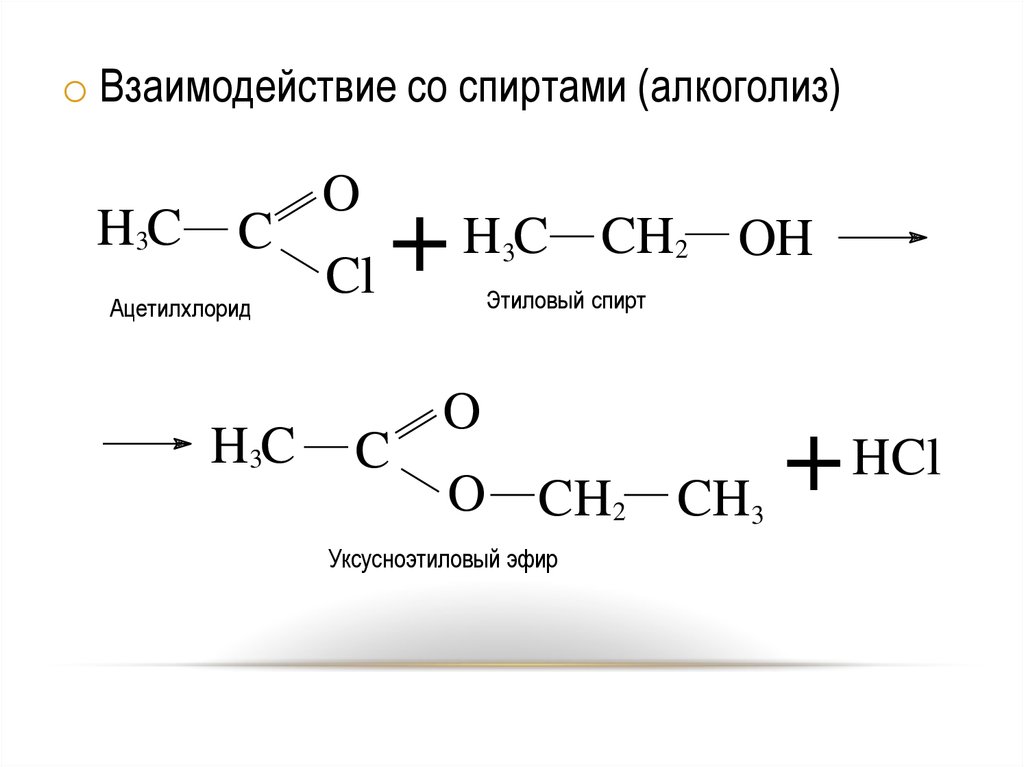
o Взаимодействие со спиртами (алкоголиз)H3C
C
Ацетилхлорид
H3C
O
HC
+
Cl
3
CH2 OH
Этиловый спирт
C
O
O CH2 CH3
+ HCl
Уксусноэтиловый эфир
21
22.
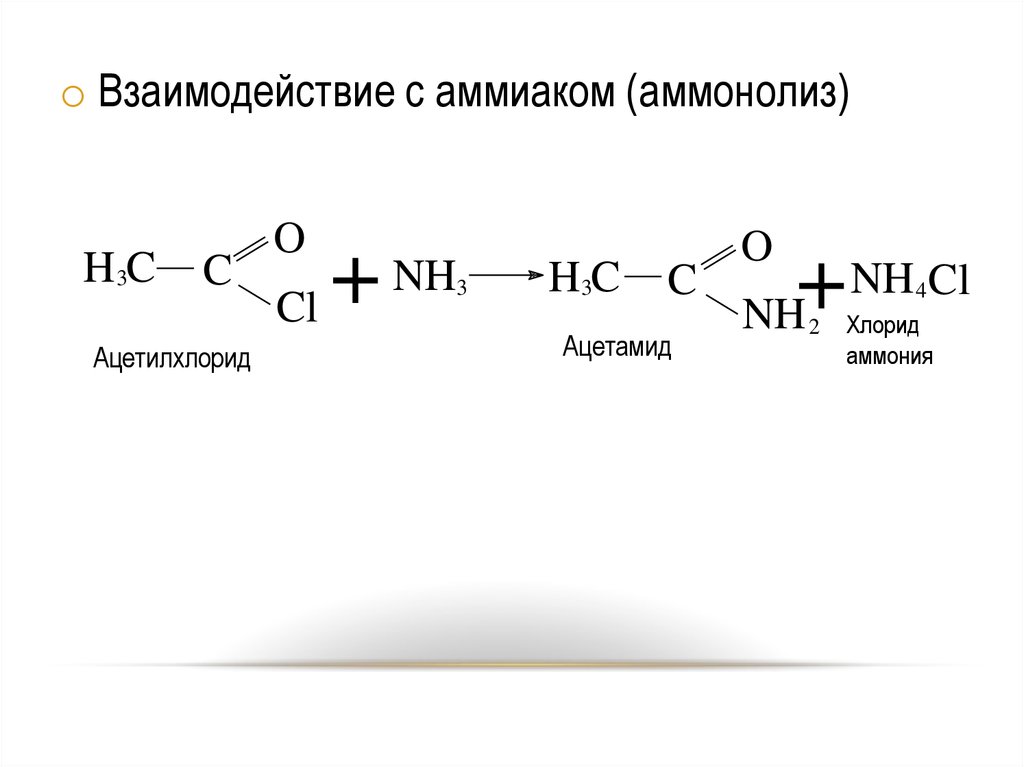
o Взаимодействие с аммиаком (аммонолиз)H3C
C
Ацетилхлорид
O
NH
+
Cl
3
H3C
C
Ацетамид
O
NH Cl
+
NH
4
2
Хлорид
аммония
22
23.
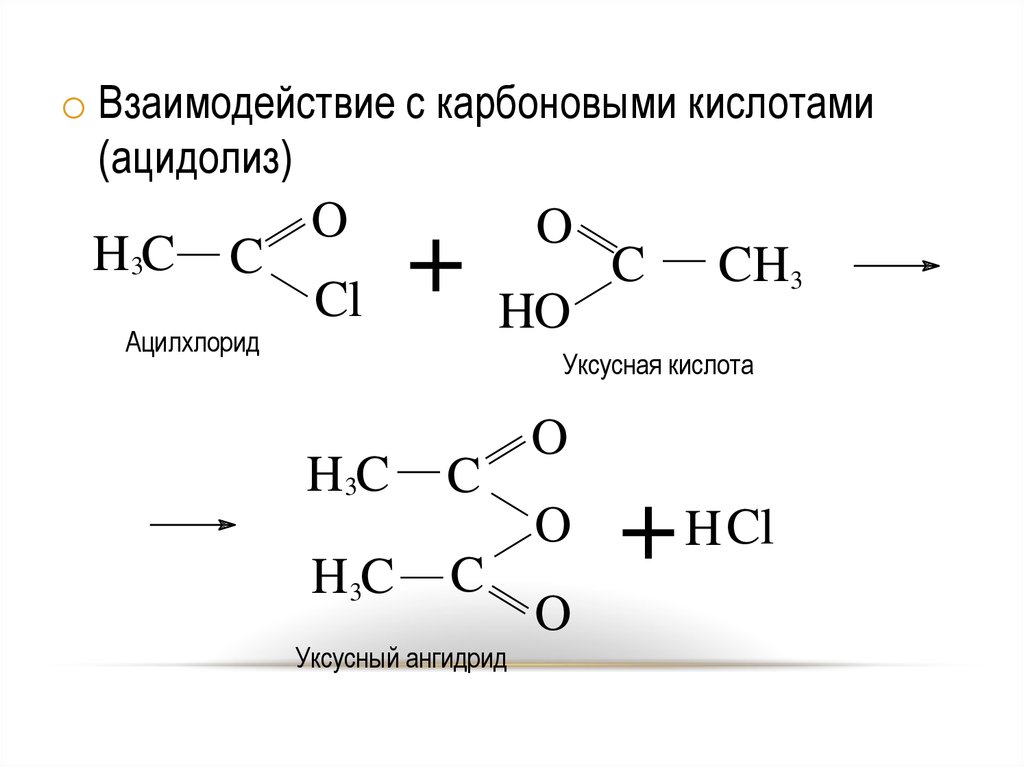
o Взаимодействие с карбоновыми кислотами(ацидолиз)
H3C
C
Ацилхлорид
O
Cl
+
O
HO
C
CH3
Уксусная кислота
H3C
C
O
O
H3C
C
+ H Cl
O
Уксусный ангидрид
23
24.
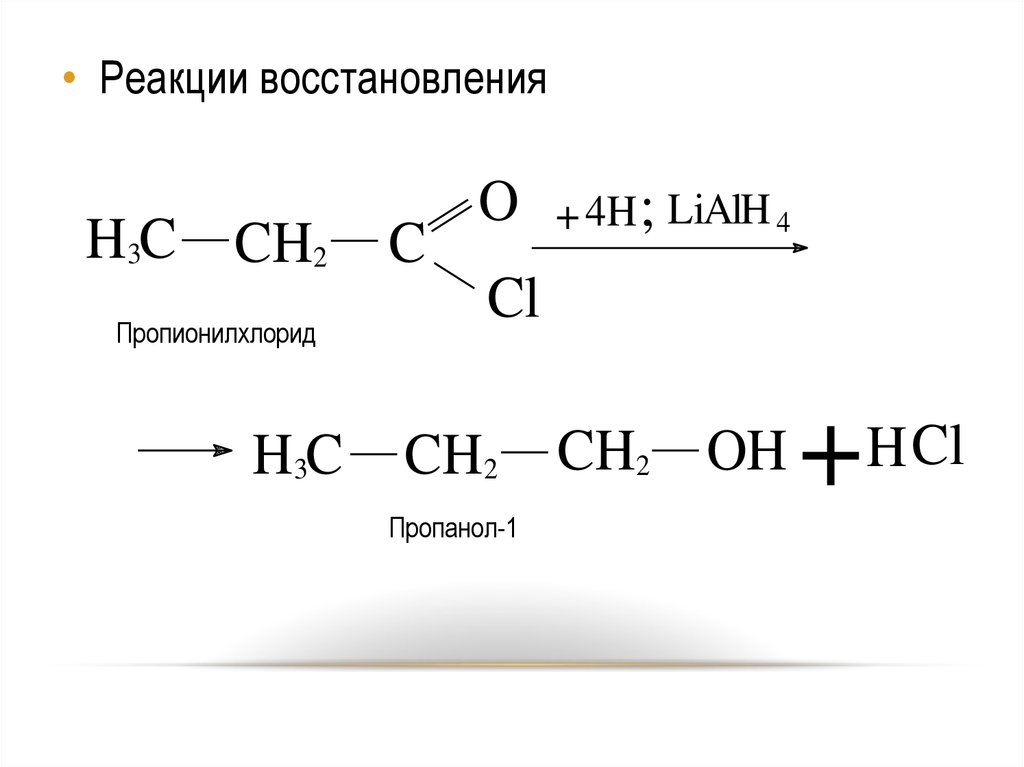
• Реакции восстановленияH3C CH2
Пропионилхлорид
H3C
C
O
+ 4H ; LiAlH 4
Cl
CH2
CH2 OH
+
H Cl
Пропанол-1
24
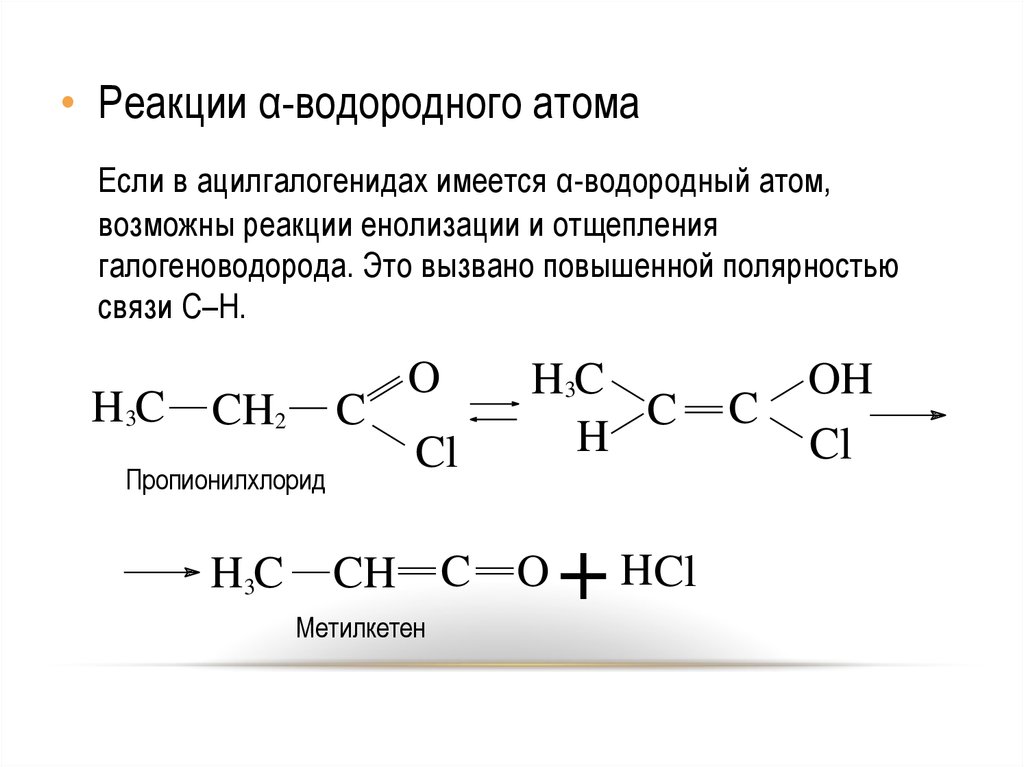
25.
• Реакции α-водородного атомаЕсли в ацилгалогенидах имеется α-водородный атом,
возможны реакции енолизации и отщепления
галогеноводорода. Это вызвано повышенной полярностью
связи C–H.
H3C
CH2
C
Пропионилхлорид
H3C
O
Cl
CH C
Метилкетен
H3C
C
H
O
C
OH
Cl
+ HCl
25
26. ПРИМЕНЕНИЕ
Ацилгалогениды применяются в основномдля органического синтеза.
26
27. АМИДЫ КАРБОНОВЫХ КИСЛОТ
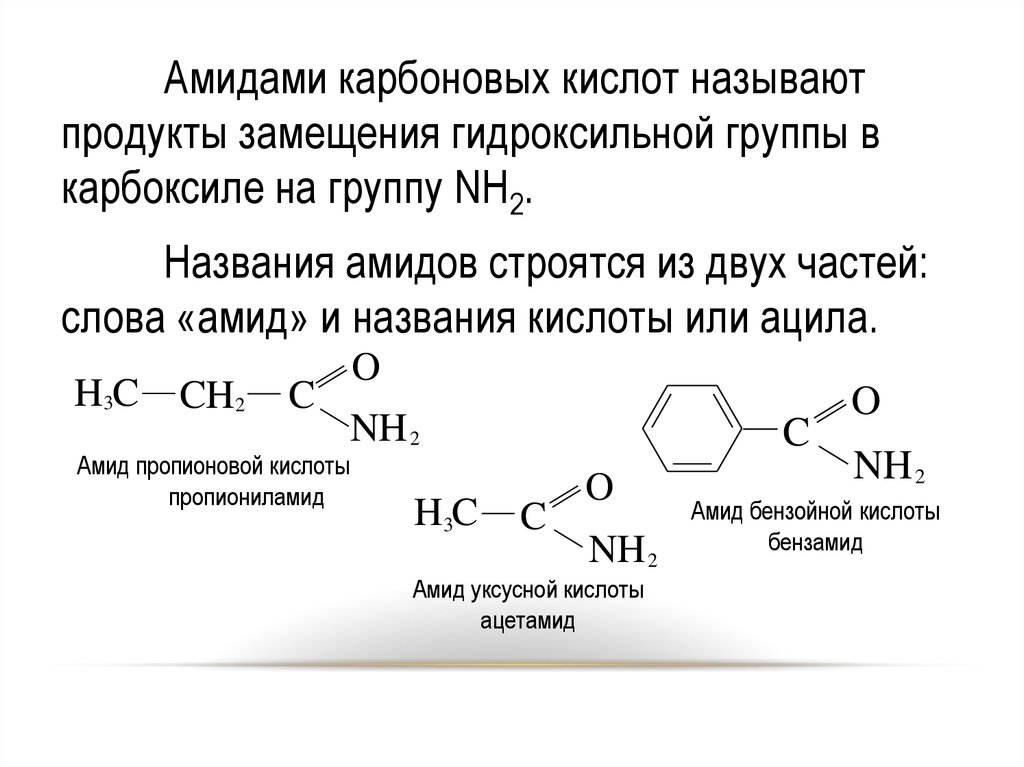
2728.
Амидами карбоновых кислот называютпродукты замещения гидроксильной группы в
карбоксиле на группу NH2.
Названия амидов строятся из двух частей:
слова «амид» и названия кислоты или ацила.
H3C
CH2
C
O
NH 2
Амид пропионовой кислоты
пропиониламид
H3C
C
C
O
NH 2
O
NH 2
Амид бензойной кислоты
бензамид
Амид уксусной кислоты
ацетамид
28
29. СПОСОБЫ ПОЛУЧЕНИЯ
• Действие аммиака на хлорангидридыкарбоновых кислот. (см. химические свойства
галогенангидридов карбоновых кислот).
• Сухая перегонка аммониевых солей
карбоновых кислот. (см. химические свойства карбоновых
кислот)
29
30. ФИЗИЧЕСКИЕ СВОЙСТВА
Амиды кислот представляют собой твердыевещества, за исключением формамида, являющегося
жидкостью; ограниченно растворимы в воде,
растворимость уменьшается с увеличением
молекулярной массы. Растворы имеют нейтральную
реакцию.
..
R3 C
.
..
O.
N
R1
R2
30
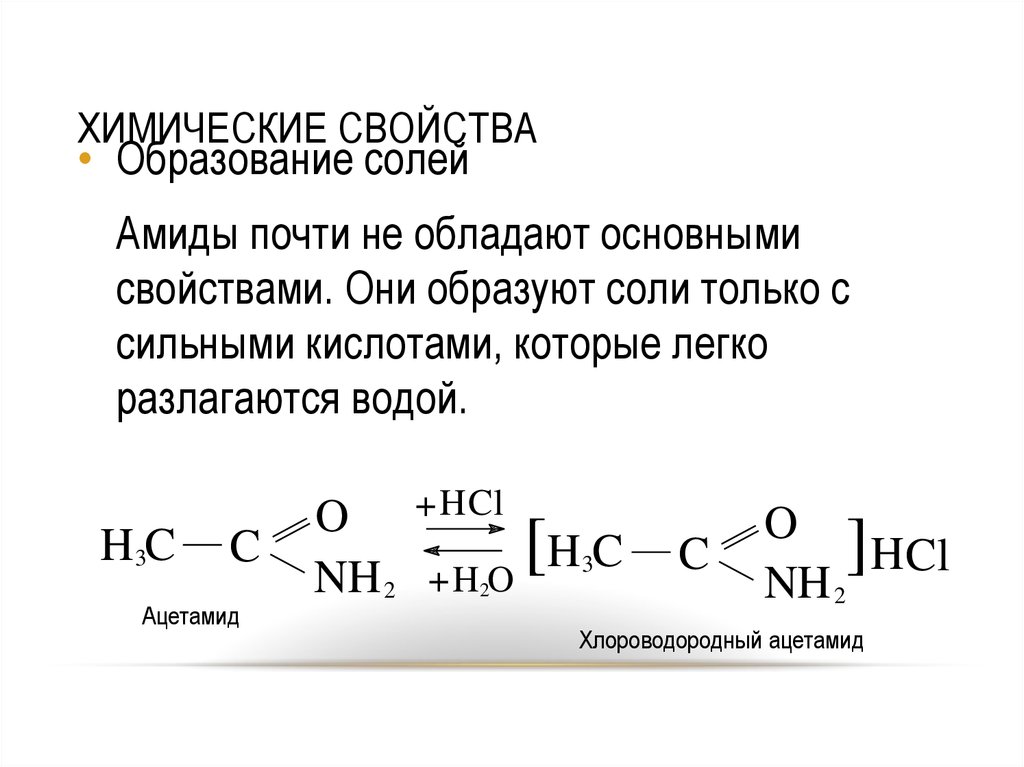
31. ХИМИЧЕСКИЕ СВОЙСТВА
• Образование солейАмиды почти не обладают основными
свойствами. Они образуют соли только с
сильными кислотами, которые легко
разлагаются водой.
H3C
C
Ацетамид
O
NH 2
+ H Cl
[
HC
+H O
3
2
C
O
]
HCl
NH 2
Хлороводородный ацетамид
31
32.
• Взаимодействие с водой (гидролиз)H3C
C
Ацетамид
O
+ H2O
NH 2
H3C
C
O
+ NH3
OH
Уксусная кислота
32
33.
• Дегидратация.При нагревании амидов кислот с
водоотнимающими веществами образуются
соответствующие нитрилы.
H3C
C
Аетамид
O
NH2
t
P2O5
H3C
C N + H 2O
Ацетнитрил
33
34.
• Восстановление.H3C
C
Ацетамид
O
NH2
4 [H]
H3C
CH2 NH2 + H 2O
Этиламин
34
35. СЛОЖНЫЕ ЭФИРЫ КАРБОНОВЫХ КИСЛОТ
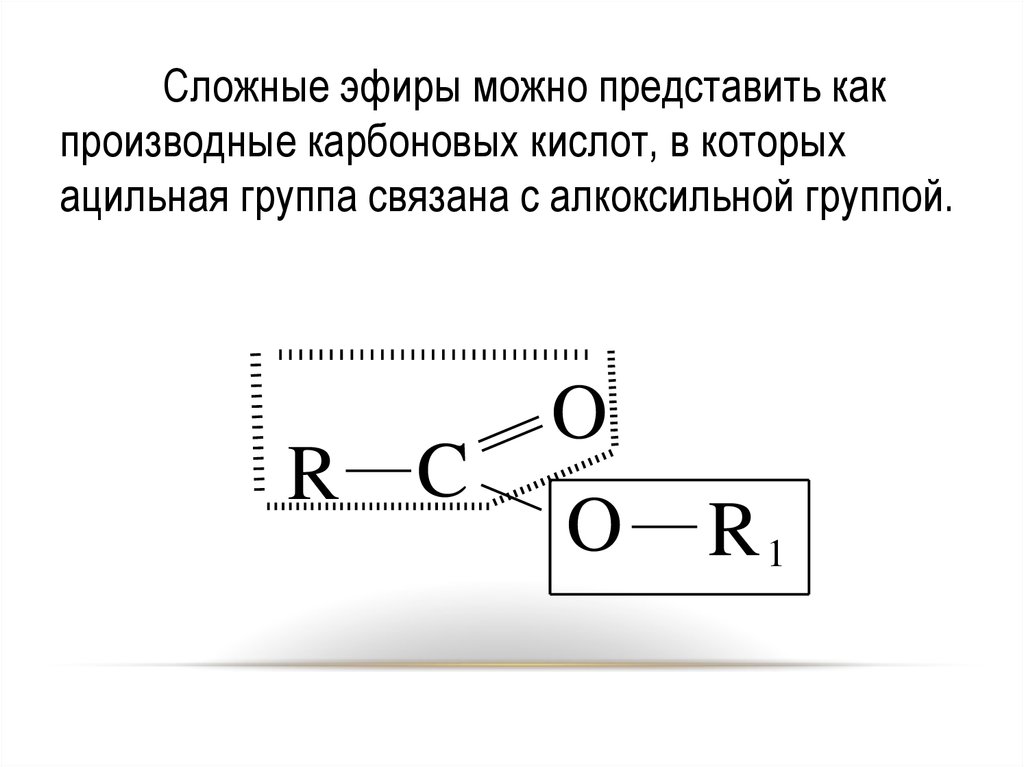
3536.
Сложные эфиры можно представить какпроизводные карбоновых кислот, в которых
ацильная группа связана с алкоксильной группой.
R C
O
O
R1
36
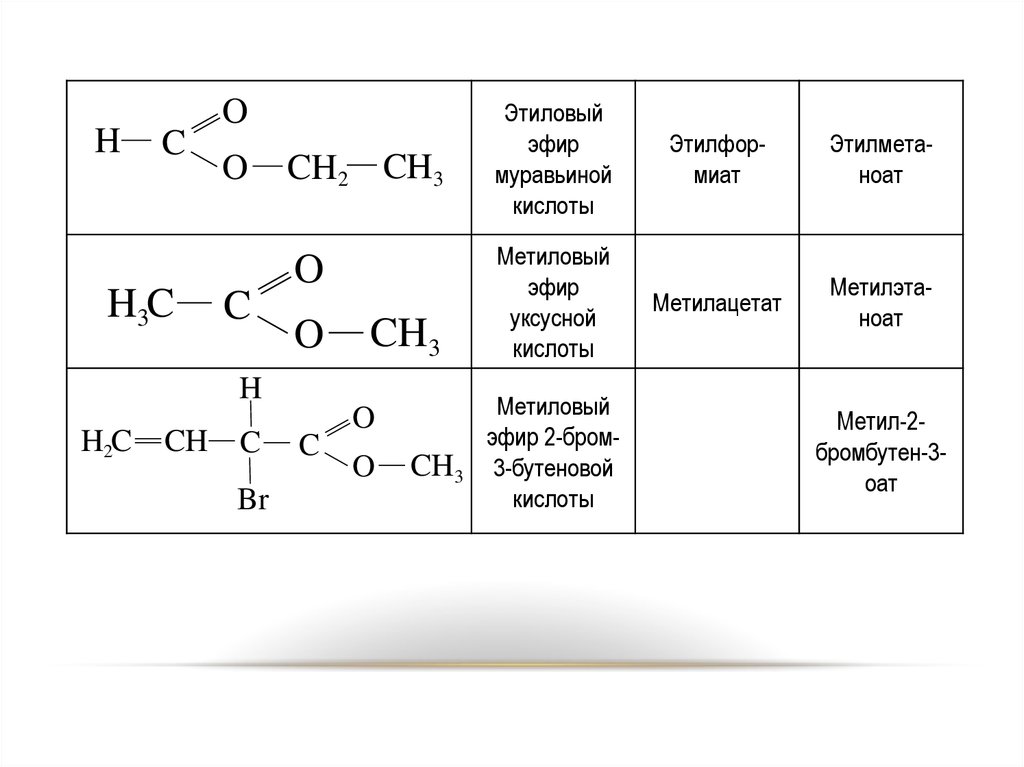
37. НОМЕНКЛАТУРА
По рациональной номенклатуренаименование эфира строится из двух частей:
названия кислоты и спиртового радикала.
По IUPAC для наименования сложных
эфиров к названию кислоты (заменив «овая» на
«оат») прибавляют название спиртового
радикала.
37
38.
HC
H3C
O
O
C
CH2 CH3
O
O
CH3
H
H2C
CH
C
Br
C
O
O
CH3
Этиловый
эфир
муравьиной
кислоты
Этилформиат
Этилметаноат
Метиловый
эфир
уксусной
кислоты
Метилацетат
Метилэтаноат
Метиловый
эфир 2-бром3-бутеновой
кислоты
Метил-2бромбутен-3оат
38
39. ИЗОМЕРИЯ.
Изомерия сложных эфиров определяетсяизомерией кислотных и спиртовых остатков.
39
40. НАХОЖДЕНИЕ В ПРИРОДЕ.
Сложные эфиры широко представлены вприроде, но обычно в небольших количествах.
Они участвуют в разнообразных процессах,
протекающих в живом организме, являются
ароматообразующими компонентами ряда
растений. В значительных количествах в природе
представлены только сложные эфиры
высокомолекулярных (чаще многоатомных)
спиртов и кислот.
40
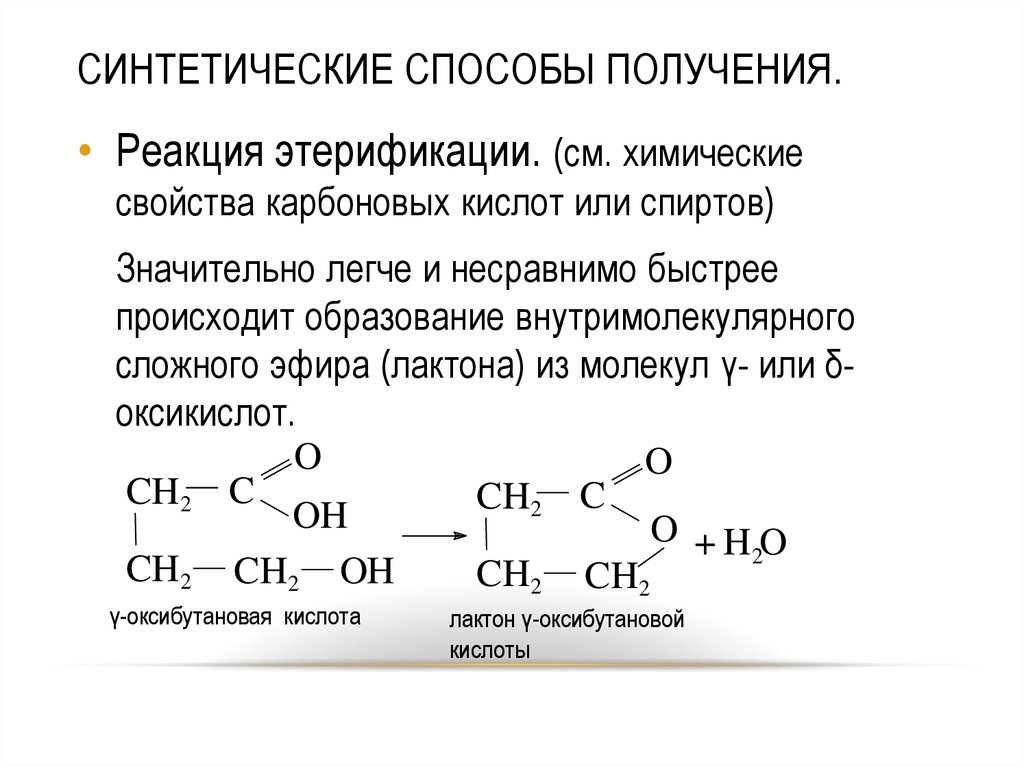
41. СИНТЕТИЧЕСКИЕ СПОСОБЫ ПОЛУЧЕНИЯ.
• Реакция этерификации. (см. химическиесвойства карбоновых кислот или спиртов)
Значительно легче и несравнимо быстрее
происходит образование внутримолекулярного
сложного эфира (лактона) из молекул γ- или δоксикислот.
O
O
CH2 C
CH2 C
OH
O +HO
2
CH2 CH2 OH
CH2 CH2
γ-оксибутановая кислота
лактон γ-оксибутановой
кислоты
41
42.
• Взаимодействие хлорангидридов илиангидридов карбоновых кислот со спиртами
или фенолами. (см. химические свойства
ацилгалогенидов или ангидридов)
42
43. ФИЗИЧЕСКИЕ СВОЙСТВА.
Сложные эфиры низкомолекулярных исреднемолекулярных кислот и спиртов –
жидкости с приятным фруктовым запахом,
высокомолекулярных – твердые вещества без
запаха. Плохо (низшие гомологи) или совсем не
растворимые в воде, хорошо растворимы во
многих органических растворителях.
43
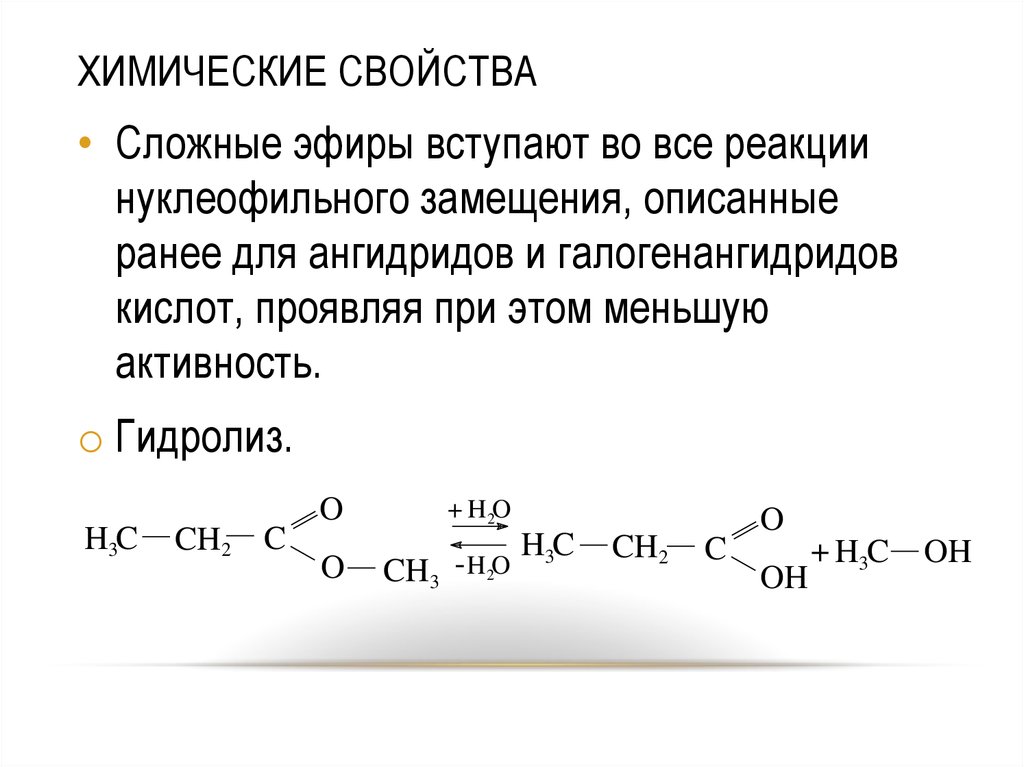
44. ХИМИЧЕСКИЕ СВОЙСТВА
• Сложные эфиры вступают во все реакциинуклеофильного замещения, описанные
ранее для ангидридов и галогенангидридов
кислот, проявляя при этом меньшую
активность.
o Гидролиз.
H3C
CH2 C
O
+ H 2O
O
CH3 - H 2O
H3C
CH2
C
O
OH
+ H3C
OH
44
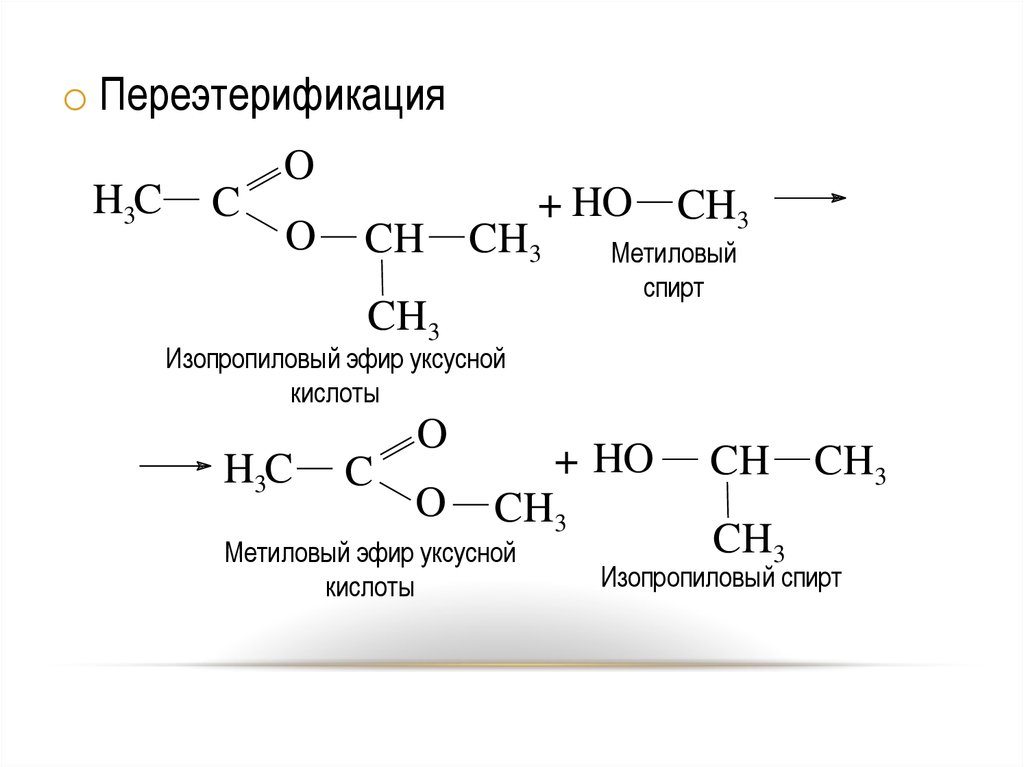
45.
o ПереэтерификацияH3C
C
O
O
CH
+ HO
CH3
CH3
Метиловый
спирт
CH3
Изопропиловый эфир уксусной
кислоты
H3C
C
O
O
+ HO
CH3
Метиловый эфир уксусной
кислоты
CH
CH3
CH3
Изопропиловый спирт
45
46.
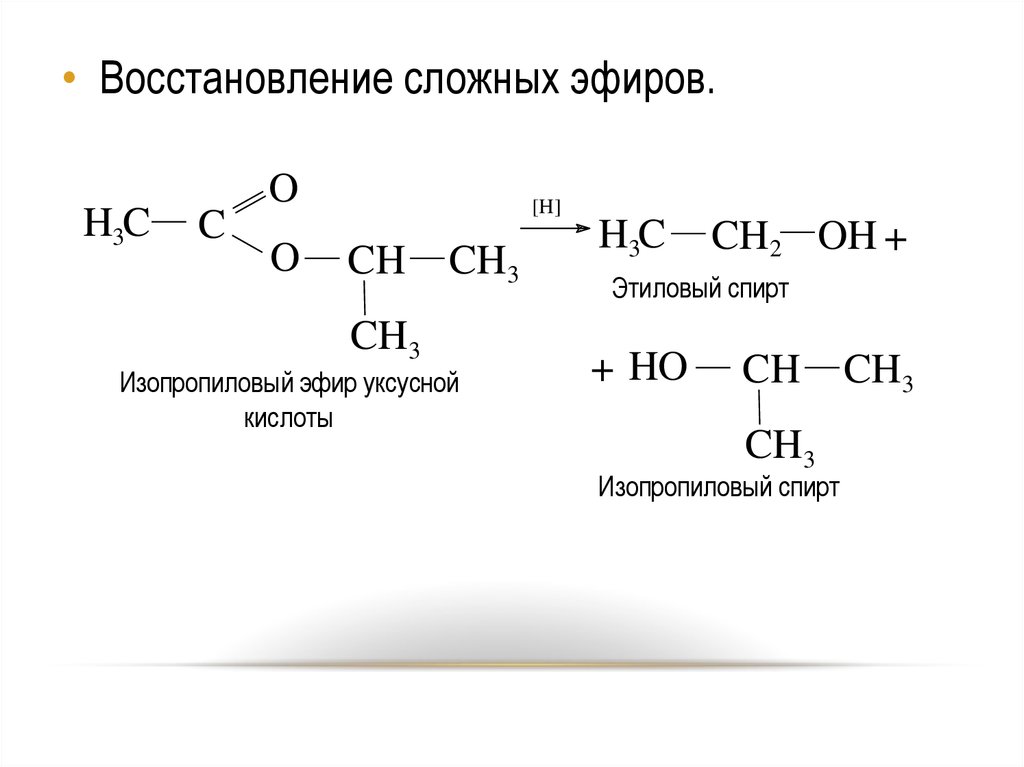
• Восстановление сложных эфиров.H3C
C
O
O
[H]
CH
CH3
CH3
Изопропиловый эфир уксусной
кислоты
H3C
CH2 OH +
Этиловый спирт
+ HO
CH
CH3
CH3
Изопропиловый спирт
46
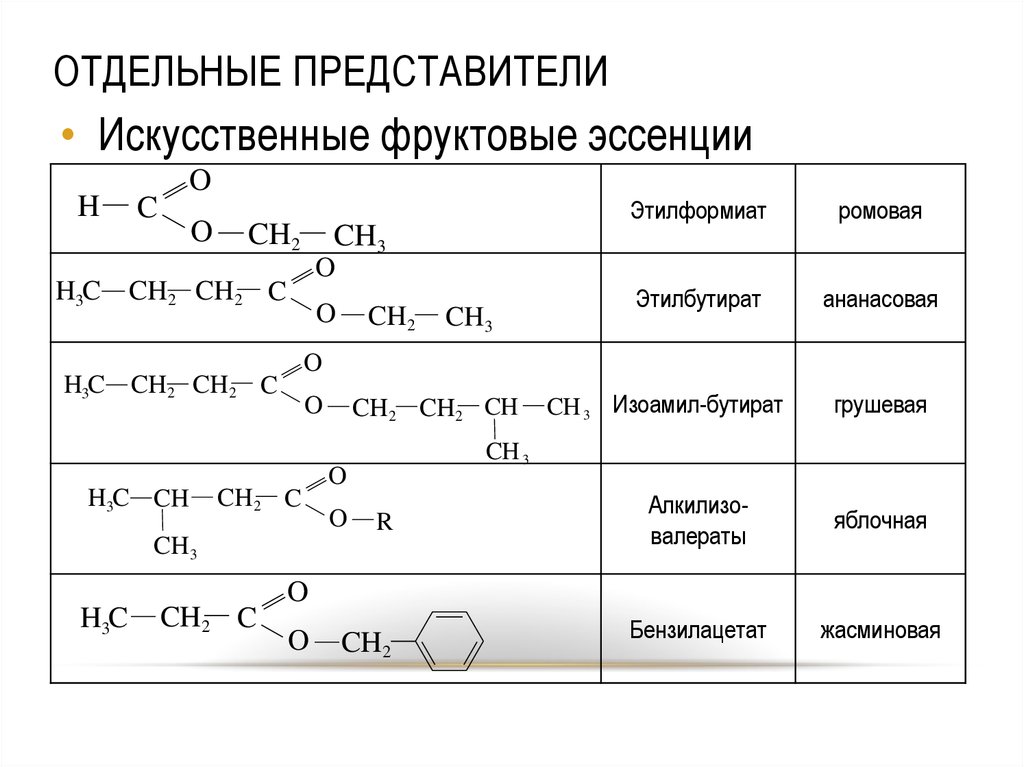
47. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
• Искусственные фруктовые эссенцииH
O
C
O
CH2
O
CH2
CH3
ананасовая
O
O
CH2 C
CH2 CH2 CH
O
O
CH 3 Изоамил-бутират
грушевая
CH 3
R
CH3
CH2 C
Этилбутират
O
H3C CH2 CH2 C
H3C
ромовая
CH3
H3C CH2 CH2 C
H3C CH
Этилформиат
Алкилизовалераты
яблочная
Бензилацетат
жасминовая
O
O
CH2
47
48.
• Природные сложные эфиры относят к липидам.Различают:
o Простые липиды – жиры, воски, стеролы и
стериды.
o Сложные липиды – фосфоросодержащие
соединения и производные моносахаридов:
фосфолипиды, гликолипиды,
сфинголипиды
48
49. ПРОСТЫЕ ЛИПИДЫ
• Жиры и масла – сложные эфирывысших жирных кислот (насыщенных и
ненасыщенных) и глицерина. В состав жиров
входят в основном триглицериды, но
присутствуют и ди- и моноглицериды.
Молекулы большинства кислот имеют
неразветвленную структуру и держат четное
количество атомов углерода.
49
50.
H2CHC
H2C
O
C
O
O
C
O
C
O
Триглицерид
триацилглицерин
R1
H2C
O
HC
R2
H2C
R3
H2C
O
C
O
O
OH
C
R1
O
R2
1,2-диглицкрид
1,2-диацилглицерин
OH
HC
O
H2C
OH
C
O
R2
2-моноглицерид
2-ацилглицерин
50
51.
Кислоты жировНазвание
Формула
Насыщенные
Капроновая
H 3C
Каприловая
Каприновая
H 3C
(CH )
2 4
(CH )
2 8
C
C
Лауриновая
Миристиновая
H 3C
(CH )
2
H 3C
12
(CH )
2
Арахиновая
Бегеновая
H 3C
Мелиссиновая
H 3C
16
(CH )
2
Церотиновая
Монтановая
OH
H 3C
O
OH
H 3C
C
Пальмитиновая
Стеариновая
O
20
(CH )
2
26
C
C
C
O
OH
(CH )
2 10
C
C
H 3C
(CH )
C
OH
OH
6
(CH )
O
O
2
C
H 3C
O
OH
(CH )
H 3C
H 3C
2
14
2
18
(CH )
2
24
(CH )
2
28
C
C
O
OH
O
OH
O
OH
O
OH
O
OH
O
OH
51
52.
НазваниеФормула
Ненасыщенные
Олеиновая
(CH )
H3C
2
(CH )
CH CH
7
2 7
H3C
(CH )
Линоленовая
H3C
(CH
Элеостеариновая
H3C
(CH ) (CH
CH)3
Арахидоновая
H3C
(CH ) (CH
CH CH)4
Линолевая
Эруковая
H3C
2
CH)3
CH
2
2 3
2 3
2
(CH )
2
CH
7
CH
OH
(CH )
CH2 CH CH
CH CH
4
O
C
(CH )
2 7
(CH )
OH
O
C
2 7
OH
(CH )
2 11
2
C
OH
O
C
(CH )
C
2 7
O
3
C
O
OH
O
OH
Оксикислоты
Рицинолевая
H3C
(CH )
2
5
CH CH2 CH CH
OH
(CH )
2 7
C
O
OH
52
53. ИЗОМЕРИЯ
Изомерия глицеридов связана с различнымположением ацилов в молекуле, их различным
строением, положением двойных связей: возможна
также цис- и транс-изомерия.
В глицеридах имеет место оптическая
изомерия.
53
54. ФИЗИЧЕСКИЕ СВОЙСТВА
Триглицериды – жидкости или твердыевещества без цвета, вкуса и запаха, нерастворимы в
воде, но хорошо растворимы в органических
растворителях.
Плотность триглицеридов при 15°С составляет
900÷980 кг/м3.
54
55. ХИМИЧЕСКИЕ СВОЙСТВА
Глицериды вступают во все реакции характерные длясложных эфиров:
• Гидролиз. Протекает в присутствии кислот или щелочей, а
также фермента – липазы, ступенчато. При повышении
температуры сильно ускоряется.
• Переэтерификация протекает в присутствии, в качестве
катализаторов, метилата и этилата натрия и калия, гидроксида
натрия.
• Алкоголиз. При этом высвобождается глицерин.
• Ацидолиз.
• Гидрогенизация.
• Окисление.
55
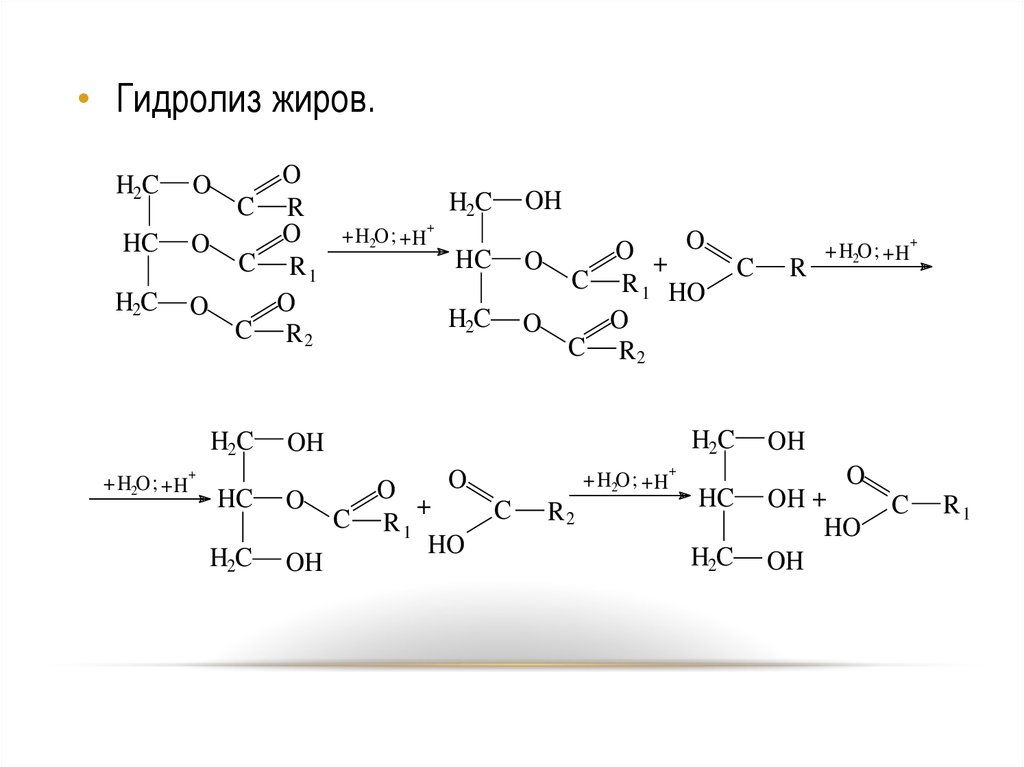
56.
• Гидролиз жиров.H2C
HC
H2C
O
C R
O
O
C R1
O
O
C R2
O
H2C
+ H2O ; + H
OH
H2C
+ H2O ; + H
+
O
O
O
+
C R 1 HO
O
O
C R2
HC
H2C
H2C
OH
+
HC
O
H2C
OH
O
O
C R1 +
HO
+ H2O ; + H
C
R2
+
HC
H2C
C
R
+ H2O ; + H
+
OH
O
OH +
HO
OH
C
R1
56
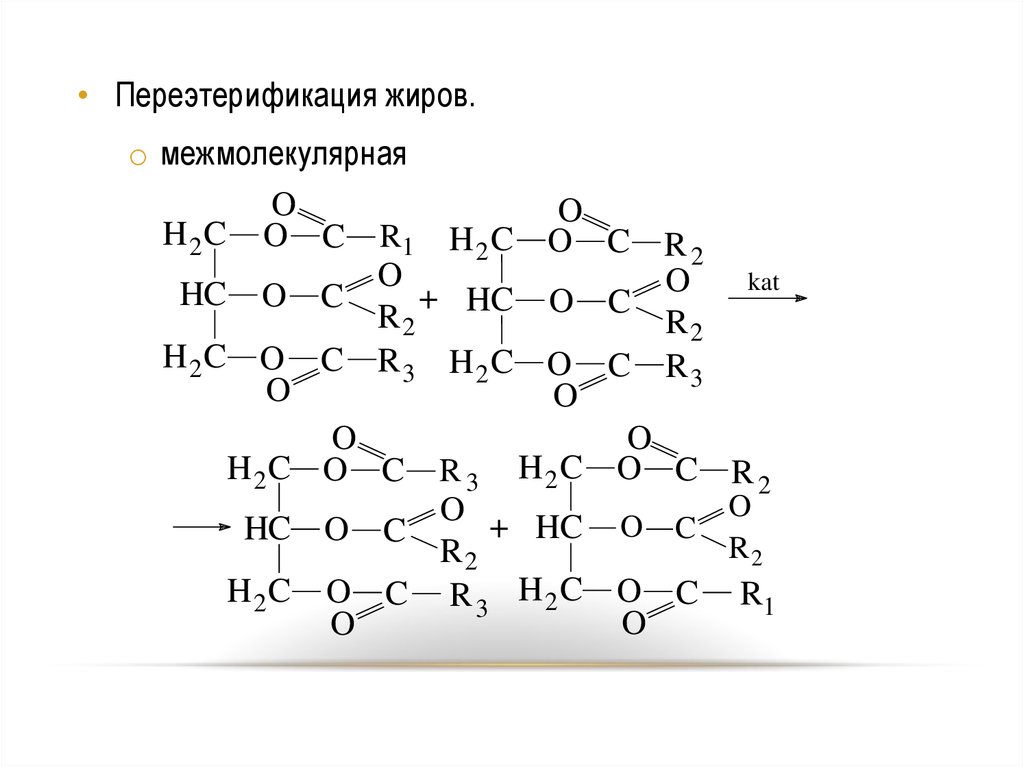
57.
• Переэтерификация жиров.o межмолекулярная
O
O
H 2 C O C R1 H 2 C O C R
2
O
kat
HC O C
+ HC O C O
R2
R2
H2C O C R3 H2C O C R
3
O
O
O
O
H2C O C R 3 H2C O C R 2
O
O +
HC O C
HC O C
R2
R2
H 2 C O C R 3 H 2 C O C R1
O
O
57
58.
o ВнутримолекулярнаяH2C
O
O C
HC
O C
H2C O C
O
R1
O
R2
R3
kat
O
H 2C O C R 2
O
HC O C
R1
H 2C O C R3
O
В качестве катализатора могут быть: чистые калий или
натрий; гидроксид натрия, метилат или этилат натрия.
58
59.
• Алкоголиз жиров.H2C
O
O C
HC
O C
H2C O C
O
H 2 C OH
R1
O
H C
R2 + 3
R3
CH 2 OH
O
C
+H 3C
R2
O C R3
O
HC O
H 2C
H 2C
HC
H 2C
H 2C
OH
O
C
O
H C
R2 + 3
CH 2
O
O C
O
O C
R1
kat
R3
kat
OH
OH
HC OH + H 3 C
H 2C
CH 2
kat
CH 2
O
O C
R2
OH
59
60.
В качестве катализаторов при алкоголизе применяютгидроксид натрия, алкоголяты щелочных металлов, серную
кислоту, хлороводород.
Алкоголиз применяют для промышленного
илабораторного получения сложных эфиров жирных кислот,
моно и диглицеридов (глицерин в качестве спирта –
глицеролиз).
60
61.
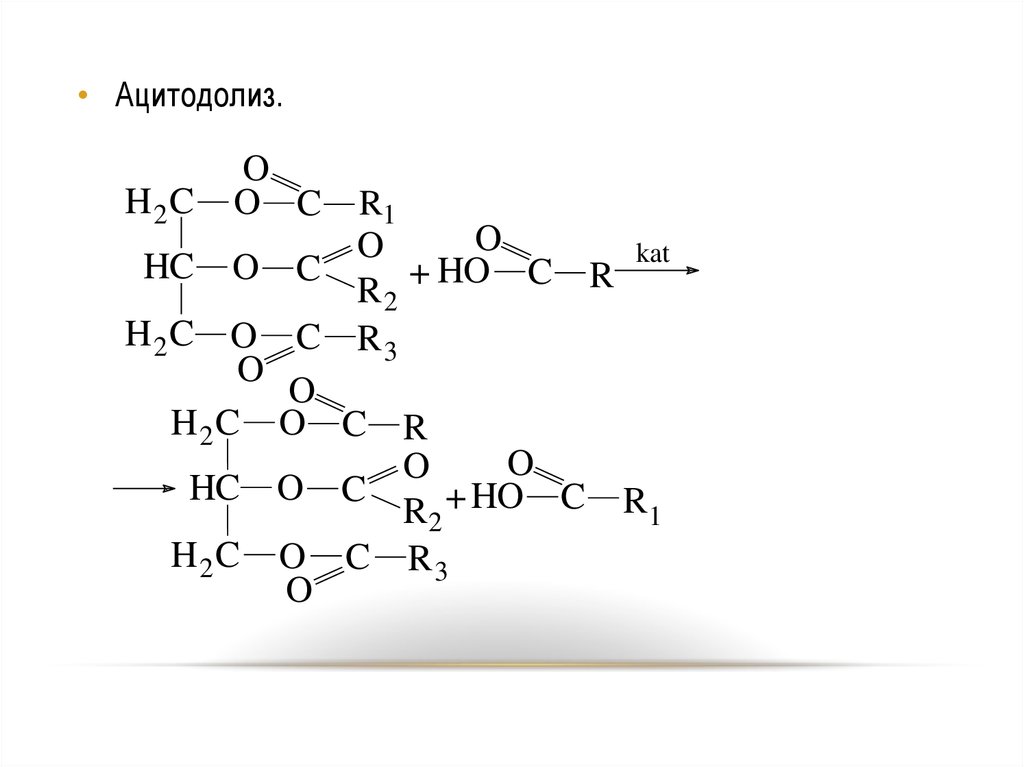
• Ацитодолиз.H2C
O
O C
HC
O C
R1
O
O
HO C
+
R2
R3
H2C O C
O
O
H 2C O C R
O
O
HC O C
R2 + HO C
H 2C O C R 3
O
R
kat
R1
61
62.
Реакция ацитодолиза протекает в присутствиисерной кислоты, воды или трифторида бора. Реакция
ускоряется с увеличением силы свободной жирной
кислоты.
62
63.
• Гидрогенизация жиров.Гидрирование жиров молекулярным водородом в
промышленности проводят при температурах 180 ÷ 240°С в
присутствии никелевых имедно-никелевых катализаторов,
как правило, при небольшом давлении. Подбирая
соответствующие условия реакции, удается осуществить
этот процесс селективно, гидрируя сначала радикалы
линоленовой кислоты до линолевой, затем линолевой до
олеиновой, а уже потом радикалы олеиновой (если это
необходимо) до стеариновой кислоты. Полученный продукт
с заранее заданным кислотным составом и свойствами
называют саломасом.
63
64.
6465.
• Окисление жиров.Жиры и масла, особенно содержащие радикалы
ненасыщенных жирных кислот, окисляются кислородом
воздуха. Начальными (первичными) продуктами окисления
являются разнообразные по строению перекиси и
гидроперекиси.
В результате сложных превращений перекисей образуются
вторичные продукты окисления: спирты, альдегиды, кетоны,
кислоты с углеродной цепочкой различной длины, а также
их произведение, в частности продукты полимеризации.
65
66.
• Воски.Сложные эфиры высокомолекулярных
одноосновных карбоновых кислот и
однотомных высокомолекулярных спиртов.
В состав восков входят главным образом
кислоты, содержащие 24÷32 атома углерода, и
спирты, углеродная цепочка которых состоит из
14÷30 атомов углерода.
66
67.
Воски широко распространены в природе. Воскипокрывают тонким слоем листья, стебли и плоды
растений.
Из растительных восков промышленное
значение имею воски, покрывающие листья пальм
(карнаубский воск), воски липидов риса и
подсолнечника. Из восков животного происхождения
наибольшую роль играют спермацет и спермацетовое
масло, шерстяной жир; из восков насекомых –
пчелиный воск.
67
68.
Спермацет – твердый кристаллический продуктбелого цвета, состоящий в основном из цетилового
эфира пальмитиновой кислоты. Выделяют спермацет
из маслообразной массы, содержащейся в голове
кашалота.
Шерстяной жир – жиропот овечьей шерсти, от
желтого до темнокоричневого цвета, с резким
неприятным запахом. После соответствующей
обработки их него получают слабоокрашенный
мазеобразный ланолин (состоит в основном из
сложных эфиров кислот с С10÷С20 и спиртов с С18÷С20.
68
69.
Пчелиный воск получают из пчелиных сотвытапливаемый или экстракцией после удаления
меда. Он состоит главным образом из эфиров кислот
С26÷С30 и спиртов С14÷С31 и содержит до 15%
углеводородов.
Воски гидролизуются труднее, чем
жиры.
Не растворимы в воде, а в
органических растворителях растворяются
хуже, чем жиры.
69
70. СЛОЖНЫЕ ЛИПИДЫ
• Фосфатиды – липиды, дающие при гидролизеглицерин, высшие монокарбоновые кислоты,
фосфорную кислоту и аминоспирты или
другие сложные спирты. Могут быть
разделены, в зависимости от строения
полиола (центрального структурного
фрагмента), на: глицерофосфолипиды,
диольные фосфолипиды и сфинголипиды.
70
71.
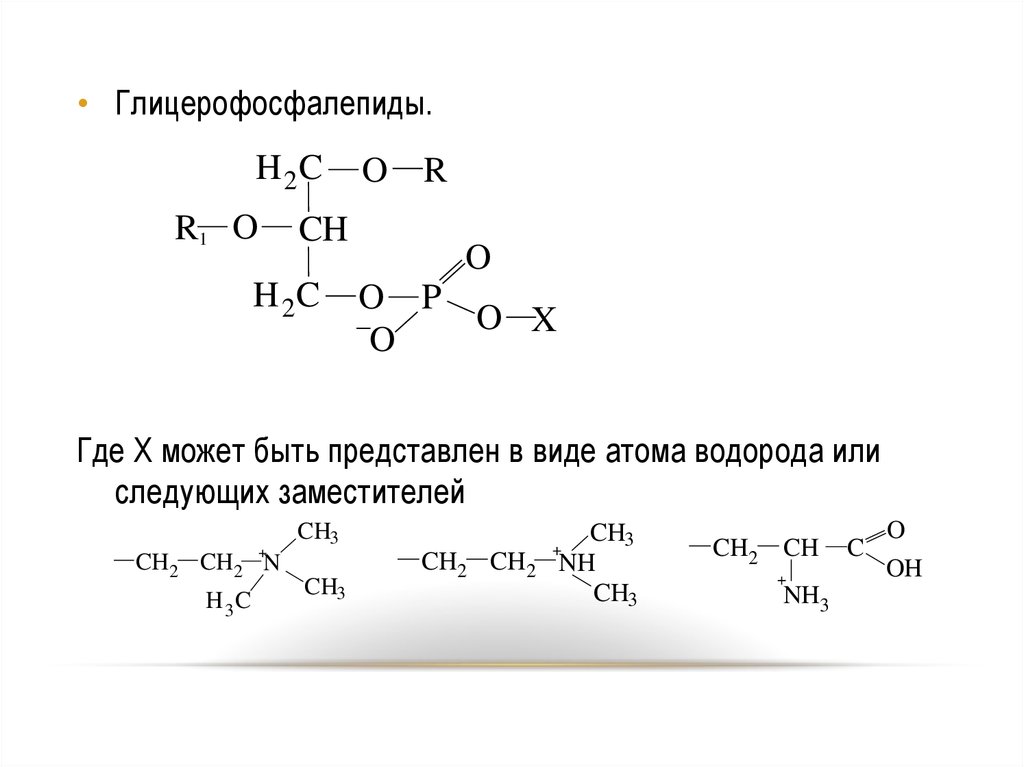
• Глицерофосфалепиды.H 2C
R1 O
CH
H 2C
O R
O
O P
O X
O
Где X может быть представлен в виде атома водорода или
следующих заместителей
+
CH2 CH2 N
H 3C
CH3
CH3
CH2 CH2
CH3
NH
CH3
+
CH2 CH
+
C
O
OH
NH3
71
72.
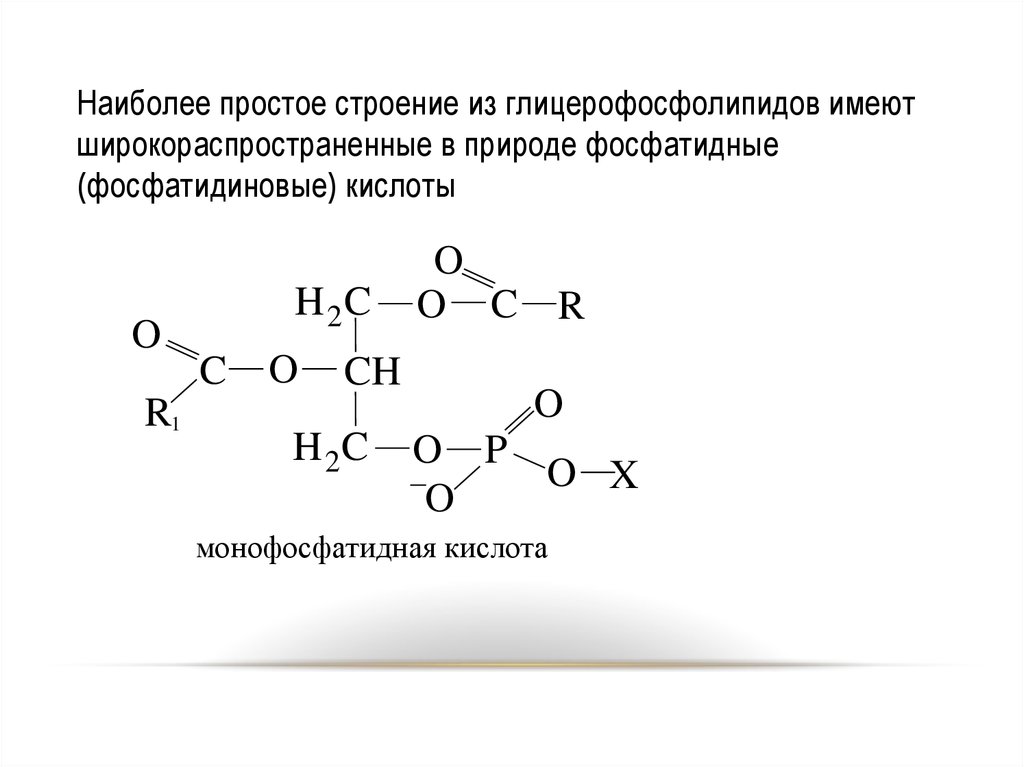
Наиболее простое строение из глицерофосфолипидов имеютширокораспространенные в природе фосфатидные
(фосфатидиновые) кислоты
O
R1
H 2C
C
O
CH
H 2C
O
O C R
O
O P
O X
O
монофосфатидная кислота
72
73.
В растениях, микроорганизмах и некоторых животныхтканях обнаружены молекулы, построенные из нескольких
остатков фосфатидных кислот, например – триглицерофосфат.
73
74.
Наиболее распространены среди фосфолипидовфосфатидилхолины (в их молекулах X представлен остатком
аминоспирта холина) и фосфатидиэтаноламины (в их
молекулах содержится остаток этаноламина).
74
75.
• ЛецитиныO
H2C
O
H33C17
O
C
O
C17H35
CH
H2C
O
O
[HO
C
CH2
CH2
P
+
N
OO
CH2
CH2
+
N
CH3
CH3
CH3
CH3
CH3 OH
CH3
]
75
76.
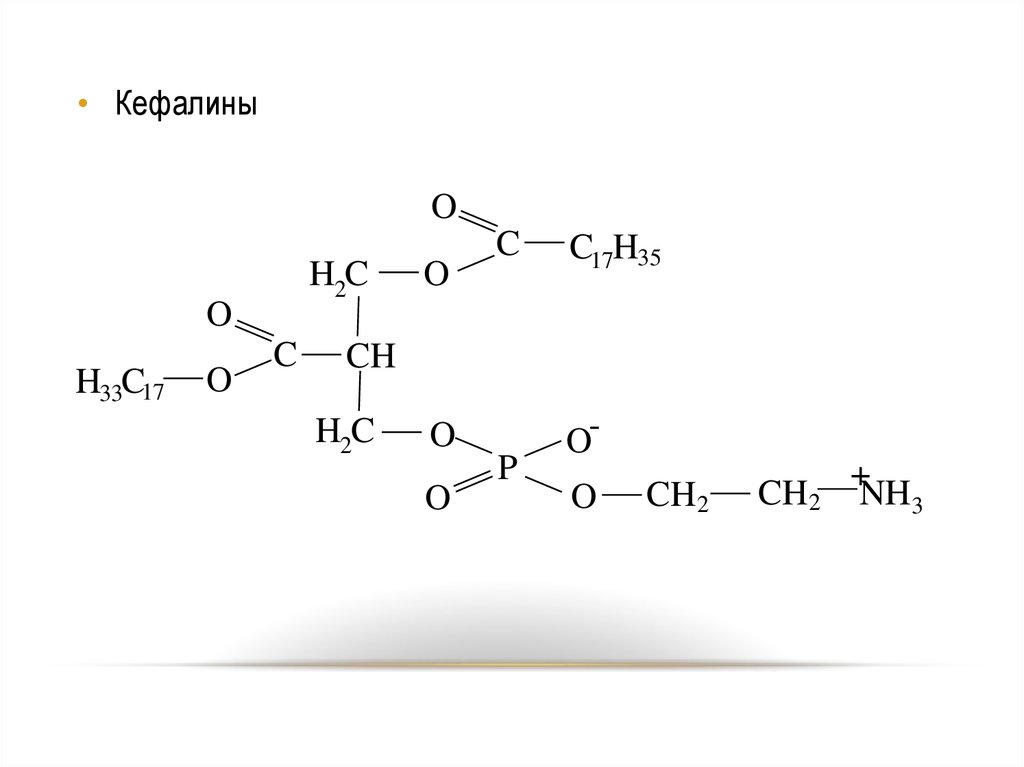
• КефалиныO
H2C
O
H33C17
O
C
O
C
C17H35
CH
H2C
O
O
P
OO
CH2
CH2
+
NH3
76
77.
• Инозитфосфатиды. Или фосфатидилинозитах Хпредставлен остатком циклического спирта –
гексаоксициклогексана (инозит).
Оксигруппы в миоинозите могут быть этерефицированы
кислотами различного строения. Фосфоинозитиды, в
молекулах которых спиртовые группы миоинозита (обычно в
положении 4,5) этерефицированы ортофосфорной
кислотой, называют полифосфоинозитидами..
77
78.
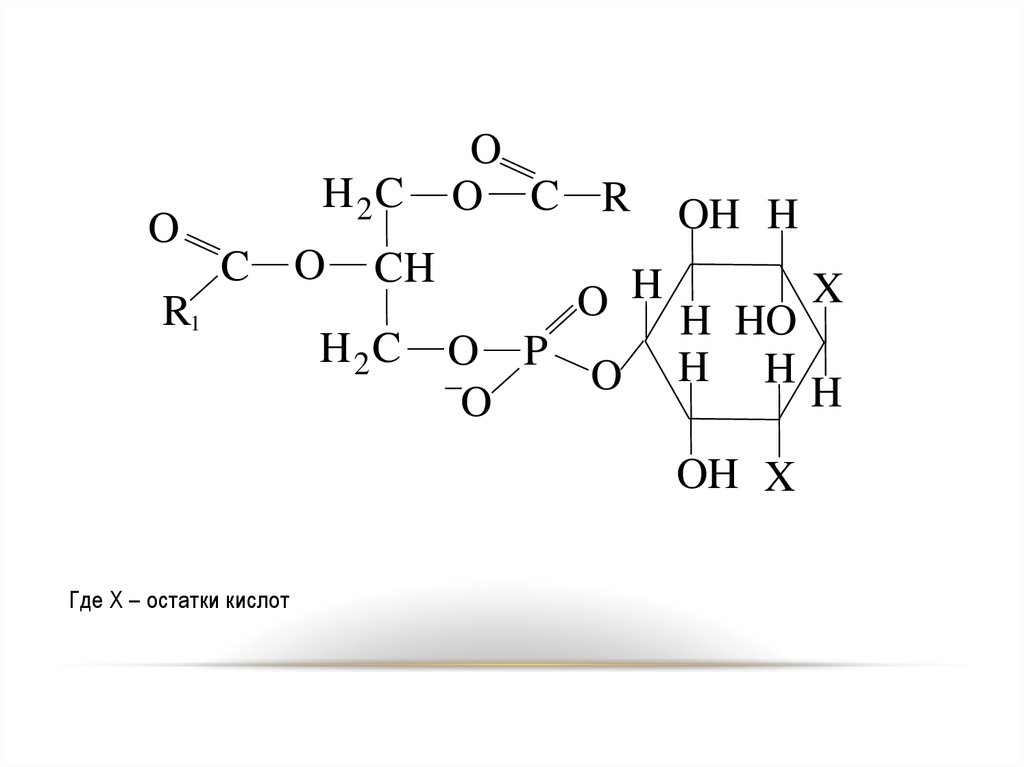
OH 2C
C
R1
O
CH
H 2C
O
O C R
OH H
O H H HO X
O P
O H HH
O
OH X
Где Х – остатки кислот
78
79.
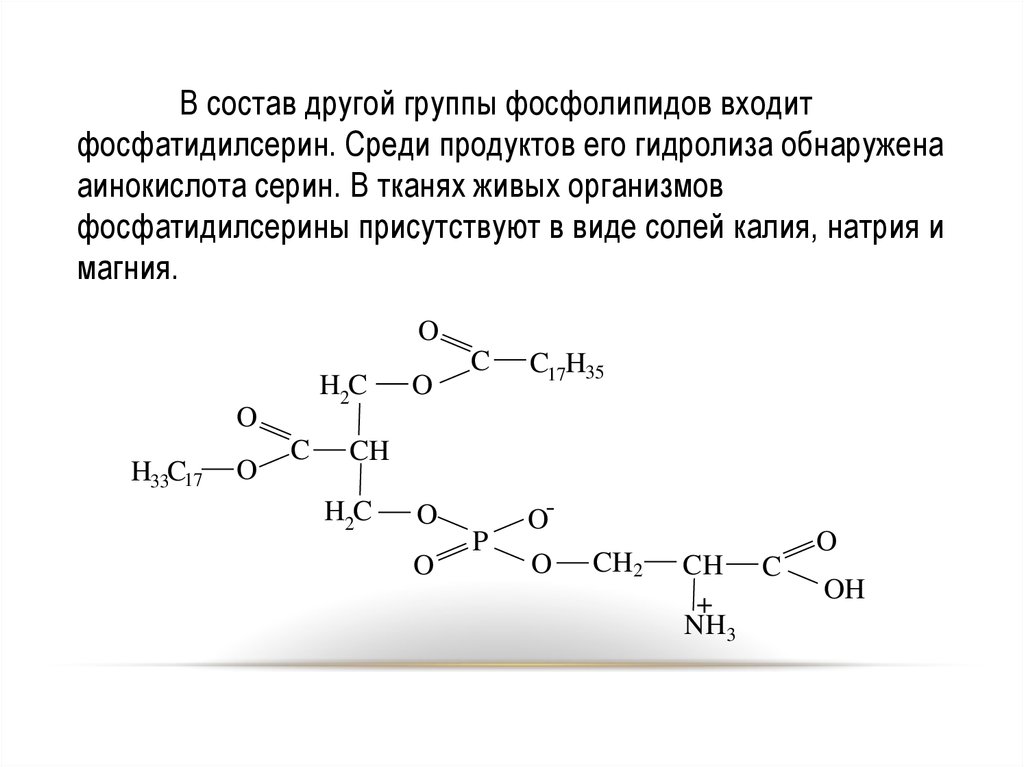
В состав другой группы фосфолипидов входитфосфатидилсерин. Среди продуктов его гидролиза обнаружена
аинокислота серин. В тканях живых организмов
фосфатидилсерины присутствуют в виде солей калия, натрия и
магния.
O
H2C
O
H33C17
O
C
O
C
C17H35
CH
H2C
O
O
P
OO
CH 2
CH C
+
NH3
O
OH
79
80.
• Фосфорсодержащие плазмалогены. Эта группа соединенийприсутствует главным образом в фосфолипидах животных и
человека. На их долю приходится до 30÷40%
фосфолипидов мозга и сердечной мышцы.
O
R1
X
H 2C
C
O
O
CH
H 2C
CH CH R
O
O P
O X
O
CH2 CH2
CH3
+
N CH3
CH3
+
CH2 CH2 NH 3
80
81. СФИНГОЛИПИДЫ
СФИНГОЛИПИДЫ
Так называют группу сложных липидов, основой
молекулы которых являются алифатические аминоспирты, из
которых наиболее распространены сфингозин и церебрин.
H 3C
(CH2) CH CH CH
12
сфингозин
H 3C
CH CH2 OH
OH NH2
(CH2) CH2 CH CH
12
OH
CH CH2 OH
OH NH 2
церебрин (фитосфингозин)
Сфинголипиды делятся на: фосфорсодержащие и
гликосфинголипиды.
81
82.
• Фосфорсодержащие сфинголипиды. Их молекулысодержат остатки холина.
H3C
( CH2)12
CH
HC
H3C
CH
CH
OH
NH
( CH2)16
CH2
O
O
C
O
P
OO
CH2
CH2
+ CH3
N CH3
CH3
82
83.
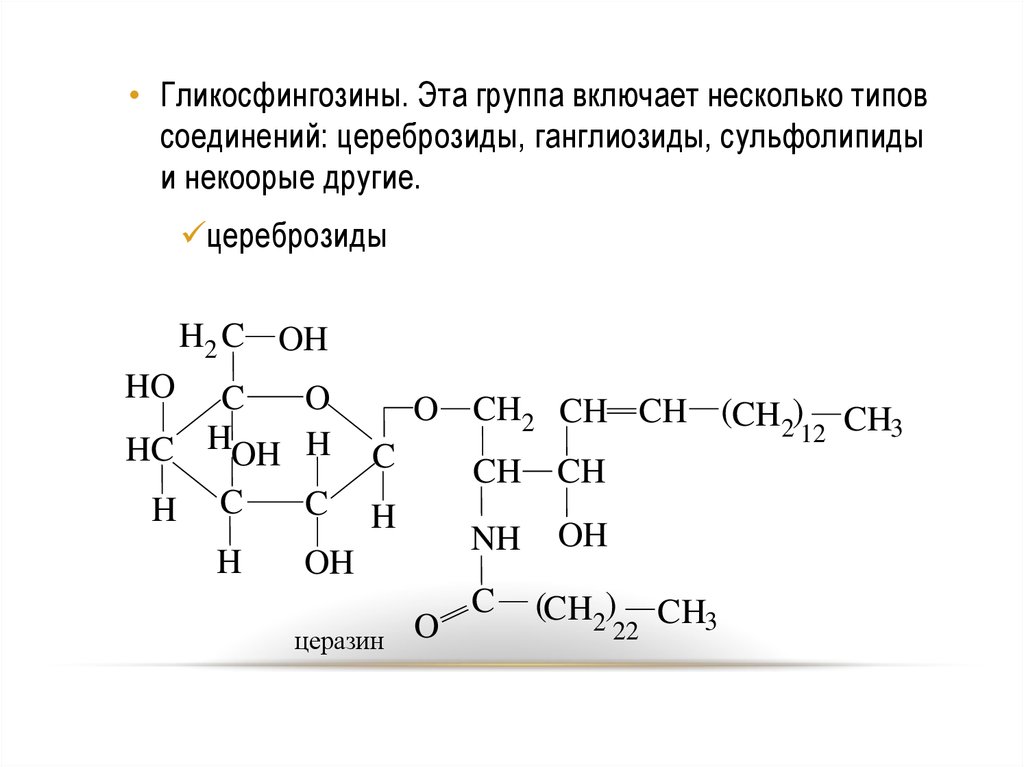
• Гликосфингозины. Эта группа включает несколько типовсоединений: цереброзиды, ганглиозиды, сульфолипиды
и некоорые другие.
цереброзиды
H2 C OH
HO
C
O
HC HOH H
C
H C
H
OH
O CH2 CH CH (CH2) CH3
12
C
CH CH
H
NH OH
церазин
O
C
(CH2)
22
CH3
83
84.
Ганглиозиды.84
85.
Сульфолипиды.85






















































 Химия
Химия








