Похожие презентации:
Функциональные производные карбоновых кислот
1. Функциональные производные карбоновых кислот
ФУНКЦИОНАЛЬНЫЕПРОИЗВОДНЫЕ
КАРБОНОВЫХ КИСЛОТ
2. Классификация
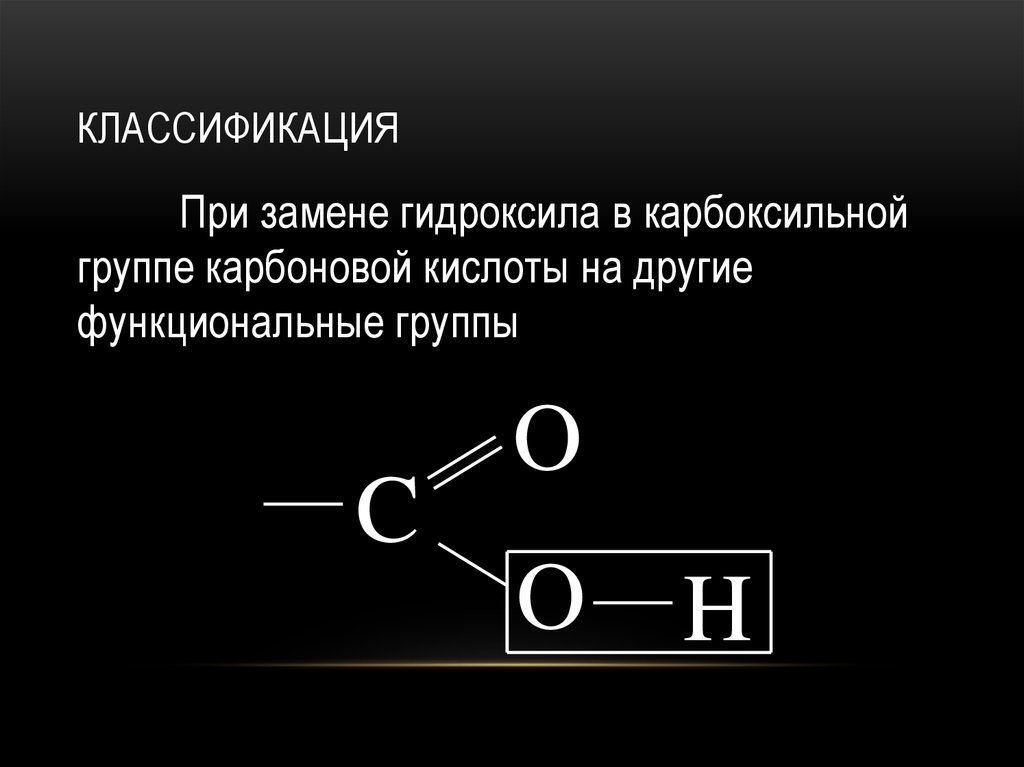
КЛАССИФИКАЦИЯПри замене гидроксила в карбоксильной
группе карбоновой кислоты на другие
функциональные группы
C
O
O
H
3.
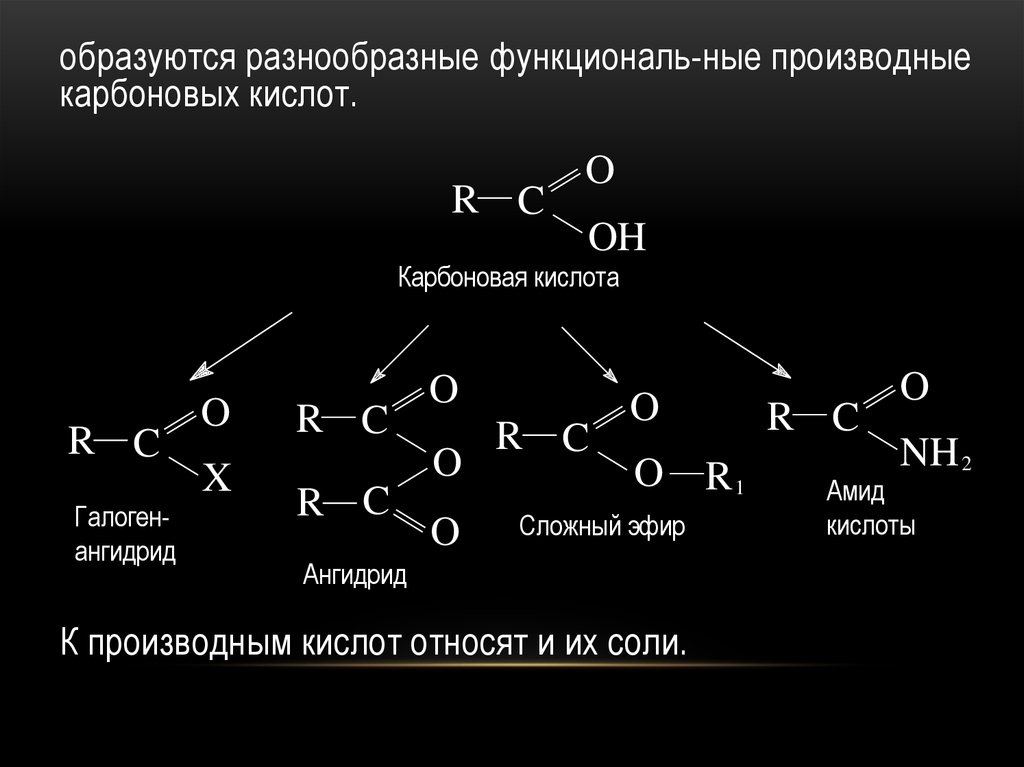
образуются разнообразные функциональ-ные производныекарбоновых кислот.
R C
O
OH
Карбоновая кислота
R C
Галогенангидрид
O
X
R C
O
O
R C
O
R C
O
O
Сложный эфир
Ангидрид
К производным кислот относят и их соли.
R C
R1
O
NH 2
Амид
кислоты
4.
Одновалентный кислотный остаток, образовавшийся после удалениягидроксильной группы, называют кислотным радикалом или ацилом:
R
C
O
Названия некоторых ацильных остатков:
H
C
H3C C
H3C
O
формил
O
CH2 C
ацетил
O
пропионил
H3C
H3C
H3C
(CH )
2 2
(CH )
2
3
(CH )
2
16
C
C
C
O
O
O
бутирил
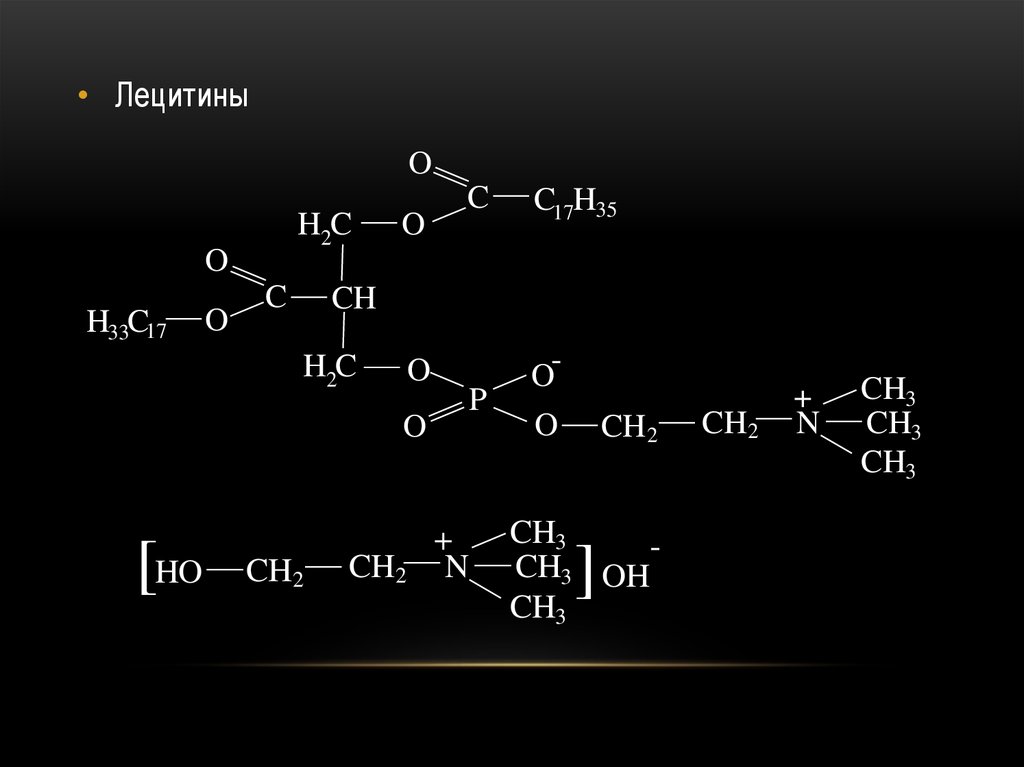
валерил
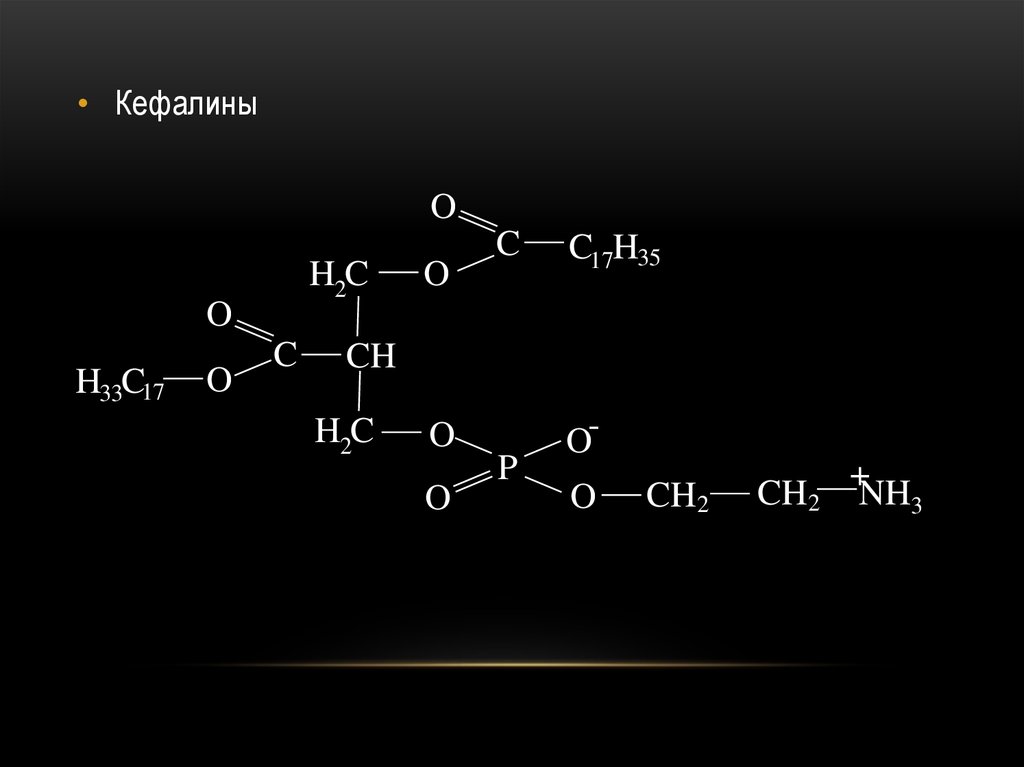
стеарил
5. Ангидриды карбоновых кислот
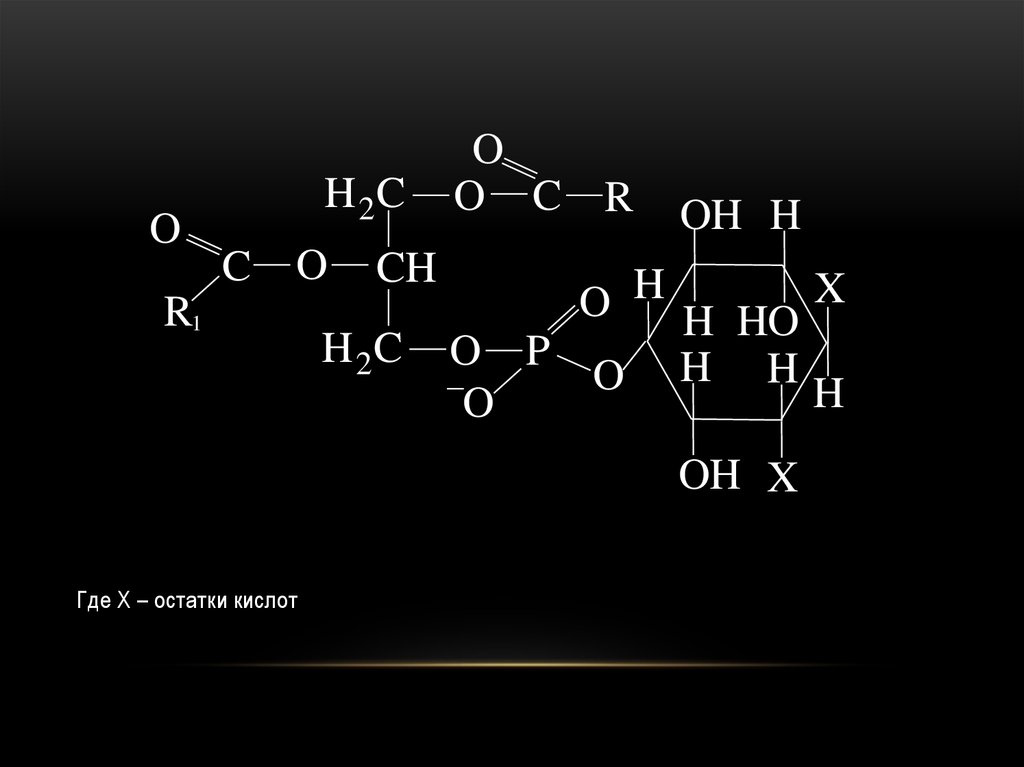
АНГИДРИДЫКАРБОНОВЫХ КИСЛОТ
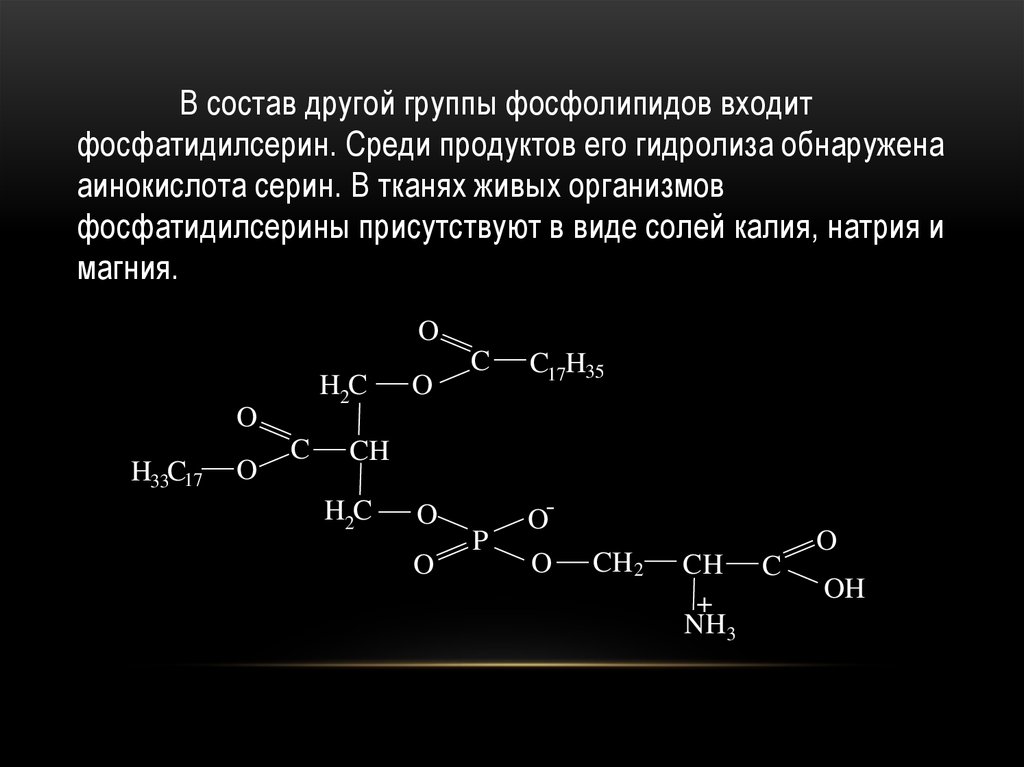
6. Получение
ПОЛУЧЕНИЕ• Из карбоновых кислот при их термической
ангидридизации или при взаимодействии с сильными
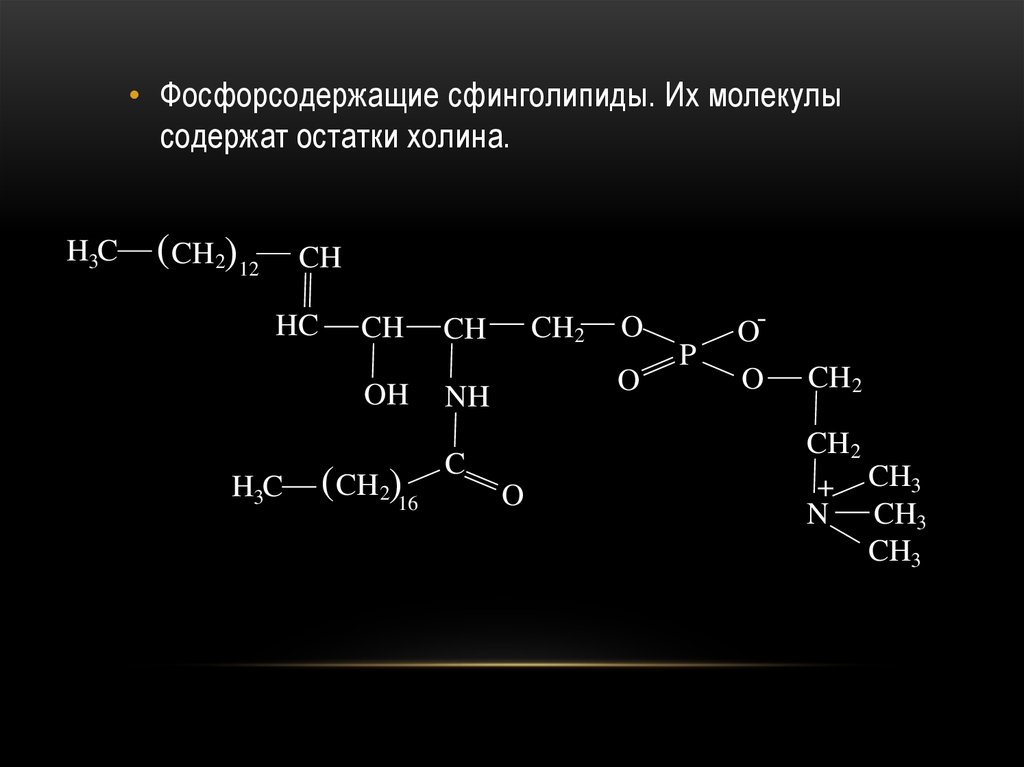
водоотнимающими реагентами (P2O5, ангидрид
трифторуксусной кислоты, карбодиимиды). При
нагревании легче всего образуются циклические
ангидриды дикарбоновых кислот (см. химические
свойства карбоновых кислот).
• При взаимодействии ацилхлоридов с карбоновыми
кислотами или их солями (см. свойства карбоновых
кислот).
Первый представитель гомологического ряда – ангидрид муравьиной кислоты –
нестабилен.
7. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВААнгидриды карбоновых кислот являются
бесцветными жидкостями или
кристаллическими веществами. Первые
представители гомологического ряда имеют
острый раздражающий запах. В воде
растворяются мало и с ней постепенно
взаимодействуют.
8. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАСвязи в молекулах ангидридов карбоновых кислот
сильно поляризованы. По сравнению с карбоновыми
кислотами ангидриды имеют более электрофильный характер,
так как в этом случае на один атом кислорода приходится две
ацильные группы.
....
O
R
δ+
δ‘-
C
....O
..
O
..
C
δ‘-
δ+
R
9.
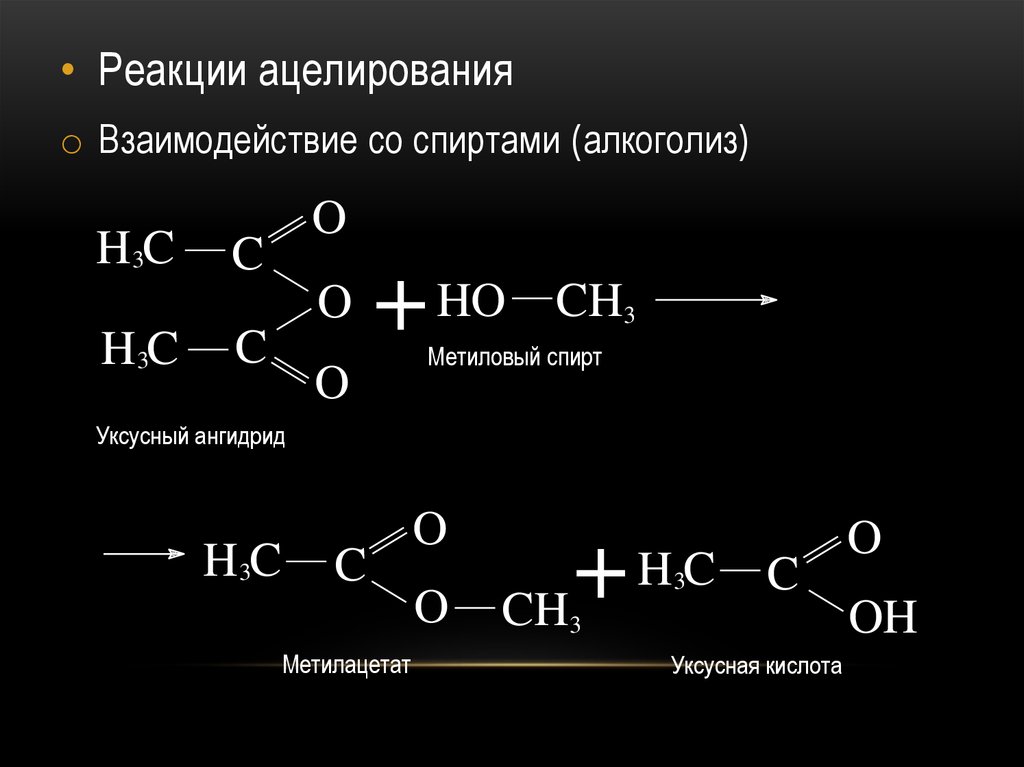
• Реакции ацелированияo Взаимодействие со спиртами (алкоголиз)
H3C
O
C
O
H3C
C
+ HO
O
CH3
Метиловый спирт
Уксусный ангидрид
H3C
C
Метилацетат
O
O
HC
+
CH
3
C
3
Уксусная кислота
O
OH
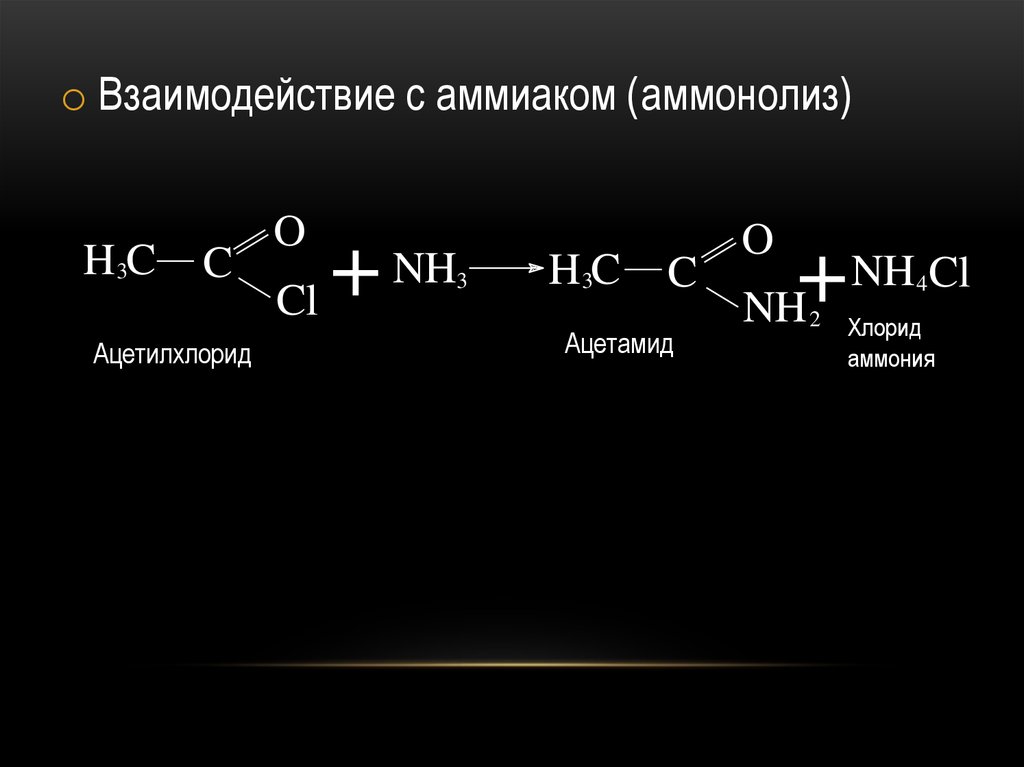
10.
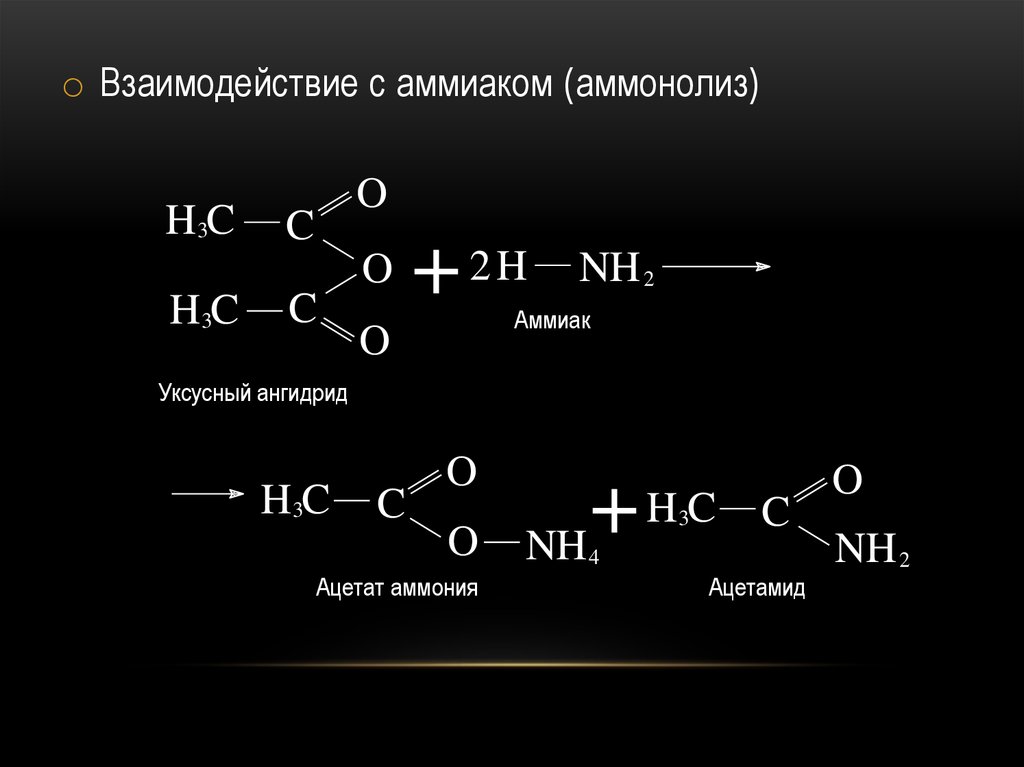
o Взаимодействие с аммиаком (аммонолиз)H3C
O
C
O
H3C
C
+ 2H
NH 2
Аммиак
O
Уксусный ангидрид
H3C
C
O
O
Ацетат аммония
HC
+
NH
3
C
4
Ацетамид
O
NH 2
11.
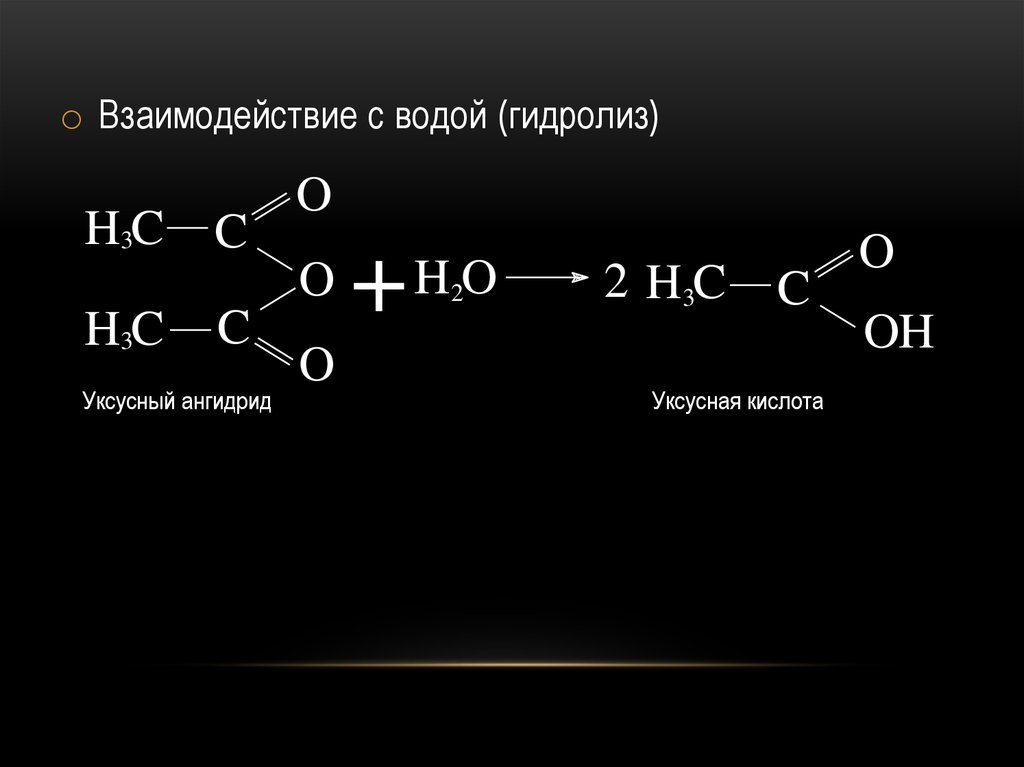
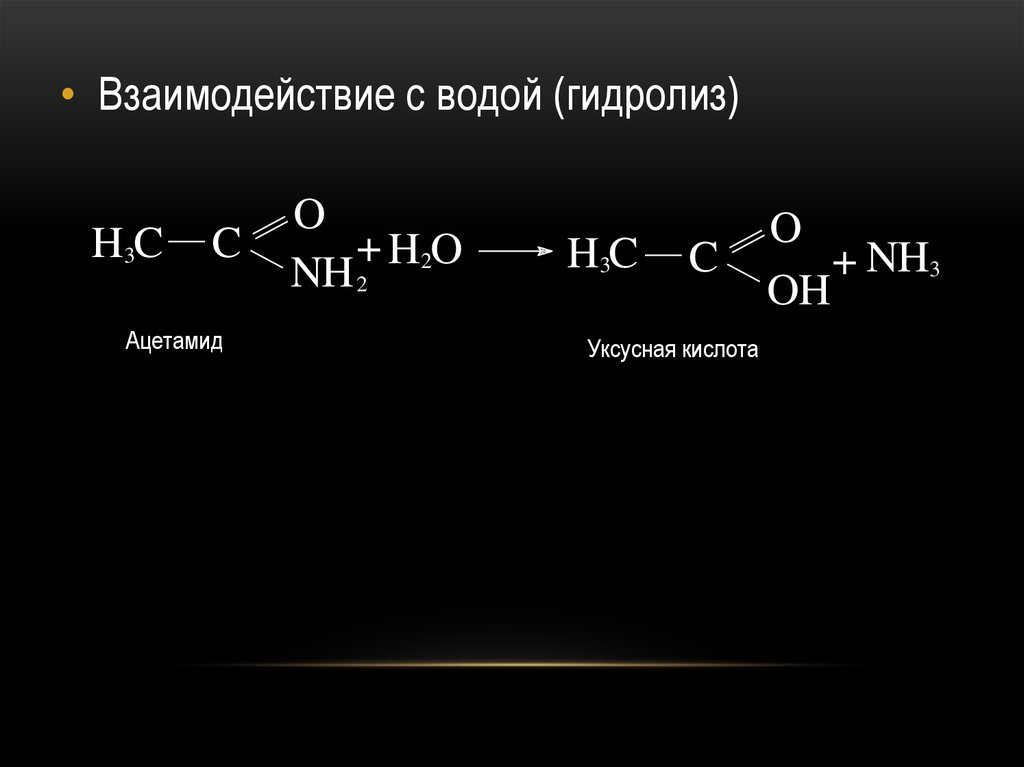
o Взаимодействие с водой (гидролиз)H3C
C
O
O
H3C
C
Уксусный ангидрид
O
+H O
2
2 H3C
C
Уксусная кислота
O
OH
12.
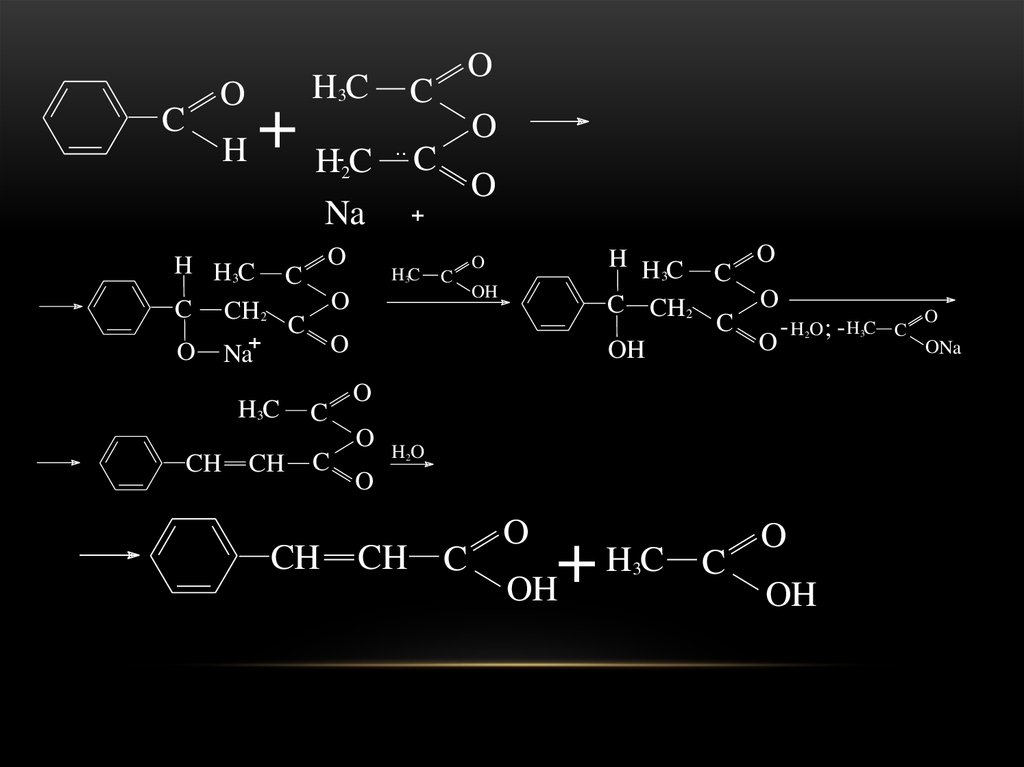
• Реакции α-водородного атомаВ присутствии оснований (соли карбоновых
кислот, третичные амины) ангидриды карбоновых
кислот, имеющих связь C–H в α-положении,
конденсируются с аренкарбальдегидами, образуя
ненасыщенные аренкарбоновые кислоты.
H3C
C
O
O
H3C
C
O
+Na
O
O
H3C
C
CH3
-
H2C
+
Na
C
O
O
C
O
+H C
3
C
O
OH
13.
CH3C
O
H + HC
-2
C
..
H3C
C
CH
C
CH
C
H 3C
O
C
O
H HC
3
C
O
C CH2
C
- H O ; -H C
O
OH
O
OH
2
O
O
CH
O
+
Na
H H3C C O
O
C CH2
C
+
O
O Na
O
H 2O
O
CH
C
O
HC
+
OH
3
C
O
OH
3
C
O
ONa
14. Применение
ПРИМЕНЕНИЕ• В качестве ацилирующих агентов (получение
ацетилцеллюлозы, лекарственных средств)
(уксусный ангидрид)
• Для получения полимеров (сополимеры со
спиртами, полиэфирные смолы), синтез гербицидов
(малеиновый)
• Для получения термостойких полимеров
(тримеллитовый и пиромеллитовый)
15. Галогенангидриды карбоновых кислот
ГАЛОГЕНАНГИДРИДЫКАРБОНОВЫХ КИСЛОТ
16.
Общая формула галогенангидридов карбоновыхкислот
R
C
O
X
где Х – фтор, хлор, бром, иод.
Названия их строятся по принципу
галогеналкилов: называется ацил и атом галогена,
например:
O
O
H3C C
H C
Cl
Cl
формилхлорид
Ацетилхлорид
17. Получение
ПОЛУЧЕНИЕГалогенангидриды карбоновых кислот
образуются при действии галогенидов фосфора
(PCl3, PCl5) и тионилхлорида (SOCl2) на кислоты
и их ангидриды (см. химические свойства карбоновых кислот)
18. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАГалогенангидриды карбоновых кислот
(ацилгалогениды) представляют собой
бесцветные жидкости или кристаллические
вещества с острым запахом, легколетучи – на
воздухе «дымят». Простейшие ацилфториды
газообразны.
В воде галогенангидриды растворяются
мало, но быстро реагируют с ней.
19. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАДля ацилгалогенидов характерна большая полярность
связей, что вызвано электроотрицательным действием атома
галогена.
...
O.
.. .
.
Cl
..
δ‘-
δ+
R
C
δ"-
20.
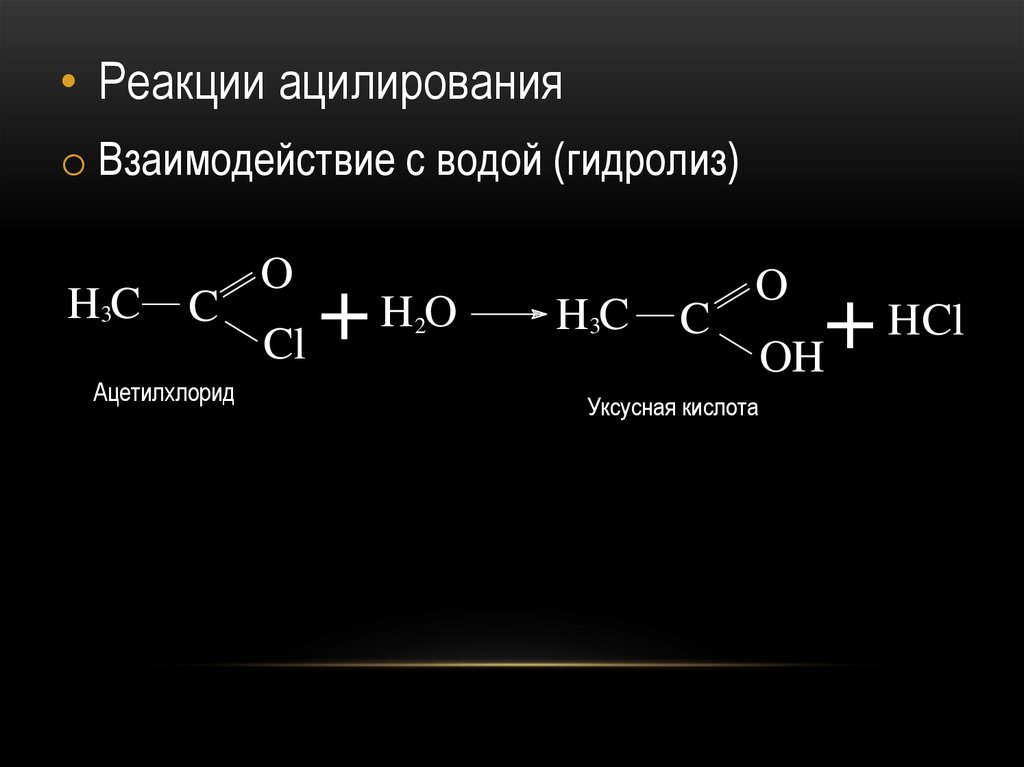
• Реакции ацилированияo Взаимодействие с водой (гидролиз)
H3C
C
Ацетилхлорид
O
HO
+
Cl
2
H3C
C
O
Уксусная кислота
HCl
+
OH
21.
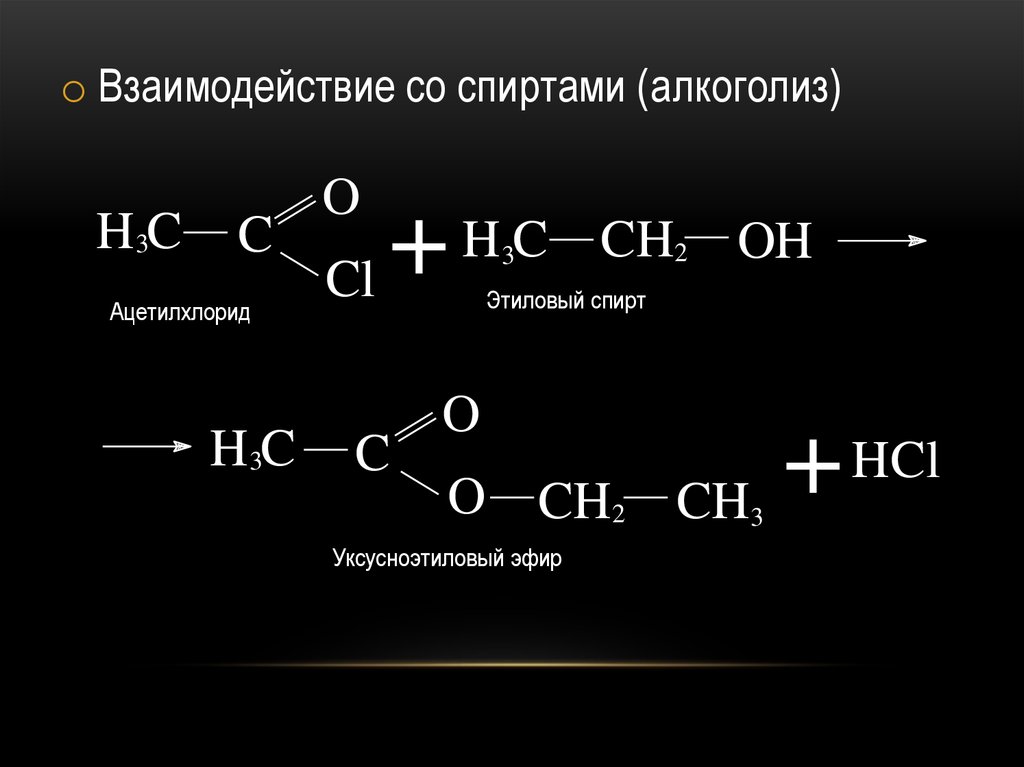
o Взаимодействие со спиртами (алкоголиз)H3C
C
Ацетилхлорид
H3C
O
HC
+
Cl
3
CH2 OH
Этиловый спирт
C
O
O CH2 CH3
Уксусноэтиловый эфир
+ HCl
22.
o Взаимодействие с аммиаком (аммонолиз)H3C
C
Ацетилхлорид
O
NH
+
Cl
3
H3C
C
Ацетамид
O
NH Cl
+
NH
4
2
Хлорид
аммония
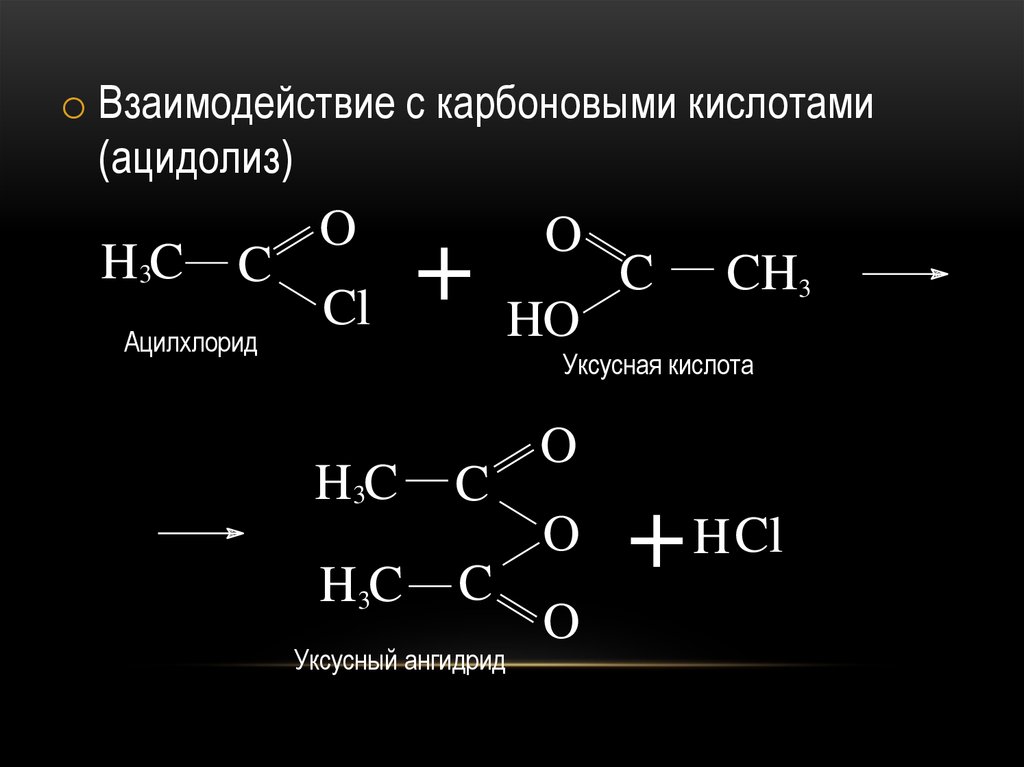
23.
o Взаимодействие с карбоновыми кислотами(ацидолиз)
H3C
C
Ацилхлорид
O
Cl
+
O
HO
C
CH3
Уксусная кислота
H3C
C
O
O
H3C
C
Уксусный ангидрид
O
+ H Cl
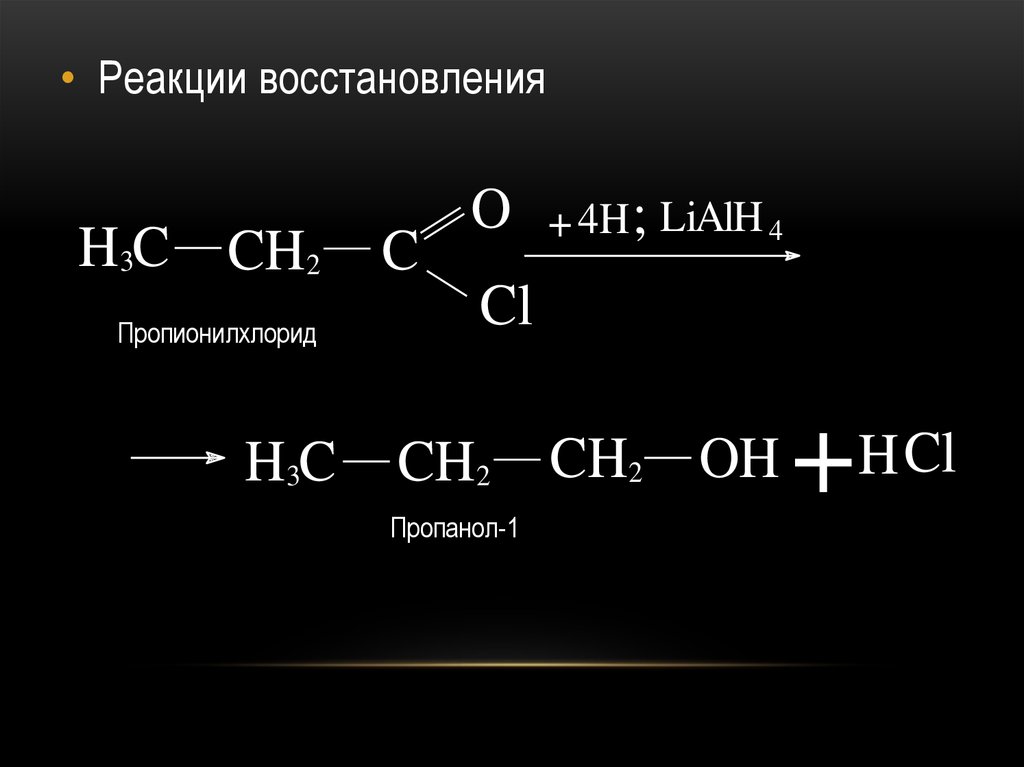
24.
• Реакции восстановленияH3C CH2
Пропионилхлорид
H3C
C
O
+ 4H ; LiAlH 4
Cl
CH2
Пропанол-1
CH2 OH
+
H Cl
25.
• Реакции α-водородного атомаЕсли в ацилгалогенидах имеется α-водородный атом,
возможны реакции енолизации и отщепления галогеноводорода.
Это вызвано повышенной полярностью связи C–H.
H3C
CH2
C
Пропионилхлорид
H3C
O
Cl
CH C
Метилкетен
H3C
C
H
O
+ HCl
C
OH
Cl
26. Применение
ПРИМЕНЕНИЕАцилгалогениды применяются в основном
для органического синтеза.
27. Амиды карбоновых кислот
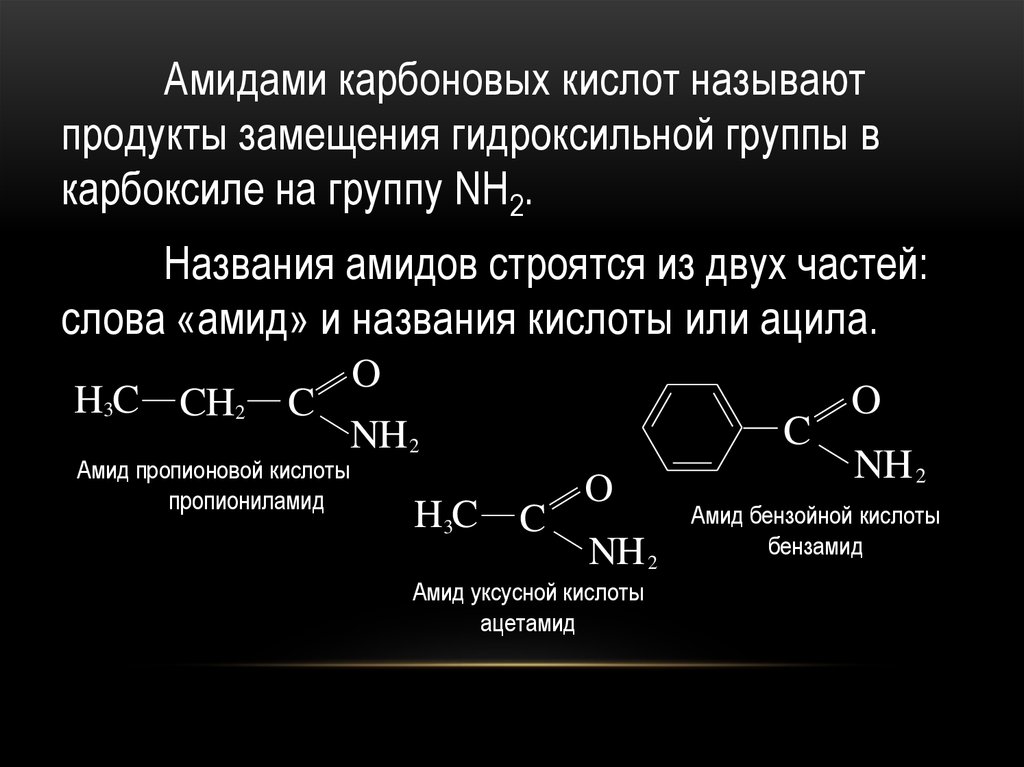
АМИДЫ КАРБОНОВЫХ КИСЛОТ28.
Амидами карбоновых кислот называютпродукты замещения гидроксильной группы в
карбоксиле на группу NH2.
Названия амидов строятся из двух частей:
слова «амид» и названия кислоты или ацила.
H3C CH2
C
O
C
NH 2
Амид пропионовой кислоты
пропиониламид
H3C
C
O
NH 2
Амид уксусной кислоты
ацетамид
O
NH 2
Амид бензойной кислоты
бензамид
29. Способы получения
СПОСОБЫ• ДействиеПОЛУЧЕНИЯ
аммиака на хлорангидриды
карбоновых кислот. (см. химические свойства
галогенангидридов карбоновых кислот).
• Сухая перегонка аммониевых солей
карбоновых кислот. (см. химические свойства карбоновых
кислот)
30. Физические свойства
ФИЗИЧЕСКИЕСВОЙСТВА
Амиды кислот
представляют собой твердые
вещества, за исключением формамида, являющегося
жидкостью; ограниченно растворимы в воде,
растворимость уменьшается с увеличением
молекулярной массы. Растворы имеют нейтральную
реакцию.
R3 C
....
O
..
N
R2
R1
31. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВА• Образование солей
Амиды почти не обладают основными
свойствами. Они образуют соли только с
сильными кислотами, которые легко
разлагаются водой.
H3C
C
Ацетамид
O
NH 2
+ H Cl
[
HC
+H O
3
2
C
O
]
HCl
NH 2
Хлороводородный ацетамид
32.
• Взаимодействие с водой (гидролиз)H3C
C
Ацетамид
O
+ H2O
NH 2
H3C
C
Уксусная кислота
O
+ NH3
OH
33.
• Дегидратация.При нагревании амидов кислот с
водоотнимающими веществами образуются
соответствующие нитрилы.
H3C
C
Аетамид
O
NH2
t
P2O5
H3C
C N + H2O
Ацетнитрил
34.
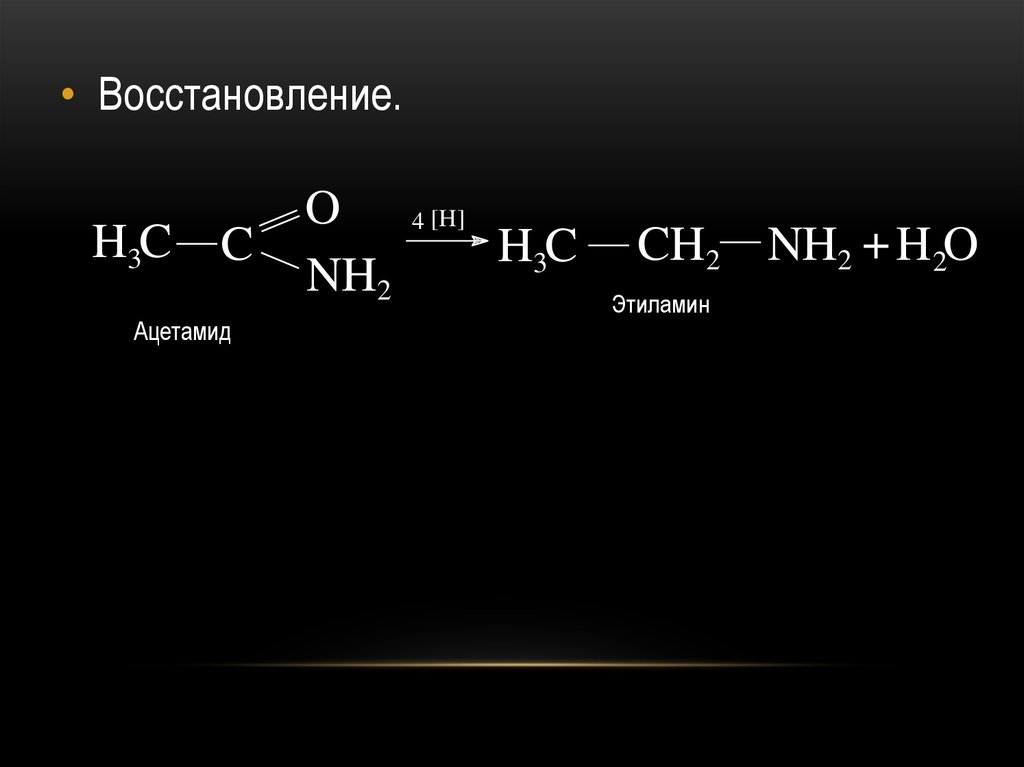
• Восстановление.H3C C
Ацетамид
O
NH2
4 [H]
H3C
CH2 NH2 + H2O
Этиламин
35. Сложные эфиры карбоновых кислот
СЛОЖНЫЕ ЭФИРЫКАРБОНОВЫХ КИСЛОТ
36.
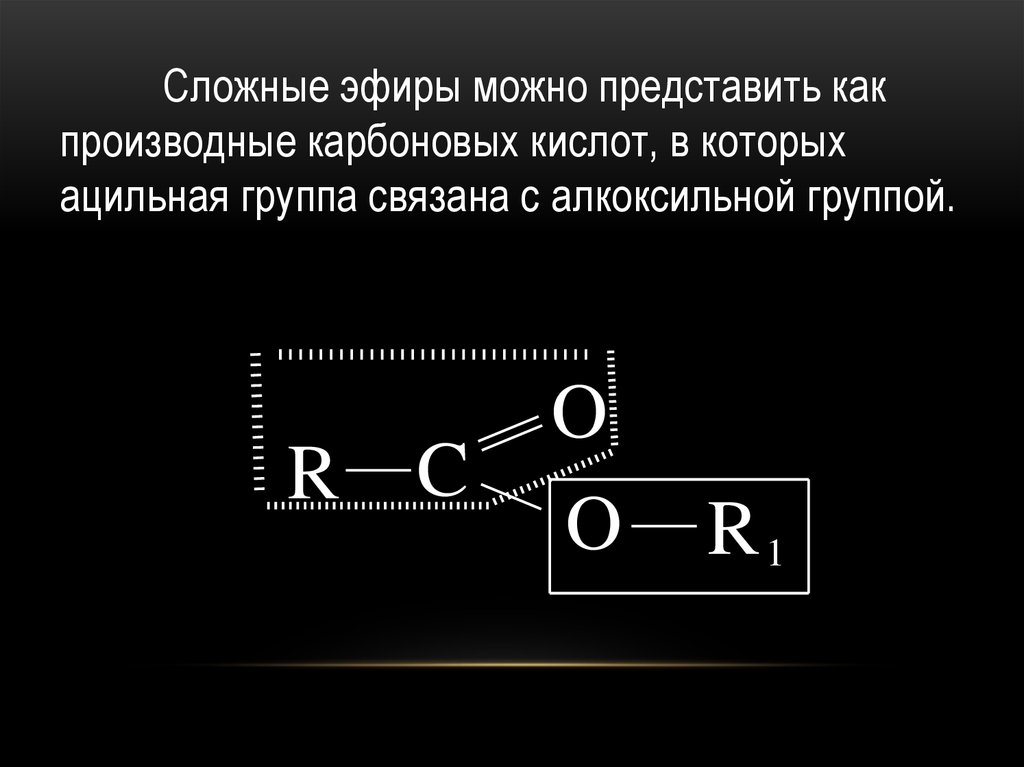
Сложные эфиры можно представить какпроизводные карбоновых кислот, в которых
ацильная группа связана с алкоксильной группой.
R C
O
O
R1
37. Номенклатура
НОМЕНКЛАТУРАПо рациональной номенклатуре
наименование эфира строится из двух частей:
названия кислоты и спиртового радикала.
По IUPAC для наименования сложных
эфиров к названию кислоты (заменив «овая» на
«оат») прибавляют название спиртового
радикала.
38.
HC
H3C
O
O
C
CH2 CH3
O
O
CH3
H
H2C
CH
C
Br
C
O
O
CH3
Этиловый
эфир
муравьиной
кислоты
Этилформиат
Этилметаноат
Метиловый
эфир
уксусной
кислоты
Метилацетат
Метилэтаноат
Метиловый
эфир 2-бром3-бутеновой
кислоты
Метил-2бромбутен-3оат
39. Изомерия.
ИЗОМЕРИЯ.Изомерия сложных эфиров определяется
изомерией кислотных и спиртовых остатков.
40. Нахождение в природе.
НАХОЖДЕНИЕ В ПРИРОДЕ.Сложные эфиры широко представлены в
природе, но обычно в небольших количествах.
Они участвуют в разнообразных процессах,
протекающих в живом организме, являются
ароматообразующими компонентами ряда
растений. В значительных количествах в природе
представлены только сложные эфиры
высокомолекулярных (чаще многоатомных)
спиртов и кислот.
41. Синтетические способы получения.
СИНТЕТИЧЕСКИЕ СПОСОБЫ ПОЛУЧЕНИЯ.• Реакция этерификации. (см. химические
свойства карбоновых кислот или спиртов)
Значительно легче и несравнимо быстрее
происходит образование внутримолекулярного
сложного эфира (лактона) из молекул γ- или δоксикислот.
O
O
CH2 C
C
CH
2
OH
O +HO
2
CH2 CH2 OH
CH2 CH2
γ-оксибутановая кислота
лактон γ-оксибутановой
кислоты
42.
• Взаимодействие хлорангидридов илиангидридов карбоновых кислот со спиртами
или фенолами. (см. химические свойства
ацилгалогенидов или ангидридов)
43. Физические свойства.
ФИЗИЧЕСКИЕ СВОЙСТВА.Сложные эфиры низкомолекулярных и
среднемолекулярных кислот и спиртов –
жидкости с приятным фруктовым запахом,
высокомолекулярных – твердые вещества без
запаха. Плохо (низшие гомологи) или совсем не
растворимые в воде, хорошо растворимы во
многих органических растворителях.
44. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВА• Сложные эфиры вступают во все реакции
нуклеофильного замещения, описанные
ранее для ангидридов и галогенангидридов
кислот, проявляя при этом меньшую
активность.
o Гидролиз.
H3C
CH2 C
O
+ H2O
O
CH3 -H2O
H3C
CH2
C
O
OH
+ H3C
OH
45.
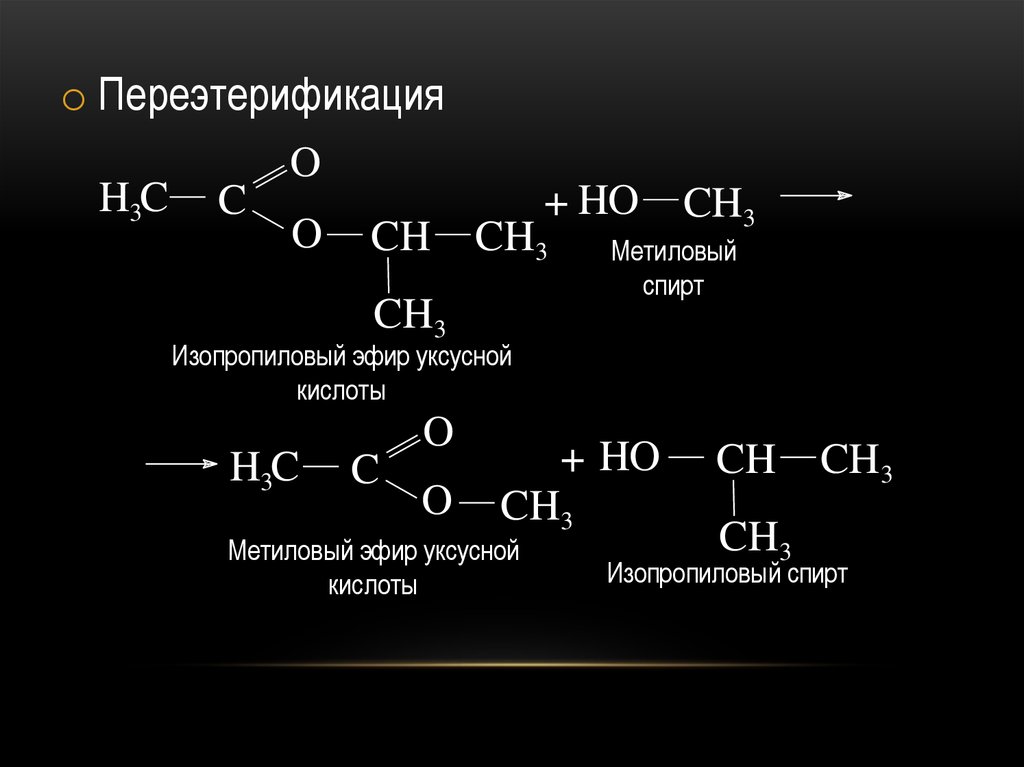
o ПереэтерификацияH3C
C
O
O
CH
+ HO
CH3
CH3
Метиловый
спирт
CH3
Изопропиловый эфир уксусной
кислоты
H3C
C
O
O
+ HO
CH3
Метиловый эфир уксусной
кислоты
CH
CH3
CH3
Изопропиловый спирт
46.
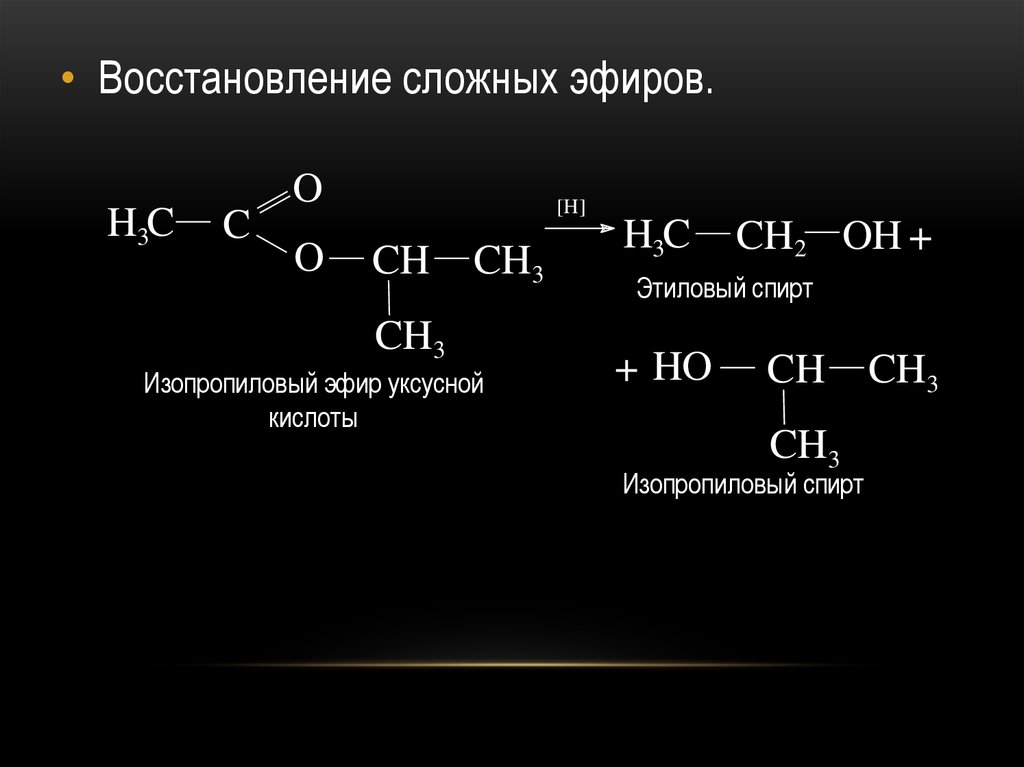
• Восстановление сложных эфиров.H3C
C
O
O
[H]
CH
CH3
CH3
Изопропиловый эфир уксусной
кислоты
H3C
CH2 OH +
Этиловый спирт
+ HO
CH
CH3
Изопропиловый спирт
CH3
47. Отдельные представители
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ• Искусственные фруктовые эссенции
H
C
O
O
CH2
ромовая
Этилбутират
ананасовая
Изоамилбутират
грушевая
Алкилизовалераты
яблочная
Бензилацетат
жасминовая
CH3
O
H3C CH2 CH2 C
H3C CH2 CH2 C
Этилформиат
O
CH2
CH3
O
O
CH2 CH2 CH
CH 3
CH 3
H3C CH
CH2 C
O
O
R
CH3
H3C
CH2 C
O
O
CH2
48.
• Природные сложные эфиры относят к липидам.Различают:
o Простые липиды – жиры, воски, стеролы и
стериды.
o Сложные липиды – фосфоросодержащие
соединения и производные моносахаридов:
фосфолипиды, гликолипиды,
сфинголипиды
49. Простые липиды
ПРОСТЫЕ ЛИПИДЫ• Жиры и масла – сложные эфиры
высших жирных кислот (насыщенных и
ненасыщенных) и глицерина. В состав жиров
входят в основном триглицериды, но
присутствуют и ди- и моноглицериды.
Молекулы большинства кислот имеют
неразветвленную структуру и содержат четное
количество атомов углерода.
50.
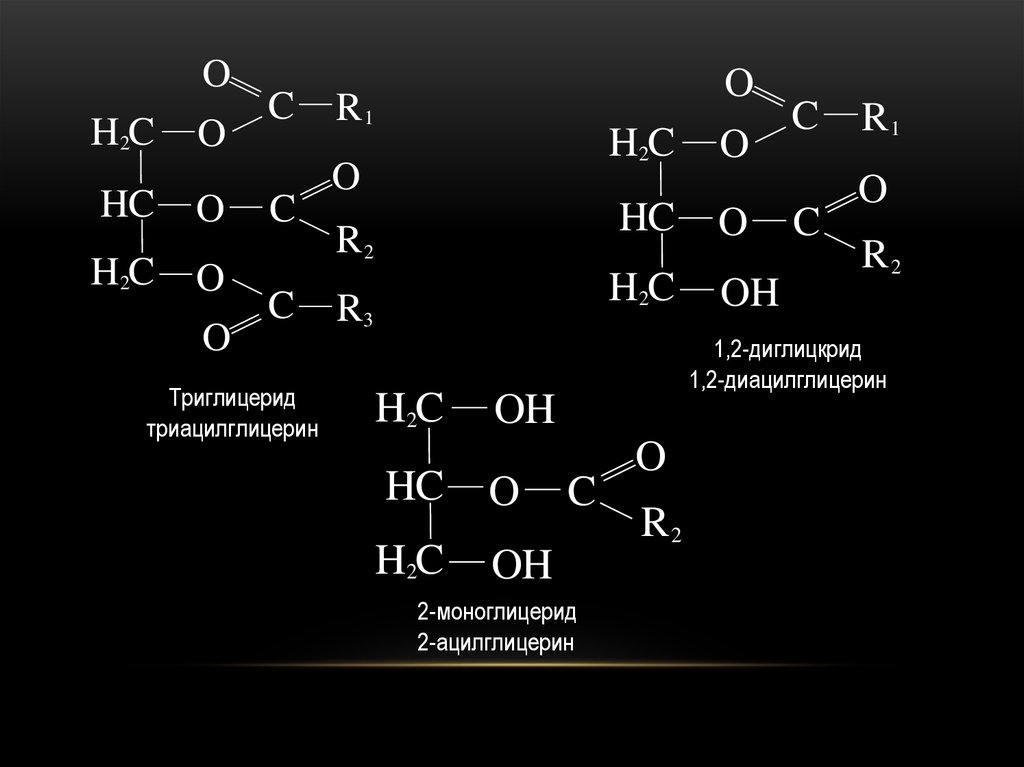
H2CHC
H2C
O
C
O
O
C
O
C
O
Триглицерид
триацилглицерин
R1
H2C
O
HC
R2
H2C
R3
H2C
O
C
O
O
OH
C
R1
O
R2
1,2-диглицкрид
1,2-диацилглицерин
OH
HC
O
H2C
OH
C
2-моноглицерид
2-ацилглицерин
O
R2
51.
Кислоты жировНазвание
Формула
Насыщенные
Капроновая
H3C
Каприловая
Каприновая
H3C
(CH )
2 4
(CH )
2 8
C
C
Лауриновая
Миристиновая
H3C
(CH )
2
12
C
Пальмитиновая
Стеариновая
H3C
(CH )
2
Арахиновая
Бегеновая
H3C
Церотиновая
Монтановая
Мелиссиновая
H3C
16
(CH )
2
20
(CH )
2
26
C
C
C
O
OH
H3C
O
OH
O
H3C
OH
O
OH
H3C
(CH )
C
(CH )
C
2
6
2 10
(CH )
2
14
C
(CH )
C
OH
H3C
O
(CH )
C
OH
(CH )
C
H3C
2
18
O
H3C
2
2
24
28
O
OH
O
OH
O
OH
O
OH
O
OH
O
OH
52.
НазваниеФормула
Ненасыщенные
Олеиновая
Линолевая
(CH )
H3C
2
(CH )
H3C
2
7
Линоленовая
H3C
(CH
Элеостеариновая
H3C
(CH ) (CH
Арахидоновая
Эруковая
H3C
H3C
CH)3
CH
2
(CH ) (CH
2 3
2
CH
7
2 7
CH
OH
(CH )
(CH )
OH
O
C
2 7
OH
(CH )
2 11
2
C
C
2 7
O
C
(CH )
CH CH)4
2
(CH )
2 7
(CH )
CH)3
2 3
O
C
CH2 CH CH
CH CH
4
(CH )
CH CH
3
C
O
OH
O
OH
Оксикислоты
Рицинолевая
H3C
(CH )
2
5
CH CH2 CH CH
OH
(CH )
2 7
C
O
OH
O
OH
53. Изомерия
ИЗОМЕРИЯИзомерия глицеридов связана с различным
положением ацилов в молекуле, их различным
строением, положением двойных связей: возможна
также цис- и транс-изомерия.
В глицеридах имеет место оптическая
изомерия.
54. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАТриглицериды – жидкости или твердые
вещества без цвета, вкуса и запаха, нерастворимы в
воде, но хорошо растворимы в органических
растворителях.
Плотность триглицеридов при 15°С составляет
900÷980 кг/м3.
55. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАГлицериды вступают во все реакции характерные для
сложных эфиров:
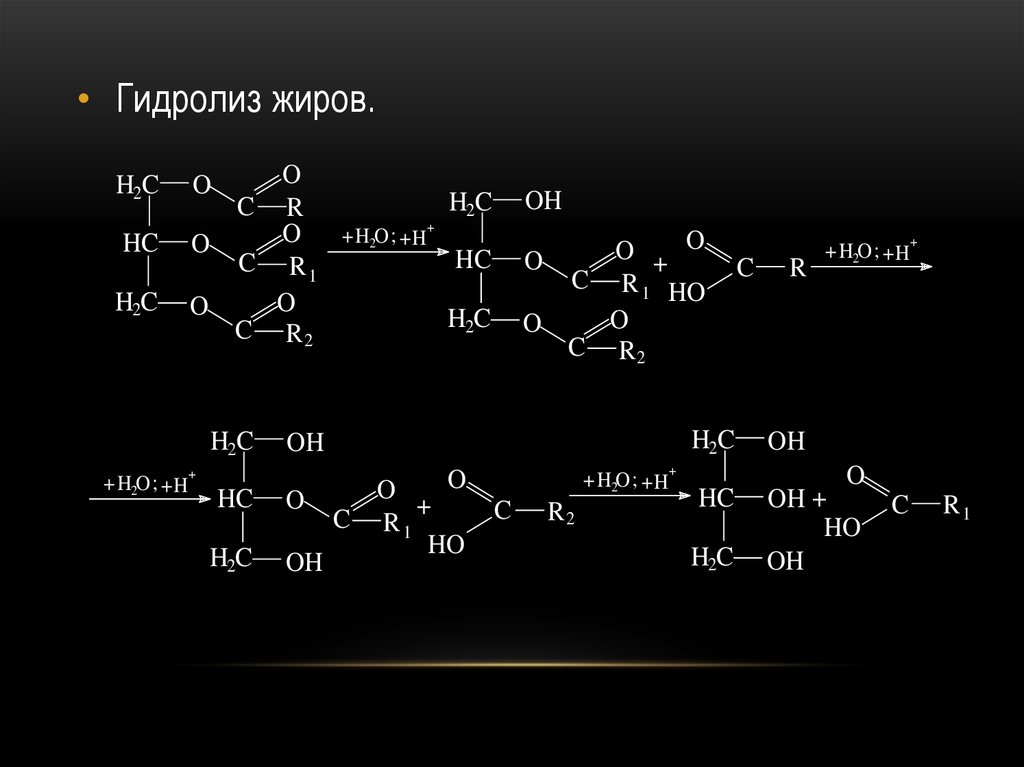
• Гидролиз. Протекает в присутствии кислот или щелочей, а
также фермента – липазы, ступенчато. При повышении
температуры сильно ускоряется.
• Переэтерификация протекает в присутствии, в качестве
катализаторов, метилата и этилата натрия и калия, гидроксида
натрия.
• Алкоголиз. При этом высвобождается глицерин.
• Ацидолиз.
• Гидрогенизация.
• Окисление.
56.
• Гидролиз жиров.H2C
HC
H2C
O
C R
O
O
C R1
O
O
C R2
O
H2C
+ H2O ; + H
OH
H2C
+ H2O ; + H
+
O
O
O
+
C R 1 HO
O
O
C R2
HC
H2C
H2C
OH
+
HC
O
H2C
OH
O
O
C R1 +
HO
+ H2O ; + H
C
R2
+
HC
H2C
C
R
+ H2O ; + H
+
OH
O
OH +
HO
OH
C
R1
57.
• Переэтерификация жиров.o межмолекулярная
O
O
H 2 C O C R1 H 2 C O
O
HC O C
+
R 2 HC O
H2C O C R3 H2C O
O
O
O
H2C O C R 3 H2C
O +
HC
HC O C
R2
H2C O C R 3 H2C
O
C R2
O
C
R2
C R3
kat
O
O C R2
O
C
O C
O
O
R2
R1
58.
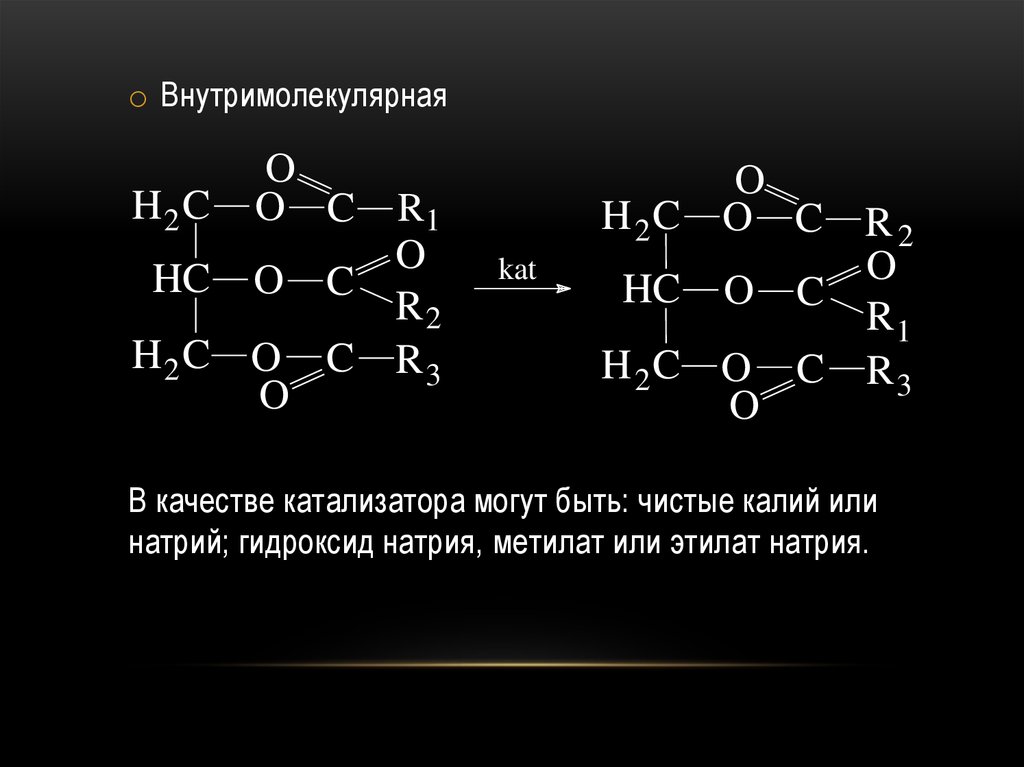
o ВнутримолекулярнаяH2C
O
O C
HC
O C
H2C O C
O
R1
O
R2
R3
kat
O
H2C O C R 2
O
HC O C
R1
H2C O C R3
O
В качестве катализатора могут быть: чистые калий или
натрий; гидроксид натрия, метилат или этилат натрия.
59.
• Алкоголиз жиров.O
H 2 C O C R1
O
kat
HC O C
H 3 C CH 2 OH
+
R2
H2C O C R3
O
H 2 C OH
O
O
kat
O
HC O C
C R1
+ H 3 C CH 2
R2
H 2C O C R3
O
H 2C
HC
H 2C
H 2C
OH
O
C
O
H C
R2 + 3
OH
OH
HC OH + H 3 C
H 2C
CH 2
O
O C
OH
CH 2
O
O C R2
R3
kat
60.
В качестве катализаторов при алкоголизе применяютгидроксид натрия, алкоголяты щелочных металлов, серную
кислоту, хлороводород.
Алкоголиз применяют для промышленного
илабораторного получения сложных эфиров жирных кислот,
моно и диглицеридов (глицерин в качестве спирта –
глицеролиз).
61.
• Ацитодолиз.O
H 2 C O C R1
O
O
kat
HC O C
HO
C R
R2 +
H2C O C R3
O
O
H 2C O C R
O
O
HC O C
R2 + HO C R1
H 2C O C R3
O
62.
Реакция ацитодолиза протекает в присутствиисерной кислоты, воды или трифторида бора. Реакция
ускоряется с увеличением силы свободной жирной
кислоты.
63.
• Гидрогенизация жиров.Гидрирование жиров молекулярным водородом в
промышленности проводят при температурах 180 ÷ 240°С в
присутствии никелевых имедно-никелевых катализаторов, как
правило, при небольшом давлении. Подбирая
соответствующие условия реакции, удается осуществить этот
процесс селективно, гидрируя сначала радикалы линоленовой
кислоты до линолевой, затем линолевой до олеиновой, а уже
потом радикалы олеиновой (если это необходимо) до
стеариновой кислоты. Полученный продукт с заранее
заданным кислотным составом и свойствами называют
саломасом.
64.
65.
• Окисление жиров.Жиры и масла, особенно содержащие радикалы
ненасыщенных жирных кислот, окисляются кислородом
воздуха. Начальными (первичными) продуктами окисления
являются разнообразные по строению перекиси и
гидроперекиси.
В результате сложных превращений перекисей
образуются вторичные продукты окисления: спирты,
альдегиды, кетоны, кислоты с углеродной цепочкой различной
длины, а также их произведение, в частности продукты
полимеризации.
66.
• Воски.Сложные эфиры высокомолекулярных
одноосновных карбоновых кислот и однотомных
высокомолекулярных спиртов.
В состав восков входят главным образом
кислоты, содержащие 24÷32 атома углерода, и
спирты, углеродная цепочка которых состоит из
14÷30 атомов углерода.
67.
Воски широко распространены в природе. Воскипокрывают тонким слоем листья, стебли и плоды
растений.
Из растительных восков промышленное
значение имею воски, покрывающие листья пальм
(карнаубский воск), воски липидов риса и
подсолнечника. Из восков животного происхождения
наибольшую роль играют спермацет и спермацетовое
масло, шерстяной жир; из восков насекомых –
пчелиный воск.
68.
Спермацет – твердый кристаллический продуктбелого цвета, состоящий в основном из цетилового
эфира пальмитиновой кислоты. Выделяют спермацет
из маслообразной массы, содержащейся в голове
кашалота.
Шерстяной жир – жиропот овечьей шерсти, от
желтого до темнокоричневого цвета, с резким
неприятным запахом. После соответствующей
обработки их него получают слабоокрашенный
мазеобразный ланолин (состоит в основном из
сложных эфиров кислот с С10÷С20 и спиртов с С18÷С20.
69.
Пчелиный воск получают из пчелиных сотвытапливаемый или экстракцией после удаления
меда. Он состоит главным образом из эфиров кислот
С26÷С30 и спиртов С14÷С31 и содержит до 15%
углеводородов.
Воски гидролизуются труднее, чем
жиры.
Не растворимы в воде, а в
органических растворителях растворяются
хуже, чем жиры.
70. Сложные липиды
СЛОЖНЫЕ ЛИПИДЫ• Фосфатиды – липиды, дающие при гидролизе
глицерин, высшие монокарбоновые кислоты,
фосфорную кислоту и аминоспирты или
другие сложные спирты. Могут быть
разделены, в зависимости от строения
полиола (центрального структурного
фрагмента), на: глицерофосфолипиды,
диольные фосфолипиды и сфинголипиды.
71.
• Глицерофосфалепиды.H 2C
R1 O
CH
H 2C
O R
O
O P
O X
O
Где X может быть представлен в виде атома водорода или
следующих заместителей
+
CH2 CH2 N
H 3C
CH3
CH3
CH2 CH2
CH3
NH
CH3
+
CH2 CH
+
NH3
C
O
OH
72.
Наиболее простое строение из глицерофосфолипидов имеютширокораспространенные в природе фосфатидные
(фосфатидиновые) кислоты
O
R1
H 2C
C
O
CH
H 2C
O
O C R
O
O P
O X
O
монофосфатидная кислота
73.
В растениях, микроорганизмах и некоторых животныхтканях обнаружены молекулы, построенные из нескольких
остатков фосфатидных кислот, например – триглицерофосфат.
74.
Наиболее распространены среди фосфолипидовфосфатидилхолины (в их молекулах X представлен остатком
аминоспирта холина) и фосфатидиэтаноламины (в их
молекулах содержится остаток этаноламина).
75.
• ЛецитиныO
H2C
O
H33C17
O
C
O
C
CH
H2C
O
P
O
[HO
C17H35
CH2
CH2
+
N
OO
CH2
CH3
CH3 OH
CH3
]
CH2
+
N
CH3
CH3
CH3
76.
• КефалиныO
H2C
O
H33C17
O
C
O
C
C17H35
CH
H2C
O
O
P
OO
CH2
CH2
+
NH3
77.
• Инозитфосфатиды. Или фосфатидилинозитах Хпредставлен остатком циклического спирта –
гексаоксициклогексана (инозит).
Оксигруппы в миоинозите могут быть этерефицированы
кислотами различного строения. Фосфоинозитиды, в
молекулах которых спиртовые группы миоинозита (обычно в
положении 4,5) этерефицированы ортофосфорной кислотой,
называют полифосфоинозитидами..
78.
OH 2C
C
O
R1
CH
H 2C
O
O C R
OH H
O H H HO X
O P
O H HH
O
OH X
Где Х – остатки кислот
79.
В состав другой группы фосфолипидов входитфосфатидилсерин. Среди продуктов его гидролиза обнаружена
аинокислота серин. В тканях живых организмов
фосфатидилсерины присутствуют в виде солей калия, натрия и
магния.
O
H2C
O
H33C17
O
C
O
C
C17H35
CH
H2C
O
O
P
OO
CH2
CH C
+
NH3
O
OH
80.
• Фосфорсодержащие плазмалогены. Эта группа соединенийприсутствует главным образом в фосфолипидах животных и
человека. На их долю приходится до 30÷40%
фосфолипидов мозга и сердечной мышцы.
O
R1
X
H 2C
C
O
O
CH
H 2C
CH CH R
O
O P
O X
O
CH2 CH2
CH3
+
N CH3
CH3
+
CH2 CH2 NH 3
81. сфинголипиды
СФИНГОЛИПИДЫ
Так называют группу сложных липидов, основой
молекулы которых являются алифатические аминоспирты, из
которых наиболее распространены сфингозин и церебрин.
H 3C
(CH2) CH CH CH CH CH2 OH
12
сфингозин
H 3C
OH NH2
(CH2) CH2 CH CH
12
OH
CH CH2 OH
OH NH 2
церебрин (фитосфингозин)
Сфинголипиды делятся на: фосфорсодержащие и
гликосфинголипиды.
82.
• Фосфорсодержащие сфинголипиды. Их молекулысодержат остатки холина.
H3C
( CH2)12
CH
HC
H3C
CH
CH
OH
NH
( CH2)16
CH2
O
O
C
O
P
OO
CH2
CH2
+ CH3
N CH3
CH3
83.
• Гликосфингозины. Эта группа включает несколько типовсоединений: цереброзиды, ганглиозиды, сульфолипиды
и некоорые другие.
цереброзиды
H2 C OH
HO
C
O
HC HOH H
C
H C
H
OH
O CH2 CH CH (CH2) CH3
12
C
CH CH
H
NH OH
церазин
O
C
(CH2)
22
CH3




























































 Химия
Химия








