Похожие презентации:
Реакции SR в ряду алканов
1. Лекция №3
Реакции SR в ряду алканов2.
Лекция №31. Реакции радикального замещения – типичная
реакция в ряду алканов
2. Природные источники алканов
3. Промышленно важные процессы с участием
алканов
4. Синтез алканов
3.
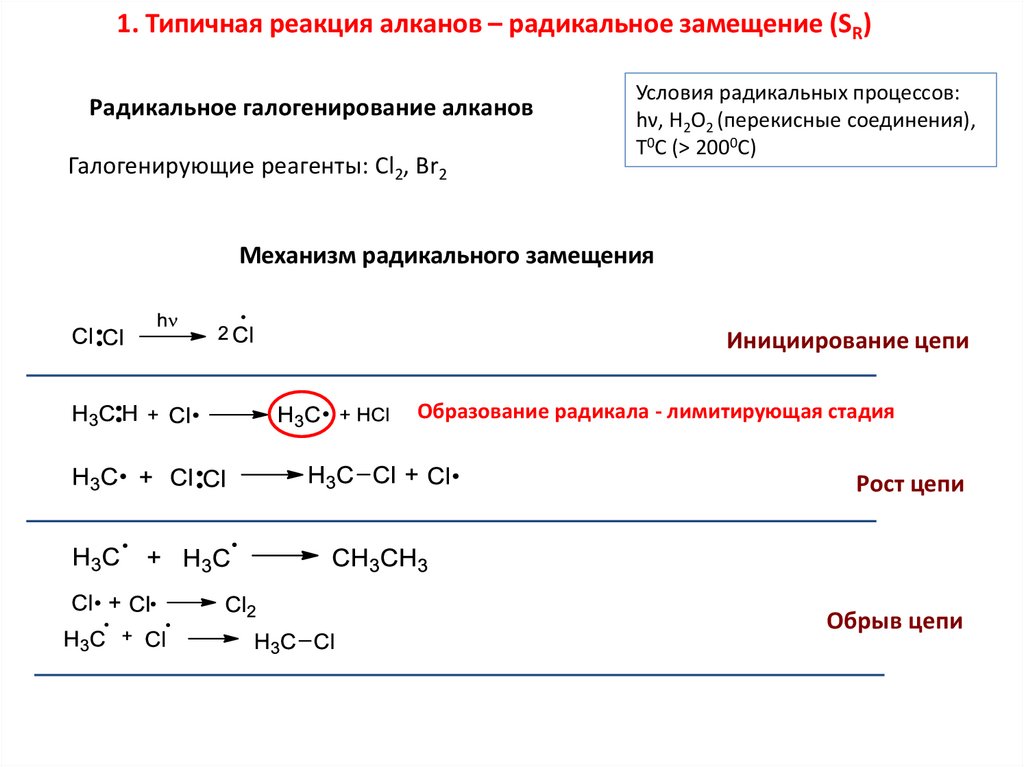
1. Типичная реакция алканов – радикальное замещение (SR)Радикальное галогенирование алканов
Галогенирующие реагенты: Cl2, Br2
Условия радикальных процессов:
hν, H2O2 (перекисные соединения),
T0C (> 2000C)
Механизм радикального замещения
Инициирование цепи
Образование радикала - лимитирующая стадия
Рост цепи
Обрыв цепи
4.
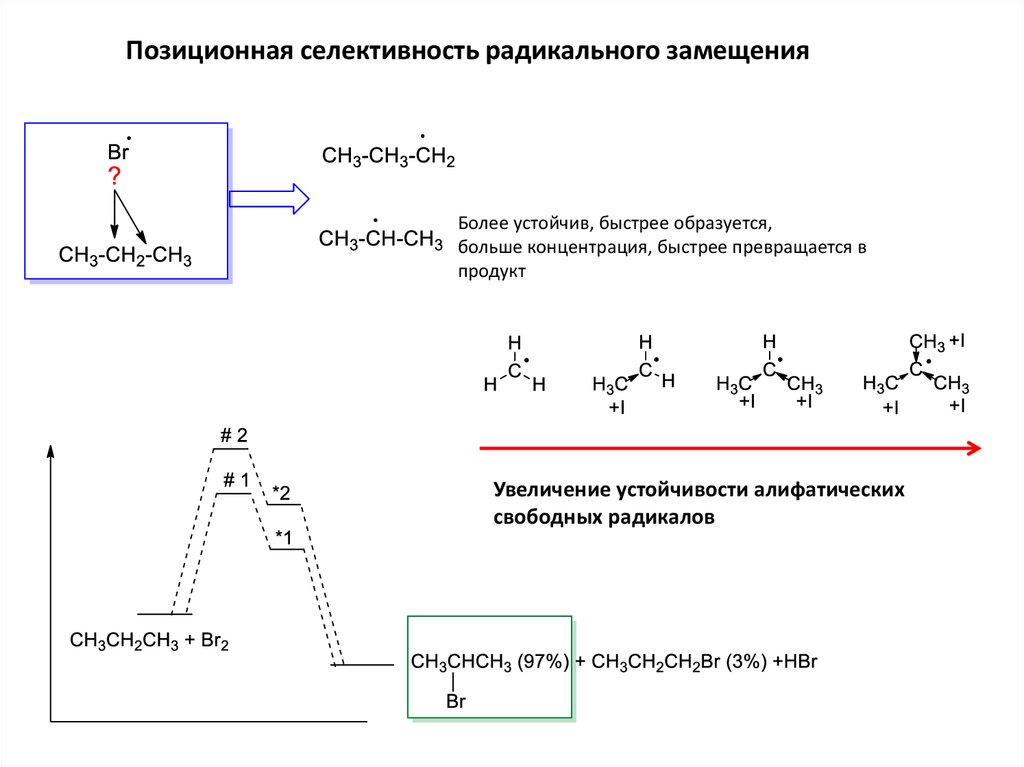
Позиционная селективность радикального замещенияБолее устойчив, быстрее образуется,
больше концентрация, быстрее превращается в
продукт
Увеличение устойчивости алифатических
свободных радикалов
5.
Другие реакции радикального замещенияалкан
реaгент
условия
продукт
реакция
пропан
HNO3 разб.
1400C, Р
2-нитропропан
нитрование
пропан
SO2, Cl2
hν
сульфохлорирование
пропан-2-сульфонил
хлорид
пропан
SO2, O2
сульфоокисление
hν
пропан-2-сульфоновая
кислота
Задание
Задача 1.5, 1.6 ИДЗ «Предельные углеводороды» (стр. 9 - 11)
6.
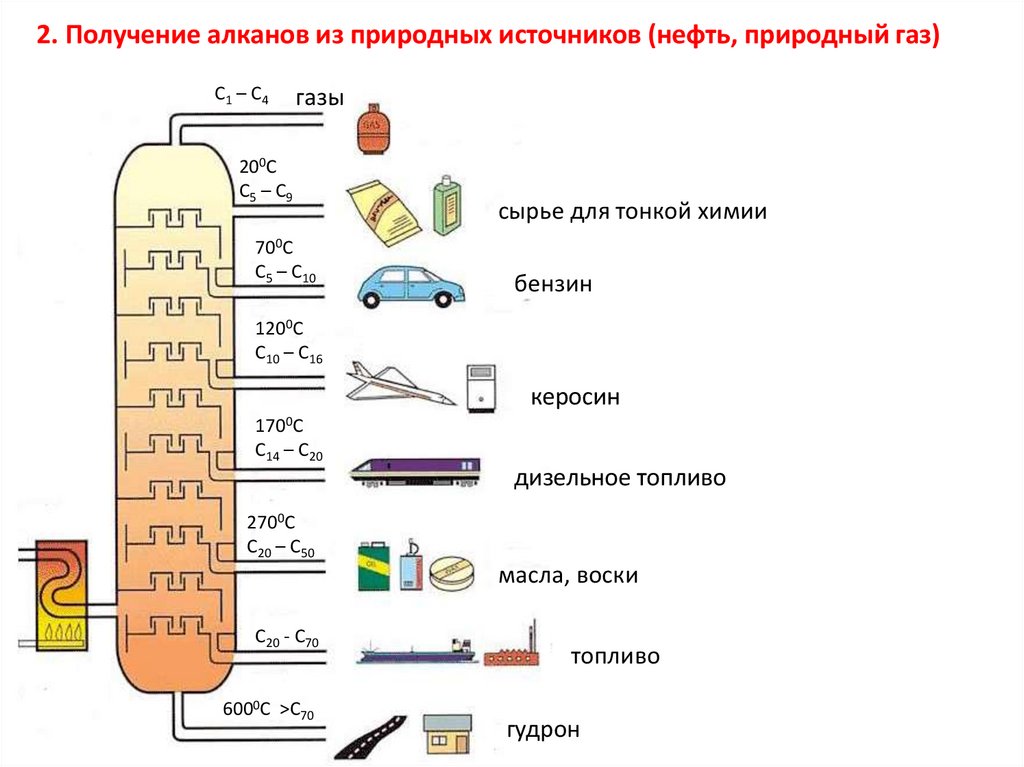
2. Получение алканов из природных источников (нефть, природный газ)C1 – C4
газы
200C
C5 – C9
700C
C5 – C10
сырье для тонкой химии
бензин
1200C
C10 – C16
керосин
1700C
C14 – C20
дизельное топливо
2700C
C20 – C50
масла, воски
C20 - C70
6000C >C70
топливо
гудрон
7.
3. Промышленно значимые процессы с участим алканов1. Окисление алканов (горение)
RCH2 + O2
t0 C
CO2 + H2O + Q
Алканы – ценное высококалорийное топливо
Радикальный процесс;
механизм реакции сложен,
до конца полностью не установлен
Антидeтонационные свойства топлива сильно зависят от структуры углеводородов
бензиновой фракции нефти
Относительная антидетонационная способность топлива характеризуется
октановым числом ОЧ):
н-гептан (ОЧ) = 0 (сильно детонирует)
изооктан (2,2,4-триметилпентан) ОЧ = 100.
2. Дегидрирование алканов
этан
этен (этилен)
8.
3. Пиролиз углеводородного сырьяПиролиз (от греч. πῦρ — огонь, жар и λύσις — разложение, распад) — термическое разложение
Пиролиз углеводородного сырья - термическое разложение органических
природных соединений при недостатке воздуха.
CH3CH2CH3 → CH2=CH2 + CH4
CH3CH2CH3 → CH3CH=CH2 + H2
Получение этилена почти 100 % мирового
производства и пропилена или более 67 %
мирового производства
В промышленных условиях пиролиз углеводородов осуществляют при температурах 800—9000С.
Большинство исследователей придерживаются теории цепного свободно-радикального механизма
разложения
9.
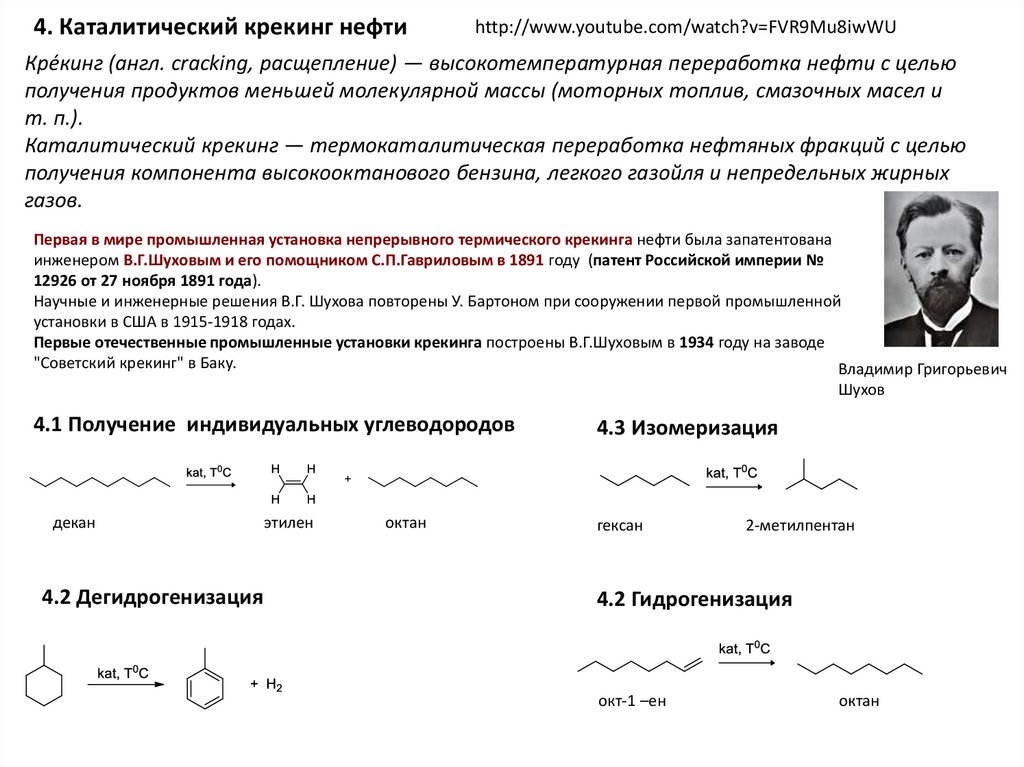
4. Каталитический крекинг нефтиhttp://www.youtube.com/watch?v=FVR9Mu8iwWU
Кре́кинг (англ. cracking, расщепление) — высокотемпературная переработка нефти с целью
получения продуктов меньшей молекулярной массы (моторных топлив, смазочных масел и
т. п.).
Каталитический крекинг — термокаталитическая переработка нефтяных фракций с целью
получения компонента высокооктанового бензина, легкого газойля и непредельных жирных
газов.
Первая в мире промышленная установка непрерывного термического крекинга нефти была запатентована
инженером В.Г.Шуховым и его помощником С.П.Гавриловым в 1891 году (патент Российской империи №
12926 от 27 ноября 1891 года).
Научные и инженерные решения В.Г. Шухова повторены У. Бартоном при сооружении первой промышленной
установки в США в 1915-1918 годах.
Первые отечественные промышленные установки крекинга построены В.Г.Шуховым в 1934 году на заводе
"Советский крекинг" в Баку.
Владимир Григорьевич
Шухов
4.1 Получение индивидуальных углеводородов
декан
4.2 Дегидрогенизация
этилен
октан
4.3 Изомеризация
гексан
2-метилпентан
4.2 Гидрогенизация
окт-1 –ен
октан
10.
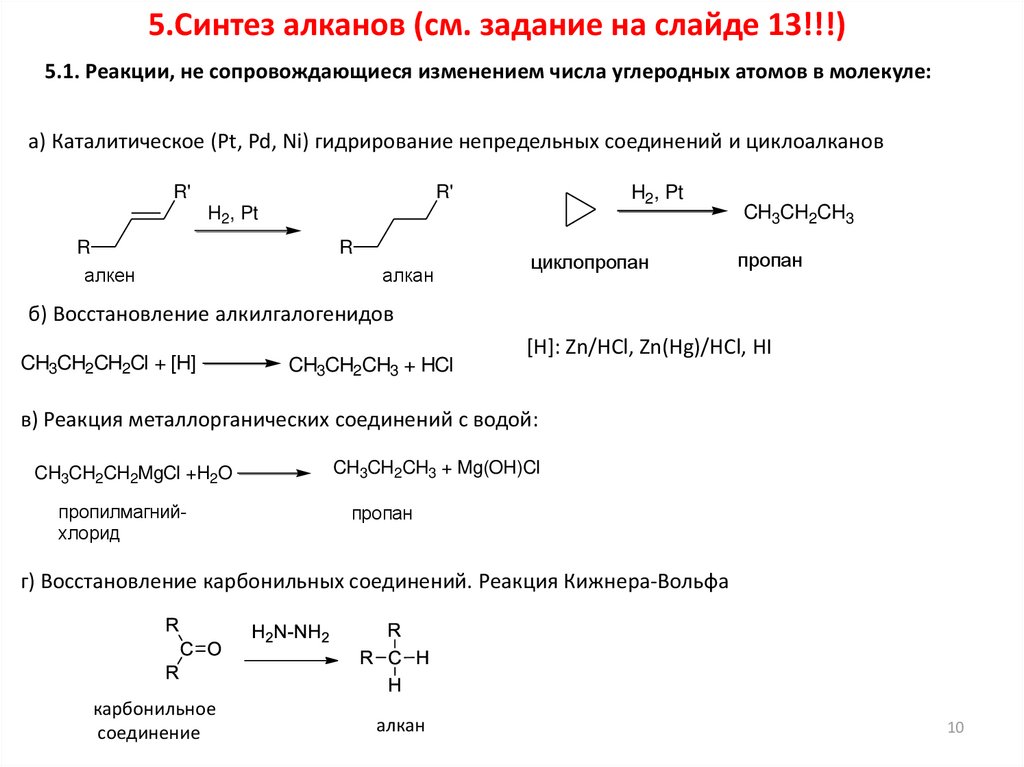
5.Синтез алканов (см. задание на слайде 13!!!)5.1. Реакции, не сопровождающиеся изменением числа углеродных атомов в молекуле:
а) Каталитическое (Pt, Pd, Ni) гидрирование непредельных соединений и циклоалканов
R'
R'
H2, Pt
H2, Pt
R
алкен
R
алкан
циклопропан
CH3CH2CH3
пропан
б) Восстановление алкилгалогенидов
CH3CH2CH2Cl + [H]
CH3CH2CH3 + HCl
[H]: Zn/HCl, Zn(Hg)/HCl, HI
в) Реакция металлорганических соединений с водой:
CH3CH2CH2MgCl +H2O
пропилмагнийхлорид
CH3CH2CH3 + Mg(OH)Cl
пропан
г) Восстановление карбонильных соединений. Реакция Кижнера-Вольфа
карбонильное
соединение
алкан
10
11.
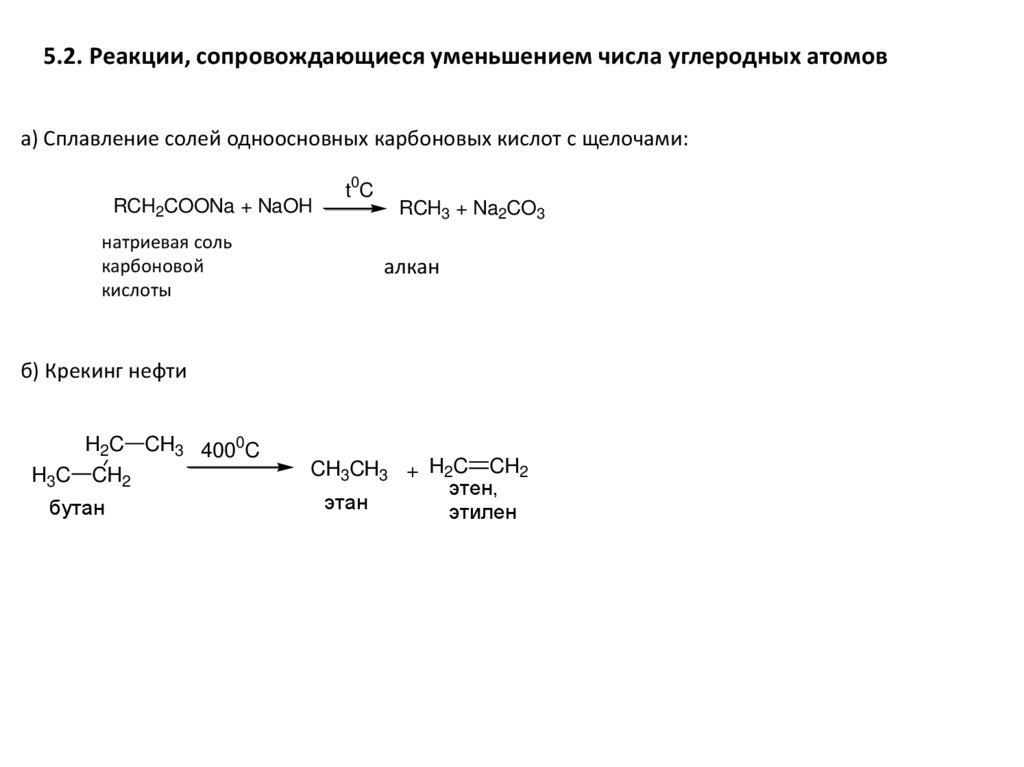
5.2. Реакции, сопровождающиеся уменьшением числа углеродных атомова) Сплавление солей одноосновных карбоновых кислот с щелочами:
RCH2COONa + NaOH
натриевая соль
карбоновой
кислоты
t0C
RCH3 + Na2CO3
алкан
б) Крекинг нефти
H2C CH3 4000C
H3C CH2
бутан
CH3CH3 + H2C CH2
этен,
этан
этилен
12.
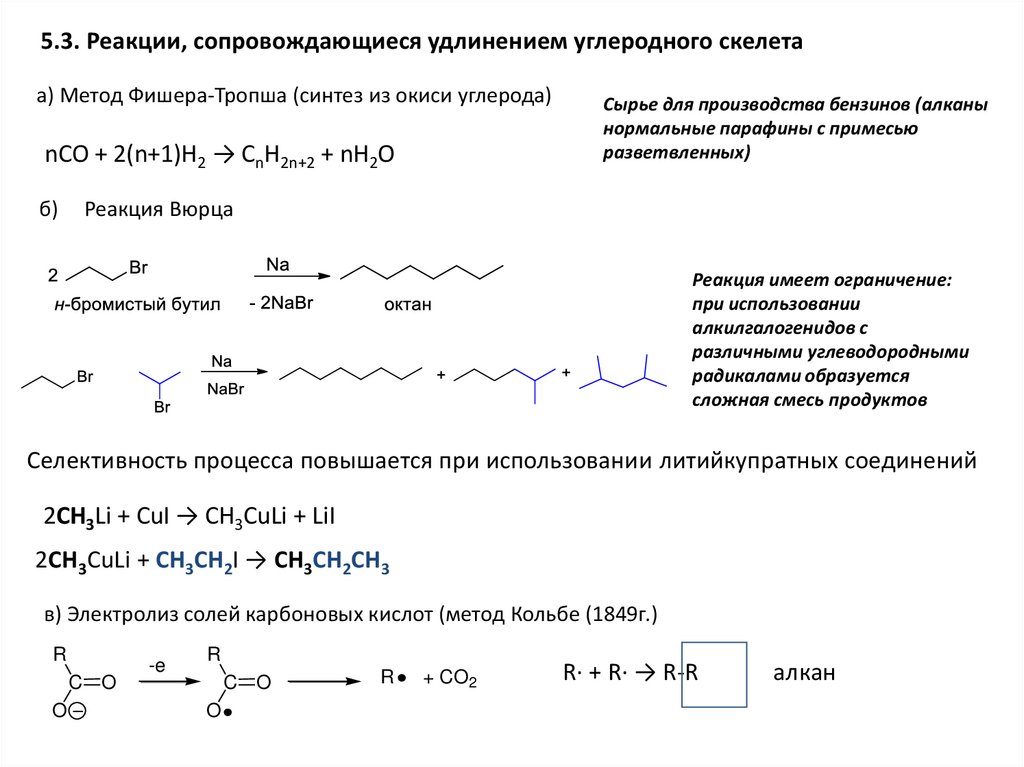
5.3. Реакции, сопровождающиеся удлинением углеродного скелетаа) Метод Фишера-Тропша (синтез из окиси углерода)
nCO + 2(n+1)H2 → CnH2n+2 + nH2O
б)
Cырье для производства бензинов (алканы
нормальные парафины с примесью
разветвленных)
Реакция Вюрца
Реакция имеет ограничение:
при использовании
алкилгалогенидов с
различными углеводородными
радикалами образуется
сложная смесь продуктов
Селективность процесса повышается при использовании литийкупратных соединений
2CH3Li + CuI → CH3CuLi + LiI
2CH3CuLi + CH3CH2I → CH3CH2CH3
в) Электролиз солей карбоновых кислот (метод Кольбе (1849г.)
R
C O
O
-e
R
C O
O
R
+ CO2
R· + R· → R-R
алкан
13.
ЗаданиеЗадача 1.9 ИДЗ «Предельные углеводороды» (стр. 14 - 17)
Дополнительные 3 балла можно получить, решив задачу 1.10.






 Химия
Химия








