Похожие презентации:
Электролиз. Электролизеры
1. ЭЛЕКТРОЛИЗ
,2. Электролиз - окислительно-восстановительные процессы, протекающие на электродах при пропускании постоянного электрического тока
черезраствор или расплав электролита.
3.
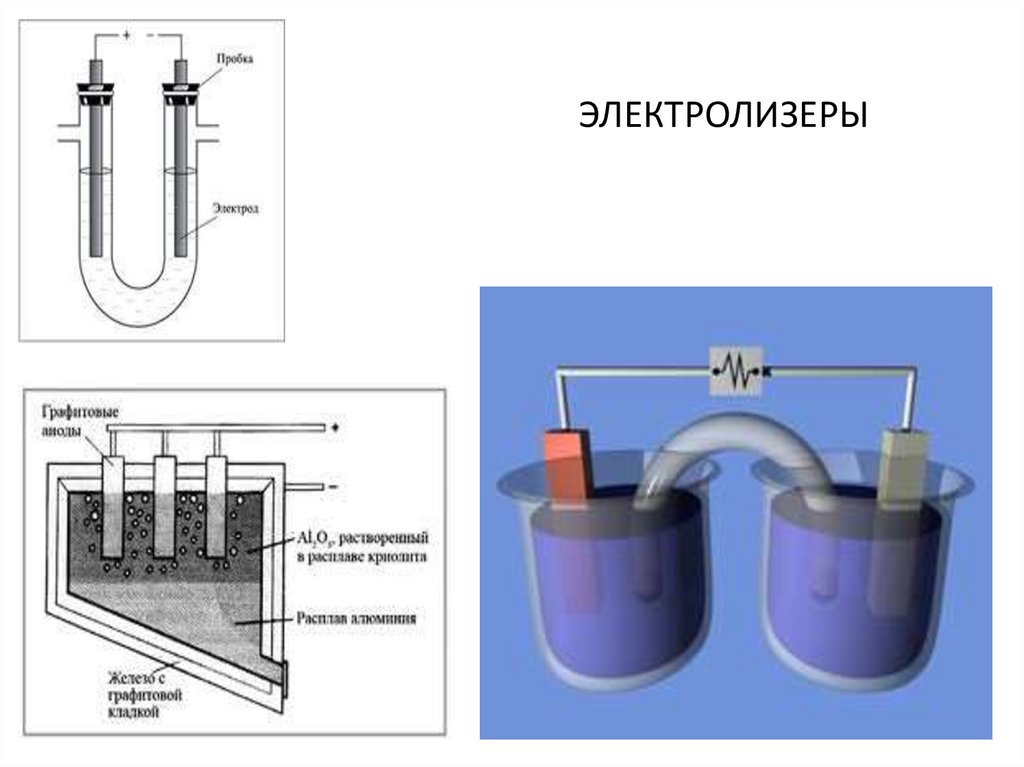
Процесс перехода электрической энергии вхимическую осуществляется в электролизере.
При электролизе катод заряжен отрицательно, а
анод – положительно. Катод соединяется с
отрицательным полюсом источника электрического
тока, а анод подключается к его положительному
полюсу.
4.
ЭЛЕКТРОЛИЗЕРЫ5. Электролиз расплавов
• Пример электролиза расплава хлорида меди (II):CuCl2 = Cu +CL2 ↑
CuCl2 → Cu2+ + 2ClK-
Cu2+ +2e = Cu0
A+
Cl- - e = Cl0
2Cl- = Cl2 ↑
6.
1.Соль активного металла и бескислородной кислотыKCl ↔ K+ + Cl−
K"катод"(-): K+ + 1e = K0
A"анод"(+): 2Cl− — 1e = Cl20;
Вывод: 2КCl → (электролиз) 2K + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
CsOH ↔ Cs+ + OH−
K(-): Cs+ +1e =Cs0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4CsOH→ 4Cs + 2H2O + O2
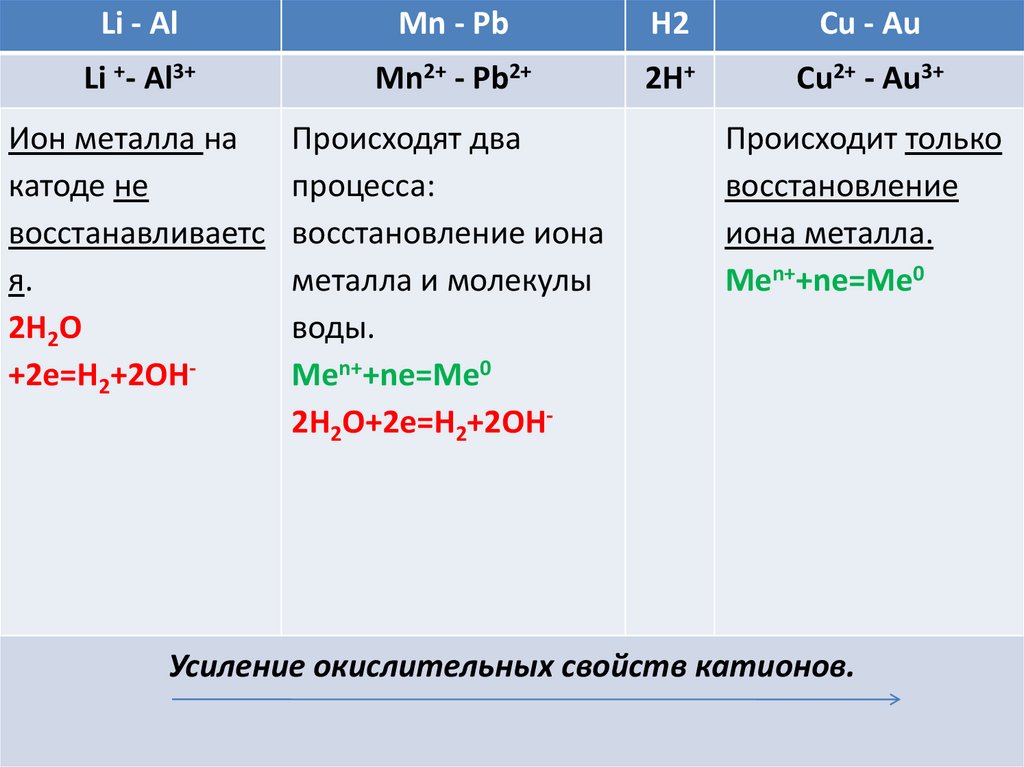
7. Электролиз растворов
Катодные процессы определяютсяокислительной активностью катионов
Рассмотрим таблицу:
8.
Li - AlMn - Pb
H2
Cu - Au
Li +- Al3+
Mn2+ - Pb2+
2H+
Cu2+ - Au3+
Ион металла на
катоде не
восстанавливаетс
я.
2H2O
+2e=H2+2OH-
Происходят два
процесса:
восстановление иона
металла и молекулы
воды.
Men++ne=Me0
2H2O+2e=H2+2OH-
Происходит только
восстановление
иона металла.
Men++ne=Me0
Усиление окислительных свойств катионов.
9.
Электролиз раствора иодида калияАнодные процессы зависят не только от
характера аниона, но и от материала анода.
Если анод растворим, то при электролизе
происходит окисление металла анода:
Me0 - ne = Men+
анод переходит в
раствор
10. В случае нерастворимого анода возможны следующие процессы:
Бескислородный анион(кроме F-)
S2-; I-; Br-; ClОкисление аниона:
Am- - e = A0
Кислородсодержащий
анион
OH-; SO42-; NO3-; CO32PO43-; FВ щелочной среде:
4ОН- - 4е = О2 + 2Н2О
В кислотной и нейтральной
средах:
2Н2О – 4е = О2 + 4Н+
Ослабление восстановительной активности анионов
11.
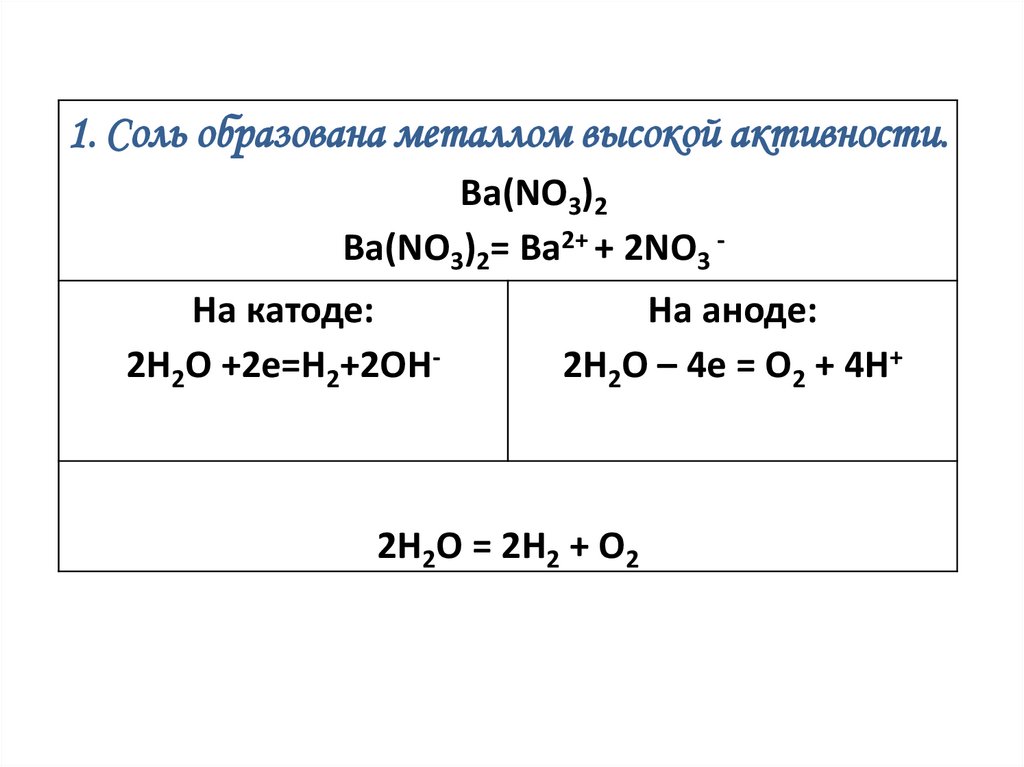
1. Соль образована металлом высокой активности.Ba(NO3)2
Ba(NO3)2= Ba2+ + 2NO3 -
На катоде:
2H2O +2e=H2+2OH-
На аноде:
2Н2О – 4е = О2 + 4Н+
2H2O = 2H2 + O2
12.
2. Соль образована металлом среднейактивности.
FeCl2
FeCl2 = Fe2+ + 2ClНа катоде:
На аноде:
А) 2H2O+2e=H2+2OH2Cl- - 2e = Cl2
Б) Fe2+ +2e = Fe0
13.
3. Соль образована металлом низкойактивности.
CuSO4
CuSO4 = Cu2+ + SO42На катоде:
На аноде:
Cu2+ + 2e = Cu0
2Н2О – 4е = О2 + 4Н+
2CuSO4 + 2H2O = O2 + 2H2SO4 + 2Cu
14. Применение электролиза:
• При электролизе расплавов солей ищелочей в промышленности получают
активные металлы ( щелочные,
щелочноземельные, бериллий, магний,
алюминий).
• Электролиз растворов лежит в основе
гальванотехники:
15.
Гальваностегия – нанесение на поверхность металласлоев других металлов с целью предохранения изделий
от коррозии, придания твердости, в декоративных
целях.
Гальванопластика – создание металлических копий с
рельефных предметов, матриц
- электрополирование стали, оксидирование
(покрытие оксидной пленкой),
- получение фтора, хлора, водорода высокой
чистоты, перекиси водорода, щелочей.
- химический источник электрического тока лежит в
основе аккумулятора – прибора, позволяющего
накапливать электроэнергию.












 Химия
Химия








