Похожие презентации:
Общая характеристика неметаллов
1. Тема урока: Общая характеристика неметаллов.
2.
Положение неметаллов в ПСХЭ.3.
Особенности атомного строения элементов-неметаллов.● Небольшой атомный радиус (в сравнении
с радиусами атомов-металлов одного с ними
периода).
Si ) ) )
Br+35 ) ) ) )
+14
2 8
6
2 8 18 7
● Большее число электронов на внешнем уровне
N ))
(4-8 е).
+7
2 5
● Элементы-неметаллы расположены только
в главных подгруппах, значит, происходит
заполнение электронами только внешнего
As ) ) ) ) энергетического уровня.
+33
2 8 18 5
Cl +17 ) ) )
2 8 7
● Для атомов-неметаллов характерны высокие
значения ЭО.
Se ) ) ) )
+34
2 8 18 6
4. Электроотрицательность – это свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие
электронные пары (мера неметалличности, т.е. чемболее электроотрицателен данный химический элемент,
тем ярче выражены неметаллические свойства).
H Si P C S Br Cl N O F
усиление
ЭО
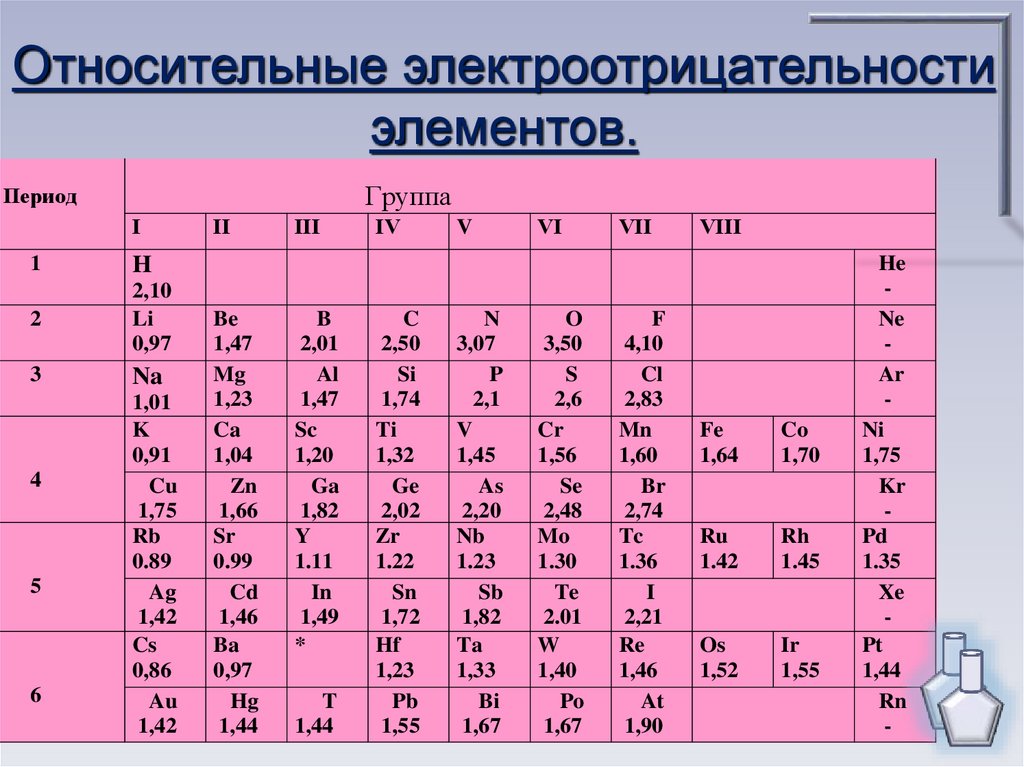
5.
Относительные электроотрицательностиэлементов.
Группа
Период
Ι
1
H
2
2,10
Li
0,97
3
Na
4
5
6
1,01
K
0,91
Cu
1,75
Rb
0.89
Ag
1,42
Cs
0,86
Au
1,42
ΙΙ
Be
1,47
Mg
1,23
Ca
1,04
Zn
1,66
Sr
0.99
Cd
1,46
Ba
0,97
Hg
1,44
ΙΙΙ
B
2,01
Al
1,47
Sc
1,20
Ga
1,82
Y
1.11
In
1,49
*
T
1,44
ΙV
C
2,50
Si
1,74
Ti
1,32
Ge
2,02
Zr
1.22
Sn
1,72
Hf
1,23
Pb
1,55
V
N
3,07
P
2,1
V
1,45
As
2,20
Nb
1.23
Sb
1,82
Ta
1,33
Bi
1,67
VΙ
O
3,50
S
2,6
Cr
1,56
Se
2,48
Mo
1.30
Te
2.01
W
1,40
Po
1,67
VΙΙ
F
4,10
Cl
2,83
Mn
1,60
Br
2,74
Tc
1.36
I
2,21
Re
1,46
At
1,90
VΙΙΙ
Fe
1,64
Co
1,70
Ru
1.42
Rh
1.45
Os
1,52
Ir
1,55
He
Ne
Ar
Ni
1,75
Kr
Pd
1.35
Xe
Pt
1,44
Rn
-
6.
Характеристика простых веществ неметаллов.ХАРАКТЕРНЫ
ТРИ АГРЕГАТНЫХ СОСТОЯНИЯ
( ПРИ Н.У. )
ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ
ВЕЩЕСТВ - НЕМЕТАЛЛОВ
РАЗНООБРАЗНАЯ ЦВЕТОВАЯ
ПАЛИТРА
ШИРОКИЙ СПЕКТР
ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
от 3800º С ( графит) до -210 º С ( N2 )
7.
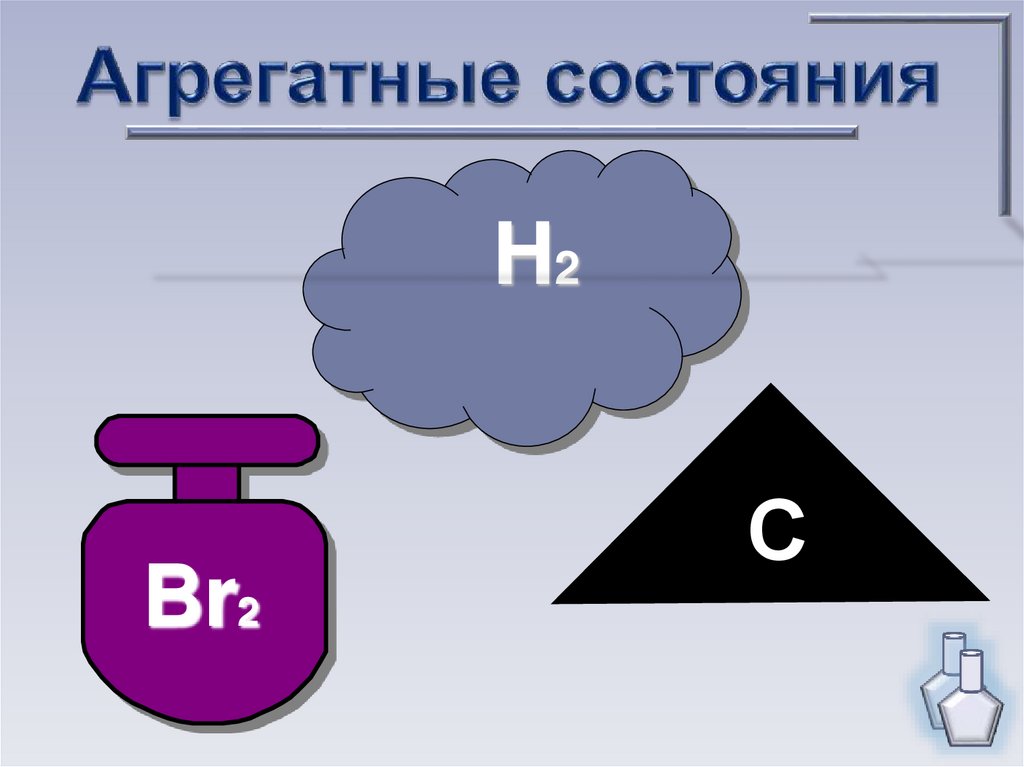
H2Br2
С
8.
ЦВЕТОВАЯ ПАЛИТРА.АЗОТ
ХЛОР
Й О Д
ФОСФОР КРАСНЫЙ
СЕРА
БРОМ
9.
??
В чем причина
разнообразия
физических
свойств
у неметаллов ?
?
10.
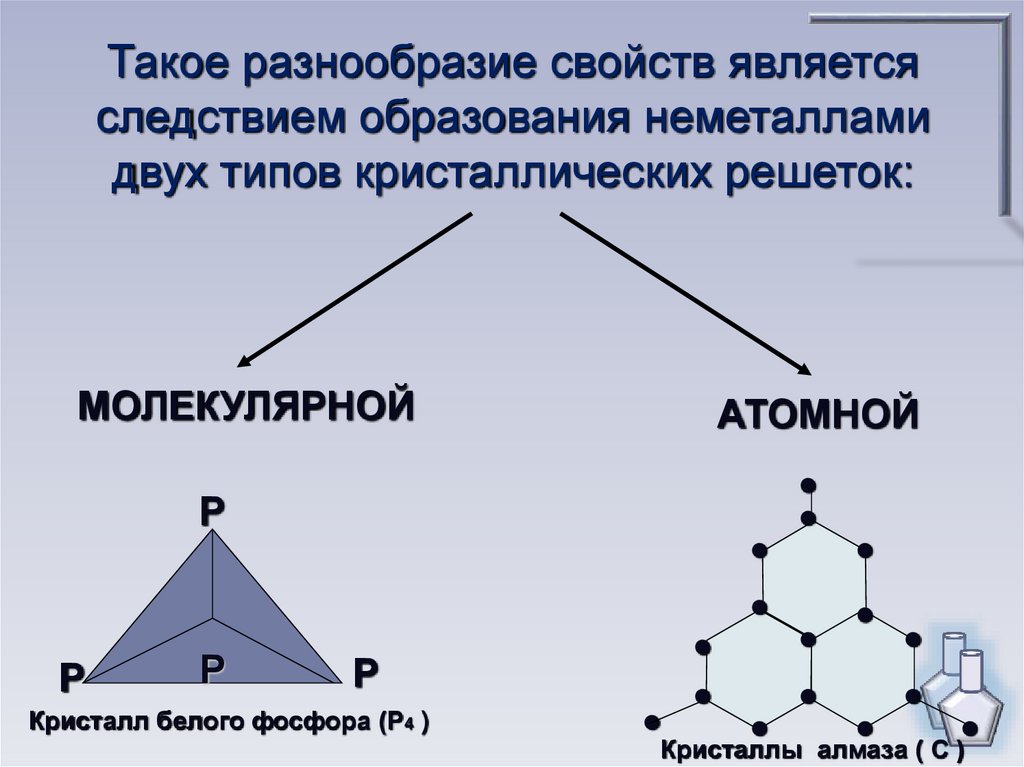
Такое разнообразие свойств являетсяследствием образования неметаллами
двух типов кристаллических решеток:
МОЛЕКУЛЯРНОЙ
АТОМНОЙ
Р
Р
Р
Р
Кристалл белого фосфора (Р4 )
Кристаллы алмаза ( С )
11.
Что такоеаллотропия?
Аллотропия – это способность
одного и того же химического
элемента образовывать несколько
простых веществ.
12.
Каковыпричины
аллотропии
неметаллов?
13.
Аллотропия неметаллов является следствием:Разных типов
кристаллических
решеток и разной
структуры
кристаллических
решеток
Разного состава
молекул
аллотропных
модификаций
( О2 и О3).
14.
Типы кристаллическихрешеток
АТОМНАЯ
МОЛЕКУЛЯРНАЯ
● Белый фосфор (Р4)
● Алмаз (С)
● Графит (С)
● Кислород (О2)
● Азот ( N2)
ТЕТРАЭДРИЧЕСКАЯ
СТРУКТУРА
АТОМНОЙ
РЕШЕТКИ
СЛОИСТАЯ
СТРУКТУРА
АТОМНОЙ
РЕШЕТКИ
15.
АЛ
М
А
З
16.
17.
ГР
А
Ф
И
Т
18.
19.
Спасибо завнимание!














 Химия
Химия








