Похожие презентации:
Кислоты
1.
Кислоты — это сложные вещества,молекулы которых состоят из атомов
водорода и кислотного остатка.
2.
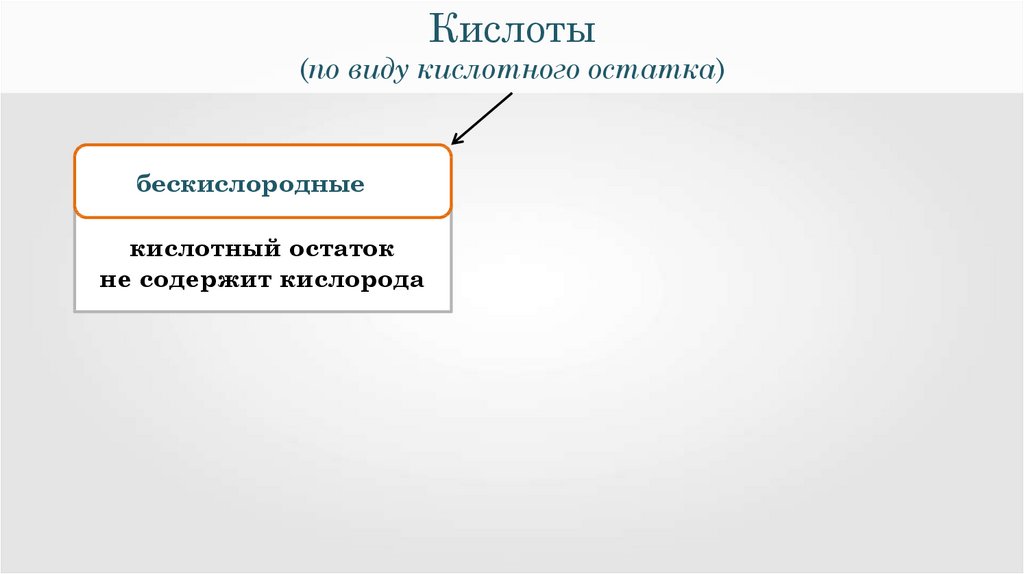
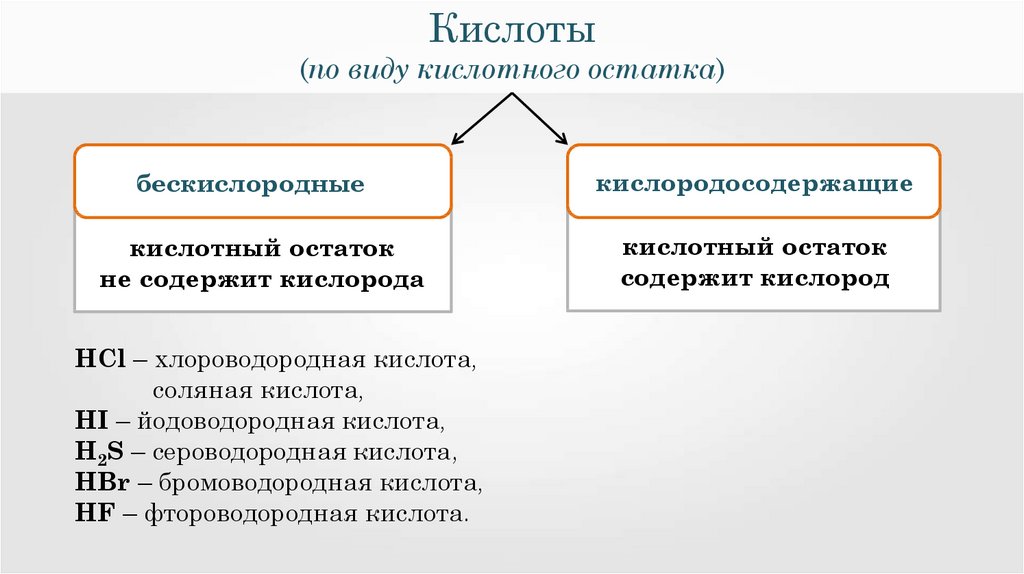
Кислоты(по виду кислотного остатка)
3.
Кислоты(по виду кислотного остатка)
м
бескислородные
кислотный остаток
не содержит кислорода
4.
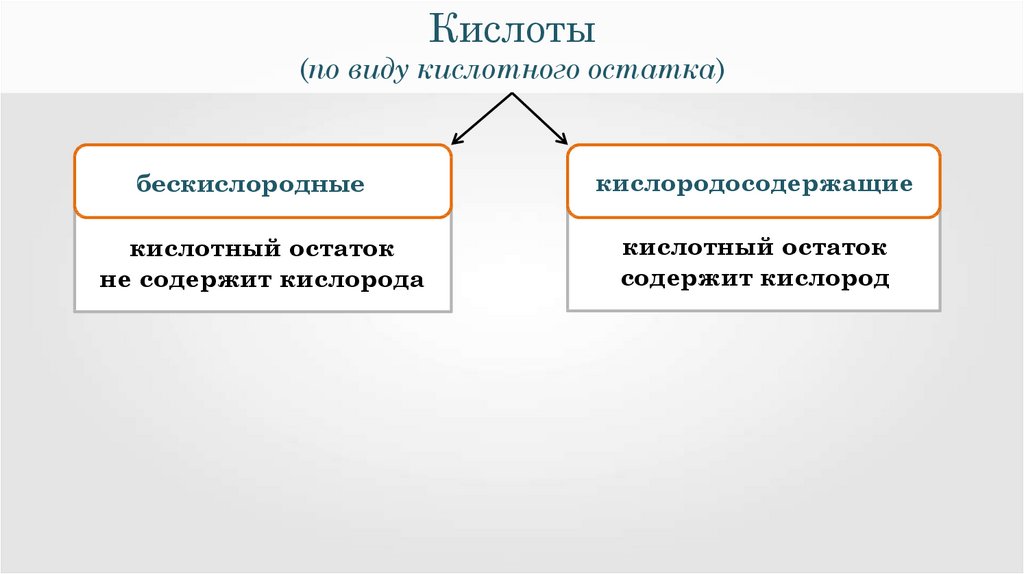
Кислоты(по виду кислотного остатка)
м
бескислородные
кислотный остаток
не содержит кислорода
м
кислородосодержащие
кислотный остаток
содержит кислород
5.
Кислоты(по виду кислотного остатка)
м
бескислородные
кислотный остаток
не содержит кислорода
HCl – хлороводородная кислота,
соляная кислота,
HI – йодоводородная кислота,
H2S – сероводородная кислота,
HBr – бромоводородная кислота,
HF – фтороводородная кислота.
м
кислородосодержащие
кислотный остаток
содержит кислород
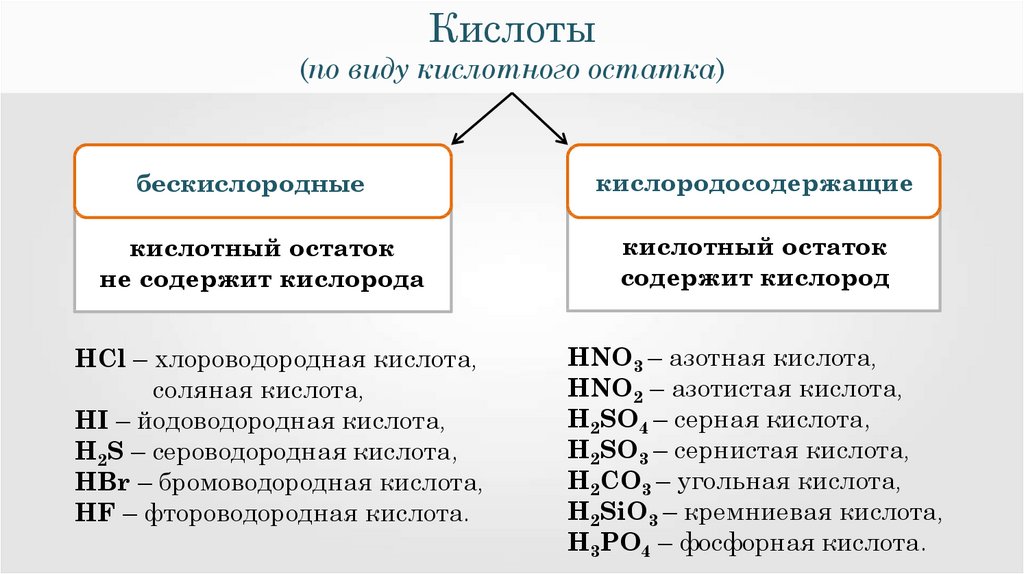
6.
Кислоты(по виду кислотного остатка)
м
бескислородные
кислотный остаток
не содержит кислорода
HCl – хлороводородная кислота,
соляная кислота,
HI – йодоводородная кислота,
H2S – сероводородная кислота,
HBr – бромоводородная кислота,
HF – фтороводородная кислота.
м
кислородосодержащие
кислотный остаток
содержит кислород
HNO3 – азотная кислота,
HNO2 – азотистая кислота,
H2SO4 – серная кислота,
H2SO3 – сернистая кислота,
H2CO3 – угольная кислота,
H2SiO3 – кремниевая кислота,
H3PO4 – фосфорная кислота.
7.
Кислоты(по заряду кислотных остатков)
8.
Кислоты(по заряду кислотных остатков)
одноосновные
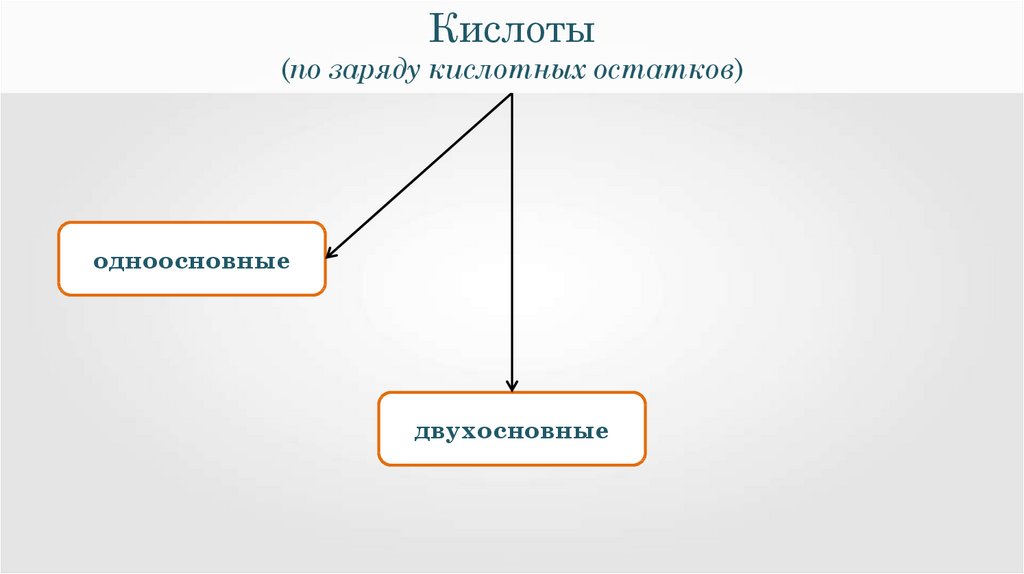
9.
Кислоты(по заряду кислотных остатков)
одноосновные
двухосновные
10.
Кислоты(по заряду кислотных остатков)
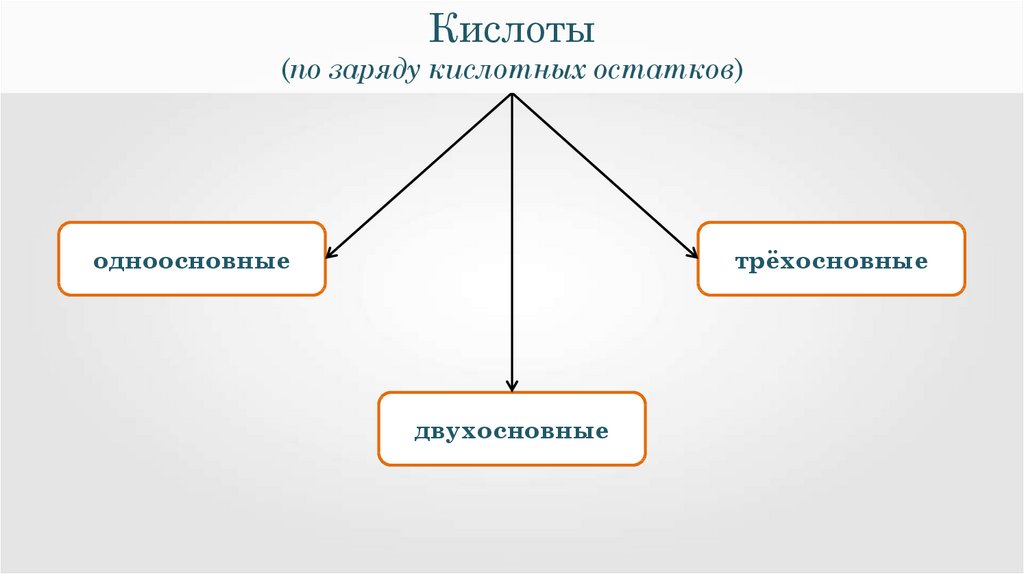
одноосновные
трёхосновные
двухосновные
11.
Одноосновные кислотыЗаряд кислотного остатка -1,
который соответственно
соединяется с одним атомом
водорода.
12.
Одноосновные кислотыЗаряд кислотного остатка -1,
который соответственно
соединяется с одним атомом
водорода.
HCl — cоляная кислота,
HNO3 — азотная кислота.
13.
Двухосновные кислотыЗаряд кислотного остатка -2, который
соответственно соединяется с двумя
атомами водорода.
14.
Двухосновные кислотыЗаряд кислотного остатка -2, который
соответственно соединяется с двумя
атомами водорода.
H2SO4 — серная кислота,
H2CO3 — угольная кислота.
15.
Трёхосновные кислотыЗаряд кислотного остатка -3, который
соответственно соединяется с тремя
атомами водорода.
16.
Трёхосновные кислотыЗаряд кислотного остатка -3, который
соответственно соединяется с тремя
атомами водорода.
H3PO4 — фосфорная кислота.
17.
Кислоты(по растворимости в воде)
18.
Кислоты(по растворимости в воде)
растворимые
19.
Кислоты(по растворимости в воде)
растворимые
нерастворимые
20.
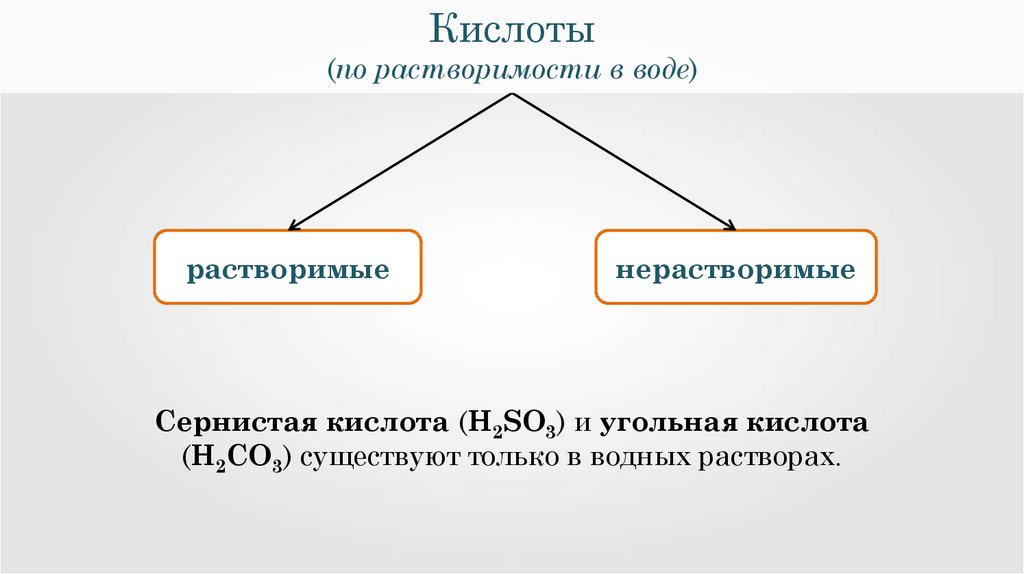
Кислоты(по растворимости в воде)
растворимые
нерастворимые
Сернистая кислота (H2SO3) и угольная кислота
(H2CO3) существуют только в водных растворах.
21.
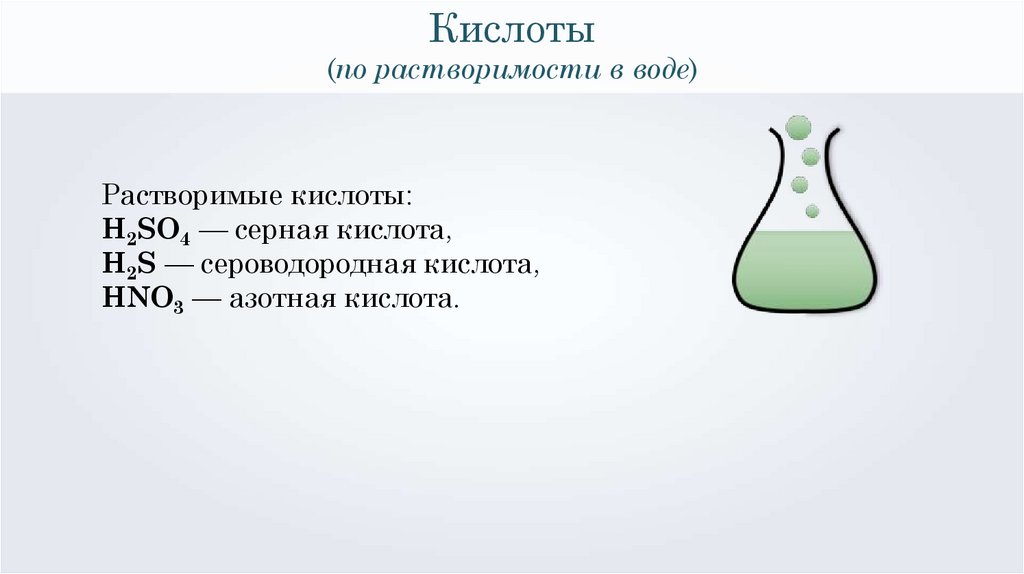
Кислоты(по растворимости в воде)
Растворимые кислоты:
H2SO4 — серная кислота,
H2S — сероводородная кислота,
HNO3 — азотная кислота.
22.
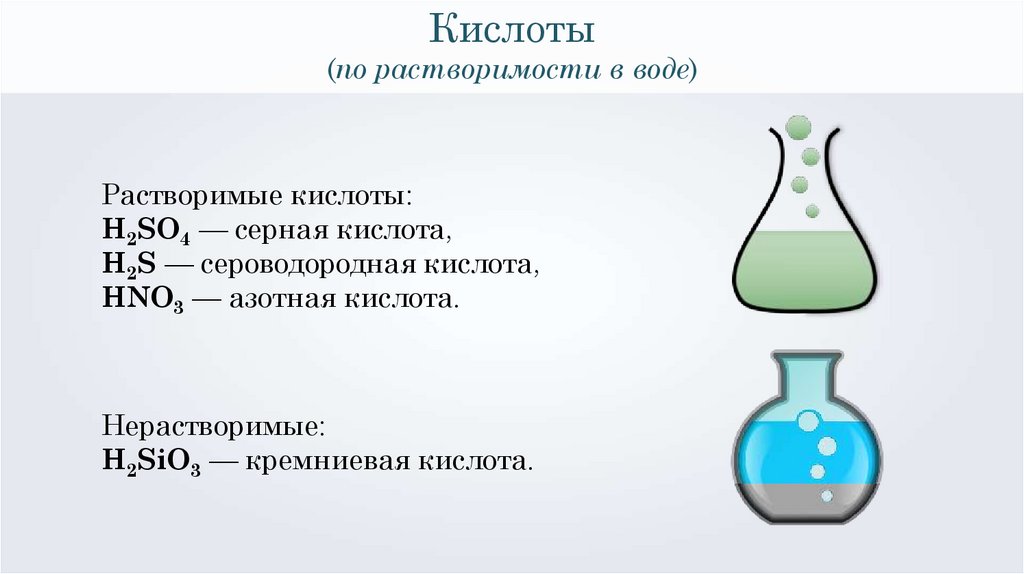
Кислоты(по растворимости в воде)
Растворимые кислоты:
H2SO4 — серная кислота,
H2S — сероводородная кислота,
HNO3 — азотная кислота.
Нерастворимые:
H2SiO3 — кремниевая кислота.
23.
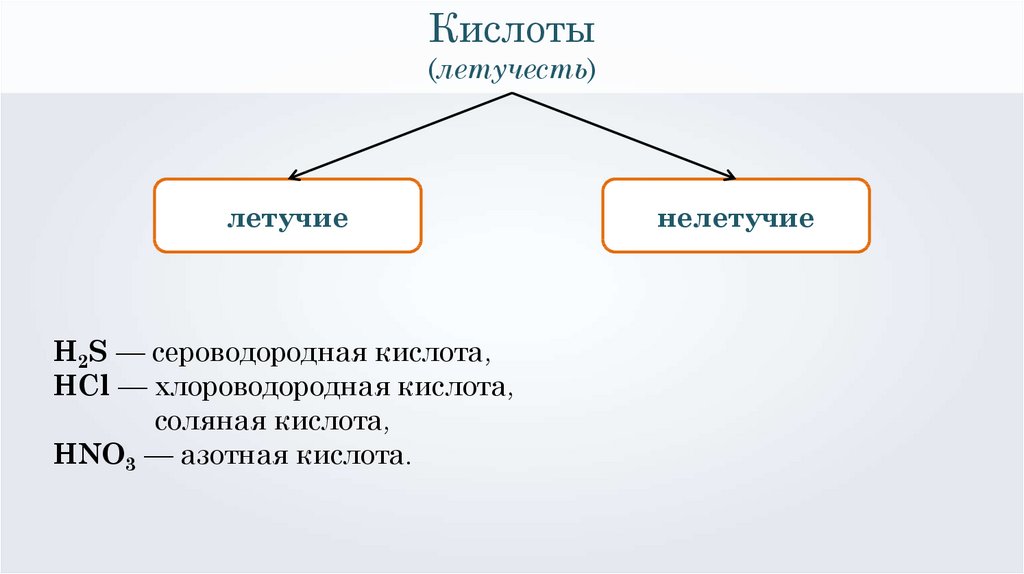
Кислоты(летучесть)
24.
Кислоты(летучесть)
летучие
25.
Кислоты(летучесть)
летучие
нелетучие
26.
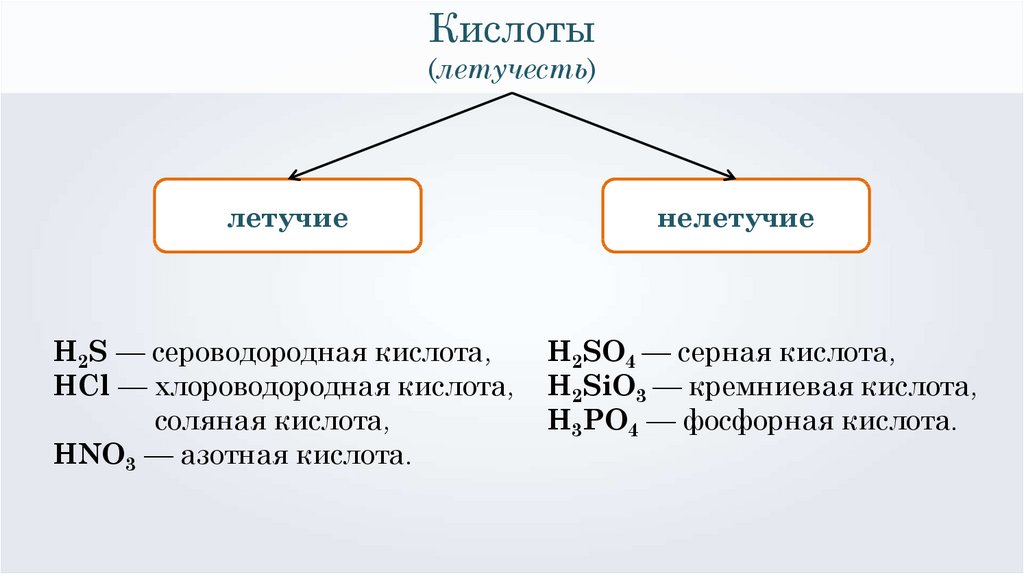
Кислоты(летучесть)
летучие
H2S — сероводородная кислота,
HCl — хлороводородная кислота,
соляная кислота,
HNO3 — азотная кислота.
нелетучие
27.
Кислоты(летучесть)
летучие
H2S — сероводородная кислота,
HCl — хлороводородная кислота,
соляная кислота,
HNO3 — азотная кислота.
нелетучие
H2SO4 — серная кислота,
H2SiO3 — кремниевая кислота,
H3PO4 — фосфорная кислота.
28.
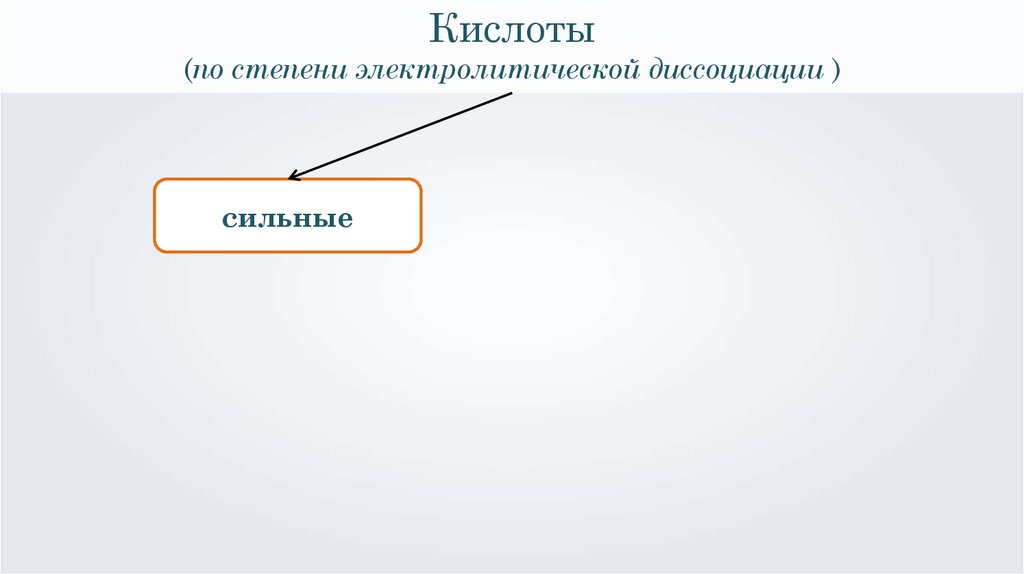
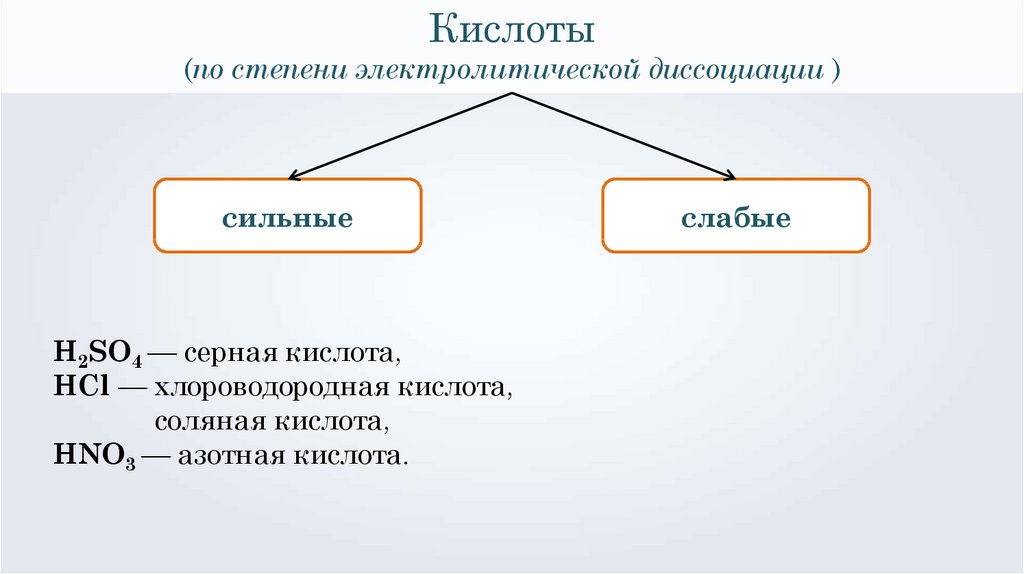
Кислоты(по степени электролитической диссоциации )
29.
Кислоты(по степени электролитической диссоциации )
сильные
30.
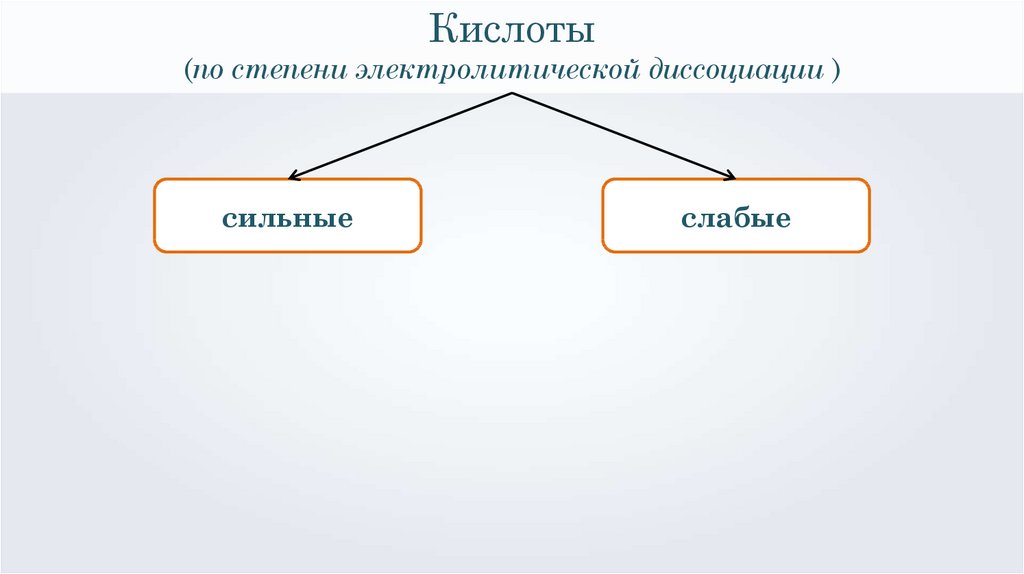
Кислоты(по степени электролитической диссоциации )
сильные
слабые
31.
Кислоты(по степени электролитической диссоциации )
сильные
H2SO4 — серная кислота,
HCl — хлороводородная кислота,
соляная кислота,
HNO3 — азотная кислота.
слабые
32.
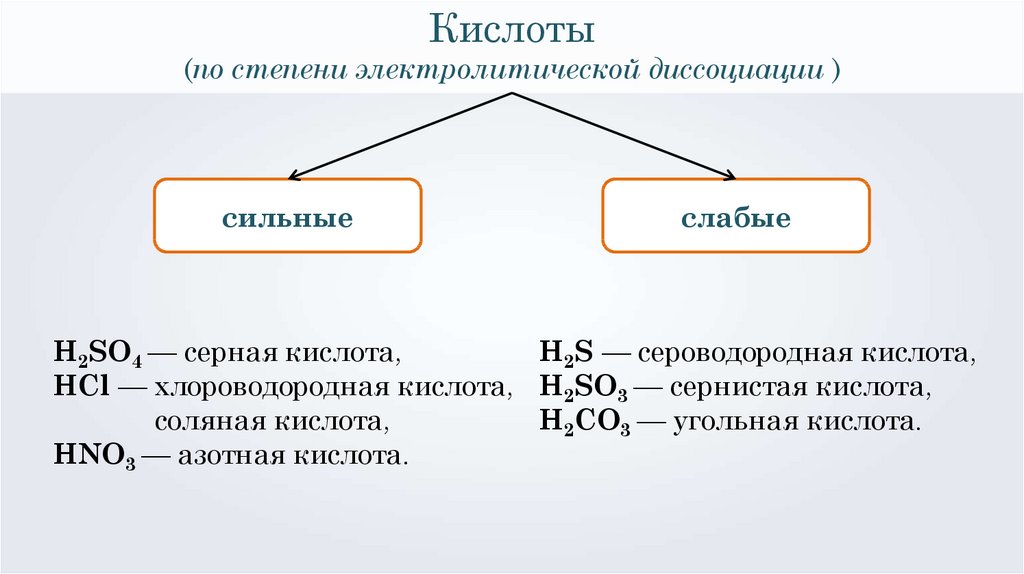
Кислоты(по степени электролитической диссоциации )
сильные
слабые
H2SO4 — серная кислота,
H2S — сероводородная кислота,
HCl — хлороводородная кислота, H2SO3 — сернистая кислота,
соляная кислота,
H2CO3 — угольная кислота.
HNO3 — азотная кислота.
33.
Стабильность кислоты — этостепень устойчивости её состава при
обычных условиях.
34.
Кислоты(по стабильности )
35.
Кислоты(по стабильности )
стабильные
36.
Кислоты(по стабильности )
стабильные
нестабильные
37.
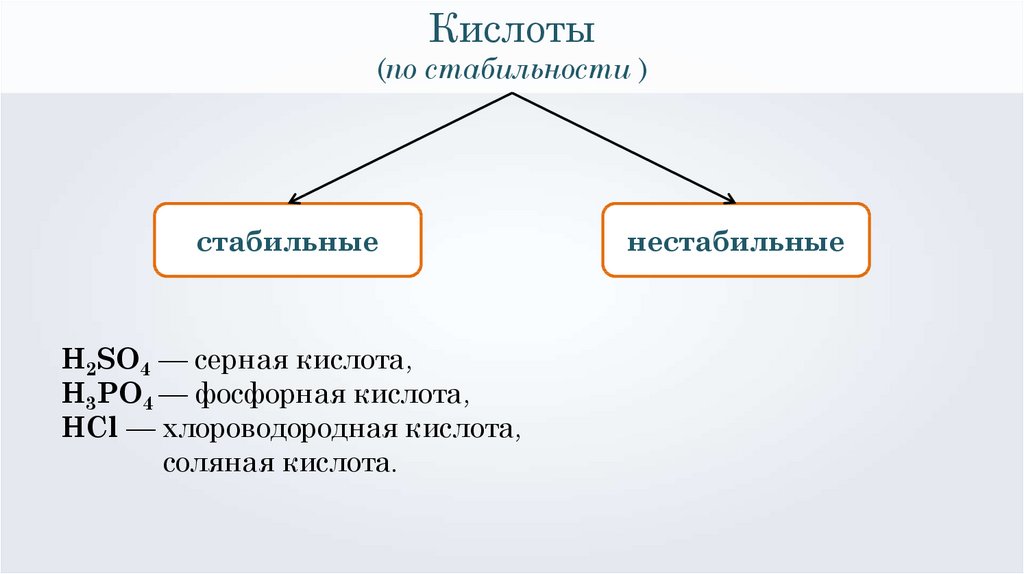
Кислоты(по стабильности )
стабильные
H2SO4 — серная кислота,
H3PO4 — фосфорная кислота,
HCl — хлороводородная кислота,
соляная кислота.
нестабильные
38.
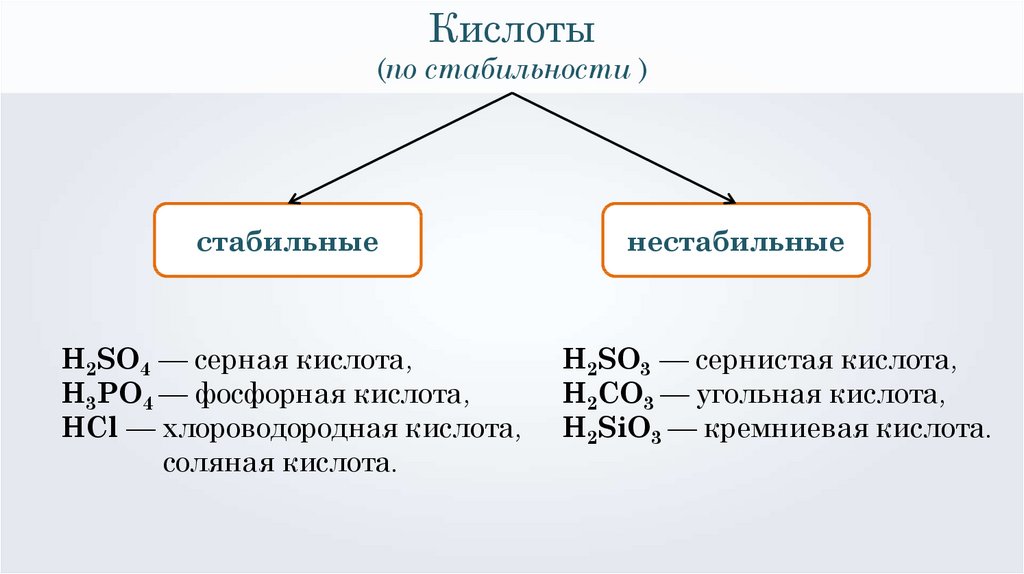
Кислоты(по стабильности )
стабильные
H2SO4 — серная кислота,
H3PO4 — фосфорная кислота,
HCl — хлороводородная кислота,
соляная кислота.
нестабильные
H2SO3 — сернистая кислота,
H2CO3 — угольная кислота,
H2SiO3 — кремниевая кислота.
39.
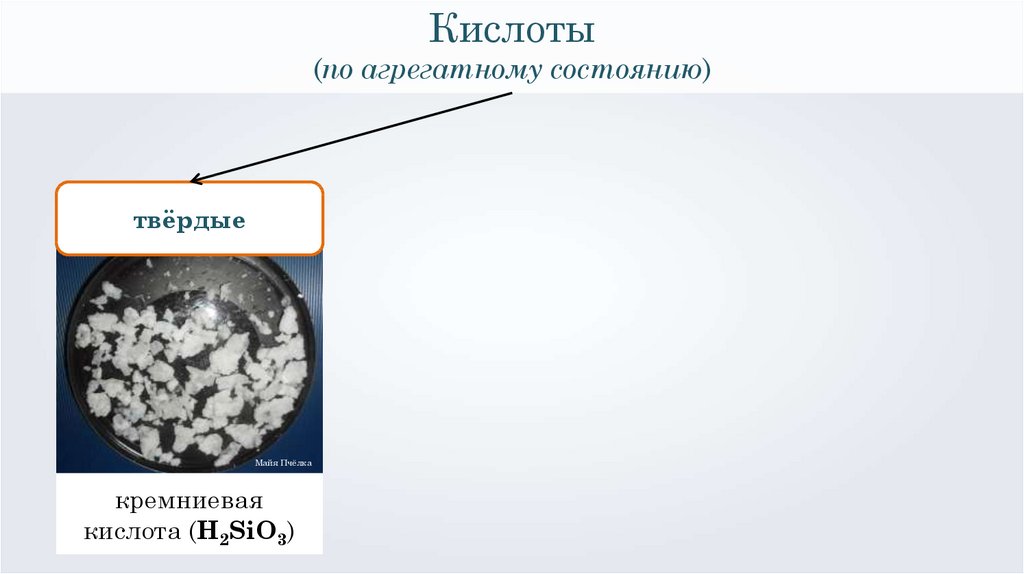
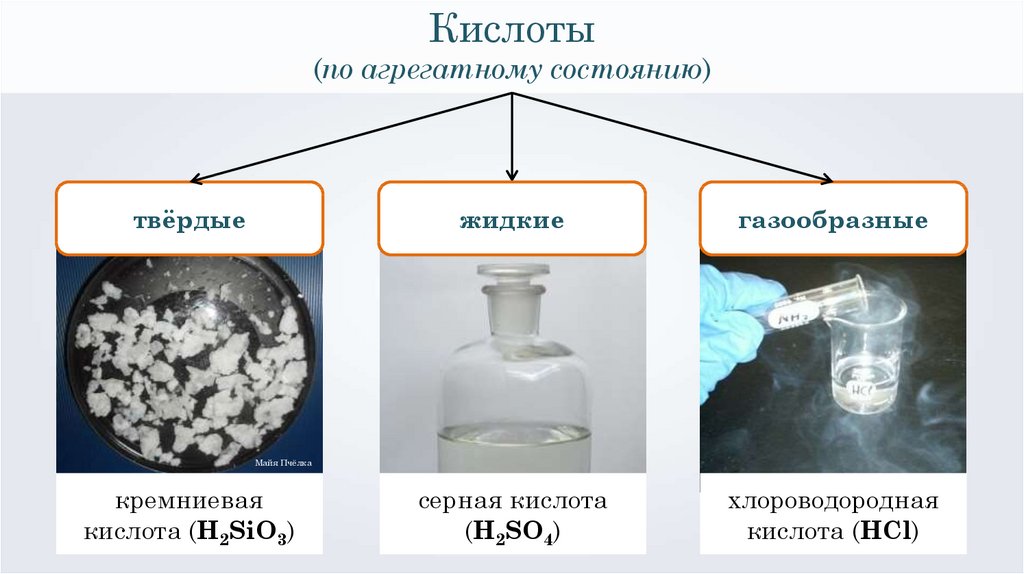
Кислоты(по агрегатному состоянию)
твёрдые
Майя Пчёлка
кремниевая
кислота (H2SiO3)
40.
Кислоты(по агрегатному состоянию)
твёрдые
жидкие
Майя Пчёлка
кремниевая
кислота (H2SiO3)
серная кислота
(H2SO4)
41.
Кислоты(по агрегатному состоянию)
твёрдые
жидкие
газообразные
серная кислота
(H2SO4)
хлороводородная
кислота (HCl)
Майя Пчёлка
кремниевая
кислота (H2SiO3)
42.
Газообразные кислоты(HCl, HBr, H2S) при обычных
условиях могут существовать
в водных растворах.
43.
Слабые кислоты(H2SO3, H2CO3 ) легко
разлагаются на газ и воду,
существуют только
в водных растворах.
молекула угольной
кислоты
44.
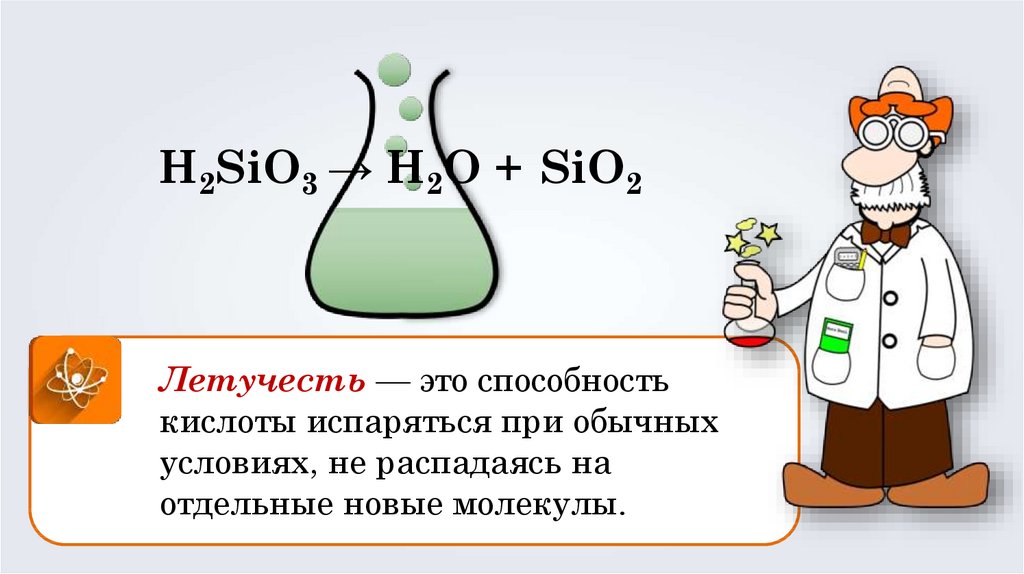
H2SiO3 → H2О + SiO2Летучесть — это способность
кислоты испаряться при обычных
условиях, не распадаясь на
отдельные новые молекулы.
45.
Большинство кислот неимеют окраски. Только
хромовая кислота (H2CrO4)
имеет жёлтую окраску, а
марганцевая (HMnO4) —
малиновую.
46.
Кислоты классифицируются в зависимости от ихсвойств, но все они объединены общими признаками:
наличием атомов водорода и кислотных остатков.
Катионы водорода, входящие в кислоты,
обуславливают их общие свойства:
кислый вкус, изменение окраски индикаторов и
взаимодействие с другими веществами.


















 Химия
Химия