Похожие презентации:
Число электронных слоев в атоме
1.
Главные подсказки:число электронных слоев в атоме определяется
номером периода.
число электронов на внешнем уровне для
элементов главных подгрупп определяет номер
группы.
у атомов элементов побочных подгрупп строится
не внешний уровень, а предвнешний с 8 эл до 18, а
затем снова внешний с 2 до 8 эл.
у d элементов- строится предвнешний d подуровень
у атомов элементов сверхбольших периодов
вначале ,как и у больших, но есть лантаноиды и
актиноиды .
2. .
:План рассмотрения строение электронных
оболочек атомов I—III периодов
1. определяем общее число электронов в атоме,
которое равно № (порядковому номеру элемента в
периодической системе)
2. определяем число энергетических уровней в
электронной оболочке (равно номеру периода, в
котором находится элемент)
3. определяем число электронов на каждом уровне.
На 1-м не больше двух, на 2-м не больше 8
электронов, на 3-м не больше 8. Хотя максимальное
число электронов на 3-м уровне равно 18, атомы
элементов 3 периода могут разместить на нем только
8 электронов.
На последнем внешнем уровне число электронов равно
номеру группы, в которой расположен данный
элемент.
3. 1 период
Н+1n=1
+
1 S1
S
Одиночный электрон на незавершенной оболочке
1
Нe + 2
n=1
2
1 S2
S - элементы
S
2 спаренных электрона на завершенной оболочке
+
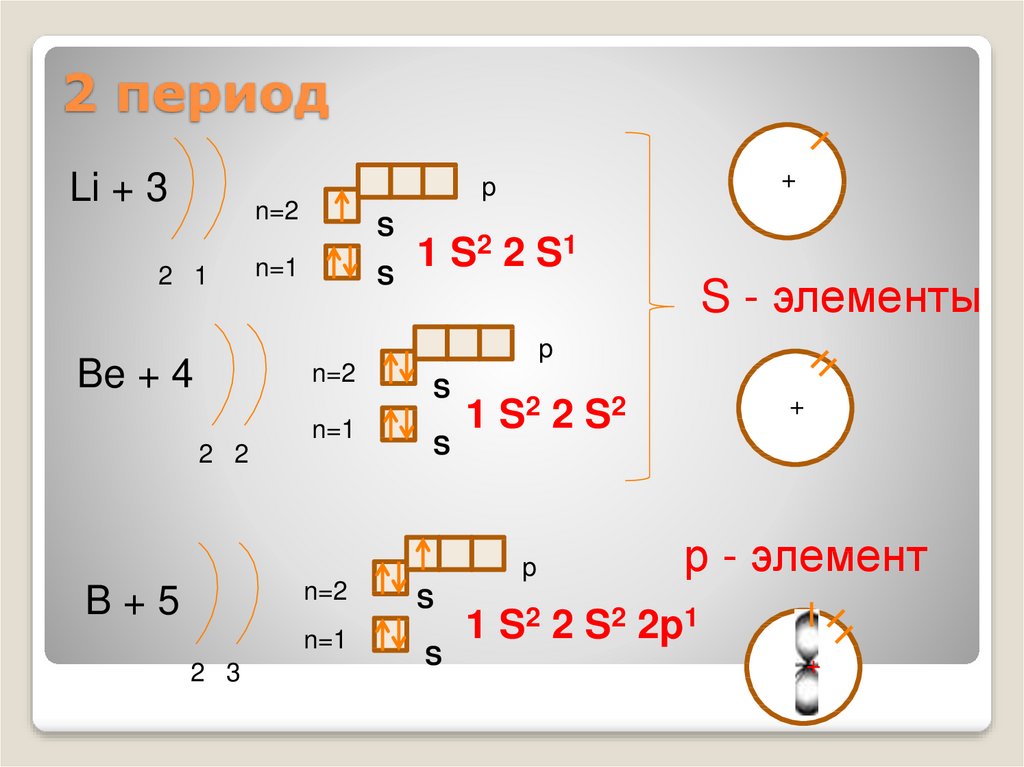
4. 2 период
Li + 3+
p
n=2
2 1
S
n=1
S
1 S2 2 S1
S - элементы
p
Be + 4
n=2
n=1
2 2
S
S
p
n=2
B+5
n=1
2 3
S
S
+
1 S2 2 S 2
р - элемент
1 S2 2 S2 2p1
++
5. 2 период
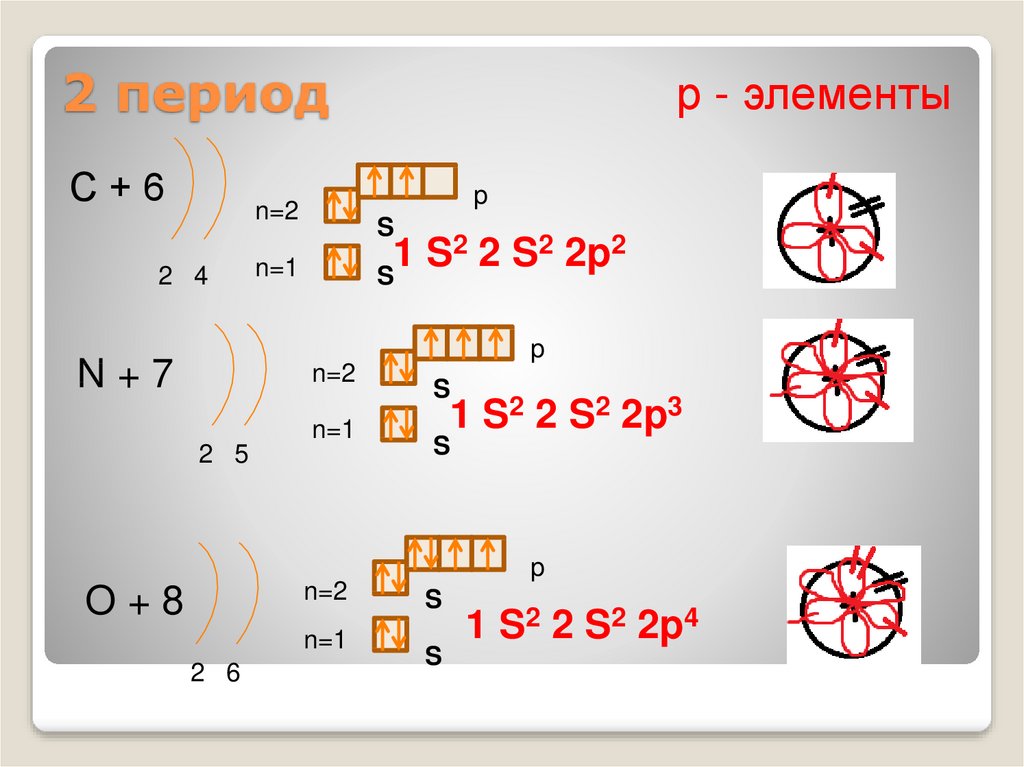
С+6p
n=2
2 4
р - элементы
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
6. 2 период
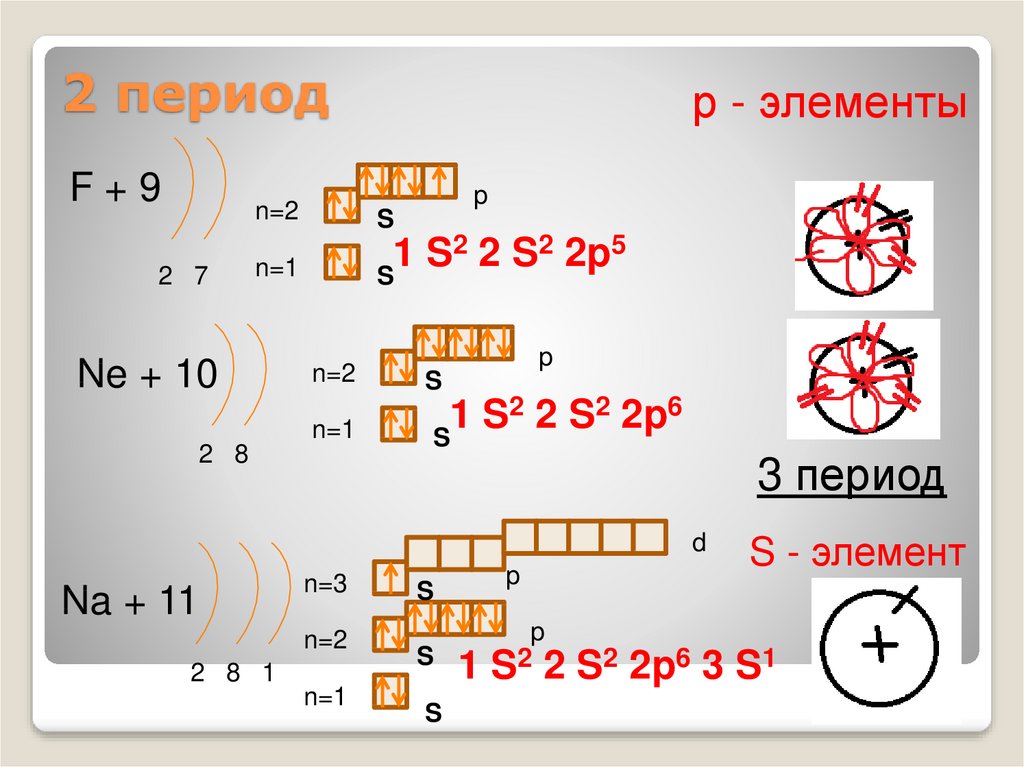
F+92 7
р - элементы
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
n=2
n=1
2 8
p
S
2 2 S2 2p6
1
S
S
3 период
d
Na + 11
n=3
n=2
2 8 1
n=1
p
S
S
S
1
p
S2 2
S - элемент
S2 2p6 3 S1



 Физика
Физика








