Похожие презентации:
Электролитическая диссоциация
1.
Урок в 11 классеЭлектролитическая
диссоциация
15.04.2020
1
2.
Электролитическая диссоциация1. Электролиты и неэлектролиты
2.Электролитическая диссоциация
3. Механизм электролитической диссоциации
4. Сильные и слабые электролиты
5. Диссоциация кислот, оснований, солей
6. Значение электролитов
7. Проверка знаний
15.04.2020
Русецкая О.П.
2
3.
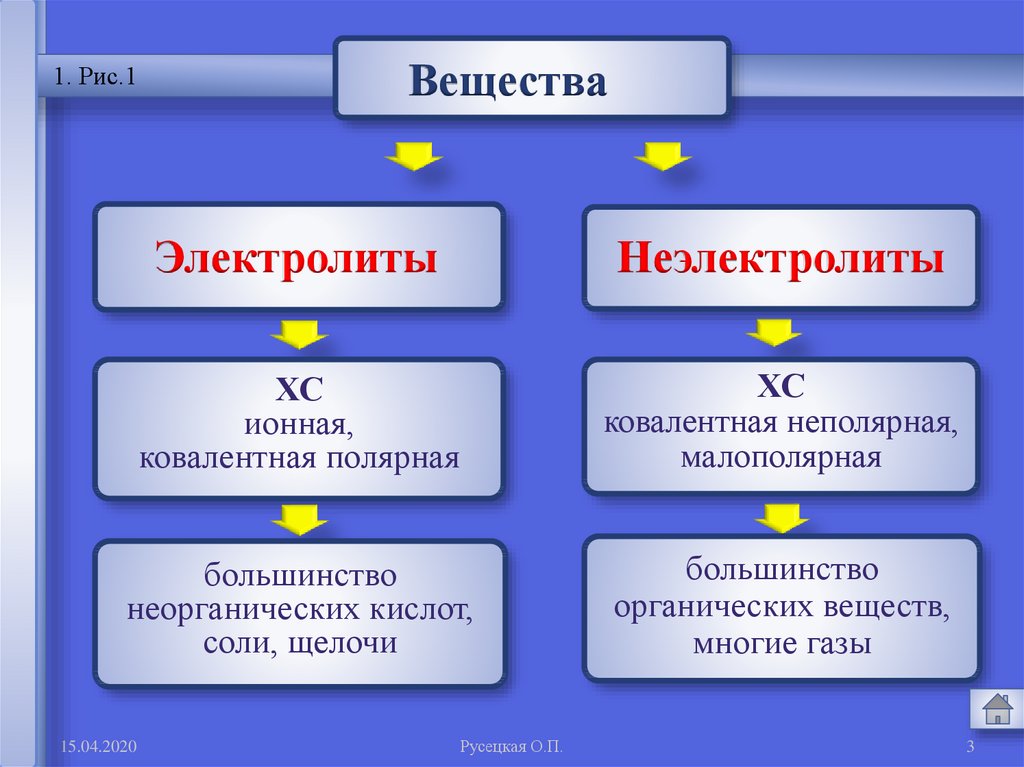
11. Рис.1
Вещества
Электролиты
Неэлектролиты
ХС
ионная,
ковалентная полярная
ХС
ковалентная неполярная,
малополярная
большинство
неорганических кислот,
соли, щелочи
большинство
органических веществ,
многие газы
15.04.2020
Русецкая О.П.
3
4.
1. Электролиты и неэлектролитыВода – хороший растворитель,
т.к. молекулы воды полярны.
Вода – слабый амфотерный
электролит.
Н2О + Н2О
104,50
Н3О+ + ОН-
ион
гидроксония
Н2О
Механизм ЭД
Н+ + ОН-
Ионное произведение воды (КН О)
КН О = [Н+]•[ОН-] = 10-7•10-7 = 10-14
2
2
15.04.2020
«Капля воды и камень точит»
4
5.
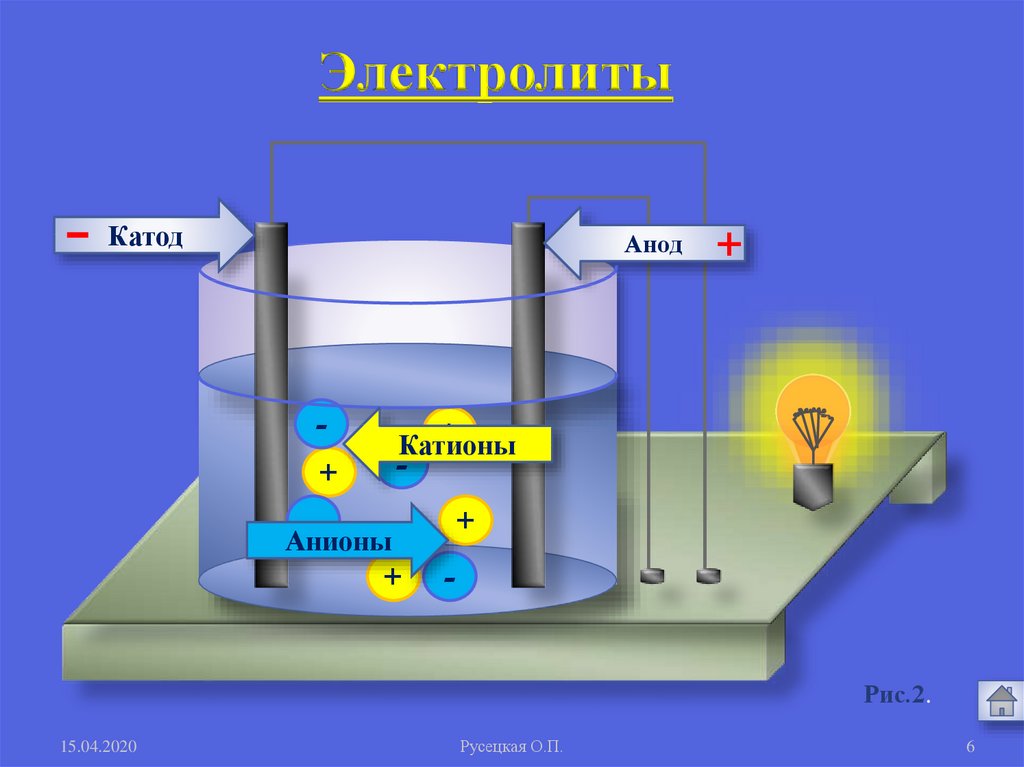
1. Электролиты и неэлектролитыЭлектролиты -
это вещества, растворы и
расплавы которых
проводят электрический ток.
Кислоты: HCl; HNO3; H2SO4
Щелочи: NaOH; KOH; Ba(OH)2
Соли:
NaCl; CuSO4; Al(NO3)3
15.04.2020
Русецкая О.П.
5
6.
Электролиты-
Катод
Анод
+
-
+
+
Катионы
-
Анионы
+
+
Рис.2.
15.04.2020
Русецкая О.П.
6
7.
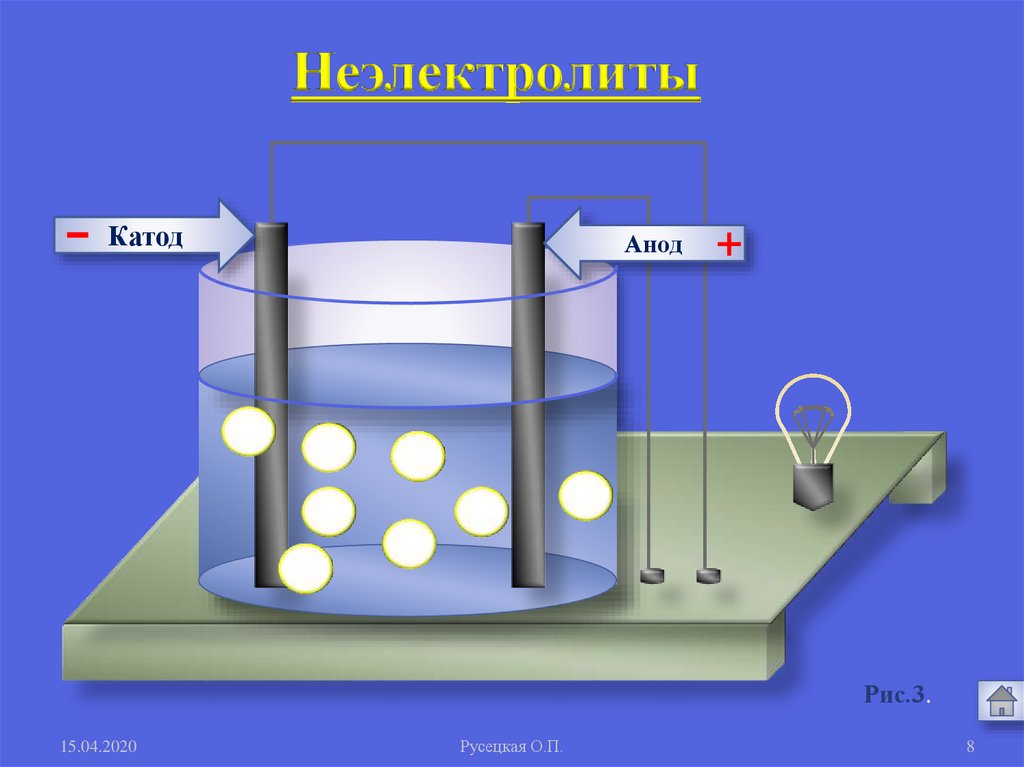
1. Электролиты и неэлектролитыНеэлектролиты -
это вещества, растворы или
расплавы которых не
проводят электрический ток.
Органические вещества:
сахар, ацетон,бензин, керосин, глицерин,
этиловый спирт, бензол и др.
Газы: кислород, водород, азот идр.
15.04.2020
Русецкая О.П.
7
8.
Неэлектролиты-
Катод
Анод
+
Рис.3.
15.04.2020
Русецкая О.П.
8
9.
2.Электролитическая диссоциацияЭлектролитическая диссоциация процесс распада молекул
электролита на ионы в
растворе или расплаве.
С.Аррениус
Теория электролитической
диссоциации. 1887 г.
15.04.2020
«Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов
9
10.
2.Электролитическая диссоциацияАррениус Сванте
Август
С.Аррениус
(1859 – 1927)
15.04.2020
Шведский ученый, академик.
В 1887 году сформулировал
основные положения теории
электролитической диссоциации.
В 1903 г. награжден
Нобелевской премией.
Проводил исследования во
многих других областях науки.
«Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов
10
11.
Механизм электролитической диссоциациивеществ с ионной связью
Раствор
Рис.4.
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
Кристалл
+
Н2О
+
Гидратированные ионы
NaCl → Na+ + Cl -
подробнее
12.
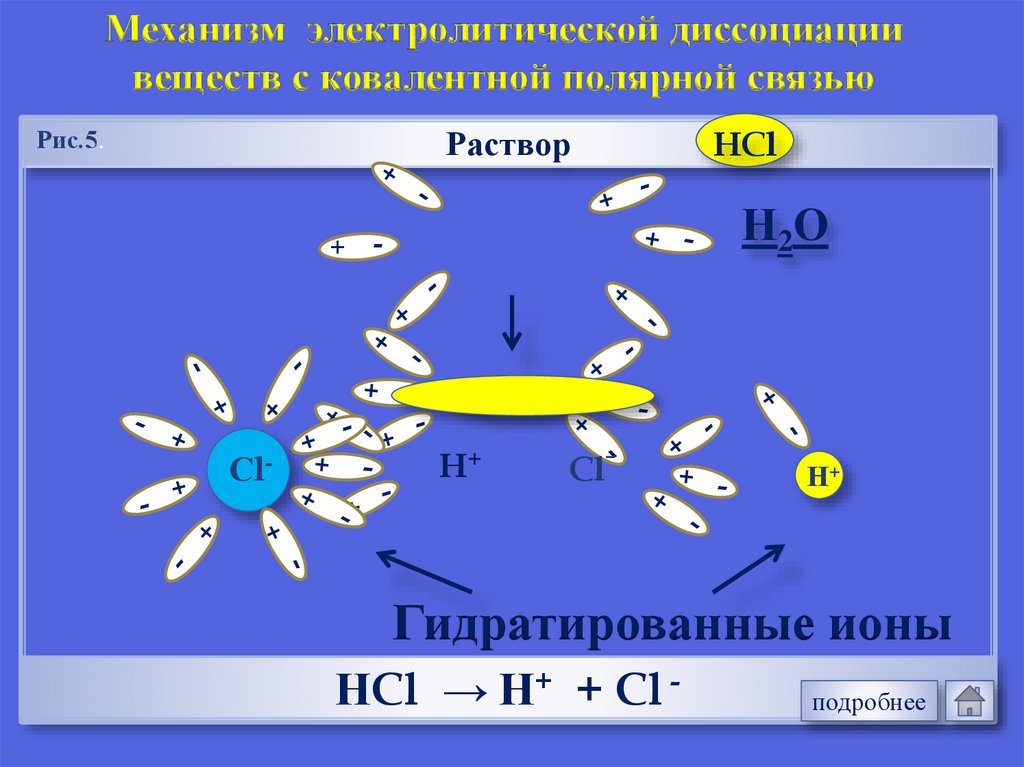
Механизм электролитической диссоциациивеществ с ковалентной полярной связью
Раствор
Рис.5.
+
Н 2О
-
+
Сl-
HCl
H+
Cl-
Н+
Гидратированные ионы
НCl → Н+ + Cl -
подробнее
13.
2.Сильные и слабые электролиты+
+
+
++
+
+
+
Сильные и слабые
Рис.6.
13
14.
Степень электролитическойдиссоциации (α) отношение числа диссоциированных
молекул к общему числу молекул,
находящихся в растворе.
n
α=
N
Сильные электролиты
α > 30%
Слабые электролиты
α< 30%
15.04.2020
Русецкая О.П.
14
15.
2.Сильные и слабые электролитыЭлектролиты
Соли
Сильные (α >30%) Слабые (α < 30%)
практически все
Hg2Cl2 , некоторые
cоли тяжелых металлов
гидроксиды
щелочных и
щелочноземельных
металлов
водный раствор
аммиака
Основания
растворимые в воде
нерастворимые
-
все
Кислоты
HI, HBr, HCl
кислородосодержащие HClO4 H2SO4,
HNO3
бескислородные
HF, H2S
H2SO3, H2CO3,
H2SiO3, Н3РO4,
CH3COOH и др.
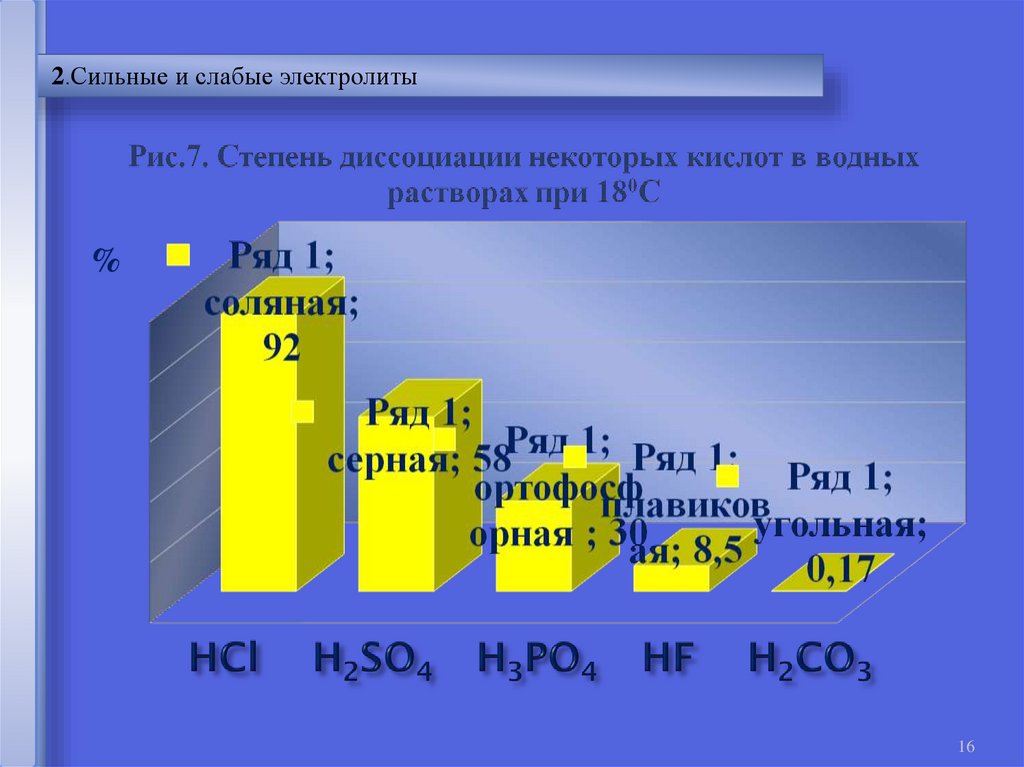
16.
2.Сильные и слабые электролиты%
16
17.
Диссоциация кислот5. Диссоциация кислот, оснований, солей
Кислоты - это сложные вещества, при
диссоциации которых в водных
растворах в качестве катионов
отщепляются только ионы водорода.
НCl → Н+ + Cl -
+
Н
Н2SO4 → 2Н+ + SO4 2-
Н2 CO3
15.04.2020
2 Н+ + CO3 2Русецкая О.П.
17
18.
Диссоциация основанийОснования - это сложные вещества,
при диссоциации которых в водных
растворах в качестве анионов
отщепляются только гидроксид-ионы.
KOH → K
+
+ OН
2+
Ca(OH)2
Ca
n+
Me
Мe(OH)n
15.04.2020
-
Русецкая О.П.
-
ОН
-
+ 2 OН
-
+ n OН
18
19.
Диссоциация солейСоли - это сложные вещества,
которые в водных растворах
диссоциируют на катионы металла и
анионы кислотного остатка.
NaCl →
K2SO4
Na+ + Сl→ 2 K+ + SO4 2-
Al(NO3)3 → Al3+ + 3 NO3 -
n+
Me
15.04.2020
(кислотный остаток)
Русецкая О.П.
в19
20.
Электролитическая диссоциация6. О значении электролитов для живых организмов
Электролиты – составная часть жидкостей и плотных
тканей живых организмов.
Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; НCO3- имеют
большое значение для физиологических и биохимических
процессов:
ионы H+; OH- играют большую роль в работе ферментов,
обмене веществ, переваривании пищи и др.
при нарушении водно-солевого обмена в медицине
применяется физиологический раствор – 0,85% раствор
NaCl;
ионы I - влияют на работу щитовидной железы.
20
21.
6. Рис.8. Характерные симптомы дефицита химических элементов в организме человекаИоны
2+
Са
Mg
Fe
2+
2+
Zn
2+
Mn
2+
Типичный симптом
Замедление роста скелета
Мускульные судороги
Анемия, нарушение иммунной
системы
Повреждение кожи, замедление
полового созревания
Учащение депрессий, дерматиты
подробнее
21
22.
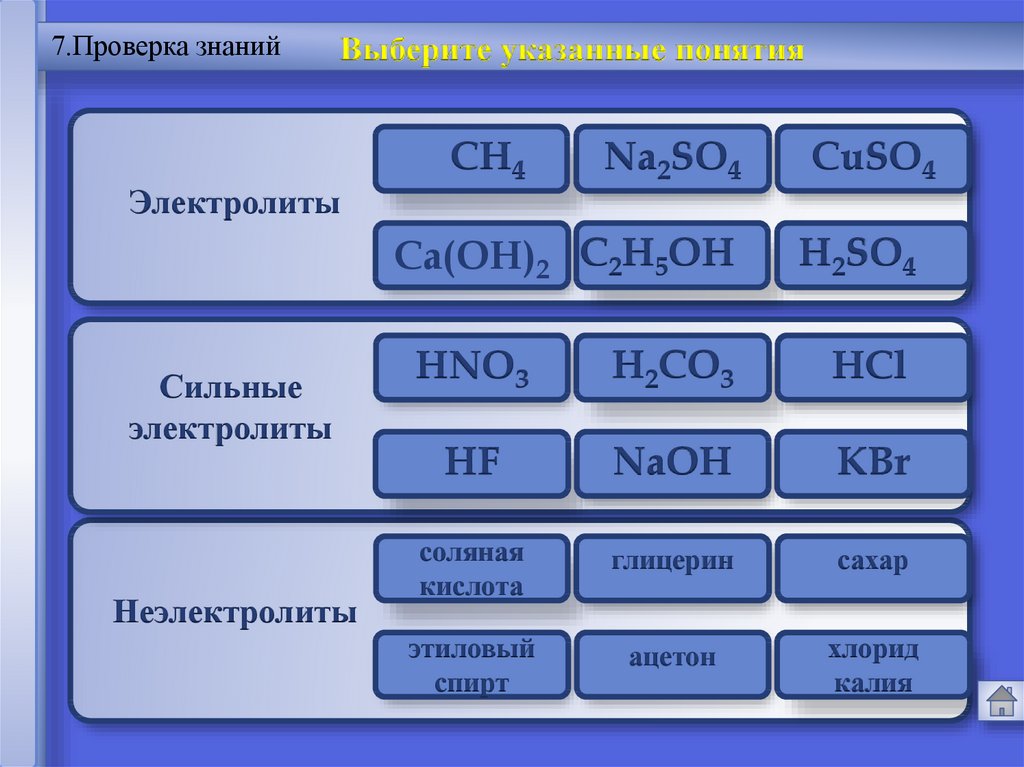
7.Проверка знанийВыберите указанные понятия
Электролиты
Сильные
электролиты
Неэлектролиты
Na2SO4
Молодец
CuSO4
Молодец
Молодец
Ca(OH)2 CОшибка
2H5OH
H2SO4
Молодец
HNO3
Молодец
H2CO3
Ошибка
HCl
Молодец
HF
Ошибка
NaOH
Молодец
KBr
Молодец
соляная
Ошибка
кислота
глицерин
Молодец
сахар
Молодец
этиловый
Молодец
спирт
ацетон
Молодец
хлорид
Ошибка
калия
CH4
Ошибка
23.
Электролитическая диссоциация7. Проверка знаний
Электролитическая диссоциация
в растворах
электролитов
Слабым
Электролитами
Основные
электролитом
положения
– это
в растворах
непроцесс
являются
электролитической
является
распада
протекает
________
_______
под
.
.
электролита__________
действием
диссоциации
сформулировал
на __________
.
. ученый ______.
Вопрос 1
А
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
15.04.2020
С
электрического
Д.И.Менделеев
атомы
KCl
оксиды
тока
молекул
М.В.Ломоносов
молекулы
NaOH
соли
растворителя
Русецкая О.П.
B
D
катализатора
ионы3
HNO
С.Аррениус
кислоты
температуры
электроны
H2S
М.Фарадей
щелочи
23
24.
Механизм электролитической диссоциацииNaCl
Разрушение кристаллической решетки под
действием молекул воды.
Гидратация
NaCl + nН2О →Na+ (Н2О)х + Сl-(Н2О)n-х
NaCl →
Na+
+ Cl
-
Механизм ЭД
HCl
Поляризация связи в молекуле НСl под
действием молекул воды.
Гидратация
HCl + nН2О →H+ (Н2О)х + Сl-(Н2О)n-х
+
Механизм ЭД
НCl → Н + Cl
15.04.2020
24
25.
Prezentacii.comЛитература
Баженов А.А. Мастер-класс «Создание презентаций к
урокам химии». Сеть творческих учителей.
http://www.it-ru/communities.aspx?cat_no=75761&tmpl=com
Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 кл. – М.:
Просвещение, 2008.
Мартыненко Б.В. Химия: кислоты и основания. – М.:
Просвещение, 2000.
Слета Л.А. Химия: Справочник. – Харьков: Фолио, 1997.
Егоров А.С. Химия. Пособие –репетитор для
поступающих в вузы. – Ростов н/Д: изд-во Феникс, 2006.
Гаршин А.П.Неорганическая химия. – СПб.: изд-во
«Лань», 2000.
http://www.alhimik.ru/kunst/man's_elem.html
Благодарю за внимание!
15.04.2020
25



















 Химия
Химия








