Похожие презентации:
Теория электролитической диссоциации
1.
Теорияэлектролитической
диссоциации.
29.10.2020
1
2.
Электролитическая диссоциация1. Электролиты и неэлектролиты
2.Электролитическая диссоциация
3. Механизм электролитической диссоциации
4. Диссоциация кислот, оснований, солей
5. Значение электролитов
29.10.2020
2
3.
ВеществаЭлектролиты
Неэлектролиты
ХС
ионная,
ковалентная полярная
ХС
ковалентная
неполярная,
малополярная
большинство
неорганических кислот,
соли, щелочи
большинство органических
веществ, многие газы
29.10.2020
3
4.
1. Электролиты и неэлектролитыВода – хороший растворитель,
т.к. молекулы воды полярны.
Вода –слабый амфотерный
электролит.
Механизм ЭД ВОДЫ
Н2О + Н2О
Н2О
29.10.2020
Н3О+ + ОН-
ион
гидроксония
Н+ + ОН-
4
5.
1. Электролиты и неэлектролитыЭлектролиты - это вещества, растворы и
расплавы которых
проводят электрический
ток.
Кислоты: HCl; HNO ; H SO
3
2
4
Щелочи: NaOH; KOH; Ba(OH)
2
Соли:
NaCl; CuSO4;Al(NO3)3
29.10.2020
5
6.
Электролиты-
Катод
Анод
+
-
+
+
Катионы
-
+
Анионы
+
-
Рис.2.
29.10.2020
6
7.
1. Электролиты и неэлектролитыНеэлектролиты это вещества, растворы или
расплавы которых не
проводят электрический ток.
Органические вещества:
сахар, ацетон,бензин, керосин, глицерин,
этиловый спирт, бензол и др.
Газы: кислород, водород, азот идр.
29.10.2020
7
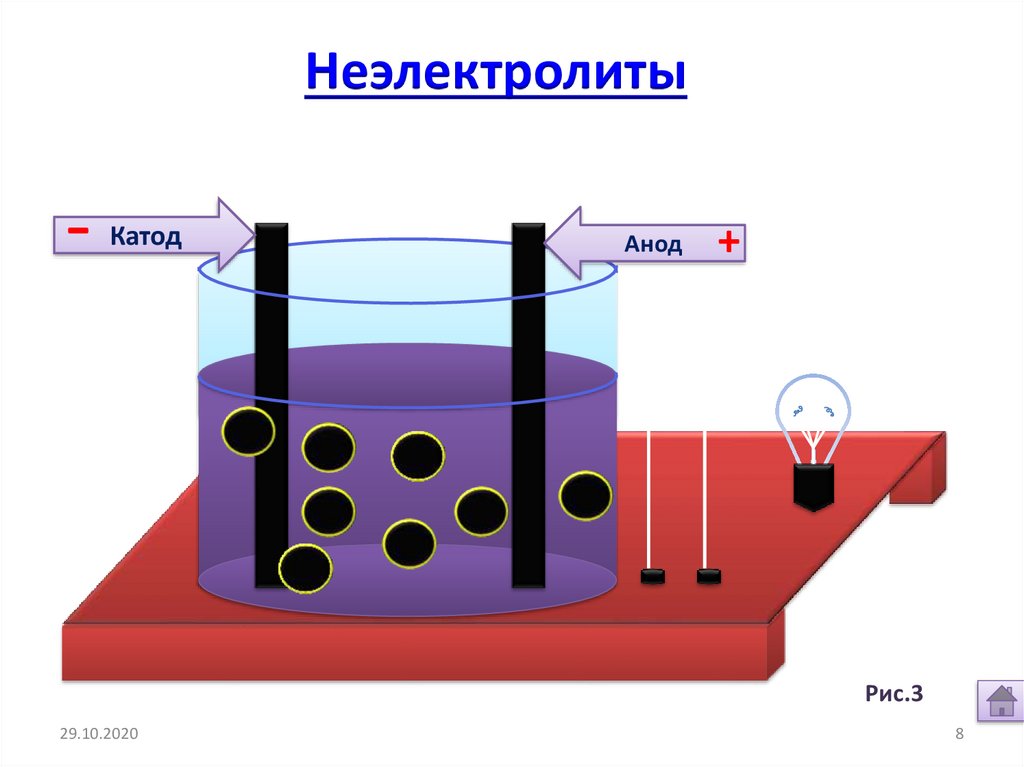
8.
Неэлектролиты-
Катод
Анод
+
Рис.3.
29.10.2020
8
9.
2.Электролитическая диссоциацияЭлектролитическая диссоциация процесс распада молекул
электролита на ионы в
растворе или расплаве.
С.Аррениус
Теория электролитической
диссоциации. 1887 г.
29.10.2020
9
10.
Основные положениятеории ЭД
1. Электролиты в водной среде (и в
расплавленном состоянии) распадаются
на положительно заряженные ионы
(катионы) и отрицательно заряженные
ионы (анионы).
11.
Основные положениятеории ЭД
2. Беспорядочное движение ионов в
растворе под действием электрического
поля становится направленным:
положительно заряженные ионы (катионы)
движутся к электроду с отрицательным
зарядом (катоду), а анионы – к аноду.
12.
Основные положениятеории ЭД
3. Диссоциация – обратимый процесс:
параллельно с распадом молекул на ионы
(диссоциацией) протекает процесс
соединения ионов (ассоциация). Поэтому в
уравнениях электролитической
диссоциации вместо знака равенства ставят
знак обратимости.
Na+ + ClNaCl
13.
Основные положениятеории ЭД
4. Степень электролитической диссоциации
(α) зависит от природы электролита и
растворителя, температуры и
концентрации.
14.
Степень электролитическойдиссоциации (α) отношение числа диссоциированных
молекул к общему числу молекул,
находящихся в растворе.
n
α=
N
29.10.2020
14
15.
Основные положениятеории ЭД
5. Свойства ионов резко отличаются от
свойств нейтральных атомов
составляющих их элементов. Ионы в
водных растворах гидратированы.
16.
Диссоциация кислот4. Диссоциация кислот, оснований, солей
Кислоты - это сложные вещества, при
диссоциации которых в водных
растворах в качестве катионов
отщепляются только ионы водорода.
НCl → Н+ + Cl -
+
Н
Н2SO4 → 2 Н+ + SO4 2Н2 CO3
2Н+ + CO3 229.10.2020
16
17.
Диссоциация основанийОснования - это сложные вещества,
при диссоциации которых в водных
растворах в качестве анионов
отщепляются только гидроксид-ионы.
-
+
OН
KOH → K +
Ca(OH)2
Мe(OH)n
29.10.2020
2+
Ca
Me
-
ОН
-
+ 2 OН
n+
+n
-
OН
17
18.
Диссоциация солейСоли - это сложные вещества,
которые в водных растворах
диссоциируют на катионы металла и
анионы кислотного остатка.
NaCl →
Na+ +
K2SO4 → 2 K+ +
Al(NO3)3 →
Me
29.10.2020
n+
3+
Al + 3
СlSO4 2NO3 -
(кислотный остаток)
в18
19.
Электролитическая диссоциация5. О значении электролитов для живых организмов
Электролиты – составная часть жидкостей и плотных
тканей живых организмов.
Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; НCO3- имеют
большое значение для физиологических и биохимических
процессов:
ионы H+; OH- играют большую роль в работе ферментов,
обмене веществ, переваривании пищи и др.
при нарушении водно-солевого обмена в медицине
применяется физиологический раствор – 0,85% раствор
NaCl;
ионы I - влияют на работу щитовидной железы.
19


















 Химия
Химия








