Похожие презентации:
Растворение. Растворимость веществ в воде
1. Тема занятия:
«Растворение.Растворимость
веществ в воде.»
2. Цель занятия:
Ознакомитьучащихся с
растворением как
физико-химическим
процессом.
3. Мы собирали модель молекулы на занятии!
4.
Вода – основа жизни, всегда содержит растворенные вещества.Пресная вода рек и озер содержит мало растворенных веществ, в
то время как морская вода содержит около 3,5% растворенных
солей.
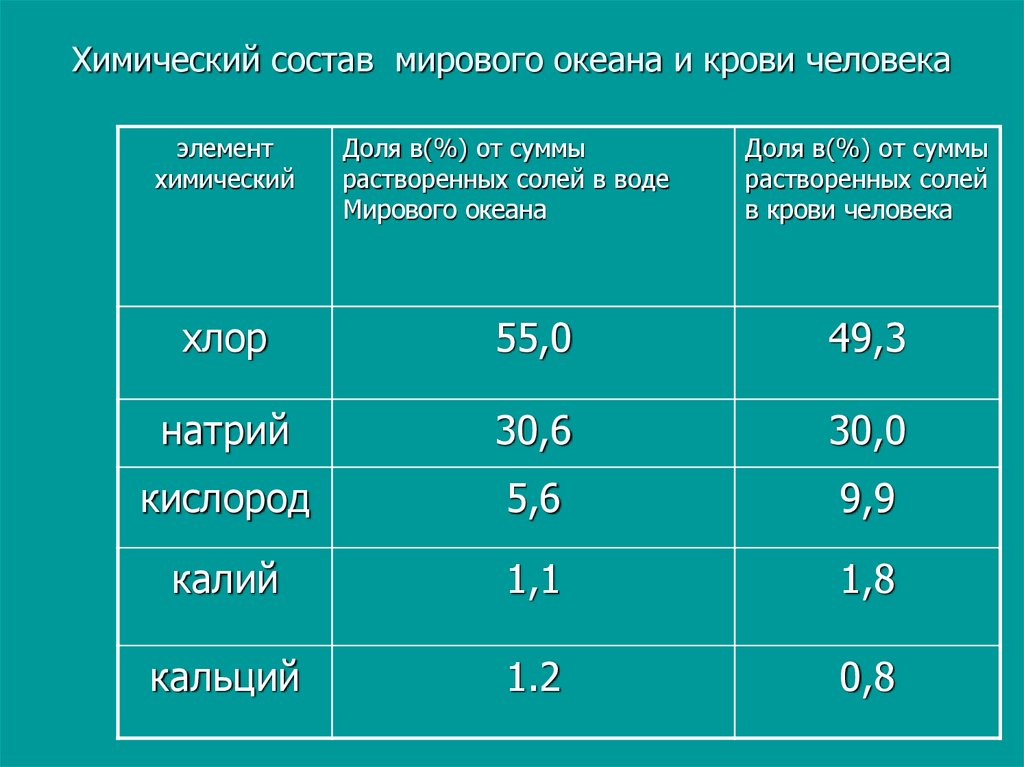
5. Химический состав мирового океана и крови человека
элементхимический
Доля в(%) от суммы
растворенных солей в воде
Мирового океана
Доля в(%) от суммы
растворенных солей
в крови человека
хлор
55,0
49,3
натрий
30,6
30,0
кислород
5,6
9,9
калий
1,1
1,8
кальций
1.2
0,8
6. Раствор состоит из растворенного вещества (1 или нескольких) и растворителя.
7. Физическая теория растворов:
Процесс растворения являетсярезультатом диффузии, т.е.
проникновения растворенного вещества
в промежутки между молекулами воды.
8. Сторонники химической теории растворов:
Дмитрий Иванович МенделеевКистяковский Владимир Александрович
Иван Алексеевич Каблуков
9. Химическая теория растворов:
Растворение результатхимического
взаимодействие
растворенного
вещества с
молекулами воды.
10. Современная теория растворов:
Растворение- это физико-химическийпроцесс. Раствор –однородная система,
состоящая из частиц растворенного
вещества, растворителя и продуктов их
взаимодействия.
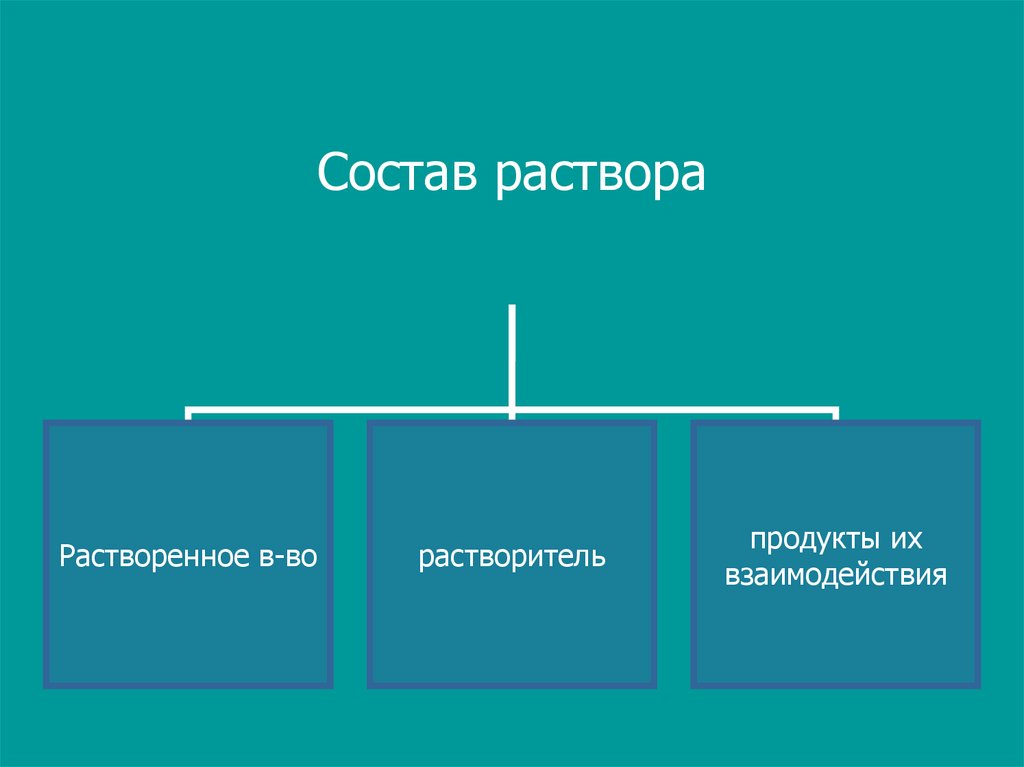
11.
Состав раствораРастворенное в-во
растворитель
продукты их
взаимодействия
12. Признаки химических реакций при растворении.
1.Тепловые явления2.Изменение цвета.
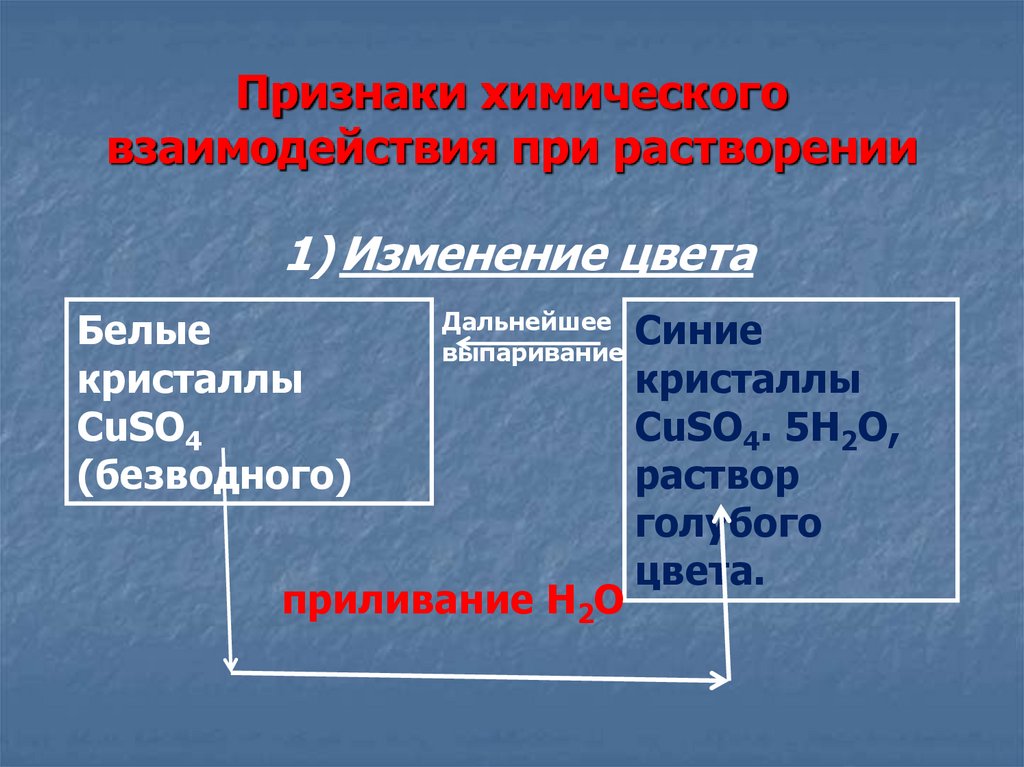
13. Признаки химического взаимодействия при растворении
1) Изменение цветаБелые
кристаллы
CuSO4
(безводного)
Дальнейшее
выпаривание
приливание H2O
Синие
кристаллы
CuSO4. 5H2O,
раствор
голубого
цвета.
14. Гидраты – это нестойкие соединения, которые образуются при химическом взаимодействии молекул воды с частицами растворенного
вещества.Кристаллогидраты – это кристаллические вещества,
содержащие молекулы воды.
Воду, входящую в
состав
кристаллогидратов,
называют
кристаллизационной.
Кристаллогидрат
сульфата меди(II)
(медный купорос):
CuSO4 · 5H2O.
Железный купорос:
FeSO4 · 7H2O
Гипс: CaSO4 · 2H2O
Сода: Na2CO3 · 10H2O
15. Факторы, от которых зависит растворимость твёрдых веществ
От природы веществ(на 1 г H2O при 20 0С)
-Хорошо растворимые ( более 1 г)
- Малорастворимые (менее 1 г)
-Практически нерастворимые (меньше
0,01г)
2) От температуры
1)
16. Типы растворов по содержанию растворённого вещества
1)2)
3)
Ненасыщенные – вещество при данной
температуре еще растворяется
Насыщенные- больше не растворяется
Перенасыщенные- содержат в растворе
больше вещества, чем насыщенный
раствор
17. Запомните !
Растворимость(коэффициент растворимости)
определяется массой
вещества, способной
раствориться в 1000 мл
растворителя при данной
температуре.
Растворимость веществ
различна. У некоторых она
ничтожно мала. Такие
вещества считают практически
нерастворимым. Так,
например, в 1000 мл воды
растворяется лишь 1,5 г
хлорида серебра AgCl, т. е. его
растворимость составляет
0,0015 г/л.
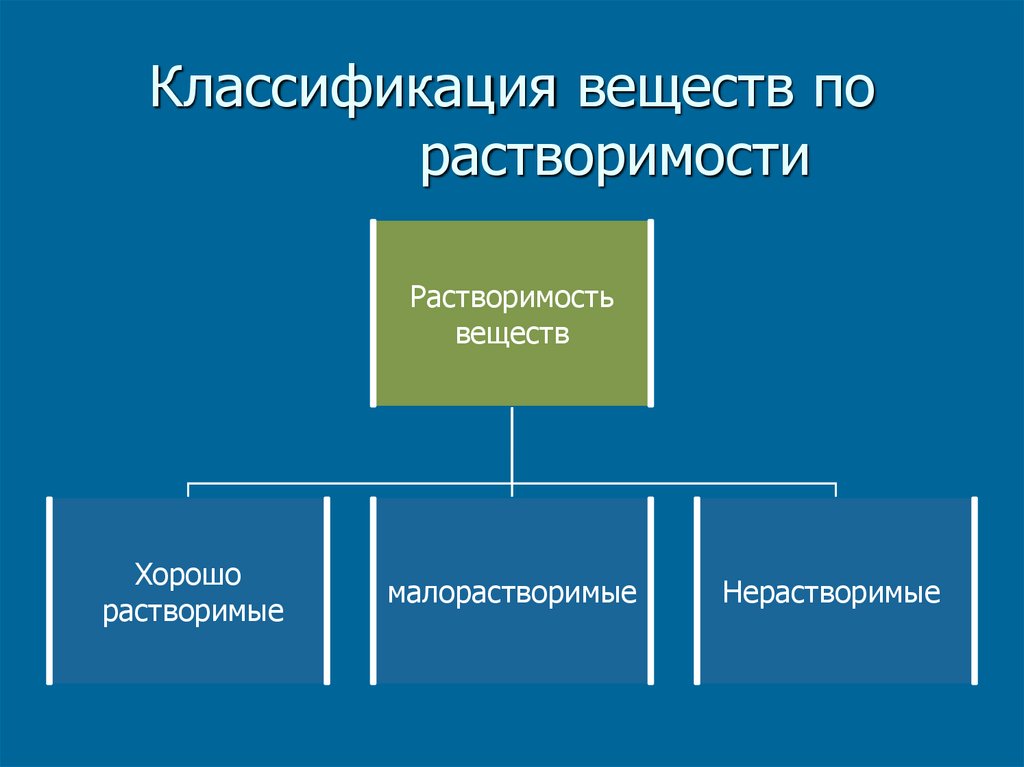
18. Классификация веществ по растворимости
Растворимостьвеществ
Хорошо
растворимые
малорастворимые
Нерастворимые
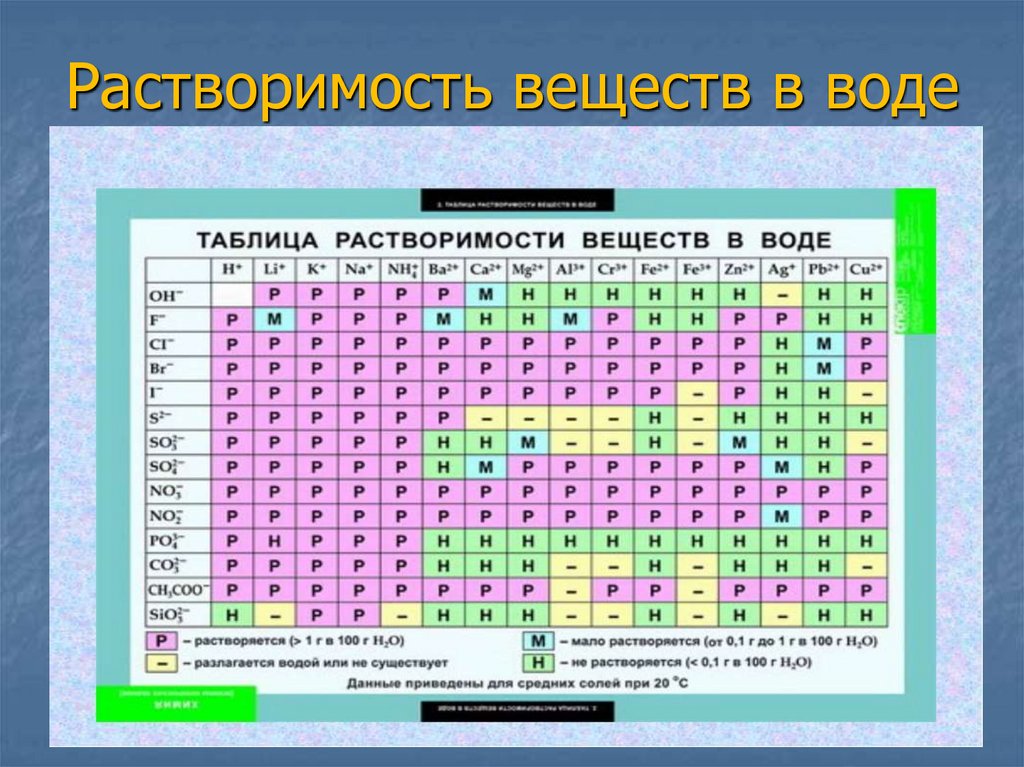
19. Растворимость веществ в воде
20. Закрепление:
1. Почему в горячем чае кусочек сахарарастворяется быстрее, чем в холодном?
2. Приведите примеры хорошо растворимых,
малорастворимых и практически
нерастворимых в воде веществ.















 Химия
Химия








