Похожие презентации:
Вода — это уникальное вещество
1.
Вода — это уникальное вещество.2.
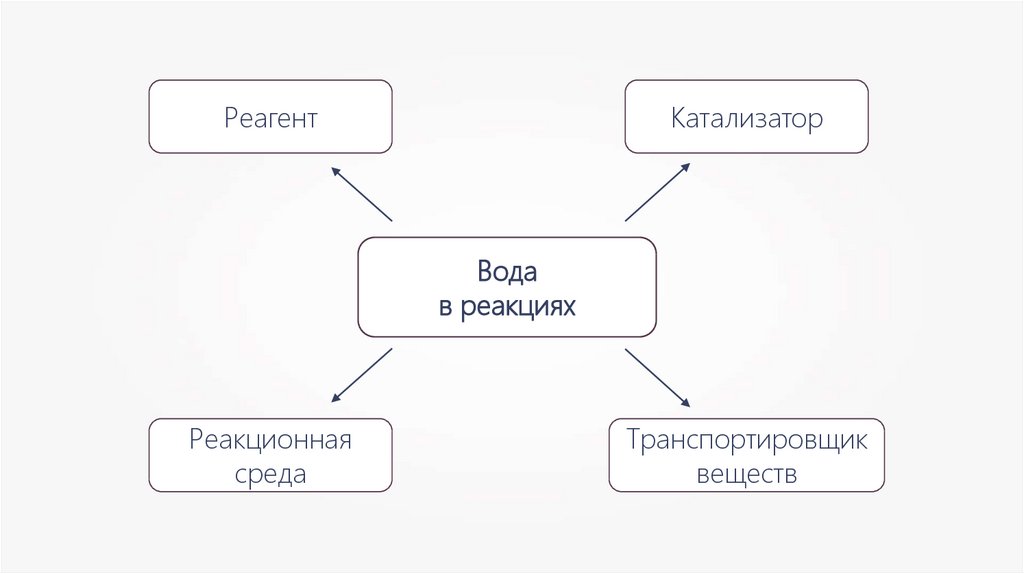
РеагентКатализатор
Вода
в реакциях
Реакционная
среда
Транспортировщик
веществ
3.
Классификация веществ по растворимости в водеВещества
Растворимые
Малорастворимые
Практически
нерастворимые
растворимость составляет
более 1 г вещества
на 100 г воды
растворимость составляет
от 0,01 до 1 г вещества на
100 г воды
растворимость составляет
менее 0,01 г вещества на
100 г воды
4.
Таблица растворимости кислот, оснований и солей5.
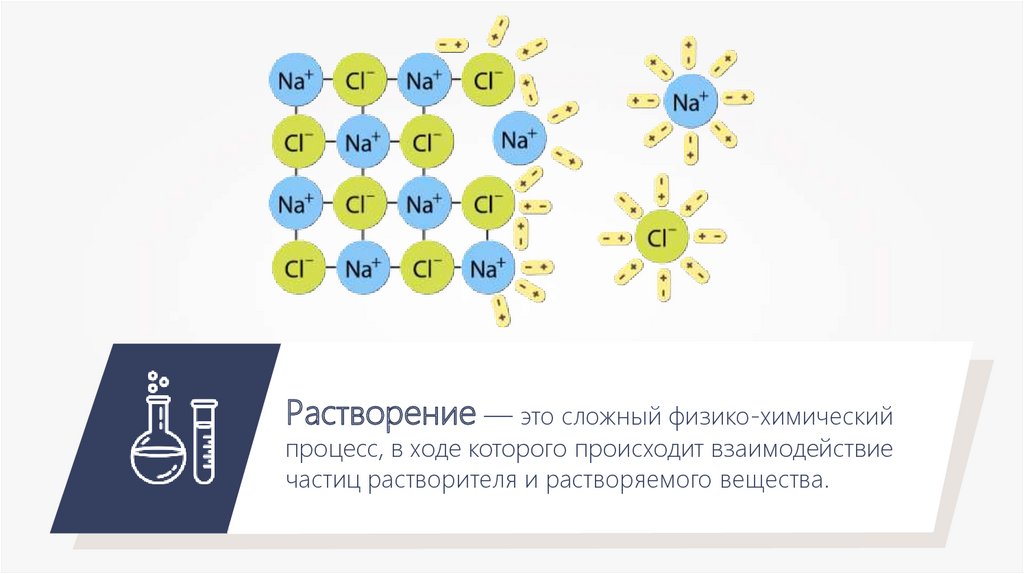
Растворение — это сложный физико-химическийпроцесс, в ходе которого происходит взаимодействие
частиц растворителя и растворяемого вещества.
6.
РастворениеФизическая сторона процесса
После контакта частиц растворителя и
растворённого вещества, частицы
растворённого вещества отрываются
от поверхности растворяемого вещества
и распределяются по всему объёму
растворителя благодаря диффузии.
Химическая сторона процесса
Взаимодействие молекул растворителя
с частицами растворяемого вещества,
которое приводит к образованию
устойчивых соединений.
7.
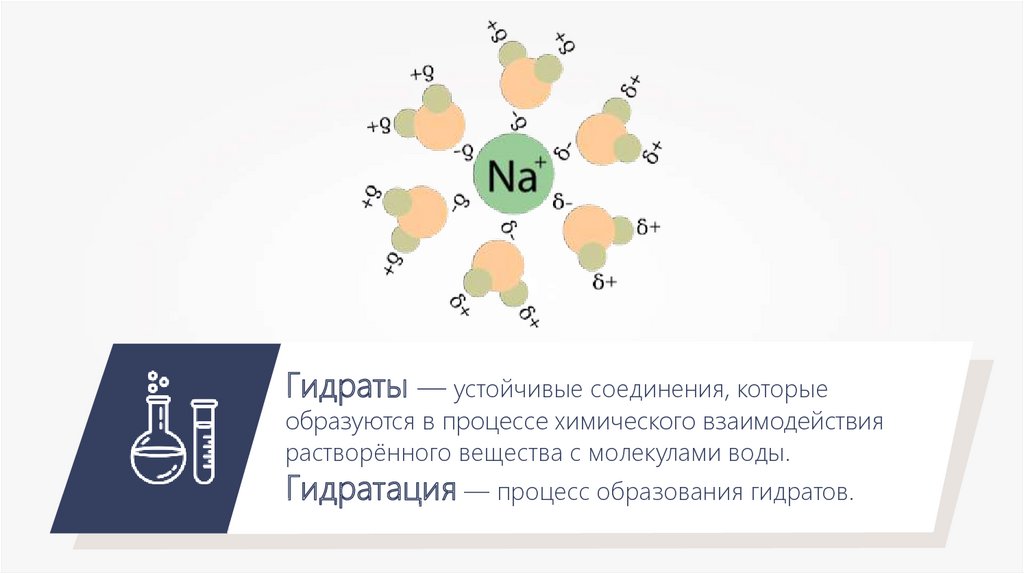
Гидраты — устойчивые соединения, которыеобразуются в процессе химического взаимодействия
растворённого вещества с молекулами воды.
Гидратация — процесс образования гидратов.
8.
Кристаллогидрат — кристалл, содержащийв своём составе воду.
Кристаллизационная вода — вода, входящая
в состав кристаллогидрата.
9.
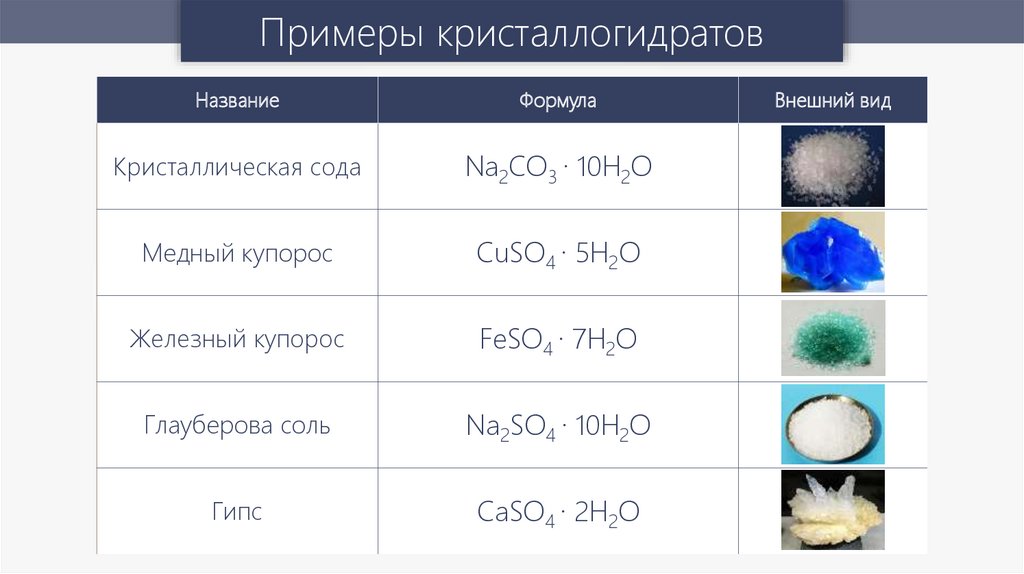
Примеры кристаллогидратовНазвание
Формула
Кристаллическая сода
Na2CO3 ∙ 10H2O
Медный купорос
CuSO4 ∙ 5H2O
Железный купорос
FeSO4 ∙ 7H2O
Глауберова соль
Na2SO4 ∙ 10H2O
Гипс
CaSO4 ∙ 2H2O
Внешний вид
10.
Русский учёный.Предложил гидратную
теорию растворов.
Д.И. Менделеев
1834–1907 гг.
11.
Электролиты — вещества, которые в растворахраспадаются на ионы — диссоциируют.
12.
n__
α = ∙ 100%
N
Степень электролитической диссоциации —
величина равная отношению числа молей вещества,
которое диссоциировало, к общему количеству
растворённого вещества.
13.
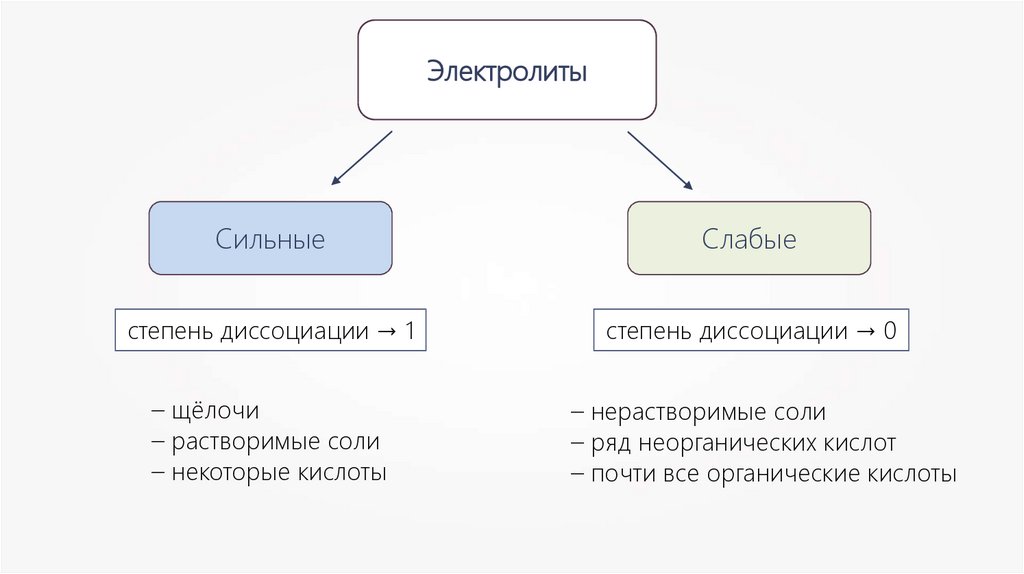
ЭлектролитыСильные
Слабые
степень диссоциации → 1
степень диссоциации → 0
– щёлочи
– растворимые соли
– некоторые кислоты
– нерастворимые соли
– ряд неорганических кислот
– почти все органические кислоты
14.
Диссоциация сильных электролитов+
KOH = K + OH
–
Гидроксид калия
+
2–
H2SO4 = 2H + SO4
Серная кислота
15.
Диссоциация слабых электролитовHF →
↔H+F
+
–
→
Фтороводородная
кислота
→ CH3COO + H
CH3COOH ↔
→
Уксусная кислота
–
Н2 О →
↔ H + OH
→
Вода
+
–
+
16.
Теория, которая объясняет электропроводностьрастворов, была предложена в 1887 году.
С. Аррениус
1859–1927 гг.
И.А. Каблуков
1857–1942 гг.
В.А. Кистяковский
1865–1952 гг.
17.
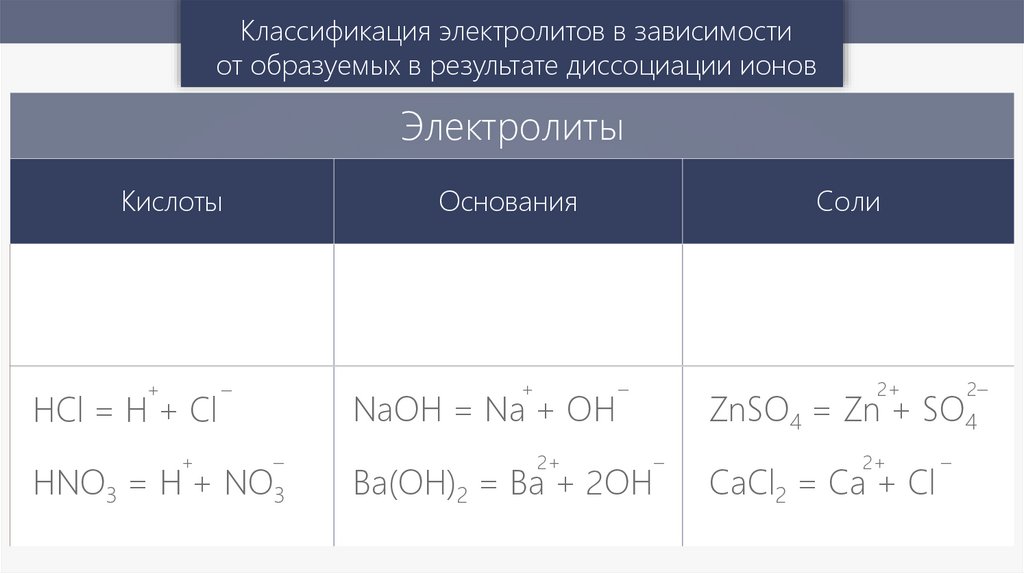
Классификация электролитов в зависимостиот образуемых в результате диссоциации ионов
Электролиты
Кислоты
Основания
Соли
диссоциируют
на катионы водорода и
анионы кислотного остатка
диссоциируют на катионы
металла и гидроксид —
анионы
диссоциируют на катионы
металла и анионы
кислотных остатков
+
HCl = H + Cl
+
+
–
NaOH = Na + OH
–
HNO3 = H + NO3
2+
–
Ba(OH)2 = Ba + 2OH
2+
2–
ZnSO4 = Zn + SO4
–
2+
CaCl2 = Ca + Cl
–
18.
СН2 — СН2 + H2O → СН3—СН2OHЭтилен
Этанол
HC —СН + H2O → Н3С—С
Ацетилен
O
OH
Уксусный альдегид
Реакции гидратации (реакции
присоединения воды) — реакции, где вода
выступает в роли реагента.
19.
Взаимодействие щелочных ищёлочноземельных металлов с водой
2К + 2Н2О = 2КОН + Н2↑
Гидроксид калия
Са + 2Н2О = Са(ОН)2 + Н2↑
Гидроксид кальция
20.
Взаимодействие галогенов с водой2F2 + 2Н2О = 4HF + O2↑
Плавиковая кислота
Cl2 + Н2О = HCl + HClO
Соляная кислота Хлорноватистая кислота
21.
Взаимодействие воды с основнымии кислотными оксидами
Н2О + СаО = Са(ОН)2
Гидроксид кальция
Н2О + СО2 = Н2СО3
Угольная кислота
















 Химия
Химия








