Похожие презентации:
История открытия теории электролитической диссоциации
1.
История открытия теорииэлектролитической диссоциации
В 1887 году
шведский химик
Сванте Аррениус
сформулировал
основные
положения теории
электролитической
диссоциации
2.
Основные положения ТЭД1. При растворении в воде
электролиты диссоциируют
(распадаются) на положительные и
отрицательные ионы.
NaCl = Na+ + ClИоны – это одна из форм
существования химического элемента
3.
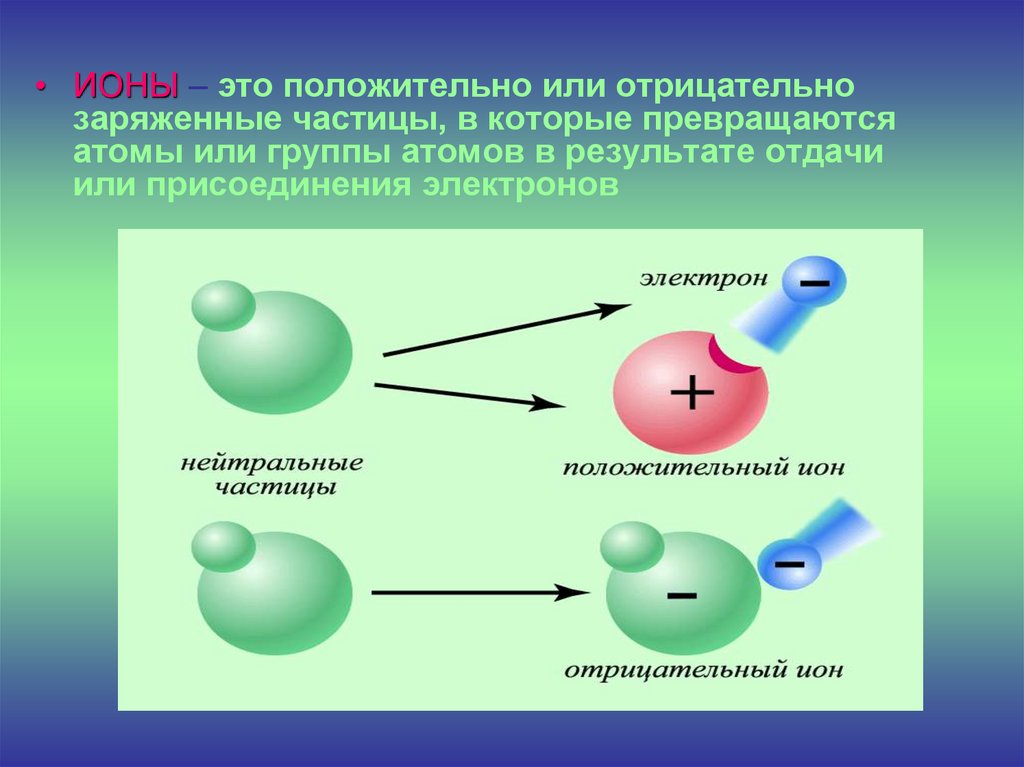
• ИОНЫ – это положительно или отрицательнозаряженные частицы, в которые превращаются
атомы или группы атомов в результате отдачи
или присоединения электронов
4.
ЭЛЕКТРОННЫЕ ФОРМУЛЫ0 2ē 8ē 1ē
Na
+11
атом
0 2ē 8ē 7ē
Cl
+17
атом
+ 2ē 8ē
Na
+11
ион
0 2ē 8ē 8ē
Cl
+17
ион
5.
ИОНЫ(по составу)
• ПРОСТЫЕ
Например:
• Cl• K+
• СЛОЖНЫЕ
Например:
• NO3• SO42-
6.
Основные положения ТЭД2. Причиной диссоциации электролита
в водном растворе является его
гидратация, т.е. взаимодействие
электролита с молекулами воды и
разрыв химической связи в нем.
7.
ИОНЫ(по наличию водной оболочки)
• ГИДРАТИРОВАННЫЕ
• НЕГИДРАТИРОВАННЫЕ
Например:
В растворах и
кристаллогидратах
CuSO4 * 5H2O
Na2SO4* 10H2O
Например:
В безводных солях
Cu2+SO42Na+NO3-
8.
Основные положения ТЭД3. Под действием электрического тока
положительно заряженные ионы
движутся к отрицательному полюсу
источника тока – катоду, поэтому их
называют катионами, а
отрицательно заряженные ионы
движутся к положительному полюсу
источника тока – аноду, поэтому их
называют анионами.
9.
ИОНЫ(по знаку заряда)
• КАТИОНЫ
положительно
заряженные
частицы
• АНИОНЫ
отрицательно
заряженные
частицы
10.
Основные положения ТЭД4. Электролитическая диссоциация –
процесс обратимый для слабых
электролитов.
Наряду с процессом диссоциации
протекает и обратный процесс –
ассоциация (соединение ионов)
HNO2
H+ + NO2-
11.
Основные положения ТЭД5. Не все электролиты в одинаковой
мере диссоциируют на ионы.
12.
степень диссоциации• Отношение числа молекул
электролита, распавшихся на ионы
к общему числу молекул в
растворе
13.
Факторы, влияющие настепень диссоциации
• 1) природа электролита и растворителя
• 2) температура
• 3) концентрация электролита
14.
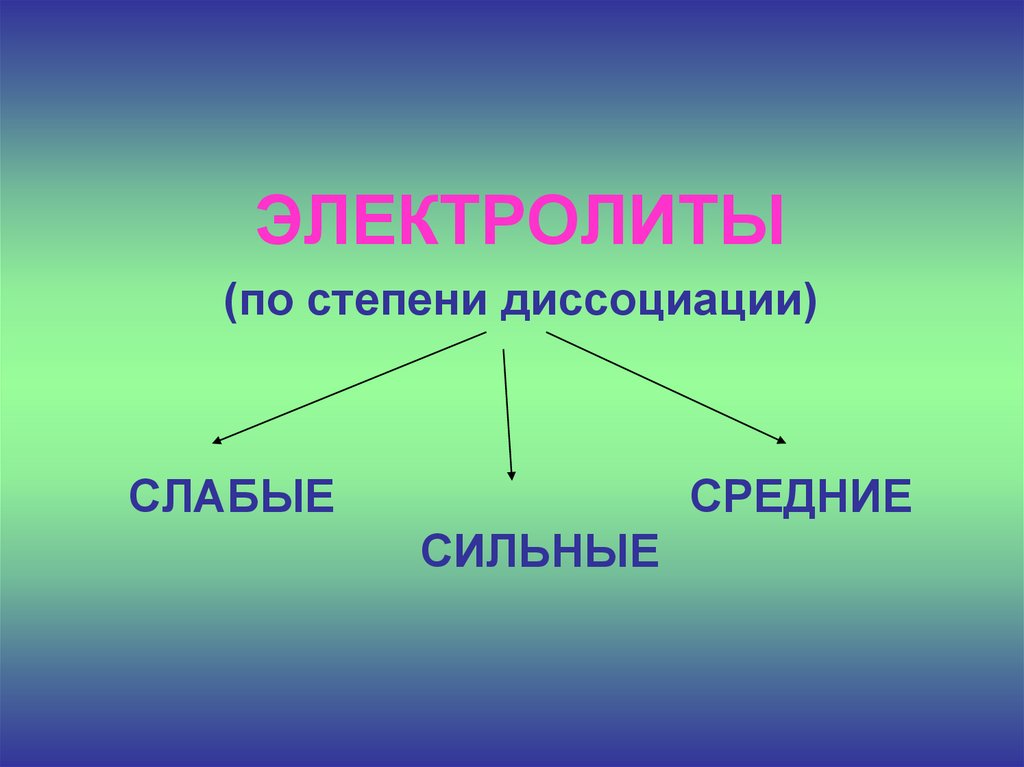
ЭЛЕКТРОЛИТЫ(по степени диссоциации)
СЛАБЫЕ
СРЕДНИЕ
СИЛЬНЫЕ
15.
Основные положения ТЭД6. Химические свойства растворов
электролитов определяются
свойствами тех ионов, которые они
образуют при диссоциации.
16.
ЭЛЕКТРОЛИТЫ(по характеру образующихся ионов)
КИСЛОТЫ
ОСНОВАНИЯ
СОЛИ
17.
ЗАДАНИЕСоставьте возможные уравнения
электролитической диссоциации
веществ в водных растворах.
1) HCl
2) HNO3 3) Н2SiO3
18.
ДОПИШИТЕ ОПРЕДЕЛЕНИЕКислоты – это электролиты, которые
диссоциируют на катионы
и анионы
19.
КИСЛОТЫ• электролиты, которые при диссоциации
образуют катионы водорода и анионы
кислотного остатка.
HCl = H+ + ClHNO3 = H+ + NO3-
20.
Многоосновные кислотыдиссоциируют ступенчато
H3PO4 (фосфорная кислота)
1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+ + H2PO42) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO423) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
21.
ЗАДАНИЕСоставьте возможные уравнения
электролитической диссоциации
веществ в водных растворах.
1) NaOH 2) KOH 3) Fe(OH)2
22.
ДОПИШИТЕ ОПРЕДЕЛЕНИЕОснования – это электролиты,
которые диссоциируют
на катионы
и анионы
23.
ОСНОВАНИЯ• электролиты, которые при диссоциации
образуют катионы металла и гидроксиданионы.
NaOH = Na+ + OHKOH = K+ + OH-
24.
Многокислотные основаниядиссоциируют ступенчато
Ba(OH)2 (гидроксид бария)
1) Образование гидроксо-ионов бария
Ba(OH)2 ↔ OH- + BaOH+
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
25.
ЗАДАНИЕСоставьте возможные уравнения
электролитической диссоциации
веществ в водных растворах.
1) NaCl 2) KNO3 3) BaSO4
26.
ДОПИШИТЕ ОПРЕДЕЛЕНИЕCоли – это электролиты, которые
диссоциируют на катионы
и анионы
27.
СОЛИэлектролиты, которые при
диссоциации образуют катионы
металла (или аммония NH4) и анионы
кислотных остатков.
K3PO4 = 3K+ + PO43NH4Cl = NH4+ + Cl-
28.
ПРОВЕРЬ СВОИ ЗНАНИЯ• Пользуясь таблицей растворимости,
приведите примеры трех веществ,
которые в растворах образуют
сульфат-ионы. Запишите уравнения
электролитической диссоциации
этих веществ.
1) H2SO4 ↔ H+ + HSO42) HSO4- ↔ H+ + SO42-


























 Химия
Химия








