Похожие презентации:
Химические реакции. Изменение степеней окисления
1.
Химические реакцииИзменение степеней окисления
атомов химических элементов
Реакции, протекающие без
изменения степеней
окисления атомов
химических элементов
Реакции, протекающие с
изменением степеней
окисления атомов
химических элементов
2.
Реакции без изменениястепени окисления
Реакции обмена
+2
–1
+1
+6 –2
+2
+6 –2
+1 –1
CaF2 + H2 SO4 = Ca SO4 + 2HF ↑
Степени окисления до реакции и
после остались неизменными.
3.
Реакции без изменениястепени окисления
Реакции обмена
+1 –2
+1
+1
+5 –2
+1 +5 –2
+1
–2
KOH + H NO3 = KNO3 + H2O
Степени окисления до реакции и
после остались неизменными.
4.
Окислительно-восстановительныереакции
Окислительно-восстановительными
реакции - химические реакции, в результате
которых происходит изменение степеней
окисления атомов химических элементов или
ионов, образующих реагирующие вещества.
5.
Окислительно-восстановительныереакции
+1
–1
0
+2
–1
0
2HCl + Mg = MgCl2 + H2 ↑
0
Mg –
+1
2H +
2е-
2е-
+2
→ Mg
→
0
H2
процесс восстановления
6.
+5N+
3e-
+3
1e-
Fe +
0
F+
→N
+2
+2
→ Fe
1e- →
F
–1
Восстановление — процесс присоединения
электронов атомами, ионами или молекулами.
7.
0Mg – 2е- → Mg+2
Окисление — процесс отдачи электронов
атомами, ионами или молекулами.
Степень окисления при этом всегда
повышается.
Окислители — атомы, ионы или
молекулы, принимающие электроны.
8.
Окислительно-восстановительныереакции
Число электронов до реакции и
после неё останется неизменным.
+1
–1
0
+2
–1
0
2HCl + Mg = MgCl2 + H2 ↑
Если атомы одного элемента в ходе реакции отдадут
электроны, повысив степень окисления, то атомы другого
элемента примут их, понизив свою степень окисления.
9.
Окислительно-восстановительныереакции
окисление
– 2e-
+1
–1
0
+2
–1
0
2 HCl + Mg = MgCl2 + H2
окислитель восстановитель
+ e-
восстановление
электронный баланс реакции
10.
Окислительно-восстановительныереакции
окисление
– 3e+2
–2
0
–2
+3
0
ZnSO4 + Al → Al2(SO4) 3 + Zn
+2
0
+ 2e
восстановление
Zn + 2e восстановление Zn 3
-
0
Al – 3e-
окисление
+3
Al
2
2Al + 3ZnSO4 = Al2(SO4)3 + 3Zn
11.
Окислительно-восстановительныереакции
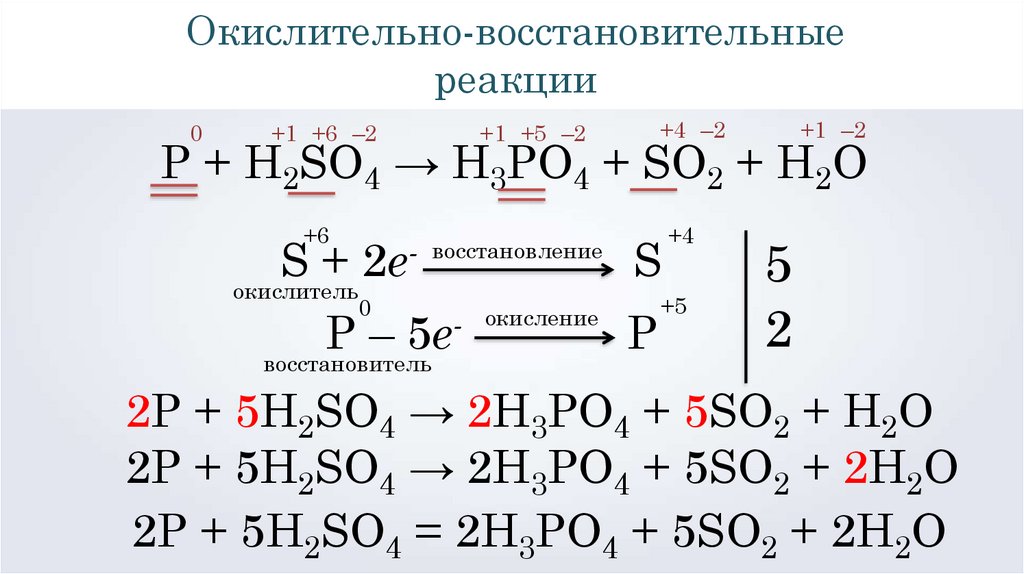
0
+1 +6 –2
+4 –2
+1 +5 –2
+1 –2
Р + H2SO4 → H3PO4 + SO2 + H2O
+6
S
+
2e
окислитель
0
восстановление
P
–
5e
восстановитель
окисление
S
P
+4
+5
5
2
2Р + 5H2SO4 → 2H3PO4 + 5SO2 + H2O
2Р + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
2Р + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
12.
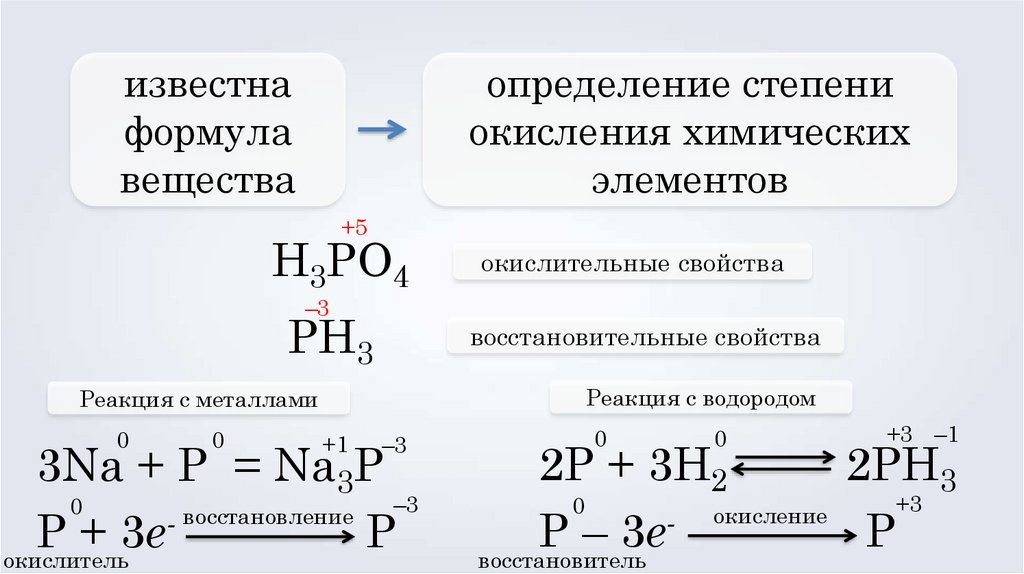
известнаформула
вещества
определение степени
окисления химических
элементов
+5
H3PO4
–3
PH3
восстановительные свойства
Реакция с водородом
Реакция с металлами
0
0
окислительные свойства
+1
–3
3Na + P = Na3P
–3
0
восстановление
P + 3e
P
окислитель
0
0
+3 –1
2P + 3H2
2PH3
+3
0
окисление
P
–
3e
P
восстановитель
13.
Основные окислители: кислород, галогены,азотная и серная кислоты, перманганат калия
(KMnO4) и т.д.
Основные восстановители: активные металлы,
водород, уголь, оксид углерода (II) (CO), сероводород
(H2S), аммиак (NH3).











 Химия
Химия








