Похожие презентации:
Место таргетной терапии в лечении пациентов с местнораспространенным плоскоклеточным раком головы и шеи
1. Место таргетной терапии в лечении пациентов с местнораспространенным плоскоклеточным раком головы и шеи
Гузь Александр ОлеговичВрач-онколог, заведующий отделением опухолей головы и шеи
ГБУЗ Челябинский областной клинический онкологический диспансер
Ижевск 2016
2.
Раскрытие информации1. Предоставленная презентация проводится при финансовой
поддержке Merck Biopharma
2. Информация, предоставляемая лектором, не обязательно отражает
мнение, идеи и взгляды Merck Biopharma
3. Плоскоклеточный рак головы и шеи (ПРГШ), диагностированный на поздних стадиях, отличается высокой смертностью
ЗаболеваемостьПРГШ* в Европе:
114 000 случаев
в год 2
>90% случаев рака
головы
и шеи* являются
плоскоклеточным
раком1
Общемировая
заболеваемость
ПРГШ*: 633 000
случаев в год1
Заболеваемость
ПРГШ* в России
в 2014г: 19 934
случаев3
Случаи ПРГШ*
составляют 5%
от общего количества
новых
злокачественных
новообразований во
всем мире1
Смертность
от ПРГШ* в Европе:
57 000 случаев
в год
Смертность
от ПРГШ*
в России в 2014г: 10
903 случаев3
Общемировая
смертность от ПРГШ*:
355 000 случаев в год1
* Включая рак губы, ротовой полости, гортани, носоглотки и других отделов глотки
1. Ferlay J, et al. Int J Cancer 2010;127:2893–2917
2. GLOBOCAN 2014 v2.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 10 [Internet]. Lyon, France: International Agency for Research on
Cancer; 2014. Available from: http://globocan.iarc.fr. Accessed on May 24.
3.Состояние онкологической помощи населению России в 2015 году. под ред. А.Д.Каприна, В.В.Старинского, Г.В. Петровой. ФГБУ «МНИОИ им. П.А.
Герцена» Минздрава России, Москва, 2016 г.
4. Запущенность и летальность
Летальность на первом году жизни,%Полость рта
Рак глотки
I; 11%
I; 4%
II; 15%
Глотка; 40,7
Глотка
IV; 31%
IV; 44%
II; 27%
III; 38%
III; 32%
Гортань
Полость рта
Полость рта; 32,6
I; 13%
IV; 18%
II; 27%
III; 42%
Гортань; 23
Гортань
0
5
10
15
20
25
30
35
40
45
Состояние онкологической помощи населению России в 2015 году.
Под редакцией А.Д.Каприна, В.В. Старинского, Г.В. Петровой, 2016
5. Задачи лечения местнораспространенного ПРГШ
ИзлечениеОсновные задачи лечения
Продление
жизни
Сохранение
органа
Качество
жизни
У пациентов с резектабельным заболеванием, у которых предполагаемые
функциональные результаты хирургического вмешательство являются
неблагоприятными, и не хирургический подход не приведет к ухудшению
выживаемости1
Может определять выбор лечения при сравнимой
эффективности разных вариантов
При подборе оптимальной тактики лечения необходимо
учитывать как клинические, так и психосоциальные факторы2
1. Soo K-C, et al. Br J Cancer 2005;93:279–286;
2. Ang KK. Oncologist 2008;13:899–910
6. Варианты лечения местнораспространенного ПРГШ
МестнораспространенныйПРГШ1
Лечение на основе
хирургического вмешательства
Хирургическое
вмешательство
Лечение на основе
ЛТ
Сочетанная
терапия
Последовательная
терапия
Только
ЛТ
Наблюдение
TPF
(Х)ЛТ
Цетуксимаб
+ ЛТ
Цетуксимаб
+ ЛТ2
ХЛТ
Цетуксимаб
+ ЛТ3,4
(Х)ЛТ
TPF, доцетаксел, карбоплатин и 5-фторурацил
1. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V1,2015; 2. Bonner JA, et al. N Engl J Med 2006;354:567–
578; 3. Lefebvre J-L, et al. J Clin Oncol 2013;31:853–859; 4. Ghi MG, et al. ICHNO 2015 (Abstract No. OC-006)
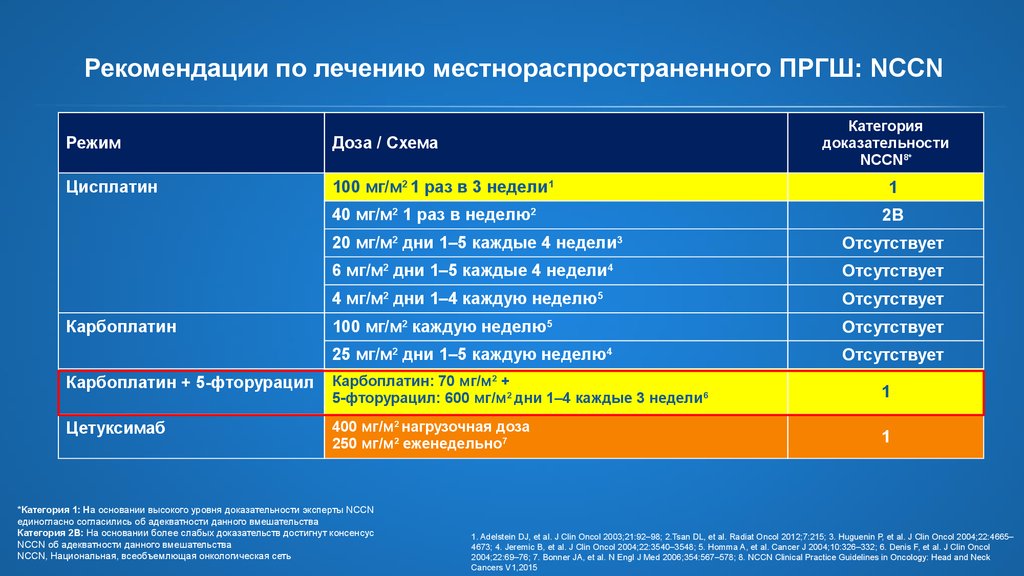
7.
Рекомендации по лечению местнораспространенного ПРГШ: NCCNРежим
Доза / Схема
Цисплатин
100 мг/м2 1 раз в 3 недели1
40 мг/м2 1 раз в неделю2
Карбоплатин
Категория
доказательности
NCCN8*
1
2B
20 мг/м2 дни 1–5 каждые 4 недели3
Отсутствует
6 мг/м2 дни 1–5 каждые 4 недели4
Отсутствует
4 мг/м2 дни 1–4 каждую неделю5
Отсутствует
100 мг/м2 каждую неделю5
Отсутствует
25 мг/м2 дни 1–5 каждую неделю4
Отсутствует
Карбоплатин + 5-фторурацил
Карбоплатин: 70 мг/м2 +
5-фторурацил: 600 мг/м2 дни 1–4 каждые 3 недели6
1
Цетуксимаб
400 мг/м2 нагрузочная доза
250 мг/м2 еженедельно7
1
*Категория 1: На основании высокого уровня доказательности
эксперты NCCN единогласно согласились об адекватности данного
вмешательства
Категория 2B: На основании более слабых доказательств достигнут
консенсус NCCN об адекватности данного вмешательства
NCCN, Национальная, всеобъемлющая онкологическая сеть
1. Adelstein DJ, et al. J Clin Oncol 2003;21:92–98; 2.Tsan DL, et al. Radiat Oncol 2012;7:215; 3. Huguenin P, et al. J Clin Oncol 2004;22:4665–4673; 4. Jeremic B, et al. J
Clin Oncol 2004;22:3540–3548; 5. Homma A, et al. Cancer J 2004;10:326–332; 6. Denis F, et al. J Clin Oncol 2004;22:69–76; 7. Bonner JA, et al. N Engl J Med
2006;354:567–578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V1,2015
8. Добавление высоких доз цисплатина к ЛТ улучшает выживаемость...
ОВ,
мес
3-х летняя
выживаемость
ЛТ
12,6
23%
ЛТ+Цисплатин
19,1
37%
ЛТ (усеч курс)
+Цисплатин/5-ФУ
13,8
27%
ЛТ
ЛТ+Цисплатин
ЛТ(усеч курс)+Цисплатин/5-ФУ
Adelstein DJ et al (2003), J Clin Oncol 21: 92-98
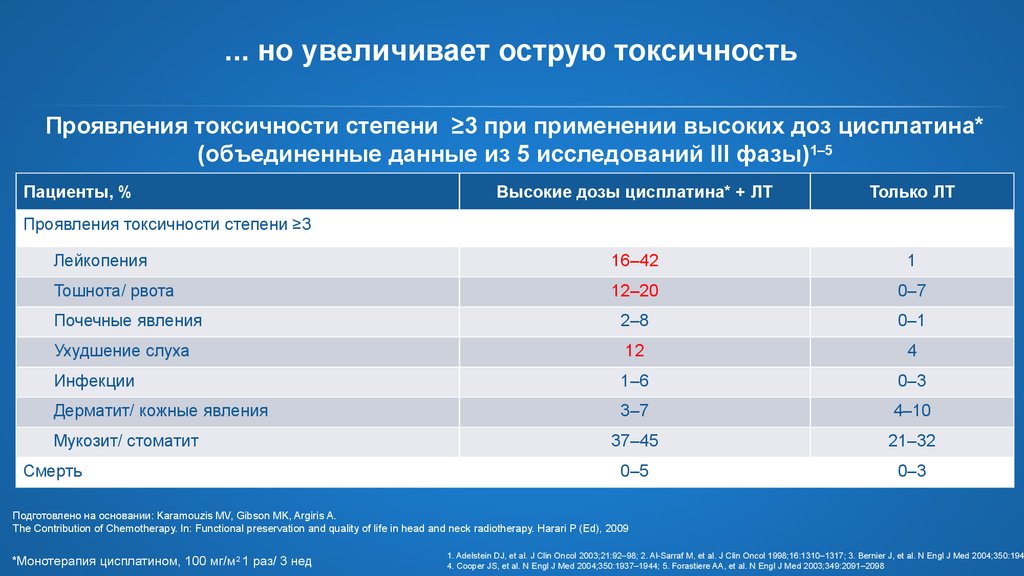
9. ... но увеличивает острую токсичность
Проявления токсичности степени ≥3 при применении высоких доз цисплатина*(объединенные данные из 5 исследований III фазы)1–5
Пациенты, %
Высокие дозы цисплатина* + ЛТ
Только ЛТ
Лейкопения
16–42
1
Тошнота/ рвота
12–20
0–7
Почечные явления
2–8
0–1
Ухудшение слуха
12
4
Инфекции
1–6
0–3
Дерматит/ кожные явления
3–7
4–10
37–45
21–32
0–5
0–3
Проявления токсичности степени ≥3
Мукозит/ стоматит
Смерть
Подготовлено на основании: Karamouzis MV, Gibson MK, Argiris A.
The Contribution of Chemotherapy. In: Functional preservation and quality of life in head and neck radiotherapy. Harari P (Ed), 2009
*Монотерапия цисплатином, 100 мг/м2 1 раз/ 3 нед
1. Adelstein DJ, et al. J Clin Oncol 2003;21:92–98; 2. Al-Sarraf M, et al. J Clin Oncol 1998;16:1310–1317; 3. Bernier J, et al. N Engl J Med 2004;350:194
4. Cooper JS, et al. N Engl J Med 2004;350:1937–1944; 5. Forastiere AA, et al. N Engl J Med 2003;349:2091–2098
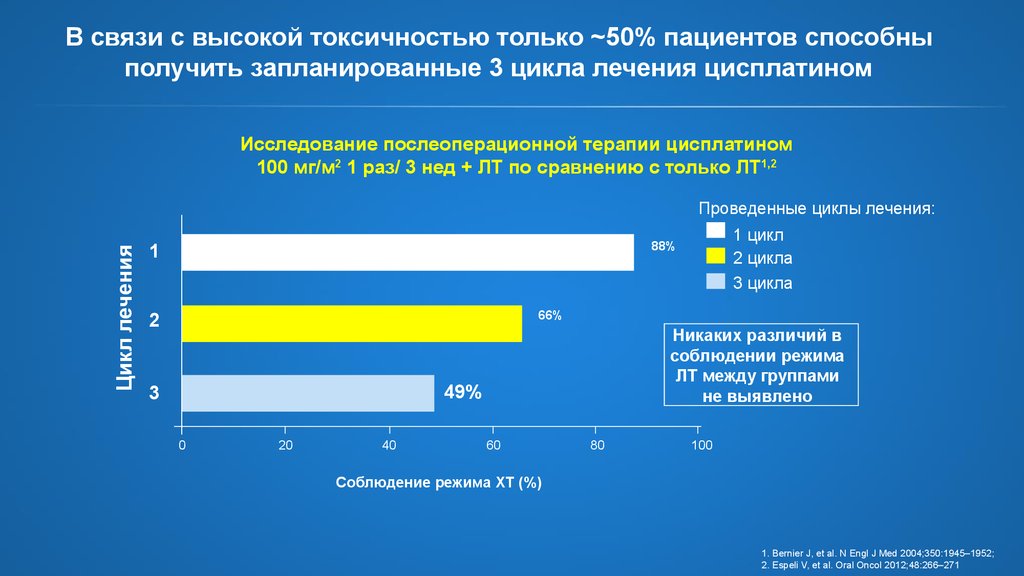
10. В связи с высокой токсичностью только ~50% пациентов способны получить запланированные 3 цикла лечения цисплатином
Исследование послеоперационной терапии цисплатином100 мг/м2 1 раз/ 3 нед + ЛТ по сравнению с только ЛТ1,2
Цикл лечения
Проведенные циклы лечения:
1 цикл
2 цикла
3 цикла
88%
1
66%
2
Никаких различий в
соблюдении режима
ЛТ между группами
не выявлено
49%
3
0
20
40
60
80
100
Соблюдение режима ХТ (%)
1. Bernier J, et al. N Engl J Med 2004;350:1945–1952;
2. Espeli V, et al. Oral Oncol 2012;48:266–271
11. На возможность применения высоких доз цисплатина влияет множество факторов, связанных с состоянием самих пациентов
Критерии пациента• Возраст > 70 лет1,2
• Потеря веса > 20%2
• Курение3,4
• В анамнезе употребление нефротоксичных препаратов2
• ECOG > 12
• Отсутствие социальной и домашней поддержки/ухода2
Сопутствующая патология
• Дисфункция почек: клиренс креатинина менее 60 мл/мин2,3
• Снижение слуха2
• Печеночная/дыхательная недостаточность2
• Неврологические расстройства2
• Сердечно-сосудистые заболевания2
• ВИЧ/СПИД (3 стадия, снижение CD клеток менее 350)2
1. Machtay M, et al. J Clin Oncol 2008;26:3582–3589; 2. Ahn MJ, Oral Oncol 2016;53:10–16; 3. Miller RP, et al.
Toxins 2010;2:2490–2518; 4. Galloway T, et al. Available at: http://www.uptodate.com/contents/management-oflate- complications-of-head-and-neck-cancer-and-its-treatment. Last accessed February 2016
12.
Рекомендации по лечению местнораспространенного ПРГШ: NCCNКатегория
доказательности
NCCN8*
Режим
Доза / Схема
Цисплатин
100 мг/м2 1 раз в 3 недели1
40 мг/м2 1 раз в неделю2
Карбоплатин
1
2B
20 мг/м2 дни 1–5 каждые 4 недели3
Отсутствует
6 мг/м2 дни 1–5 каждые 4 недели4
Отсутствует
4 мг/м2 дни 1–4 каждую неделю5
Отсутствует
100 мг/м2 каждую неделю5
Отсутствует
25 мг/м2 дни 1–5 каждую неделю4
Отсутствует
Карбоплатин + 5-фторурацил
Карбоплатин: 70 мг/м2 +
5-фторурацил: 600 мг/м2 дни 1–4 каждые 3 недели6
1
Цетуксимаб
400 мг/м2 нагрузочная доза
250 мг/м2 еженедельно7
1
*Категория 1: На основании высокого уровня доказательности эксперты NCCN
единогласно согласились об адекватности данного вмешательства
Категория 2B: На основании более слабых доказательств достигнут консенсус
NCCN об адекватности данного вмешательства
NCCN, Национальная, всеобъемлющая онкологическая сеть
1. Adelstein DJ, et al. J Clin Oncol 2003;21:92–98; 2.Tsan DL, et al. Radiat Oncol 2012;7:215; 3. Huguenin P, et al. J Clin Oncol 2004;22:4665–
4673; 4. Jeremic B, et al. J Clin Oncol 2004;22:3540–3548; 5. Homma A, et al. Cancer J 2004;10:326–332; 6. Denis F, et al. J Clin Oncol
2004;22:69–76; 7. Bonner JA, et al. N Engl J Med 2006;354:567–578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck
Cancers V1,2015
13. Комбинация Карбоплатин/5-фторурацил + ЛТ также характеризуется значимой острой токсичностью
Карбоплатин/5-фторурацил
+ ЛТ, %
ЛТ, %
Значение р
GORТEC 94-01 (МР РРГ)1
51,0
31,0
0,02
GORТEC 99-02 (МР ПКРГШ)2
42,6
36,5
0,04
Карбоплатин/
5-фторурацил
+ ЛТ, n
ЛТ, n
Значение р
3-летняя общая выживаемость
Продление
выживаемости
Токсичность (GORТEC 94-01 [МР РРГ])1
Мукозит
Мукозит
Очаговый мукозит
Сливной фибринозный мукозит
57
14
32
7
0,005
Не сообщено
Проблемы со
стороны кожи
Кожа
Эритема/ зуд/ сухое шелушение
Влажное шелушение
44
23
47
12
0,02
Не сообщено
Статус питания
Снижение массы тела >10%
Необходимость питания через зонд
14
36
6
15
0,04
0,02
Общий клинический анализ крови
Количество нейтрофилов <0,9 клеток/ мм3
Количество тромбоцитов <50 клеток/мм3
Уровень гемоглобина <8 г/100 мл
4
6
3
0
1
0
0,04
0,04
0,05
Токсическая смерть
1
0
Не сообщено
Ухудшение питания
Снижение
гематологических
показателей
Смерть
МР = местнораспространенный; РРГ = рак ротоглотки
1. Calais G, et al. J Natl Cancer Inst 1999;91:2081–2086;
2. Bourhis J, et al. Lancet Oncol 2012;13:145–153;
14.
Рекомендации по лечению местнораспространенного ПРГШ: NCCNКатегория
доказательности
NCCN8*
Режим
Доза / Схема
Цисплатин
100 мг/м2 1 раз в 3 недели1
40 мг/м2 1 раз в неделю2
Карбоплатин
1
2B
20 мг/м2 дни 1–5 каждые 4 недели3
Отсутствует
6 мг/м2 дни 1–5 каждые 4 недели4
Отсутствует
4 мг/м2 дни 1–4 каждую неделю5
Отсутствует
100 мг/м2 каждую неделю5
Отсутствует
25 мг/м2 дни 1–5 каждую неделю4
Отсутствует
Карбоплатин + 5-фторурацил
Карбоплатин: 70 мг/м2 +
5-фторурацил: 600 мг/м2 дни 1–4 каждые 3 недели6
1
Цетуксимаб
400 мг/м2 нагрузочная доза
250 мг/м2 еженедельно7
1
*Категория 1: На основании высокого уровня доказательности
эксперты NCCN единогласно согласились об адекватности данного
вмешательства
Категория 2B: На основании более слабых доказательств достигнут
консенсус NCCN об адекватности данного вмешательства
NCCN, Национальная, всеобъемлющая онкологическая сеть
1. Adelstein DJ, et al. J Clin Oncol 2003;21:92–98; 2.Tsan DL, et al. Radiat Oncol 2012;7:215; 3. Huguenin P, et al. J Clin Oncol 2004;22:4665–
4673; 4. Jeremic B, et al. J Clin Oncol 2004;22:3540–3548; 5. Homma A, et al. Cancer J 2004;10:326–332; 6. Denis F, et al. J Clin Oncol
2004;22:69–76; 7. Bonner JA, et al. N Engl J Med 2006;354:567–578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck
Cancers V1,2015
15. Таргетная терапия позволяет добиться высокой эффективности лечения при невысоком уровне токсичности
Рандомизированное исследование III фазы BonnerНеметастатический ПРГШ
III и IV стадии
1,2
:
Цетуксимаб + ЛТ
(n=211)
81
Только ЛТ
(n=213)
79
56 (35–83)
58 (34–81)
ФС Karnofsky, %
60–80
90–100
30
70
34
67
Первичная локализация опухоли, %
Ротоглотка
Гортаноглотка
Гортань
56
17
27
63
13
24
Стадия опухоли, %
III
IV
26
74
24
76
Стадия для регионарных метастазов, %
N0
N1–3
20
80
18
82
Показатель
Пол (мужской), %
Медиана возраста (диапазон), годы
N=424
R
Цетуксимаб +
ЛТ
ЛТ
Первичная конечная точка:
• Локорегионарный контроль
Вторичные конечные точки:
• Общая выживаемость, выживаемость без
прогрессирования, частота ответов, безопасность
*p<0,01 для сравнения с только ЛТ; **p<0,05
1. Bonner JA, et al. N Engl J Med 2006;354:567–578;
2. Bonner JA, et al. Lancet Oncol 2010;11:21–28
16. Добавление Цетуксимаба к ЛТ достоверно улучшает как локорегионарный контроль...
Локорегионарный контроль (%)100
Цетуксимаб + ЛТ (n=211)
ЛТ (n=213)
80
Частота контроля в течение 3 лет
60
47%
24,4 месяца
14,9
месяца
40
20
34%
0
HR 0,68 (95% ДИ 0,52–0,89)
p=0,005
0
10
20
30
40
50
60
Месяцы
Bonner JA, et al. N Engl J Med 2006;354:567–578
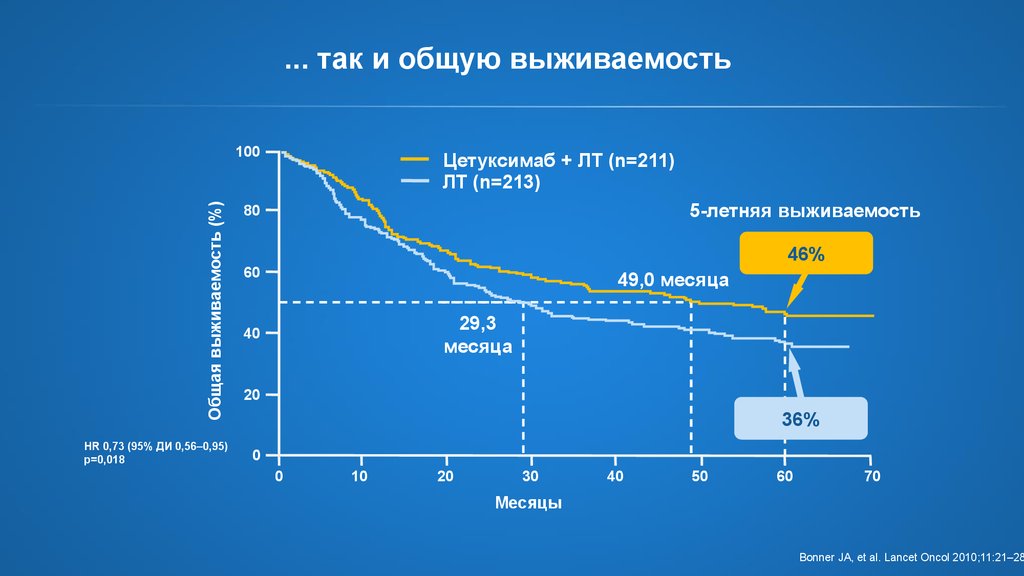
17.
... так и общую выживаемостьОбщая выживаемость (%)
100
HR 0,73 (95% ДИ 0,56–0,95)
p=0,018
Цетуксимаб + ЛТ (n=211)
ЛТ (n=213)
5-летняя выживаемость
80
46%
60
49,0 месяца
29,3
месяца
40
20
36%
0
0
10
20
30
40
50
60
70
Месяцы
Bonner JA, et al. Lancet Oncol 2010;11:21–28
18.
Добавление Цетуксимаба к ЛТне увеличивает тяжесть проявлений токсичности*
Цетуксимаб + ЛТ (n=208)
Проявления токсичности у пациентов с
местнораспространенным ПКРГШ
ЛТ (n=212)
Мукозит
Дисфагия
Специфичные для ЛТ
нежелательные явления
Лучевой дерматит
Значимое увеличение отсутствует
Ксеростомия
Усталость/
недомогание
Специфичные для Цетуксимаба
нежелательные явления
p<0,001
Угревидная сыпь
Поддающиеся коррекции и
обратимые
p=0,01
Инфузионные
реакции
0
10
20
30
40
50
60
Пациенты (%)
Медиана длительности мукозита или дисфагии в общей популяции была схожа в обеих группах
*За исключением инфузионных реакций и угревидной сыпи, которые обычно не наблюдаются
при проведении только ЛТ
Bonner JA, et al. N Engl J Med 2006;354:567–578
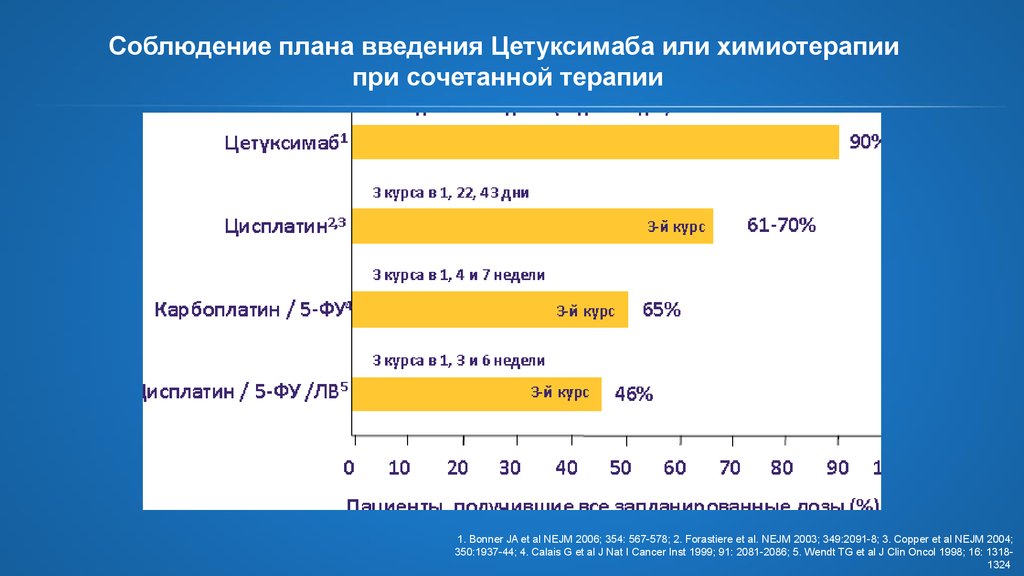
19. Соблюдение плана введения Цетуксимаба или химиотерапии при сочетанной терапии
1. Bonner JA et al NEJM 2006; 354: 567-578; 2. Forastiere et al. NEJM 2003; 349:2091-8; 3. Copper et al NEJM 2004;350:1937-44; 4. Calais G et al J Nat I Cancer Inst 1999; 91: 2081-2086; 5. Wendt TG et al J Clin Oncol 1998; 16: 13181324
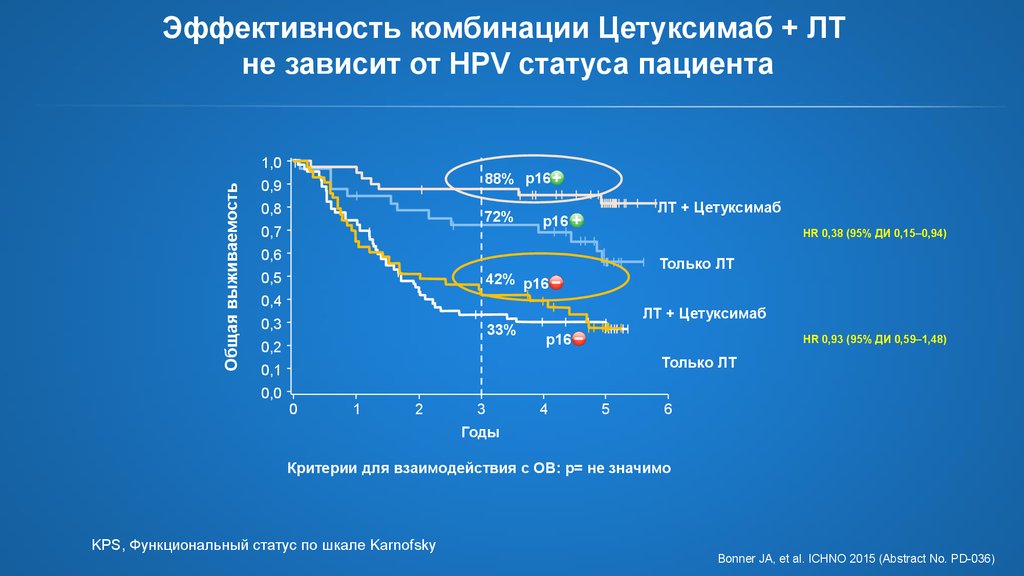
20. Эффективность комбинации Цетуксимаб + ЛТ не зависит от HPV статуса пациента
Общая выживаемость1,0
88% p16
0,9
0,8
72%
0,7
ЛТ + Цетуксимаб
p16
HR 0,38 (95% ДИ 0,15–0,94)
0,6
0,5
Только ЛТ
42% p16
0,4
0,3
33%
0,2
ЛТ + Цетуксимаб
p16
HR 0,93 (95% ДИ 0,59–1,48)
Только ЛТ
0,1
0,0
0
1
2
3
4
5
6
Годы
Критерии для взаимодействия с ОВ: p= не значимо
KPS, Функциональный статус по шкале Karnofsky
Bonner JA, et al. ICHNO 2015 (Abstract No. PD-036)
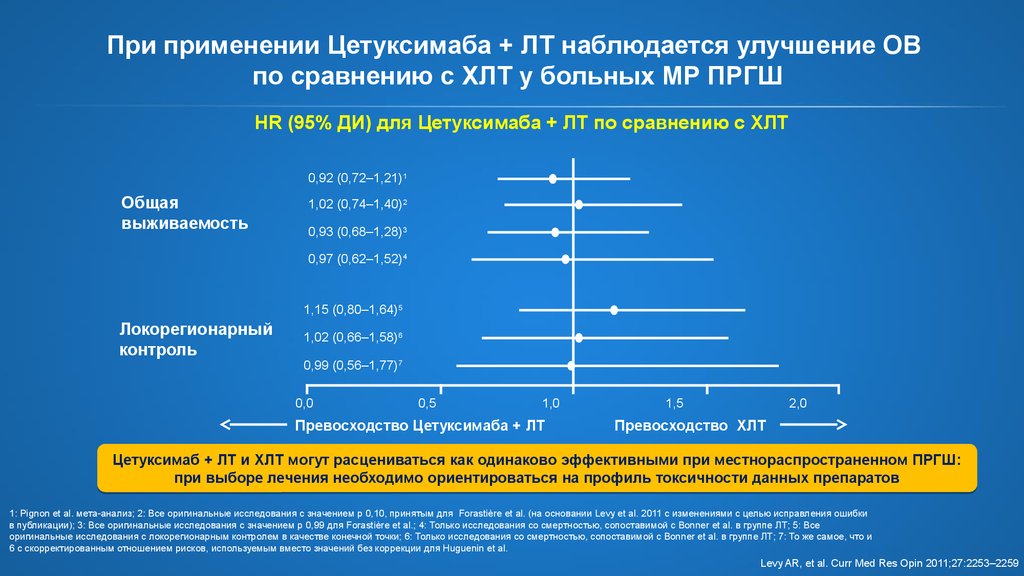
21. При применении Цетуксимаба + ЛТ наблюдается улучшение ОВ по сравнению с ХЛТ у больных МР ПРГШ
HR (95% ДИ) для Цетуксимаба + ЛТ по сравнению с ХЛТ0,92 (0,72–1,21)1
Общая
выживаемость
1,02 (0,74–1,40)2
0,93 (0,68–1,28)3
0,97 (0,62–1,52)4
1,15 (0,80–1,64)5
Локорегионарный
контроль
1,02 (0,66–1,58)6
0,99 (0,56–1,77)7
0,0
0,5
1,0
Превосходство Цетуксимаба + ЛТ
1,5
2,0
Превосходство ХЛТ
Цетуксимаб + ЛТ и ХЛТ могут расцениваться как одинаково эффективными при местнораспространенном ПРГШ:
при выборе лечения необходимо ориентироваться на профиль токсичности данных препаратов
1: Pignon et al. мета-анализ; 2: Все оригинальные исследования с значением р 0,10, принятым для Forastière et al. (на основании Levy et al. 2011 с изменениями с целью исправления ошибки
в публикации); 3: Все оригинальные исследования с значением р 0,99 для Forastière et al.; 4: Только исследования со смертностью, сопоставимой с Bonner et al. в группе ЛТ; 5: Все
оригинальные исследования с локорегионарным контролем в качестве конечной точки; 6: Только исследования со смертностью, сопоставимой с Bonner et al. в группе ЛТ; 7: То же самое, что и
6 с скорректированным отношением рисков, используемым вместо значений без коррекции для Huguenin et al.
Levy AR, et al. Curr Med Res Opin 2011;27:2253‒2259
22. Цетуксимаб (400 мг/м2 в день 1), за 1 неделю до начала ЛТ; Затем на 2-8-й неделях по 250 мг/м2 1 раз в неделю. ЛТ проводится на 2-8-й неделях.
Режим дозирования Цетуксимаба приместнораспространенном ПРГШ в комбинации с ЛТ
Цетуксимаб (400 мг/м2 в день 1), за 1 неделю до начала ЛТ;
Затем на 2-8-й неделях по 250 мг/м2 1 раз в неделю.
ЛТ проводится на 2-8-й неделях.
23. В руководствах Цетуксимаб + ЛТ признается стандартным вариантом терапии местно-распространенного ПРГШ
Альтернативным вариантом может быть одновременное с лучевой терапией назначениеЦетуксимаба (400 мг / м2 за неделю до лучевой терапии и 250 мг/м2
еженедельно в процессе ее), что обеспечивает увеличение общей продолжительности
жизни и улучшает локорегионарный контроль в сравнении с лучевой терапией, но не
увеличивает токсичность.(RUSSCO)
Злокачественные
В руководствах NCCN рекомендуется применение
опухоли головы и шеи
Цетуксимаба в качестве первичной системной терапии в
сочетании с ЛТ при местнораспространенном ПКРГШ за
пределами носоглотки, или в составе последовательной ХТ
после индукционной ХТ (Категория 1
доказательности)1
Плоскоклеточный рак
головы и шеи: Практические
клинические руководства по диагностике, лечению и
наблюдению EHNS-ESMO-ESTRO
Согласно руководствам ESMO «Цетуксимаб + ЛТ характеризуется более
высокой частотой ответов, увеличением выживаемости без прогрессирования
[!!!] и общей выживаемости по сравнению с только ЛТ»
(Уровень доказательности II, B)2
ESMO, Европейское общество медицинской онкологии
1. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V1. 2015;
2. Grégoire V, et al. Ann Oncol 2010;21(Suppl 5): vi184–vi186
24. Выводы
Добавление препаратов платины к ЛТ улучшает выживаемость по сравнениюс ЛТ, но характеризуется высокой токсичностью и значимой частотой
несоблюдения режима терапии
Цетуксимаб + ЛТ улучшает общую выживаемость по сравнению с ЛТ без
ухудшения качества жизни
Цетуксимаб+ ЛТ демонстрирует локорегиональный контроль в течение 3-х
лет
Цетуксимаб эффективен вне зависимости от статуса HPV (р16)
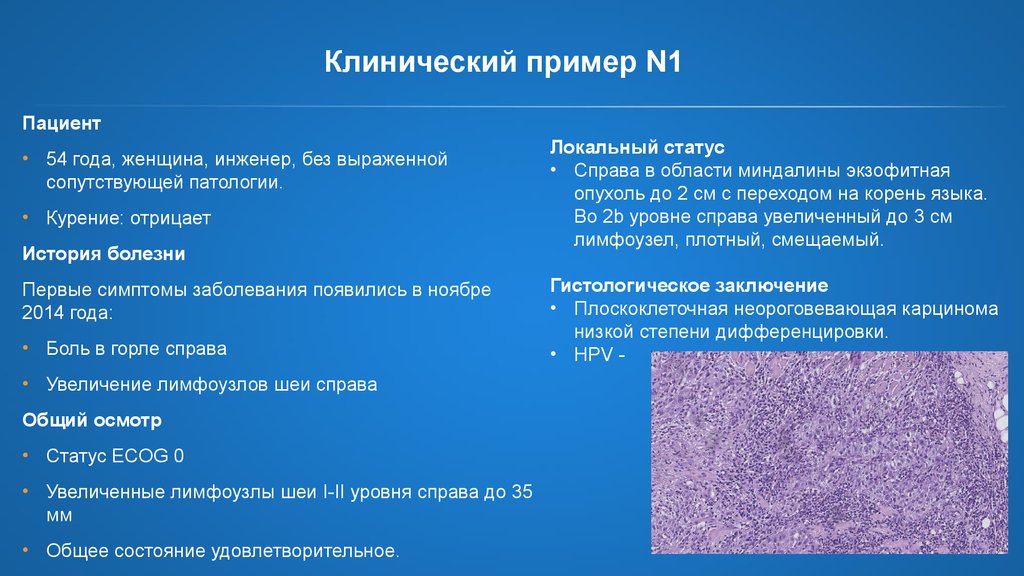
25. Клинический пример N1
Пациент• 54 года, женщина, инженер, без выраженной
сопутствующей патологии.
• Курение: отрицает
История болезни
Первые симптомы заболевания появились в ноябре
2014 года:
• Боль в горле справа
• Увеличение лимфоузлов шеи справа
Общий осмотр
• Статус ECOG 0
• Увеличенные лимфоузлы шеи I-II уровня справа до 35
мм
• Общее состояние удовлетворительное.
Локальный статус
• Справа в области миндалины экзофитная
опухоль до 2 см с переходом на корень языка.
Во 2b уровне справа увеличенный до 3 см
лимфоузел, плотный, смещаемый.
Гистологическое заключение
• Плоскоклеточная неороговевающая карцинома
низкой степени дифференцировки.
• HPV -
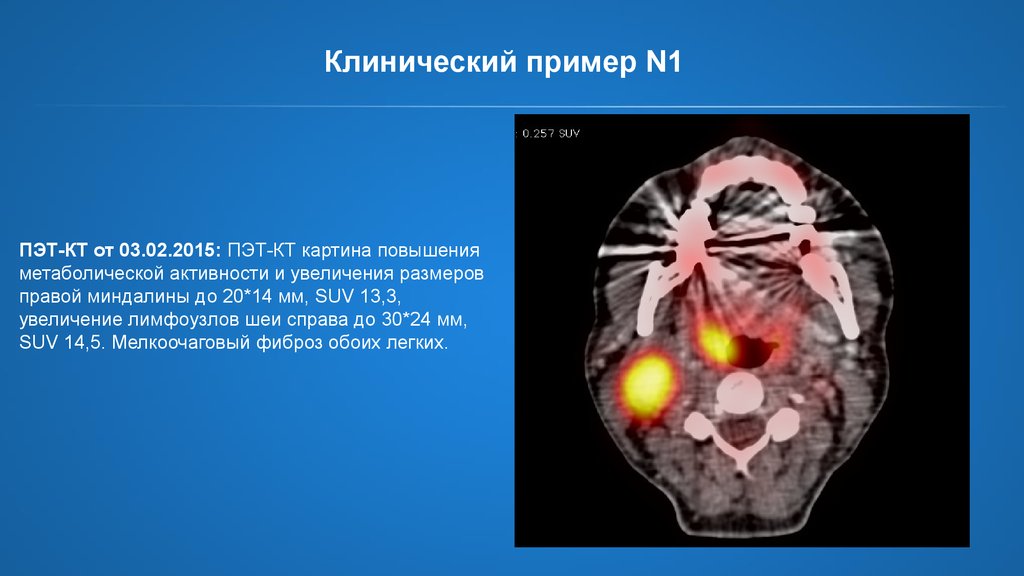
26. Клинический пример N1
ПЭТ-КТ от 03.02.2015: ПЭТ-КТ картина повышенияметаболической активности и увеличения размеров
правой миндалины до 20*14 мм, SUV 13,3,
увеличение лимфоузлов шеи справа до 30*24 мм,
SUV 14,5. Мелкоочаговый фиброз обоих легких.
27.
Клинический пример N1Диагноз
• Плоскоклеточный рак ротоглотки с метастазами в лимфоузлы шеи
справа.
• cT1N2bM0 IVa ст.
• Дисфагия 0 ст.
28.
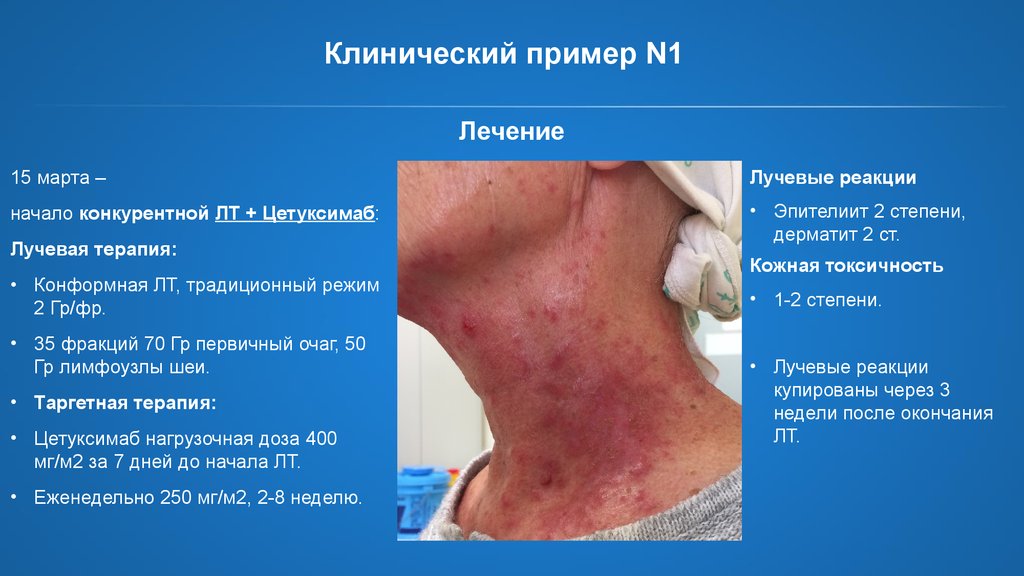
Клинический пример N1Лечение
15 марта –
Лучевые реакции
начало конкурентной ЛТ + Цетуксимаб:
• Эпителиит 2 степени,
дерматит 2 ст.
Лучевая терапия:
• Конформная ЛТ, традиционный режим
2 Гр/фр.
• 35 фракций 70 Гр первичный очаг, 50
Гр лимфоузлы шеи.
• Таргетная терапия:
• Цетуксимаб нагрузочная доза 400
мг/м2 за 7 дней до начала ЛТ.
• Еженедельно 250 мг/м2, 2-8 неделю.
Кожная токсичность
• 1-2 степени.
• Лучевые реакции
купированы через 3
недели после окончания
ЛТ.
29.
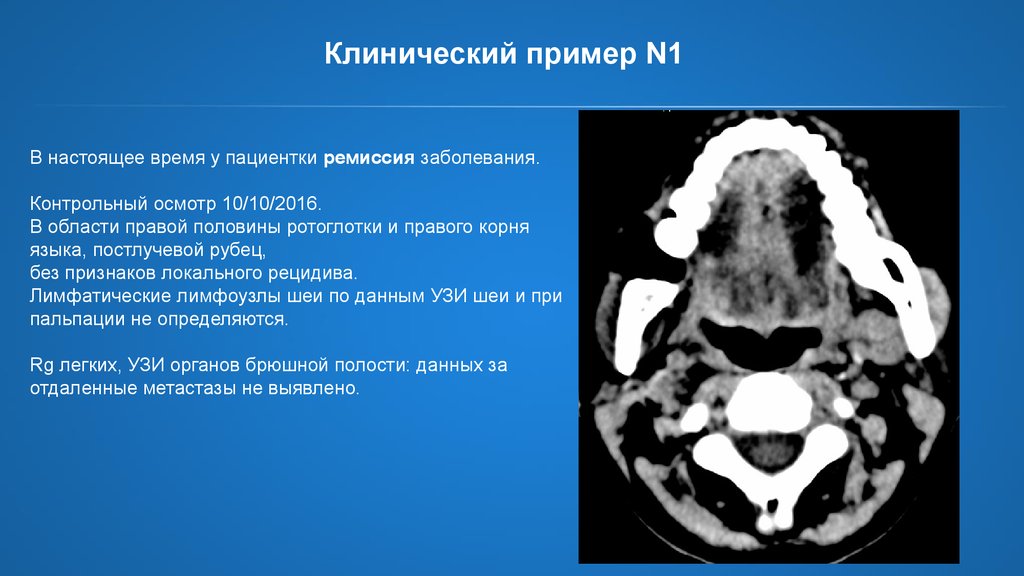
Клинический пример N1В настоящее время у пациентки ремиссия заболевания.
Контрольный осмотр 10/10/2016.
В области правой половины ротоглотки и правого корня
языка, постлучевой рубец,
без признаков локального рецидива.
Лимфатические лимфоузлы шеи по данным УЗИ шеи и при
пальпации не определяются.
Rg легких, УЗИ органов брюшной полости: данных за
отдаленные метастазы не выявлено.
30.
Режим дозирования Цетуксимаба прирецидивирующем/ метастатическом ПРГШ
Цетуксимаб
(Начальная доза 400 мг/м2 - неделя 1
Со 2-ой недели - 250 мг/м2 еженедельно)
Цисплатин (100 мг/м2 в/в, день1)
[или Карбоплатин (AUC 5 мг/мл/мин, день1)]
+
5-Фторурацил (1000 мг/м2 /день в/в, дни 1–4)
Цетуксимаб
(250 мг/м2 еженедельно)
До прогрессирования
До 6 курсов (длительность 1 курса = 3 недели)
Vermorken JB, et al. N Engl J Med 2008;359:1116–1127
31.
Клинический пример N2Пациент
• 27 лет, мужчина.
• Курение: отрицает
История болезни
Первые симптомы заболевания появились в ноябре
2015 года:
Локальный статус
Правая половина гортани занята
экзофитной опухолью, опухоль
локализована в вестибуляном и среднем
отделе, переходит на подскладочный
отдел. Парез правой половины гортани.
Лимфатические узлы шеи не увеличены.
• Осиплость.
• Чувство инородного тела при глотании.
Общий осмотр
• Статус ECOG 0-1
• Регионарные лимфоузлы не увеличены
• Общее состояние удовлетворительное.
Rg органов грудной клетки
• Данных за отделенные метастазы нет.
Клиническое обследование
• Патологии не выявлено
32.
Клинический пример N2Гистологическое заключение
• Плоскоклеточная ороговевающая
карцинома высокой степени
дифференцировки.
• HPV -
Диагноз
Плоскоклеточный рак гортани
cT3N0M0 III ст.
Дисфагия 0 ст.
ХБС 0 баллов по ШВО.
С учетом стадии заболевания, поражения всех
отделов гортани пациенту спланировано
хирургическое лечение в объеме:
ларингэктомия, селективная лимфаденэктомия с
двух сторон II-V уровней, трахеостомия
33.
Клинический пример N2Лечение
25.04.2016 операция: СШЛАЭ 2-5 уровней с двух сторон,
ларингэктомия, трахеостомия.
Гистологическое заключение:Плоскоклеточная ороговевающая
карцинома гортани высокой степени дифференцировки G1, толщина
опухоли 0.8 cм, с прорастанием в фиброзно-хрящевую оболочку. Края
резекции – роста опухоли не обнаружено. Метастазов в 7 лимфоузлах
слева, 8 справа, а также 8 лимфоузлах основного органокомплекса
не выявлено.
Периневральной инвазии и опухолевых эмболов не выявлено.
С 07.06.2016 по 18.07.2016 проведен послеоперационный курс
лучевой терапии на ложе удаленной опухоли + зона
субклинического распространения + лимфатические узлы шеи (I, II
уровень) с РОД 2 Гр до СОД=50 Гр + лимфатические узлы шеи (II,
IV, V уровень) с РОД 2 Гр до СОД 46 Гр.
34.
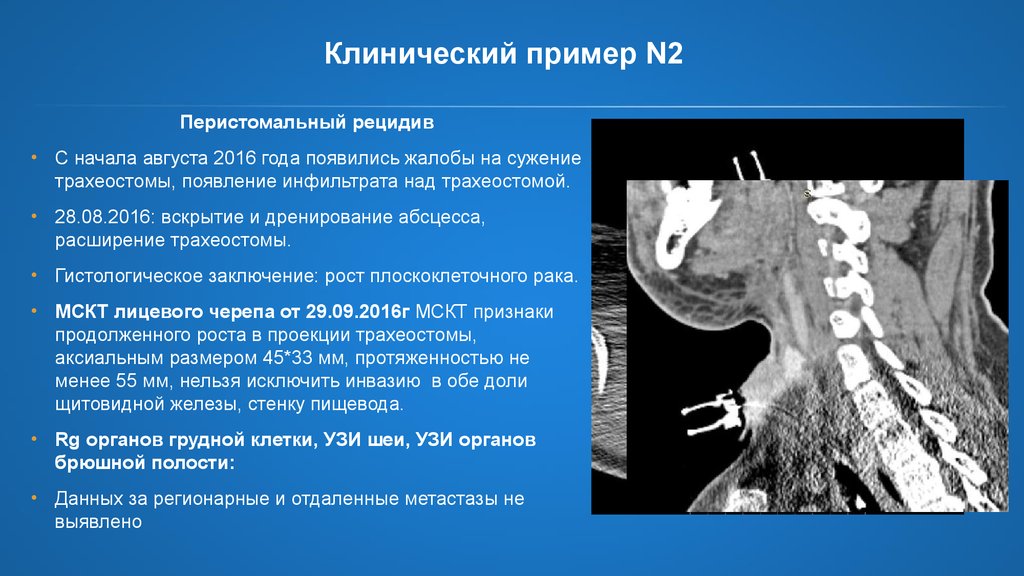
Клинический пример N2Перистомальный рецидив
• С начала августа 2016 года появились жалобы на сужение
трахеостомы, появление инфильтрата над трахеостомой.
• 28.08.2016: вскрытие и дренирование абсцесса,
расширение трахеостомы.
• Гистологическое заключение: рост плоскоклеточного рака.
• МСКТ лицевого черепа от 29.09.2016г МСКТ признаки
продолженного роста в проекции трахеостомы,
аксиальным размером 45*33 мм, протяженностью не
менее 55 мм, нельзя исключить инвазию в обе доли
щитовидной железы, стенку пищевода.
• Rg органов грудной клетки, УЗИ шеи, УЗИ органов
брюшной полости:
• Данных за регионарные и отдаленные метастазы не
выявлено
35.
Клинический пример N2С учетом рецидива в области трахеостомы пациенту назначено лечение:
Цетуксимаб 400 мг/м2 нагрузочная доза в 1 неделю, далее еженедельно 250 мг/м2
до прогрессирования заболевания или появлением непереносимой токсичности
+
Цисплатин 100 мг/м2;; 5-Фторурацил 1000 мг/м2 96 часовая инфузии в 1, 22, 43
день с оценкой динамики от лечения после 3 курсов.
36.
Клинический пример N2Лечение рецидива
27.09.16
1-ый курс ПХТ по схеме PF + Цетуксимаб :
5 –Фторурацил - 9040 мг,
Цисплатин - 220 мг,
1-е введение Цетуксимаба 400 мг/м2 - 900 мг.
4.10.2016
2-е введение Цетуксимаба 250 мг/м2 - 560 мг.
11.10.2016
3-е введение Цетуксимаба 560 мг.
18.10.2016
4-е введение Цетуксимаба 560 мг.
Токсические реакции и нежелательные явления
ECOG 0-1
Угреподобная сыпь на лице
Кожная токсичность - нет
Снижение клиренса креатинина - нет.
37.
Клинический пример N227.09.2016
18.10.2016
11.10.2016
38.
КРАТКАЯ ИНСТРУКЦИЯпо применению лекарственного препарата для медицинского
применения ЭРБИТУКС® (ERBITUX®)
Регистрационный номер: ЛСР-002745/09
Торговое название препарата: Эрбитукс ®
Международное непатентованное название: цетуксимаб (cetuximab)
Лекарственная форма: раствор для инфузий
Фармакотерапевтическая группа: противоопухолевое средство, антитела моноклональные
Код АТХ: L01ХС06
Показания к применению
•метастатический колоректальный рак (мКРР) с экспрессией EGFR и «диким» типом генов RAS в комбинации с химиотерапией на основе иринотекана или
продолжительной инфузии фторурацил/кальция фолинат с оксалиплатином;
•метастатический колоректальный рак (мКРР) с экспрессией EGFR и «диким» типом генов RAS в качестве монотерапии в случае неэффективности предшествующей
химиотерапии на основе иринотекана и оксалиплатина, а также при непереносимости иринотекана;
•местнораспространенный плоскоклеточный рак головы и шеи (ПРГШ) в комбинации с лучевой терапией;
•рецидивирующий и/или метастатический плоскоклеточный рак головы и шеи (ПРГШ) в комбинации с химиотерапией на основе препаратов платины;
•рецидивирующий и/или метастатический плоскоклеточный рак головы и шеи (ПГРШ) в качестве монотерапии при неэффективности предшествующей химиотерапии на
основе препаратов платины.
Способ применения и дозы
•Терапию препаратом Эрбитукс® необходимо проводить под наблюдением врача, имеющего опыт применения противоопухолевых лекарственных средств.
•При всех показаниях Эрбитукс® вводится 1 раз в неделю в начальной дозе 400 мг/ м2 площади поверхности тела. Первую дозу следует вводить медленно, со
скоростью, не привышающей 5 мг/мин. Рекомендуемая продолжтельностьинфузии состовляет 120 минут. Все последующие еженедельные инфузии проводятся в дозе
250 мг/ м2 площади поверхности тела при рекомендуемой длительности инфузии 60 минут. Скорость инфузии не должна превышать 10 мг/мин
Противопоказания
•выраженная (3 или 4 степени по шкале токсичности Национального института рака США) гиперчувствительность к цетуксимабу;
•беременность;
•период кормления грудью;
•детский возраст до 18 лет (эффективность и безопасность применения не установлены);
•применение препарата Эрбитукс® в комбинации с оксалиплатин-содержащей терапией у пациентов с мКРР с мутантным типом генов RAS или с неизвестным статусом
генов RAS.
Перед началом комбинированной терапии необходимо оценить противопоказания к применению сопутствующих химиопрепаратов и лучевой терапии
39.
КРАТКАЯ ИНСТРУКЦИЯпо применению лекарственного препарата для медицинского
применения ЭРБИТУКС® (ERBITUX®)s
С осторожностью
При нарушениях функции печени и/или почек, угнетении костномозгового кроветворения, сердечно-легочных заболеваниях в анамнезе, пожилом возрасте.
Побочное действие
головная боль; конъюнктивит; диарея, тошнота, рвота; кожные реакции; гипомагниемия; дегидротация, в том числе в результате диареи или мукозита,
гипокальциемия, анорексия, которая может приводить к снижению массы тела; инфузионно-зависимые реакции легкие и средней степени тяжести; мукозиты, в
некоторых случаях тяжелые; инфузионно-зависимые реакции, которые в некоторых случаях могут приводить к летальному исходу, утомляемость; повышение
уровня аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ).
Особые указания
Колоректальный рак с мутантным типом генов RAS
Препарат Эрбитукс® не должен применяться при лечении колоректального рака с мутантным типом генов RAS или если статус мутации генов RAS не определен.
Результаты клинических исследований свидетельствуют об отрицательном соотношении польза/риск при использовании препарата при опухолях с мутантным
типом генов RAS, в частности, при применении цетуксимаба в комбинации с химиотерапией на основе оксалиплатина.
Особые группы пациентов
В клинические исследования до настоящего времени включались только пациенты, имевшие нормальную функцию почек и печени (т. е. концентрация креатинина
в сыворотке крови в ≤1,5 раза, активность трансаминаз – в ≤5 раз, концентрация билирубина – в ≤1,5 раза выше верхней границы нормы).
Цетуксимаб не исследовался у пациентов, имевших одно или несколько из следующих изменений лабораторных показателей: концентрация гемоглобина <9 г/дл;
количество лейкоцитов <300 мм3; абсолютное количество нейтрофилов <1500/мм3; количество тромбоцитов <100000/мм3.
Опыт применения цетуксимаба в комбинации с лучевой терапией у пациентов с колоректальным раком ограничен.
Применение у детей
Эффективность цетуксимаба у детей в возрасте младше 18 лет не установлена. Никаких новых данных по безопасности у этих пациентов по сравнению с уже
имеющейся информацией, полученной в процессе I фазы клинических исследований, не поступало.
Применение у лиц пожилого возраста
Коррекция дозы препарата у лиц пожилого возраста не требуется, однако опыт его применения у пациентов в возрасте ≥ 75 лет ограничен.
Претензии потребителей и информацию о нежелательных явлениях следует направлять по адресу:
«Представительство компании Арес Трейдинг С.А.»,
Российская Федерация, 125445 Москва, ул. Смольная 24Д,
офис ООО «Мерк»
Тел.: (495) 937-33-04, факс: (495) 937-33-05,
e-mail: safety@merck.ru



























 Медицина
Медицина








