Похожие презентации:
Алкены (олефины). Лекция 3
1. Лекция
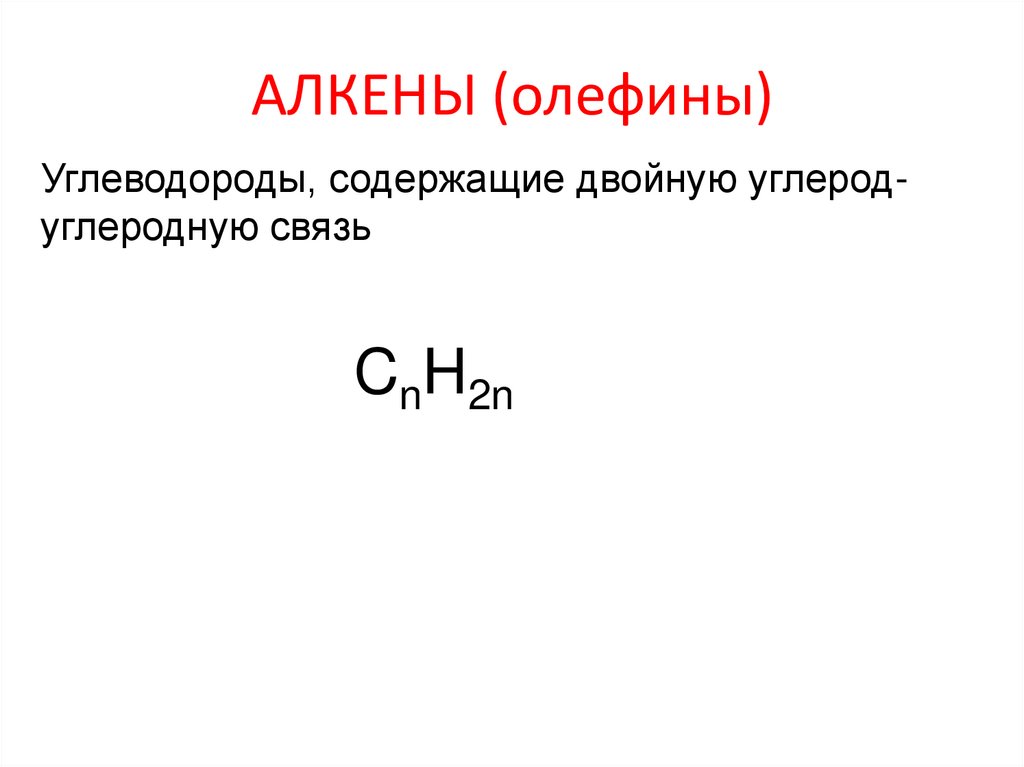
Алкены (олефины)2. АЛКЕНЫ (олефины)
Углеводороды, содержащие двойную углеродуглеродную связьCnH2n
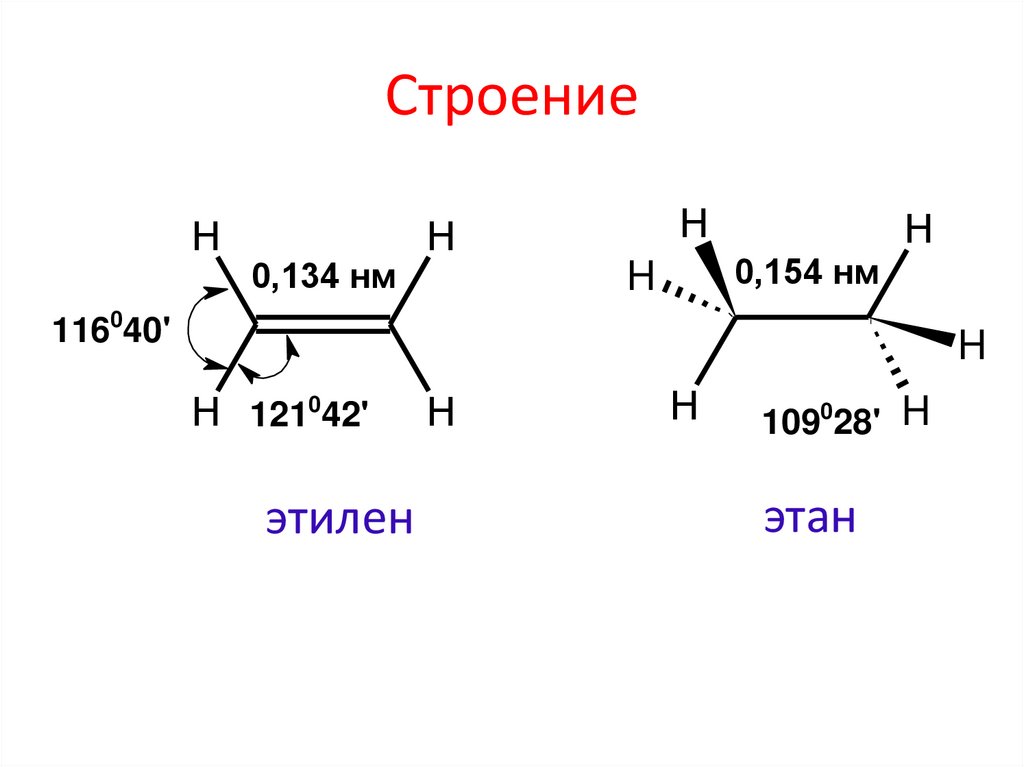
3. Строение
Н0,134 нм
Н
Н
Н
0,154 нм
H
116040'
H
Н 121042'
этилен
Н
Н
109028' H
этан
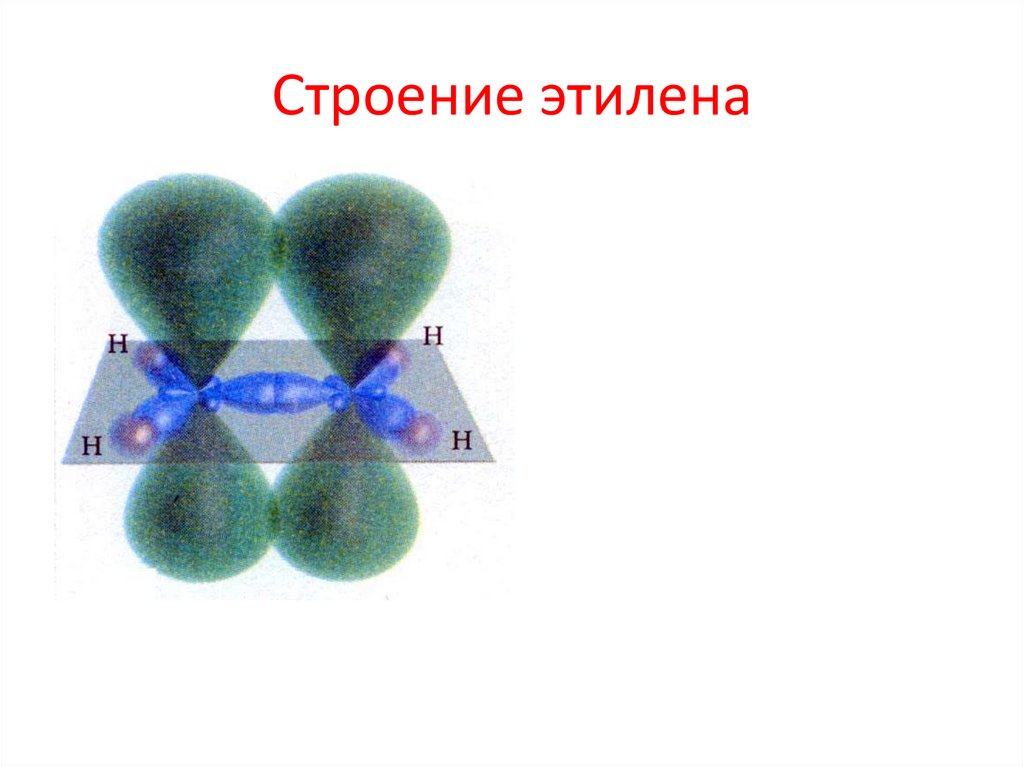
4. Строение этилена
5.
Строение и свойства-связь открыта для
атак:
присоединение
электрофилов AdE
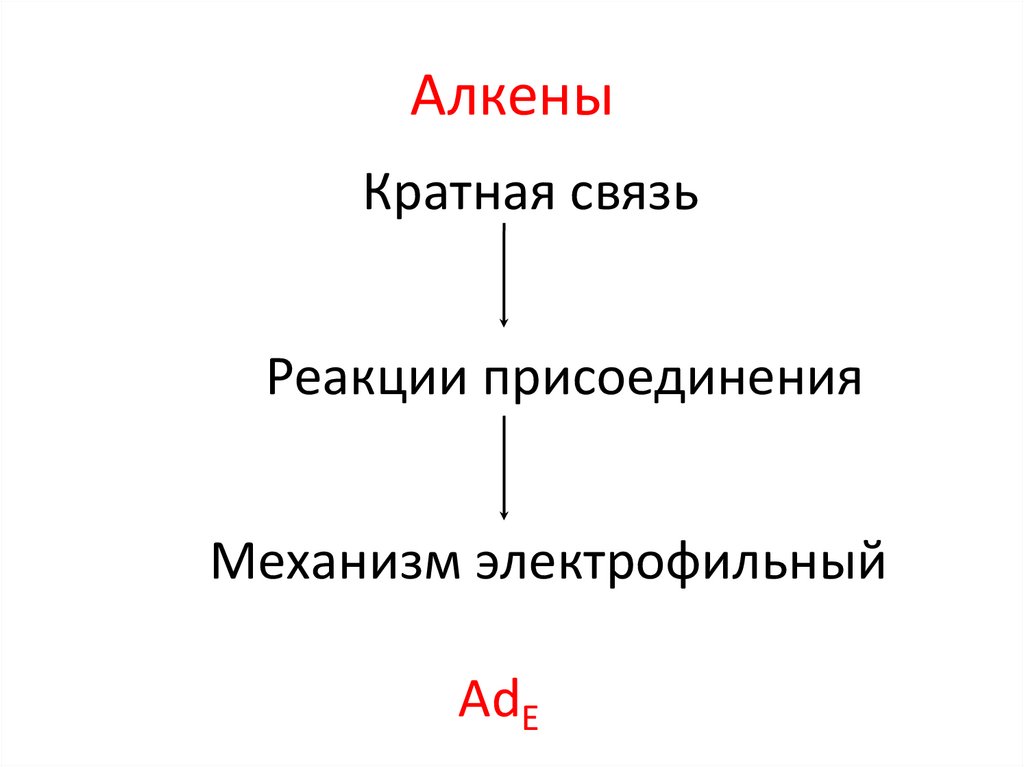
6. Строение и свойства
АлкеныКратная связь
Реакции присоединения
Механизм электрофильный
AdE
7. Алкены
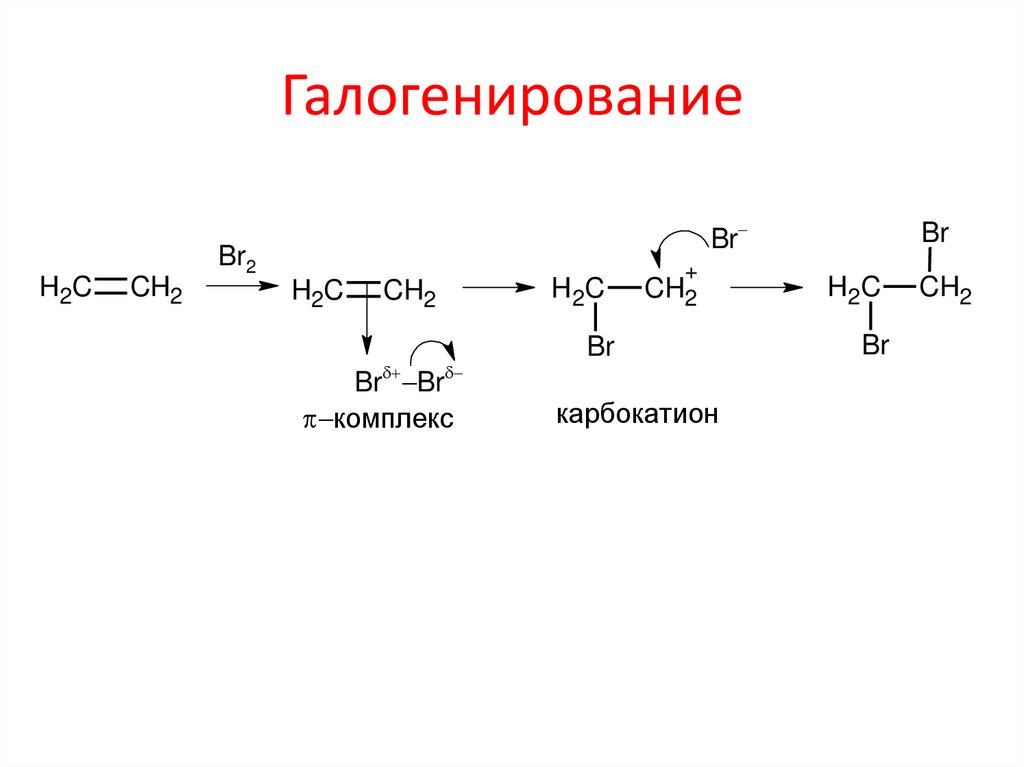
ГалогенированиеH2C
CH2
Br
Br2
H2C
CH2
Br Br
комплекс
H2C
+
CH2
Br
карбокатион
Br
H2C
Br
CH2
8. Галогенирование
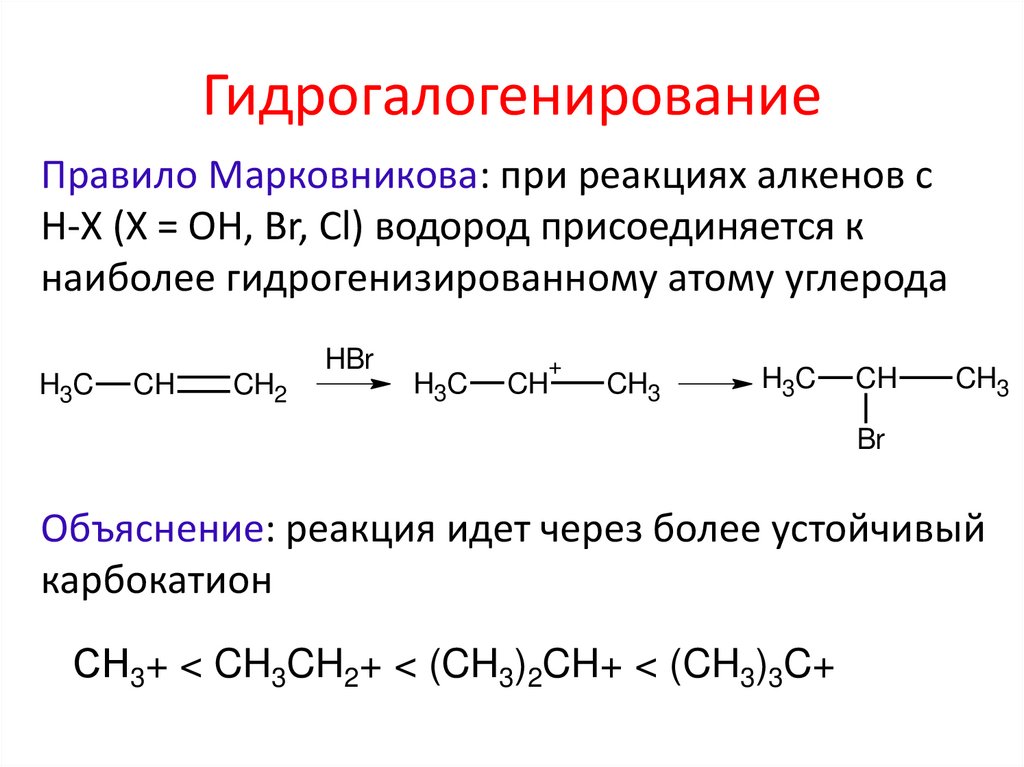
ГидрогалогенированиеПравило Марковникова: при реакциях алкенов с
Н-Х (Х = ОН, Br, Cl) водород присоединяется к
наиболее гидрогенизированному атому углерода
H3C
CH
CH2
HBr
H3C
+
CH
CH3
H3C
CH
CH3
Br
Объяснение: реакция идет через более устойчивый
карбокатион
СН3+ < CH3CH2+ < (CH3)2CH+ < (CH3)3C+
9. Гидрогалогенирование
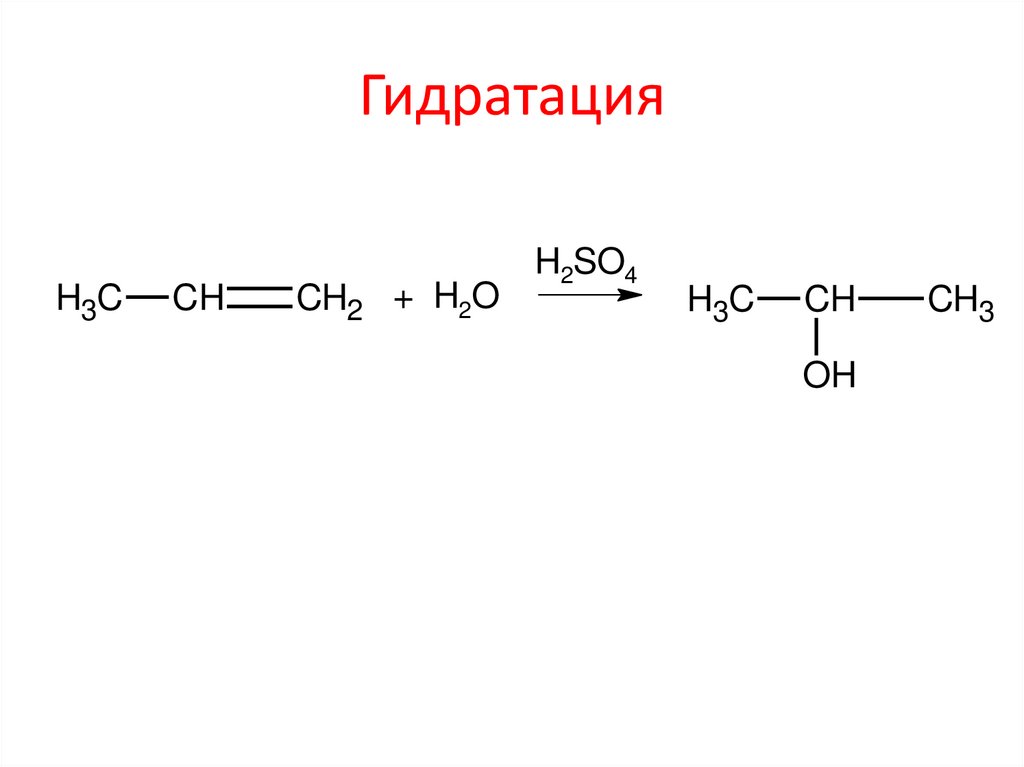
ГидратацияH3C
CH
CH2 + H2O
H2SO4
H3C
CH
OH
CH3
10. Гидратация
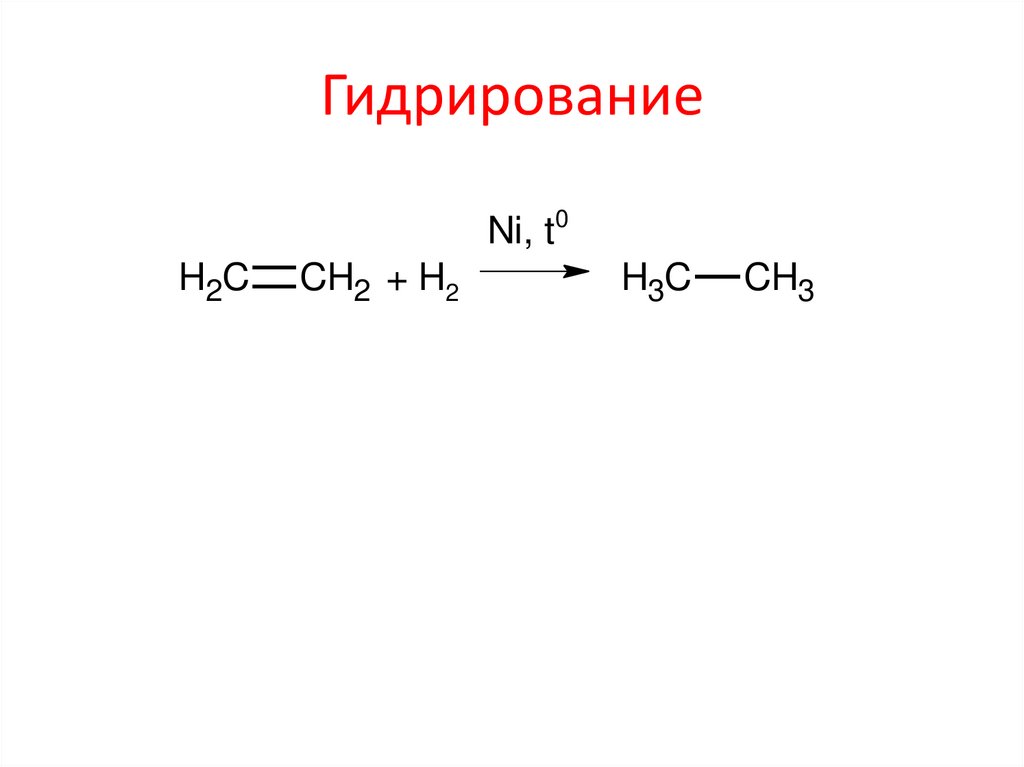
ГидрированиеNi, t0
H2C
CH2 + H2
H3C
CH3
11. Гидрирование
Полимеризация(радикальная реакция)
СН2=СН2 → -(СН2-СН2)-n
n = 100-1000
Пероксиды, р = 100 МПа и t >1000С
12. Гидробромирование по Харашу
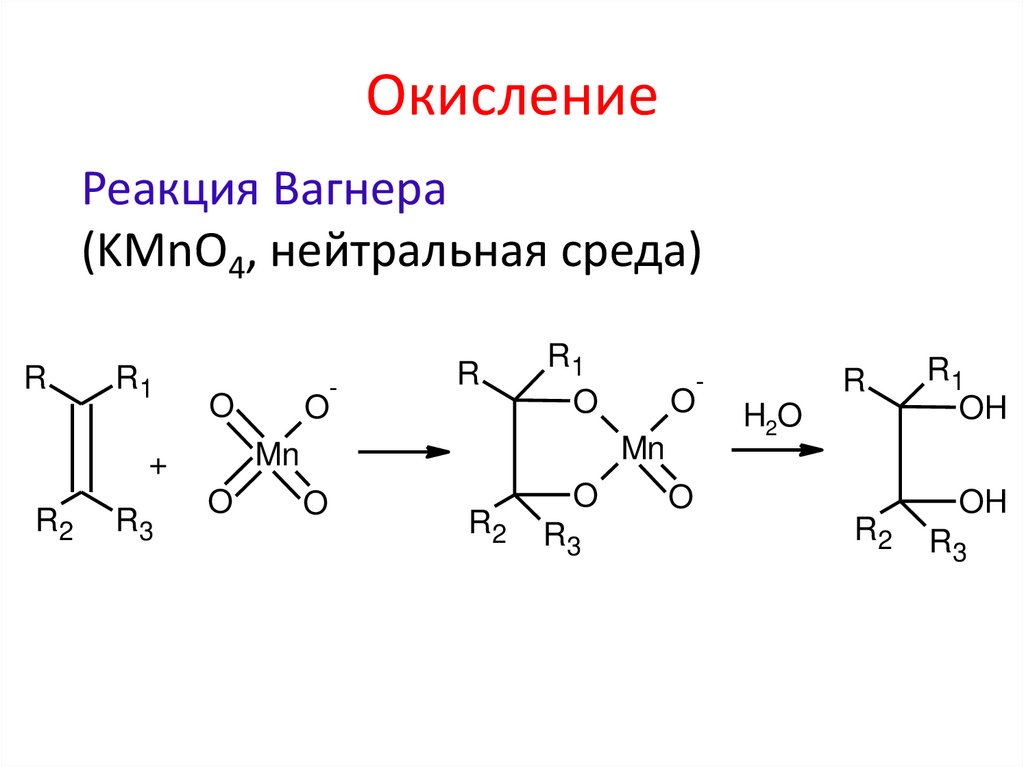
ОкислениеРеакция Вагнера
(KMnO4, нейтральная среда)
R
R1
O
R3
O
R1
O
O
O
R2
O
R3
R
-
O
Mn
Mn
+
R2
-
R
H2O
O
R2
R1
OH
OH
R3
13. Полимеризация (радикальная реакция)
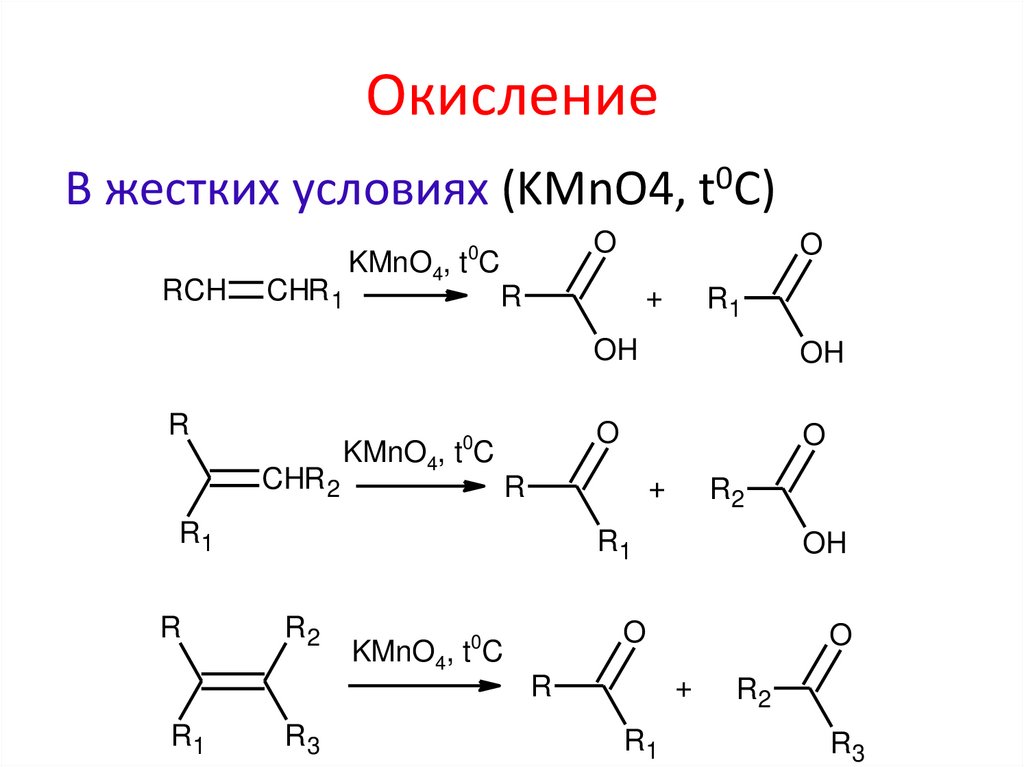
ОкислениеВ жестких условиях (KMnO4, t0C)
O
0
RCH
CHR 1
R
KMnO4, t C
R
+
0
CHR 2
KMnO4, t C
OH
O
O
+
R2
R1
R2
R3
OH
O
0
KMnO4, t C
R
R1
R1
OH
R
R1
R
O
O
+
R1
R2
R3
14. Окисление
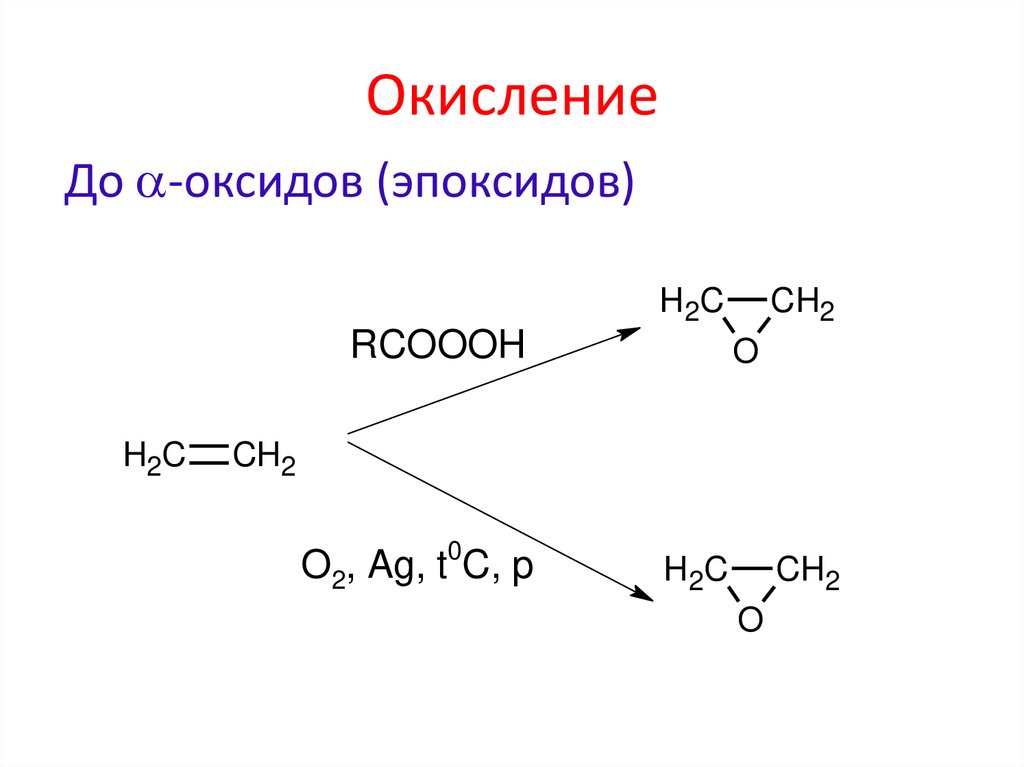
До -оксидов (эпоксидов)H 2C
RCOOOH
H2C
CH2
O
CH2
O2, Ag, t0C, p
H 2C
CH2
O
15. Окисление
Получение алкеновI. В промышленности
1) Крекинг алканов
2) Дегидрирование алканов (t , кат.)
CnH2n+2 CnH2n + Н2
3) Гидрирование алкинов (Ni, t )
CnH2n-2 + H2 CnH2n
16. Окисление
Получение алкеновII. В лаборатории
1) Дегидратация спиртов (Н2SO4конц., 160 C
или Al2O3, 350 C)
CН3СН2ОН CH2=СН2 + Н2О
2) Дегидрогалогенирование
CH3CН2СHСlCH3 + КOHспирт.
CH3-CH=CH-CH3
3) Дегалогенирование дигалогеналканов
CH3-CH2-CНBr-СHBr-CH3 + Zn
CH3-CH2-CH=CH-CH3





 Химия
Химия








