Похожие презентации:
Алкены (олефины, этиленовые углеводороды)
1.
Алкены (Ч. II)(олефины, этиленовые углеводороды
2.
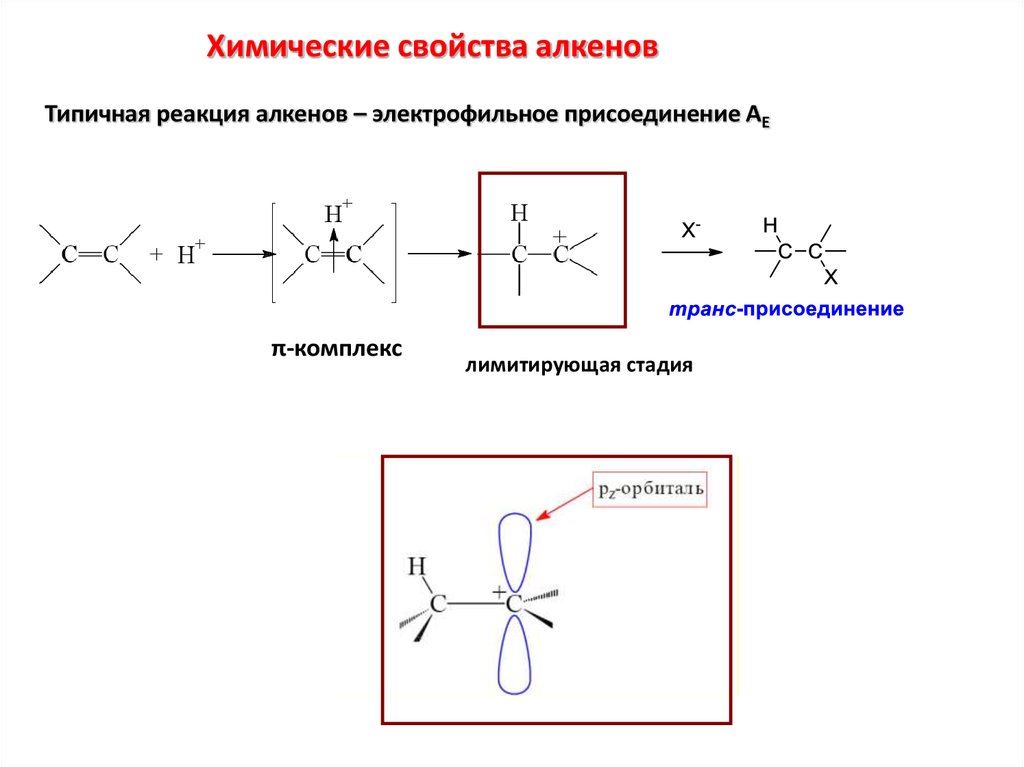
Химические свойства алкеновТипичная реакция алкенов – электрофильное присоединение АЕ
π-комплекс
лимитирующая стадия
3.
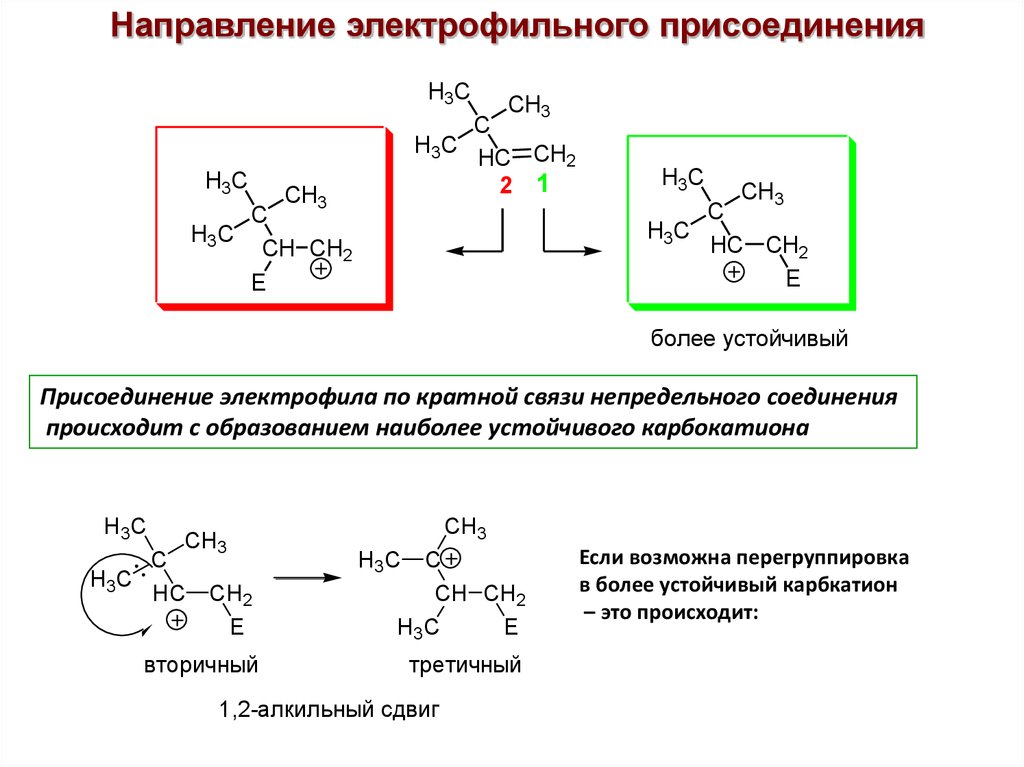
Направление электрофильного присоединенияH3C
H3C
H3C
CH3
C
H3C
HC CH2
2 1
CH3
C
CH CH2
E
H3C
CH3
C
H3C
HC CH2
E
более устойчивый
Присоединение электрофила по кратной связи непредельного соединения
происходит с образованием наиболее устойчивого карбокатиона
H 3C
CH3
C
H 3C
HC
CH3
H 3C
CH2
E
C
CH CH2
H 3C
E
вторичный
третичный
1,2-алкильный сдвиг
Если возможна перегруппировка
в более устойчивый карбкатион
– это происходит:
4.
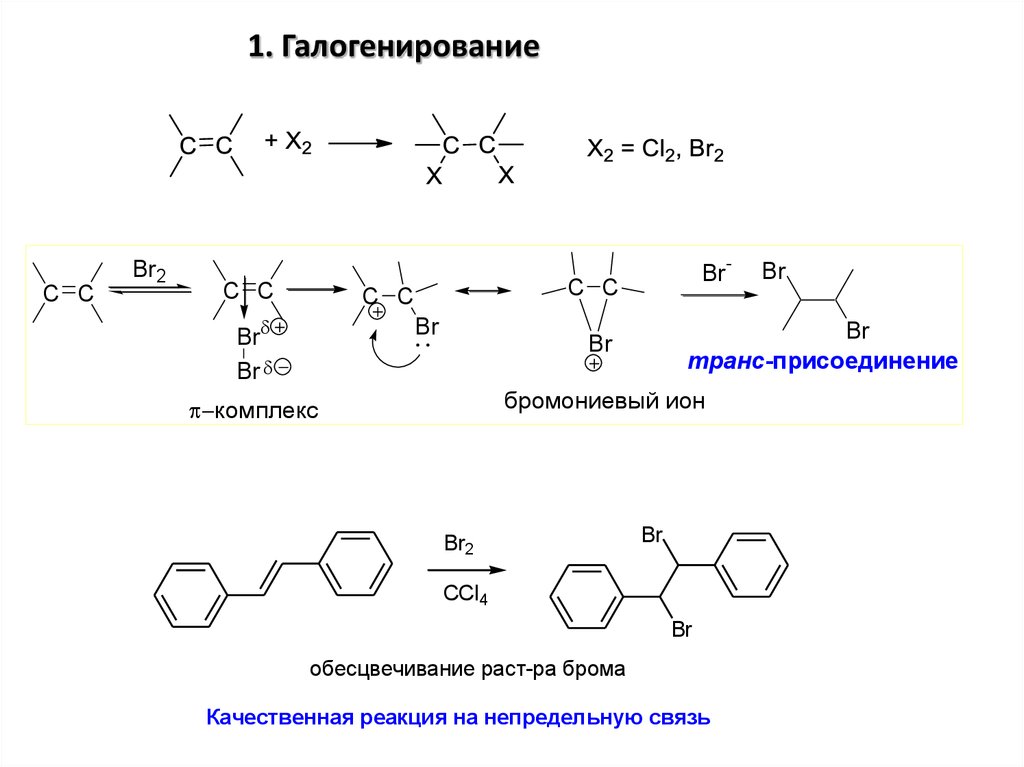
1. ГалогенированиеC C
Br2
C C
C C
C C
Br
Br
Br-
Br
Br
транс-присоединение
Br
бромониевый ион
комплекс
Br2
Br
Br
CCl4
Br
обесцвечивание раст-ра брома
Качественная реакция на непредельную связь
5.
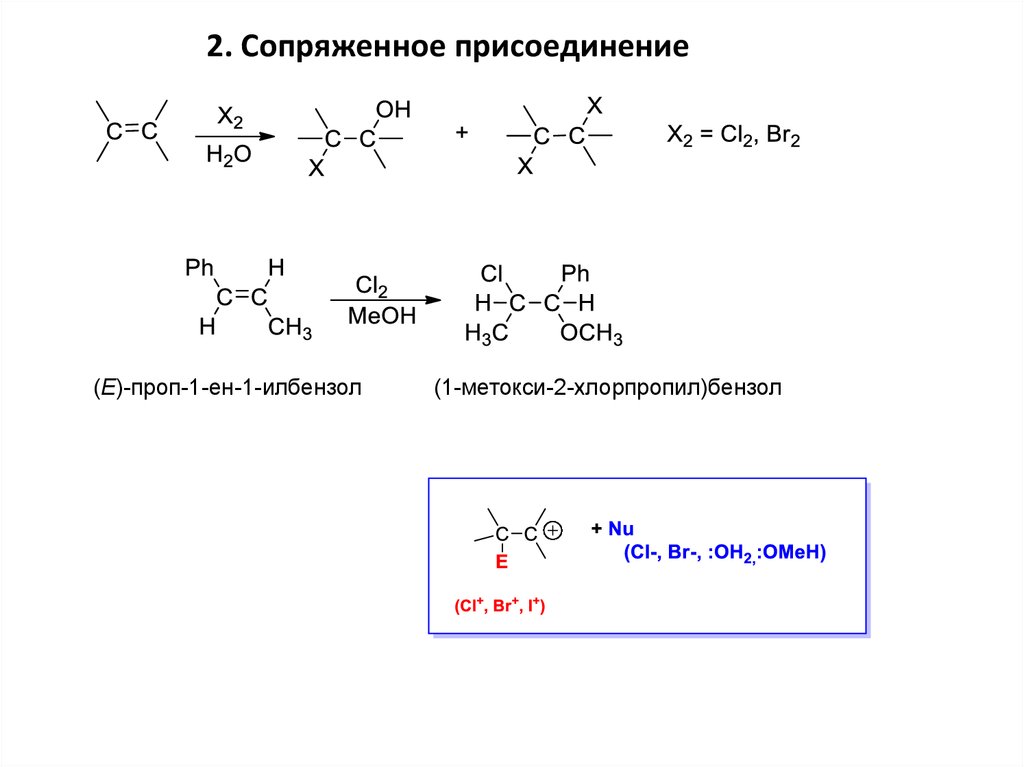
2. Сопряженное присоединение(Е)-проп-1-ен-1-илбензол
(1-метокси-2-хлорпропил)бензол
6.
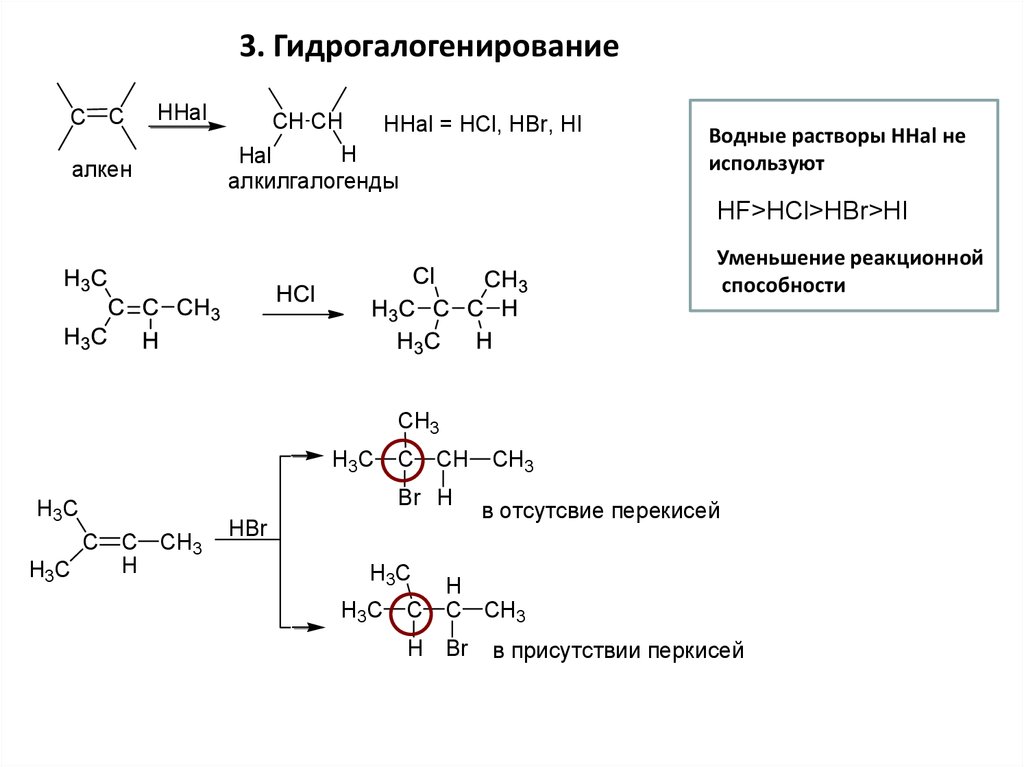
3. ГидрогалогенированиеC C
HHal
алкен
CH CH
HHal = HCl, HBr, HI
H
Hal
алкилгалогенды
Водные растворы НHal не
используют
HF>HCl>HBr>HI
Уменьшение реакционной
способности
CH3
H3C
H3C
C C CH3
H
H3C
C CH
Br H
HBr
H3C
H3C
C
CH3
в отсутсвие перекисей
H
C CH3
H Br
в присутствии перкисей
7.
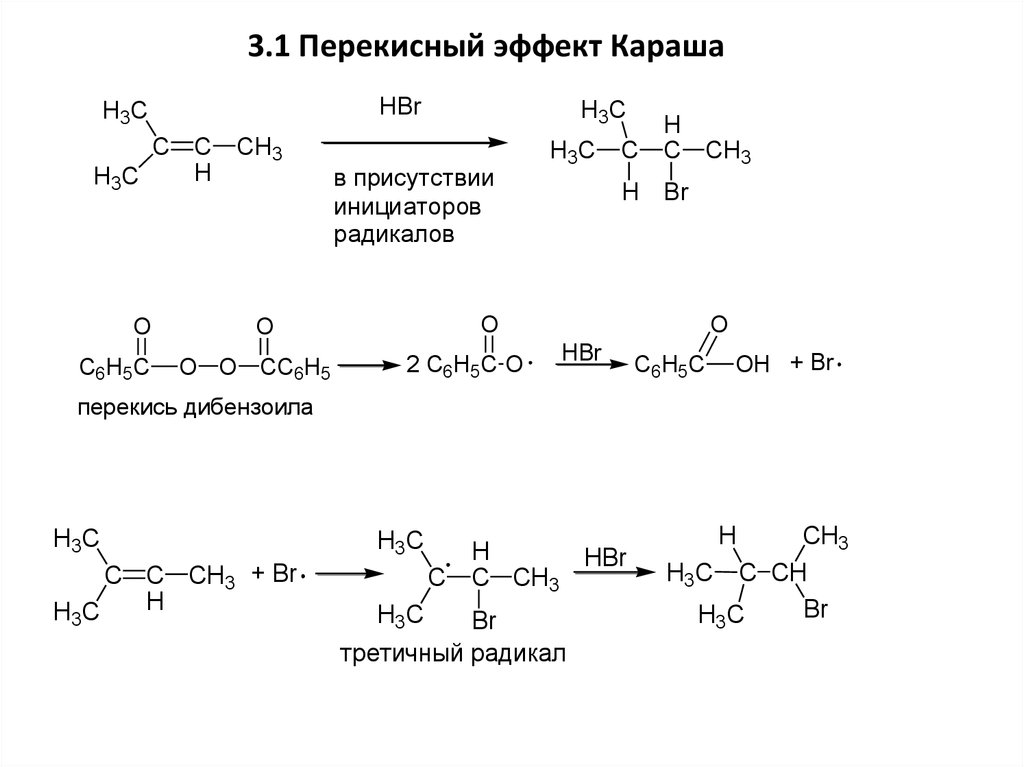
3.1 Перекисный эффект КарашаHBr
H3C
C C CH3
H
H3C
O
C6H5C
в присутствии
инициаторов
радикалов
H3C
C
H
C CH3
H Br
O
O
O O CC6H5
H3C
2 C6H5C O
O
HBr
C6H5C
OH + Br
перекись дибензоила
H3C
H3C
C C CH3 + Br
H
H3C
H3C
H
HBr
C C CH3
Br
третичный радикал
H
CH3
H3C C CH
Br
H3C
8.
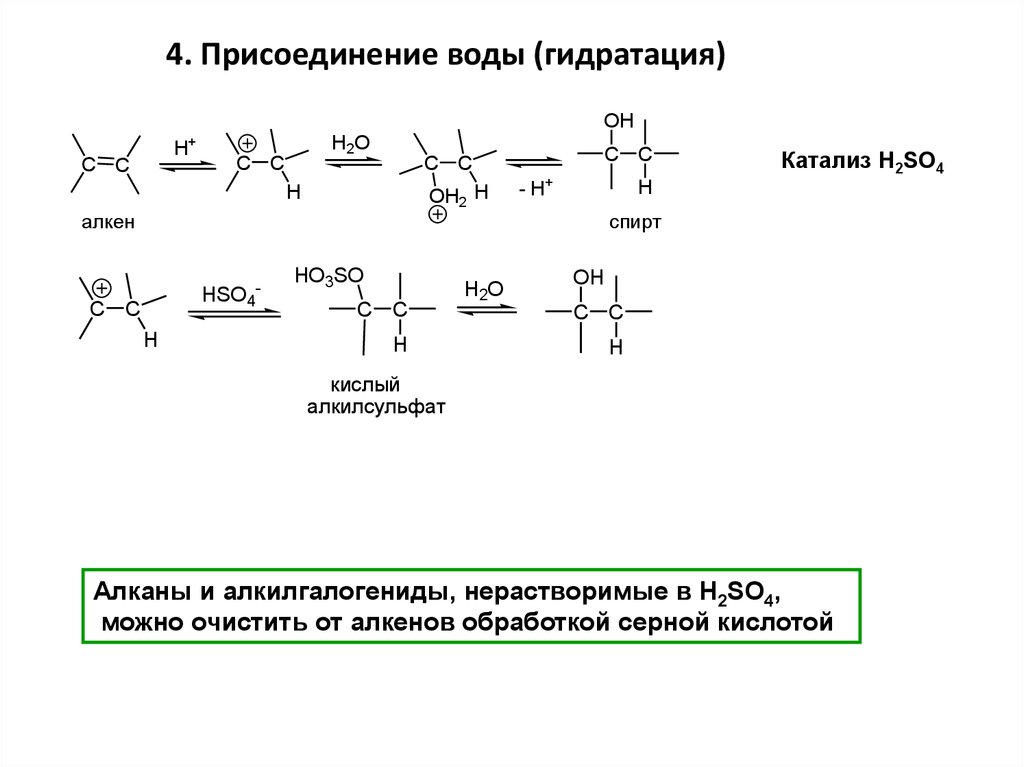
4. Присоединение воды (гидратация)OH
H+
C C
H2O
C C
H
OH2 H
алкен
HSO4
C C
H
-
C C
C C
HO3SO
C C
H
H2O
- H+
Катализ H2SO4
H
спирт
OH
C C
H
кислый
алкилсульфат
Алканы и алкилгалогениды, нерастворимые в H2SO4,
можно очистить от алкенов обработкой серной кислотой
9.
Основные закономерности гидратации алкенов:1. Кислотный катализ. Присоединение инициируется протоном;
2. Обратимость процесса гидратации;
3. Лимитирующая стадия – образование карбкатиона.
Присоединение протона происходит таким с образованием
наиболее устойчивого карбкатиона;
4. При образовании карбкатиона могут происходить перегруппировки;
5. Гидратация алкенов приводит к образованию транс-продуктов;
6. Только в случае этилена может образовываться первичный спирт.
H
H H+
C C
H
H
этилен
H H
C C H
H H
H2O
H2O
C C
H
- H+
OHH
H C C H
H H
этиловый
спирт
1-фенилбутан-1-ол
10.
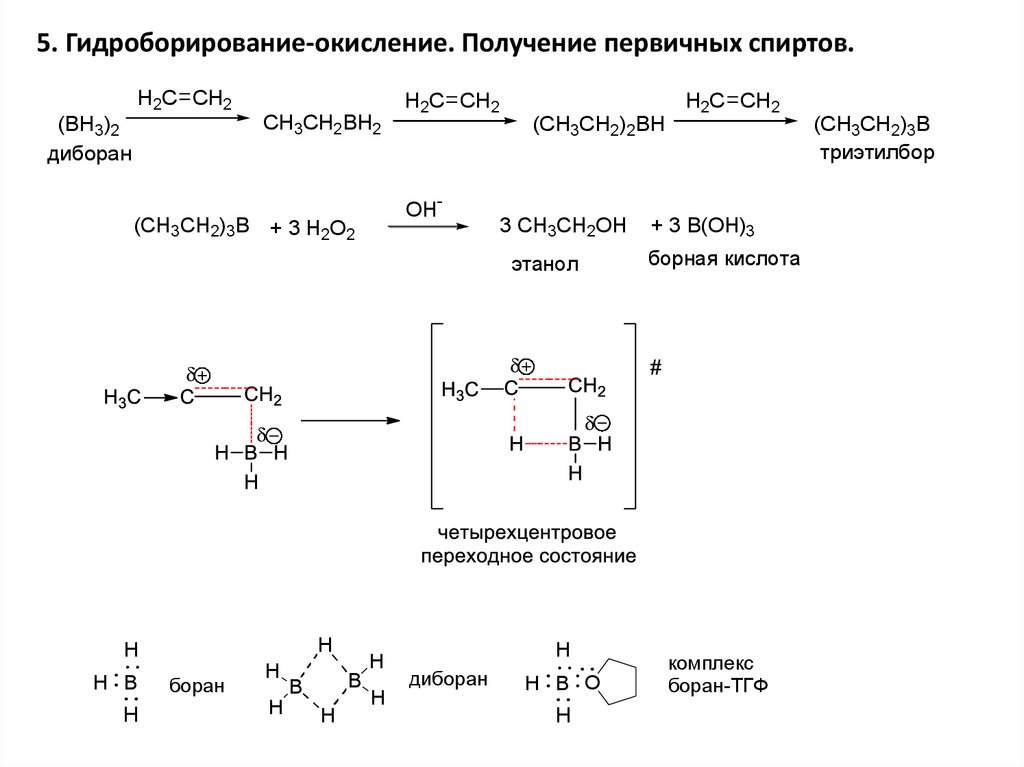
5. Гидроборирование-окисление. Получение первичных спиртов.H2C CH2
CH3CH2BH2
(BH3)2
диборан
H2C CH2
OH-
(CH3CH2)3B + 3 H2O2
(CH3CH2)2BH
3 CH3CH2OH
этанол
H
H
H B
H
боран
H
H
H
B
B
H
H
H
диборан
H B O
H
H2C CH2
+ 3 B(OH)3
борная кислота
комплекс
боран-ТГФ
(CH3CH2)3B
триэтилбор
11.
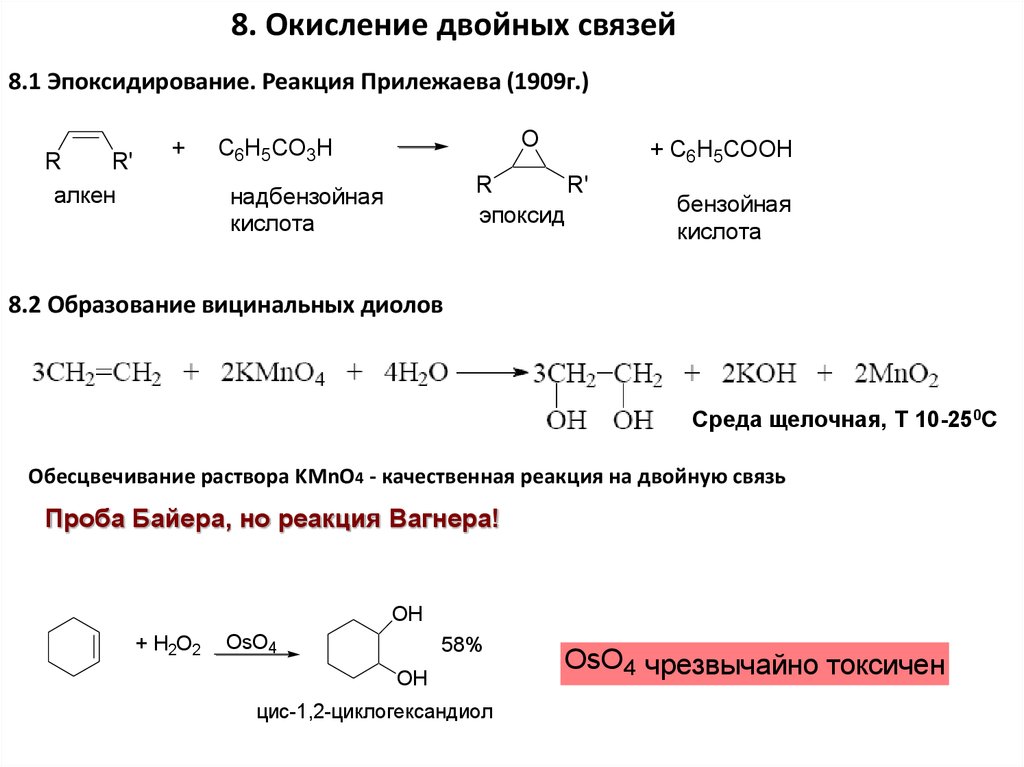
8. Окисление двойных связей8.1 Эпоксидирование. Реакция Прилежаева (1909г.)
R
R'
алкен
+
O
C6H5CO3H
+ C6H5COOH
R
R'
эпоксид
надбензойная
кислота
бензойная
кислота
8.2 Образование вицинальных диолов
Среда щелочная, Т 10-250С
Обесцвечивание раствора KMnO4 - качественная реакция на двойную связь
Проба Байера, но реакция Вагнера!
OH
+ H2O2
OsO4
58%
OH
цис-1,2-циклогександиол
OsO4 чрезвычайно токсичен
12.
8.3 Озонолиз13.
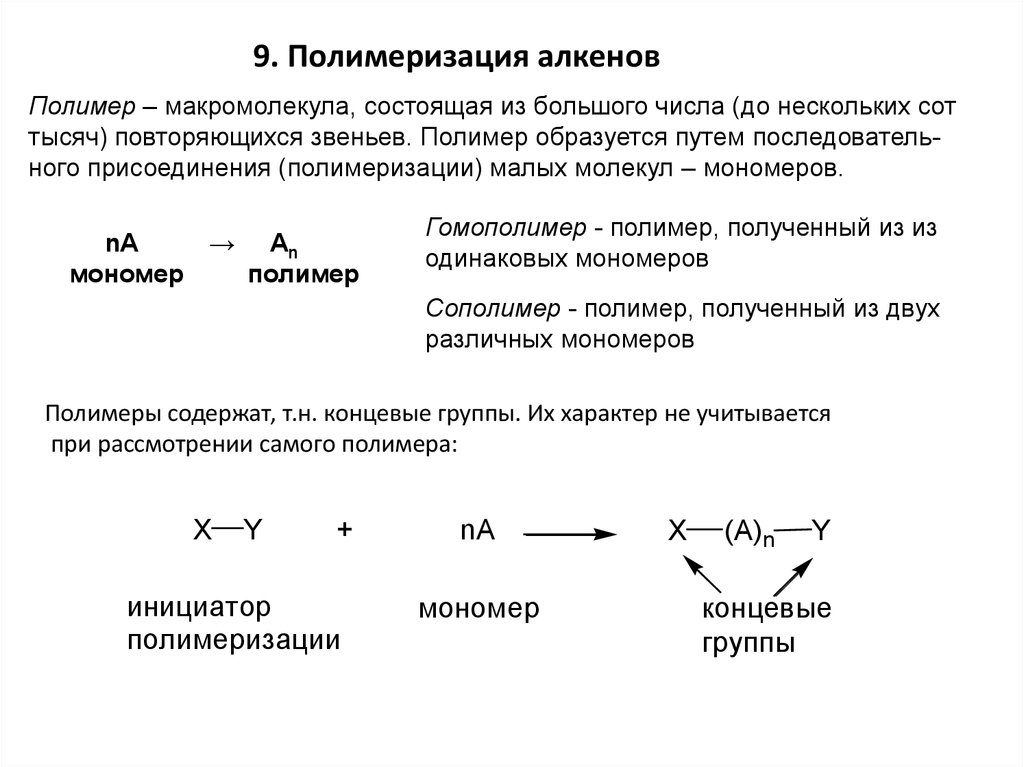
9. Полимеризация алкеновПолимер – макромолекула, состоящая из большого числа (до нескольких сот
тысяч) повторяющихся звеньев. Полимер образуется путем последовательного присоединения (полимеризации) малых молекул – мономеров.
nA
мономер
→
An
полимер
Гомополимер - полимер, полученный из из
одинаковых мономеров
Сополимер - полимер, полученный из двух
различных мономеров
Полимеры содержат, т.н. концевые группы. Их характер не учитывается
при рассмотрении самого полимера:
X
Y
+
инициатор
полимеризации
nA
мономер
X
(A)n
Y
концевые
группы
14.
9.1 Ионная полимеризацияПолимеризация может инициироваться катионамми, анионами,
радикалами, металлорганическими соединениями
E
CH3
H2C C
CH3
изобутилен
E
CH2
CH3
C
CH3
CH3
H2C C
CH3
E
CH2
CH3
C CH2
CH3
полимеризация по типу "голова к хвосту"
Инициаторы катионной полимеризации
кислоты Льюиса: H+, BF3, AlCl3
CH3
C
CH3
H CH3
C C
H CH3 n
полиизобутилен
15.
9.2 Свободнорадикальная полимеризацияR
F F
R C C
F F
F2C CF2
тетрафторэтилен
F F
C C
F F
тефлон
n
R = (CH3CO)2
пероксид ацетила
Тефлон химически устойчив, прочен.
Деполимиризация наступает при 600 - 8000С,
поэтому используют при 70 - 2500С.
C C
H2 H2
n
Инициатор пероксид бензоила (С6Н5СО)2
Условия полимеризации: 1000С, 70 атм
полиэтилен
R + PhCH=CH2
стирол
R-CH2
CHC6H5
PhCH=CH2
R-CH2
H
C CH2CH2
C6H5 C6h5
Полимеризация по типу «голова к хвосту»
H Cl
C C
H H
n
поливинилхлорид
(ПВХ)
Получают полимеризацией винилхлорида CH2=CH-Cl
т.д.





 Химия
Химия








