Похожие презентации:
Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции
Окислительновосстановительные реакции2. Какие типы химических реакций мы знаем?
CaCO3→CaO +CO2(разложение)
2Ca +O2 →2CaO
(соединение)
Zn +H2 SO4 →ZnSO4+H2
(замещение)
СuO +H2 SO4 →CuSO4+H2O
(обмен)
3. Расставьте степени окисления.
Ca+2C+4O3-2→ Ca+2O-2 +C+4O-22Ca0+O20→ 2Ca+2O-2
Zn0+H2+1S+6O4-2→ Zn+2S+6O4-2+H20
Cu+2O-2+H2+1S+6O4-2→ Cu+2S+6O4-2 +H2+1O-2
4.
Реакции идущие без изменения степениокисления:
Ca+2C+4O3-2→ Ca+2O-2 +C+4O-2
Cu+2O-2+H2+1S+6O4-2→ Cu+2S+6O4-2 +H2+1O-2
Реакции идущие с изменением
степени окисления- называются
окислительно-восстановительные:
2Ca0+O20→ 2Ca+2O-2
Zn0+H2+1S+6O4-2→ Zn+2S+6O4-2+H20
5. Метод электронного баланса.
Составить схему реакций и определитьстепени окисления.
Zn0+H2+1S+6O4-2→ Zn+2S+6O4-2+H20
Определить элементы изменившие
степени окисления. Составьте
электронные уравнения.
Zn0 +2=Zn+2
2H+1 +2= H20
6. Метод электронного баланса.
Определите окислитель и восстановитель.Составьте схему электронного баланса.
Zn0 -2=Zn+2 2
1 - окисление
2
2H+1 +2= H20 2
1 - восстановление
Zn0 - восстановитель
H+1 - окислитель
7.
Процесс отдачи электронов атомом,ионом или молекулой называется
окислением.
Процесс присоединения электронов
атомом, ионом или молекулой
называется восстановлением.
Вещество атомы, ионы или молекулы
которого отдают электроны
называются восстановителем.
Вещество атомы, ионы или молекулы
которого принимают электроны
называются окислителем.
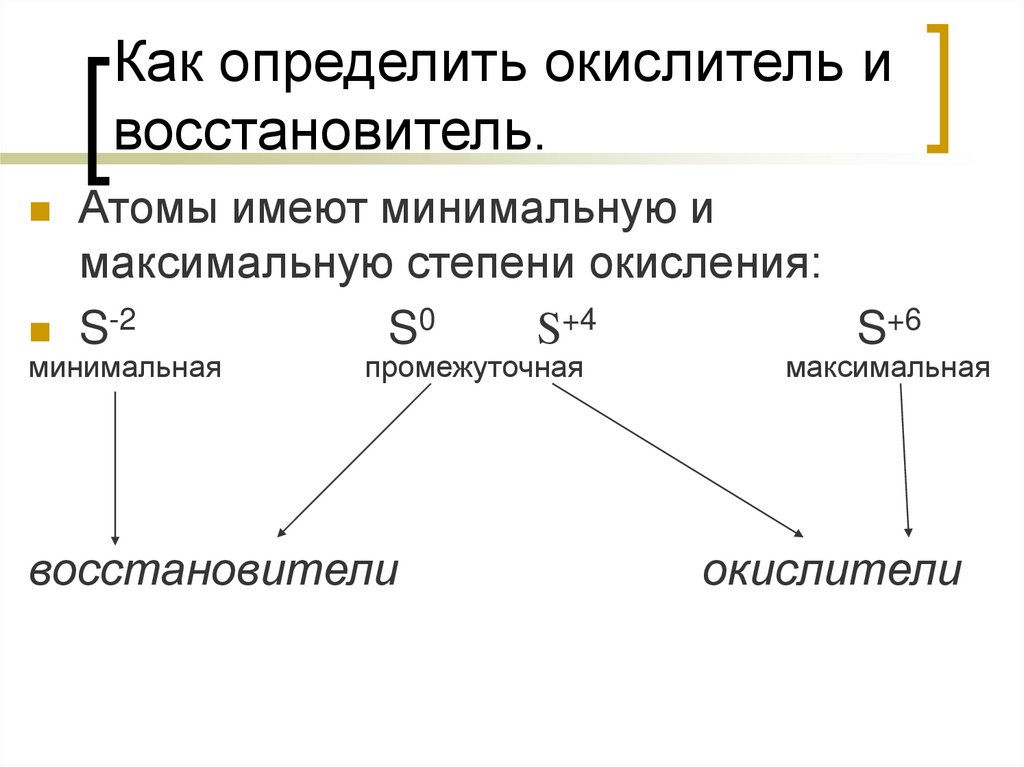
8. Как определить окислитель и восстановитель.
Атомы имеют минимальную имаксимальную степени окисления:
S-2
S0
S+4
S+6
минимальная
промежуточная
восстановители
максимальная
окислители
9. Как определить окислитель и восстановитель.
Восстановителями могут быть:атомы металлов Zn0 -2=Zn+2
сложные вещества в составе которых есть
элементы с минимальной степенью окисления:
N-3H3
Окислителями могут быть:
только окислителями атомы фтора и
кислорода;
сложные вещества в составе которых есть
элементы с максимальной степенью окисления:
H2+1S+6O4-2








 Химия
Химия








