Похожие презентации:
Ионные уравнения
1. Тема: Ионные уравнения
2. ЦЕЛИ УРОКА
1.Повторить основные понятия теорииэлектролитической диссоциации и
проверить их усвоение.
2.Изучить условия протекания реакций
ионного обмена.
3.Научиться составлять молекулярные,
полные и сокращённые ионные
уравнения
3. СОДЕРЖАНИЕ:
1.Историческая справка2. «Проверь себя»(теоретическая и
письменная часть)
3. Изучение нового материала
4. Выполнение заданий по новому
материалу
4. Историческая справка.
Сванте Август Аррениус(1859-1927г.)
Шведский физик и химик, академик
Королевской академии наук.
В1887году сформулировал основные
положения теории
электролитической диссоциации.
5.
И.А. Каблуков.Д.И.Менделеев.
Применил к теории
Аррениуса химическую
теорию растворов
Д.И.Менделеева и
одновременно с
В.А. Кистяковским
высказал предположение
о наличии в растворах
гидратированных ионов.
Разработал гидратную
теорию растворов.
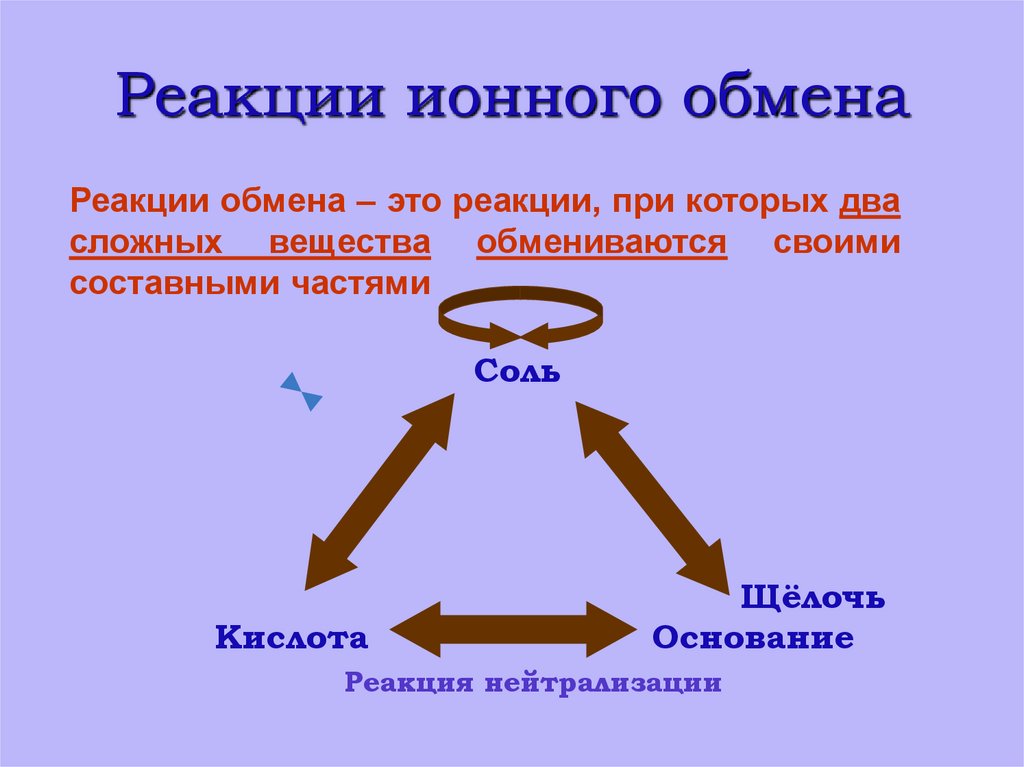
6. Реакции ионного обмена
Реакции обмена – это реакции, при которых двасложных вещества обмениваются своими
составными частями
Соль
Кислота
Щёлочь
Основание
Реакция нейтрализации
7. РЕАКЦИИ ИОННОГО ОБМЕНА.
Реакции между ионами называют ионнымиреакциями,
а уравнения – ионными уравнениями.
Ионные реакции протекают только в тех случаях,
когда в результате выделяется газ , осадок или
вода.
Формулы малодиссоциирующих, нерастворимых и
газообразных веществ записывают в молекулярном
виде.
8. Алгоритм составления ионных уравнений.
1. Запишите молекулярное уравнение. Расставьте коэффициенты.Определите по таблице растворимости электролиты.
Укажите осадки, газы
2NaOH+H2SO4 = Na2SO4+2H2O
2.
Запишите электролиты в виде ионов с учётом
коэффициентов и индексов, а уходящие из сферы реакции - в
виде молекул.
2Na++2OH-+2H++SO42- = 2Na++SO42-+2H2O
3.
Исключите из обеих частей уравнения одинаковые
ионы и запишите оставшиеся в сокращенное ионное
уравнение.
2OH-+2H+=2H2O
OH-+H+=H2O
Данная реакция взаимодействия кислоты с основанием
называется реакцией нейтрализации.
9. Задание: Составьте молекулярные и ионные уравнения двух других реакций пользуясь алгоритмом.
CuSO4+2NaOH=Cu(OH)2 +Na2SO4Cu2++SO42-+2Na++2OH-=Cu(OH)2 +2Na++ SO42Cu2++2OH-=Cu(OH)2
Na2CO3+2HCL=2NaCL+CO2 +H2O
2Na++CO32-+2H++2CL-=2Na++CO32-+CO2 +H2O
CO32-+2H+=CO2 +H2O
10. Решение задач. Задача№1. Составте молекулярные и ионные уравнения взаимодействия хлорида железа(III) с гидроксидом калия,
нитратом серебра.FeCL3+ 3KOH = Fe(OH)3
Fe3++3CL-+3K+ + 3OH- = Fe(OH)3
Fe3+ + 3OH- = Fe(OH)3
+ 3KCL
+ 3K+ + 3CL-
FeCL3 + 3AgNO3 = Fe(NO3)3 + 3AgCL
Fe3+ +3CL-+3Ag++3NO3- = Fe3+ + 3NO3- + 3AgCL
3Ag++3CL- = 3AgCL
11. Задача№2. Составьте молекулярные и полные ионные уравнения соответствующие сокращенным ионным уравнениям.
а).Mg2++2OH-=Mg(OH)2
Mg2++2NO3-+2Na++2OH-=Mg(OH)2 +2Na++2NO3Mg(NO3)2+2NaOH=Mg(OH)2 +2NaNO3
б).
СaCO3 +2H+=Ca2++CO2 +H2O
CaCO3 +2H++2CL-=Ca2++2CL-+CO2 +H2O
CaCO3 2HCL=CaCL2+CO2 +H2O











 Химия
Химия








