Похожие презентации:
Ионные уравнения
1. Чтобы что-то узнать, нужно уже что-то знать
2.
“Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебяневозможно описать, тобой наслаждаются не ведая, что
ты такое! Нельзя сказать, что ты необходима для
жизни, ты сама жизнь”
(А.С. Экзюпери)
3.
29/11/21Убери лишнее. (Найдите неэлектролиты)
О2
Ошибка
NaOH
Ошибка
Ca(OH)
2
H2 O
Ошибка
NaCl
Ошибка )
Mg(NO
3 2
Ошибка)
Al(NO
3 3
Ошибка
Na
2CO3
Ошибка
K
2SO4
CO2
Ошибка
CuCl
CaSO4
CaCO3
Ошибка
FeCl
BaSO4
Ошибка
NaNO
3
Ошибка
H
2SO4
SО3
Cu(OH)2
Ошибка
KS
3
2
2
4. Тема урока: Реакции ионного обмена.
5. Закончите уравнения реакций. Какие из предложенных реакций относятся к реакциям обмена?
Na2S04 + BaСl2 =Mg + НСl=
Na2C03 + Н2SO4 =
Zn(OH)2 =
NaOH + HCl =
SO3 + MgO =
NaCI + KNO3 =
6.
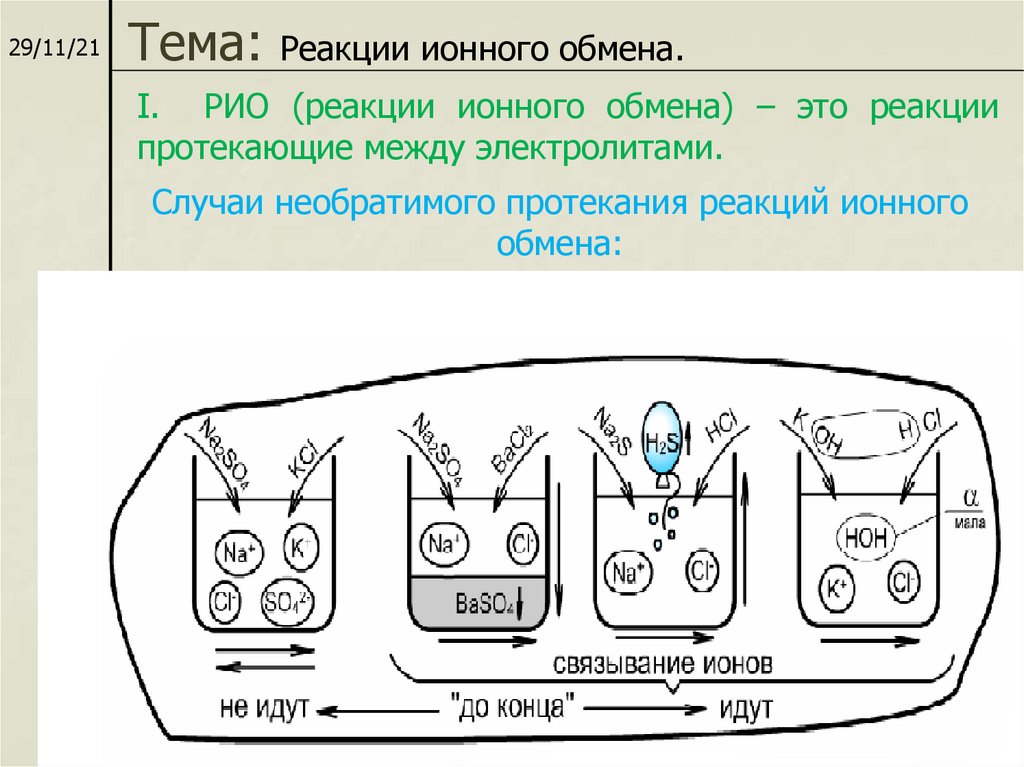
29/11/21Тема:
Реакции ионного обмена.
I. РИО (реакции ионного обмена) – это реакции
протекающие между электролитами.
Случаи необратимого протекания реакций ионного
обмена:
7. Условия необратимого протекания реакций ионного обмена:
Если выделится газЭто раз;И получится вода Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
8.
29/11/21Тема:
Реакции ионного обмена.
I. РИО (реакции ионного обмена) – это реакции
протекающие между электролитами.
Пример: Взаимодействие хлорида бария с сульфатом натрия.
Порядок действий:
6. По
1.
2.
3.
4.
5.
Записать
Расставить
Составить
Сократить
таблице
уравнение
полное
сокращенное
одинаковые
коэффициенты.
растворимости,
ионное
реакции
ионы
ионное
уравнение
определить
вв молекулярном
левой
уравнение.
(растворимые
и правой
нерастворимые
виде.
частивещества
полного
вещества.
расписать
ионного
уравнения.
на
Обозначить
ионы.
их стрелкой вниз.
2+ - + 2Na
+ BaCl
Na+2SO42- BaSO4 + 2Na
Ba
2Cl
2 NaCl
2Cl
2
Ba2+ +
+ SO42- BaSO4
+
+
+
+
9.
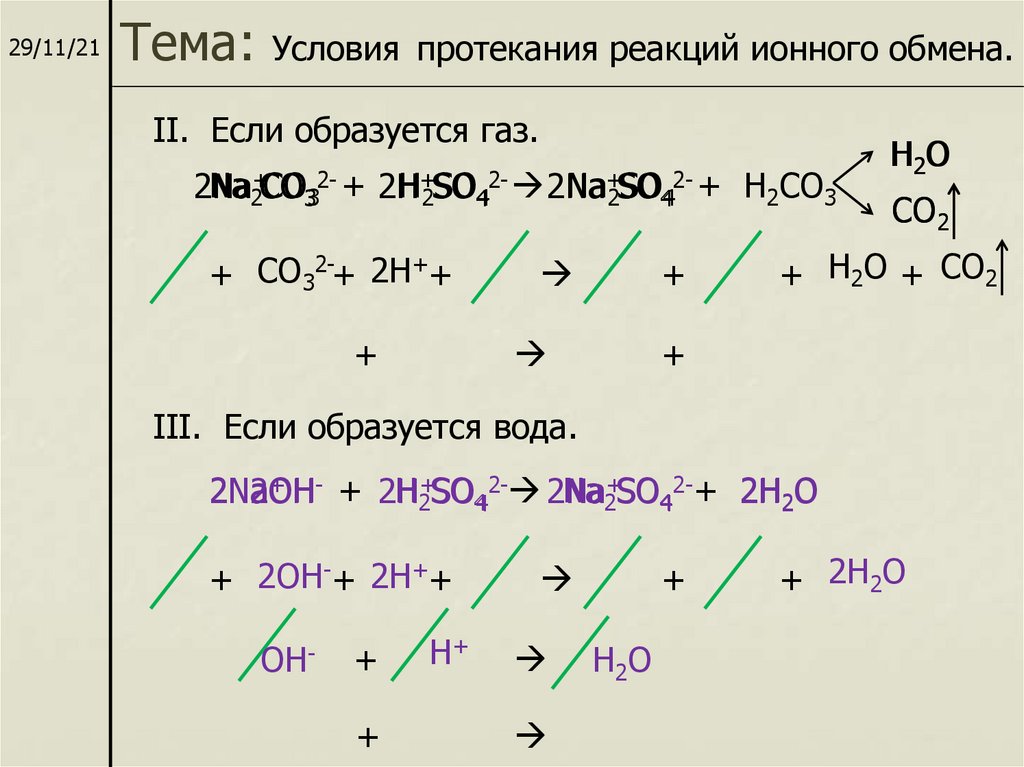
29/11/21Тема:
Условия протекания реакций ионного обмена.
II. Если образуется газ.
Na2+CO332- + 2H
H+2SO42- 2Na
Na+2SO442- + H2CO3
2Na
+ CO32-+ 2H++
+
+
H2 O
CO2
+ H2O + CO2
+
III. Если образуется вода.
+ - + 2H
2NaOH
H2+SO4 2- 2Na
Na2+SO42-+ 2H2O
2Na
2OH
+ 2OH-+ 2H++
OH-
+
+
H+
+
H2O
+ 2H2O
10. Применение реакций ионного обмена
Разрыхлители теста.Определение
качества воды.
Устранение
жесткости воды.
Определение
качества продуктов
питания.
Определение
массовой доли
уксусной кислоты в
ее растворе.
Приготовление
лекарственных
растворов
11. Правила «выживания» в химической лаборатории
1.Выполнять только те опыты, которыеуказаны в инструкции.
2.Использовать растворы в небольших
количествах.
3.При работе с растворами кислот и
щелочей соблюдать особую
аккуратность и осторожность.
12. Лабораторная работа. Реакции ионного обмена. Вариант
Что бралиЧто наблюдали
Уравнения реакций
13. Спасибо за работу
Все, чтовыучили вы
пригодится,
надо только
никогда не
лениться!











 Химия
Химия








