Похожие презентации:
Тепловые эффекты химических реакций. Энтальпия. Термохимические уравнения
1.
Тепловые эффекты химическихреакций.
Энтальпия.
Термохимические уравнения
2.
Термодинамика – это наука о взаимныхпревращениях различных видов энергии.
Термохимия раздел химической
термодинамики, изучает тепловые эффекты
химических реакций.
3.
Химическая термодинамика изучает:• переходы
химической энергии в другие формытепловую, электрическую и. т.д.
• энергетические
эффекты,
сопровождающие
химические реакции;
• возможность и направление самопроизвольного
протекания реакции.
4.
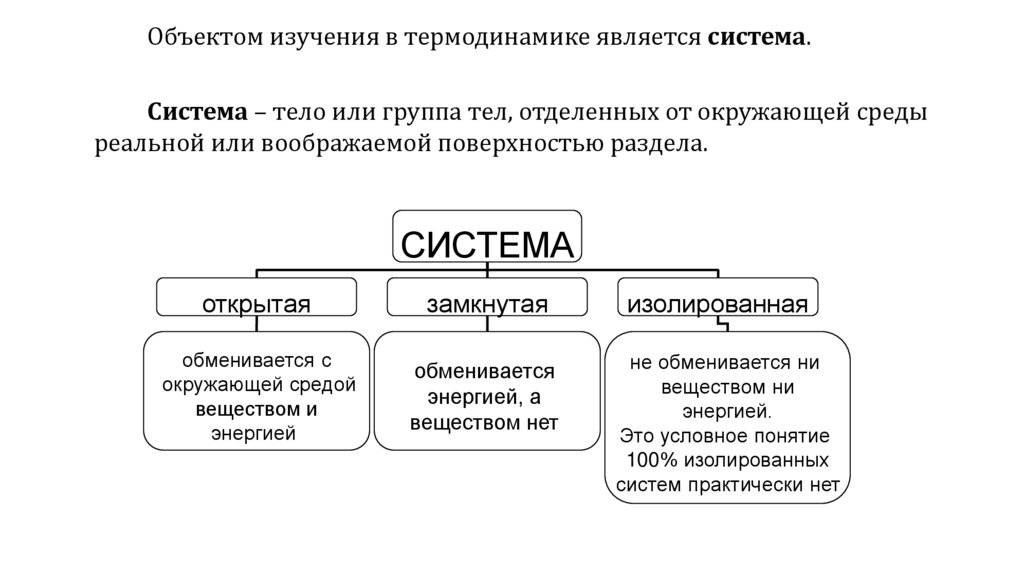
Объектом изучения в термодинамике является система.Система – тело или группа тел, отделенных от окружающей среды
реальной или воображаемой поверхностью раздела.
СИСТЕМА
открытая
замкнутая
обменивается с
окружающей средой
веществом и
энергией
обменивается
энергией, а
веществом нет
изолированная
не обменивается ни
веществом ни
энергией.
Это условное понятие
100% изолированных
систем практически нет
5.
Внутренняя энергия системыВнутренняя энергия системы (U) – общий запас энергии
системы, который
складывается из кинетической и
потенциальной энергий молекул, атомов, атомных ядер и
электронов.
Абсолютное значение внутренней энергии определить
невозможно, однако можно измерить ее изменение ΔU при
переходе из одного состояния в другое.
6.
Первый закон термодинамики(закон сохранения энергии)
Выражает количественное соотношение между
изменением внутренней энергии, теплотой и работой:
Q=ΔU +A
Сумма изменения внутренней энергии и совершенной
ею работы равна сообщенной (или выделенной) теплоте.
7.
Изохорный процессПри химических реакциях А – это работа против
внешнего давления:
А = pΔV,
где ΔV – изменение объема системы (V2 – V1).
При изохорном процессе (V-const):
(V2–V1)=0, тогда А=0; теплота QV=ΔU+ 0,
QV = (U2 – U1) = ΔU
8.
Изобарный процесс(p-const) теплота
Qp = ΔU + pΔV,
Qp = (U2 – U1) + p(V2 – V1) или
Qp = (U2 + pV2) – (U1 + pV1).
Сумма U + pV обозначим через Н, тогда:
Qp = Н2 – Н1 = ΔН
Большинство реакций протекают при постоянном
давлении, поэтому энергетический эффект реакции
характеризуется изменением энтальпии системы.
9.
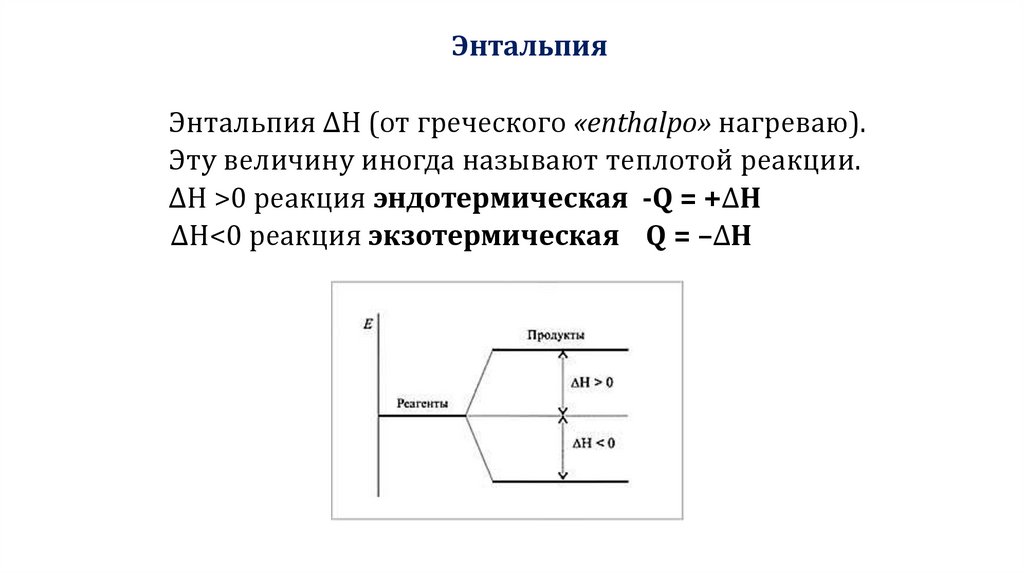
ЭнтальпияЭнтальпия ∆Н (от греческого «enthalpo» нагреваю).
Эту величину иногда называют теплотой реакции.
ΔH >0 реакция эндотермическая -Q = +ΔH
ΔH<0 реакция экзотермическая Q = –ΔH
10.
Стандартная энтальпия образованияСтандартные условия:
Т=298 К (250С)
Р=101,3 КПа, 1 атм., 760 мм. рт. ст.
Энтальпия
образования
определенная
при
стандартных
условиях
называется
стандартной
энтальпией образования вещества и обозначается
∆Н0обр.
11.
Стандартная энтальпия (теплота)образования ∆Н0298 – количество теплоты, которое
выделяется (Q=-∆H) или поглощается (Q=+∆H) при
образовании 1 моль соединения из простых веществ
в стандартных условиях.
Теплота (энтальпия) образования простых веществ
при стандартных условиях равна нулю.
12.
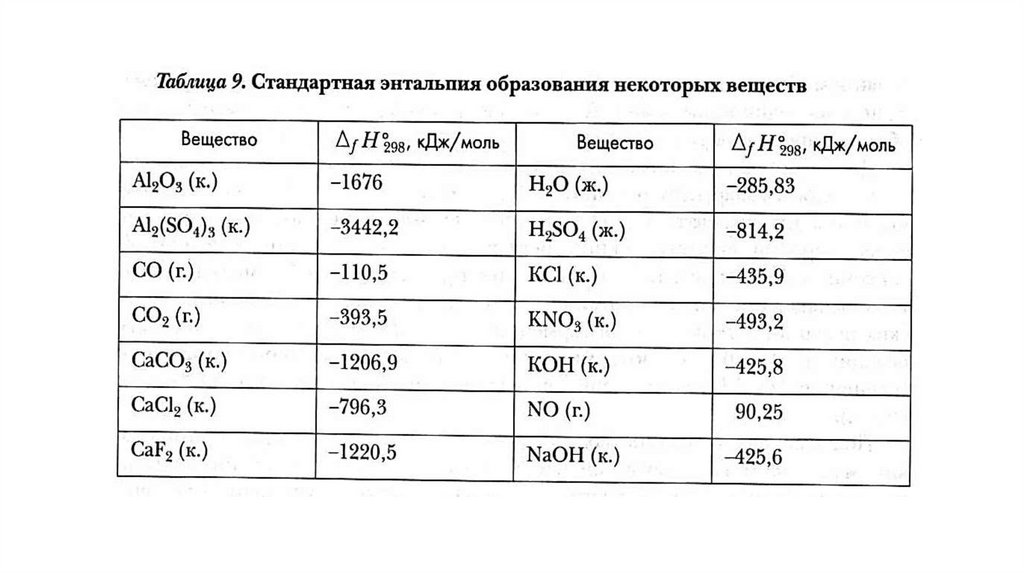
Единицы измеренияЗначения стандартных энтальпий образования
приведены в таблицах, необходимо обращать внимание
на агрегатные состояния веществ.
13.
14.
Термохимические уравнения - этоуравнения химических реакций в которых
указан тепловой эффект химической
реакции и агрегатные состояния.
15.
Виды агрегатного состояния вещества16.
Особенности термохимических уравненийВ термохимических уравнениях могут быть
дробные стехиометрические коэффициенты.














 Химия
Химия








