Похожие презентации:
Кислотно-основные равновесия. Введение в титриметрию
1.
Аналитическая химияЛекция 3
Кислотно-основные равновесия
Введение в титриметрию
2.
План лекции:1. Протолитические равновесия в титриметрии
2. Буферные растворы
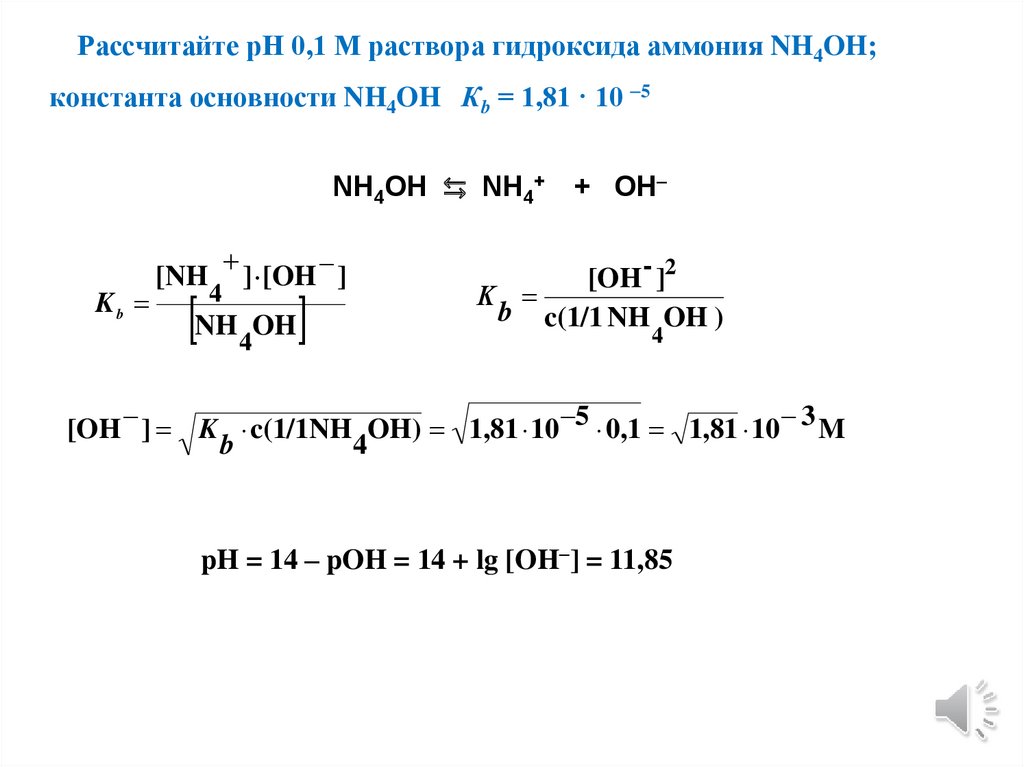
3. Вычисления рН растворов протолитов
4. Примеры
5. Титриметрия
Учебная литература:
1. Аналитическая химия. Химические методы анализа
/ под ред. О.М. Петрухина.
2. Качественный анализ и кислотно-основное титрование.
Практическое пособие / под ред. Кузнецова В.В.
3. Аналитическая химия. Химические методы анализа.
Лабораторный практикум / под редакцией доц. С. Л. Рогатинской
4. Руководство для самостоятельной работы студента в лаборатории
химических методов анализа. В.В. Кузнецов, А.Ф. Жуков и др.
3.
Литература каф. аналитической химииРХТУ им. Д.И. Менделеева
4.
Теории кислотно-основноговзаимодействия
Теория Аррениуса: кислота – частица, которая
диссоциирует с отщеплением протона, основание - с
отщеплением гидроксила
Теория Бренстеда - Лоури: кислота – частица, которая
способна отщеплять протон, основание – частица, способная
присоединять протон
Теория Люиса: кислота – частица, которая способна
принимать пару электронов (частица, имеющая атомы со
свободными электроннными орбиталями), основание –
отдавать пару электронов (частица с неподеленной
электронной парой).
5.
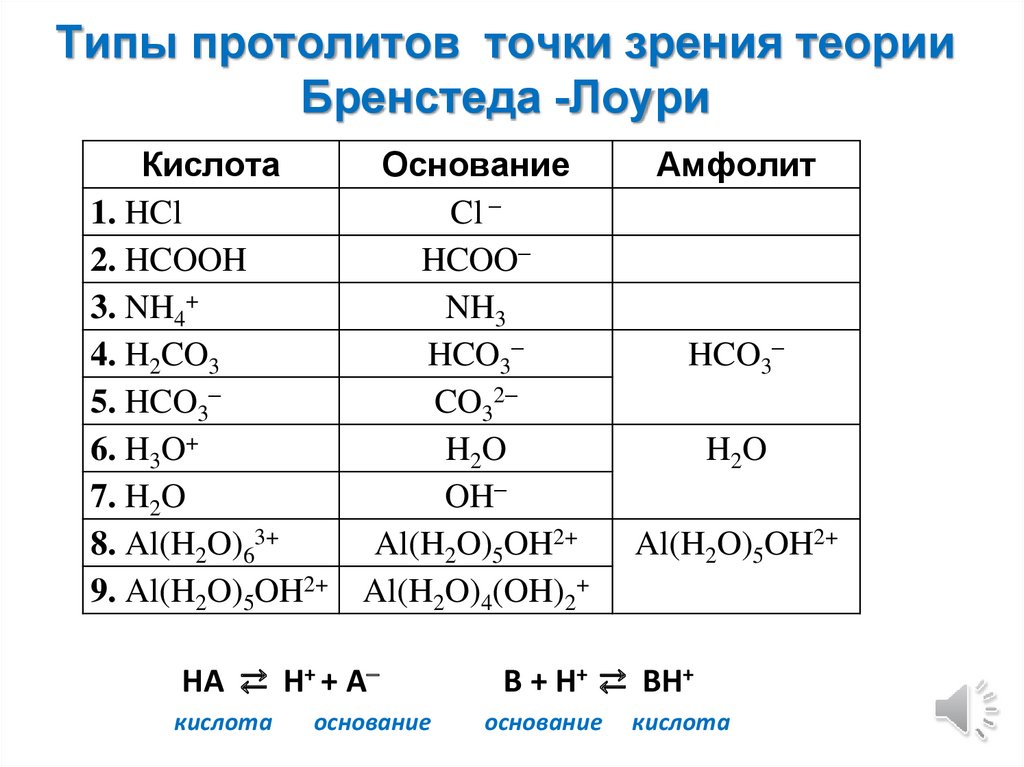
Типы протолитов точки зрения теорииБренстеда -Лоури
Кислота
1. HCl
2. HCOOH
3. NH4+
4. H2CO3
5. HCO3
6. H3O+
7. H2O
8. Al(H2O)63+
9. Al(H2O)5OH2+
Основание
Cl
HCOO
NH3
HCO3
CO32
H2O
OH
Al(H2O)5OH2+
Al(H2O)4(OH)2+
HA ⇄ H+ + A
кислота
основание
Амфолит
HCO3
H2O
Al(H2O)5OH2+
B + H+ ⇄ BH+
основание
кислота
6.
Автопротолиз растворителя(самоионизация)
Вода
H2O + H2O ⇄ H3O+ + OH
Растворители
H2O










 Химия
Химия








