Похожие презентации:
Кислоты. Классификация. Способы получения
1.
Кислоты2.
Кислоты — сложные вещества, состоящие из атомовводорода, которые способны замещаться на атомы металла,
и кислотного остатка. С точки зрения теории
электролитической диссоциации кислоты — это электролиты,
которые при диссоциации в качестве катионов образуют
только катион водорода
.
3.
Классификация4.
Способы получения1. Бескислородные кислоты получают при
растворении в воде газообразных
неметаллов с водородом.
соединений
2. Кислородсодержащие кислоты можно
получить взаимодействием
соответствующих кислотных оксидов
с водой.
3. Кислоты можно получить из соответствующих солей.
Реакции обмена протекают в соответствии с вытеснительным
рядом кислот.
Например, соляная кислота вытесняет уксусную из растворов её
солей, а фосфорная кислота может быть вытеснена серной:
5.
4. Взаимодействие кислоты с солью.NaCl + H2SO4(конц.) → HCl + Na2SO4
5. Окисление некоторых простых веществ:
P + 5HNO3 +2H2O → 3H3PO4 + 5NO
6.
Физические свойстваПо агрегатному состоянию большинство кислот являются
жидкостями (HNO3, H2SO4, HClO4 и др.). Некоторые жидкие
кислоты представляют собой растворы газов в воде (HCl,
H2S, H2CO3(H2CO3=H2O+CO2), H2SO3 (H2SO3= H2O+SO2)
и др.). Ортофосфорная кислота H3PO4, борная H3BO3,
йодная кислота HIO4- твердые вещества.
Кислоты могут быть бесцветными и окрашенными (хромовая
кислота H2CrO4 существует в виде раствора желтого цвета, а
марганцовая кислота HMnO4 - в виде раствора фиолетовогокрасного цвета).
По растворимости в воде почти все кислоты относятся к
хорошо растворимым веществам, кремниевая кислота
H2SiO3 нерастворима в воде. При растворении в воде
метакислоты переходят в ортокислоты (HPO3+H2O=H3PO4;
HBO2+H2O=H3BO3).
7.
Химические свойстваКислоты вступают как в реакции, протекающие без изменения
степеней окисления (реакции кислотно-основного взаимодействия),
так и в окислительно-восстановительные реакции.
1. Действие кислот на индикаторы.
Водные растворы кислот изменяют окраску индикаторов.
8.
2. В водных растворах кислоты диссоциируют на катионыводорода Н+ и анионы кислотных остатков. При этом
сильные кислоты диссоциируют почти полностью, а слабые
кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H+ + Cl–
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H2SO3 ↔ H+ + HSO3–
HSO3– ↔ H+ + SO32–
3. Взаимодействие кислот с основными и амфотерными
оксидами. В результате реакции обмена образуются соль и
вода.
9.
4. Взаимодействие кислот с основаниями и с амфотернымигидроксидами. Образуется соль и вода.
Такие реакции называются
реакциями нейтрализации.
Возможно и образование кислой соли, если кислота
многоосновная, при определенном соотношении реагентов,
либо в избытке кислоты. В избытке щёлочи образуется
средняя соль и вода
щёлочь + многоосновная кислота(избыток) = кислая соль +
вода
Например, гидроксид натрия при взаимодействии с
трёхосновной фосфорной кислотой может образовывать 3 типа
солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты,
либо при мольном соотношении (соотношении количеств
веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
10.
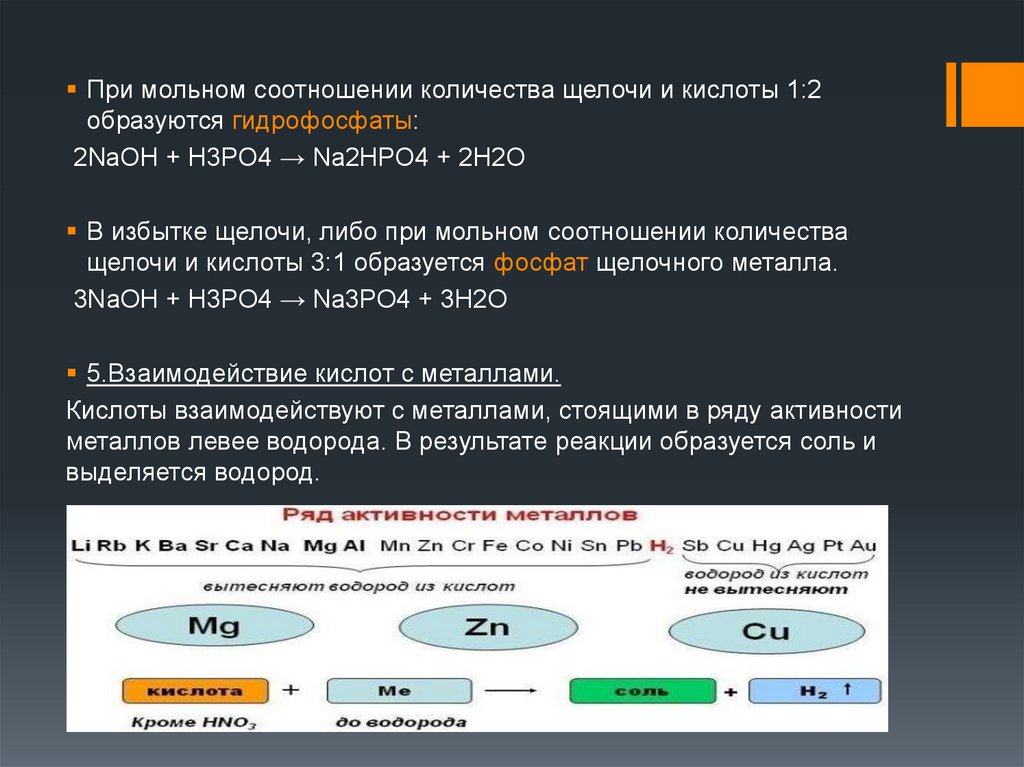
При мольном соотношении количества щелочи и кислоты 1:2образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества
щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
5.Взаимодействие кислот с металлами.
Кислоты взаимодействуют с металлами, стоящими в ряду активности
металлов левее водорода. В результате реакции образуется соль и
выделяется водород.
11.
Можно сказать, что металлы, расположенные в рядуактивности левее, вытесняют водород из кислот.
Например, при взаимодействии магния с соляной кислотой
образуется хлорид магния и выделяется водород:
Эта реакция относится к реакциям замещения.
Необходимо отметить, что при взаимодействии кислотсильных окислителей (азотная к-та, серная конц. к-та и др.)
с металлами водород не образуется.
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3
и кремниевая H2SiO3 с металлами не взаимодействуют.
12.
6. Взаимодействие кислот с солями.Реакции обмена между кислотами и солями возможны, если
в результате образуется практически нерастворимое в воде
вещество (выпадает осадок), образуется летучее вещество
(газ) или слабый электролит.
А) Кислоты реагируют с растворами солей, если в
результате реакции один из продуктов выпадает в осадок.
Б) Продукт реакции при обычных условиях, либо при
нагревании, улетучивается.
13.
В) Если кислота, которая вступает в реакцию, являетсясильным электролитом, то кислота, которая образуется —
слабым.
Например, соляная кислота может вытеснить угольную из
её соли:
Для того чтобы вынести суждение о возможности протекания
реакции, можно воспользоваться вытеснительным рядом
кислот:
В этом ряду кислота, находящаяся левее, может вытеснить
из соли кислоту, находящуюся правее.












 Химия
Химия








