Похожие презентации:
Растворы
1.
2.
Водачто
добавили
+
+ речной песок +
поваренная + оксид калия (K2O)
растительно
соль (NaCl)
е масло
Растворение нет
нет
да
да
Химическая нет
реакция
нет
Что
неоднородн неоднородная
образовалос ая система система
ь
(эмульсия) (суспензия)
нет
да
K2O + Н2О 2КОН
однородная
однородная
система (раствор) (раствор)
система
3.
Растворы – это однородные системы, состоящие измолекул растворителя и частиц растворенного
вещества, между которыми происходят
физические и химические взаимодействия
4.
Способность вещества образовывать сдругими веществами
(растворителями) однородные
системы – растворы
Зависит:
От природы растворяемого вещества
От температуры
5. Природа растворенного вещества
*Хлорид
кальция CaCl2
Гидроксид
кальция Ca(OH)2
Карбонат
кальция CaCO3
хорошо растворимые
(в 100г H2O
больше 1г вещества)
малорастворимые
(в 100г H2O
меньше 1г вещества)
нерастворимые
(в 100г H2O
меньше 0,01г вещества)
Вещества
РАСТВОРИМОСТЬ НЕКОТОРЫХ СОЛЕЙ В 100 г ВОДЫ ПРИ 20 °С
Хорошо растворимые
Сульфат меди
Нитрат калия
Иодид натрия
CuS04
KN03
Nal
Малорастворимые
22,2
31,6
179,10
Сульфат серебра
Сульфат кальция
Иодид свинца
Практически нерастворимые
Ag2S04
CaS04
Pbl2
0,79
0,20
0,07
Бромид серебра
Хлорид серебра
Иодид серебра
AgBr
AgCl
Agl
0,0037
0,00009
0,000003
6.
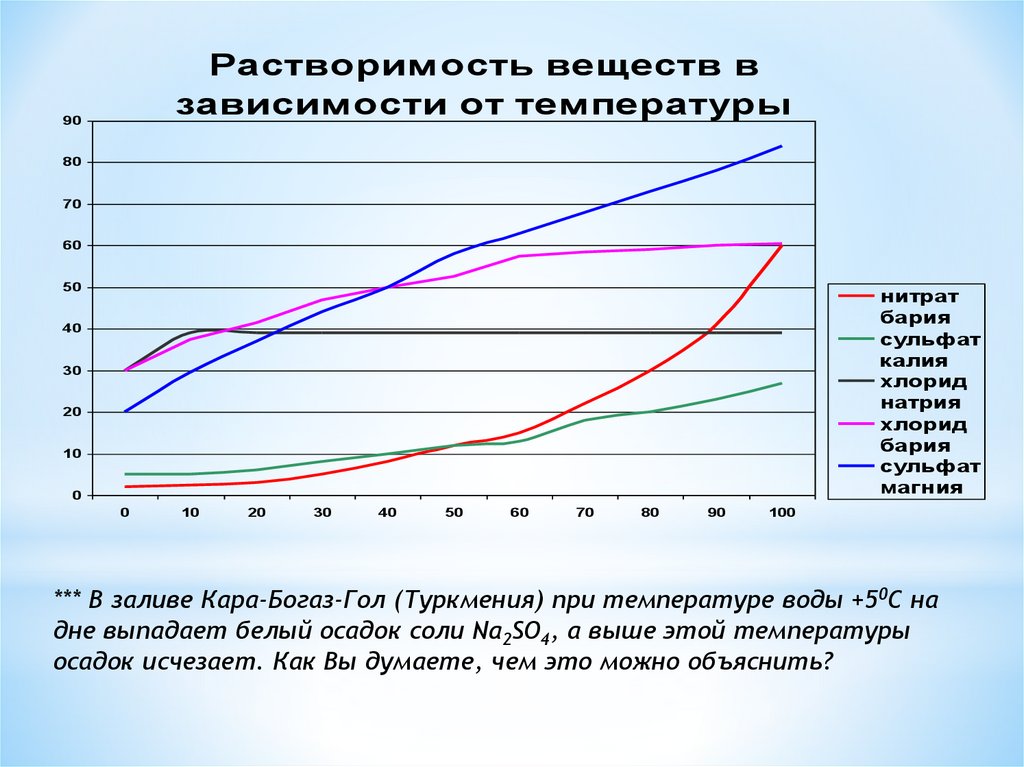
Растворимость веществ взависимости от температуры
90
80
70
60
50
нитрат
бария
сульфат
калия
хлорид
натрия
хлорид
бария
сульфат
магния
40
30
20
10
0
0
10
20
30
40
50
60
70
80
90
100
*** В заливе Кара-Богаз-Гол (Туркмения) при температуре воды +50С на
дне выпадает белый осадок соли Na2SO4, а выше этой температуры
осадок исчезает. Как Вы думаете, чем это можно объяснить?
7.
Растворынасыщенные
это растворы, в которых
данное вещество при данной
температуре
больше
растворяться не может
ненасыщенные
это растворы, в которых
данное вещество при данной
температуре
еще
может
растворяться
Коэффициент растворимости – это масса вещества (г),
способная раствориться в одном литре растворителя (л)
mв ва ( г )
Кр
Vр ля ( л)
Например, растворимость NANO3 равна 80,5 г/л при 100С. Это означает, что при
данной температуре в одном литре воды может раствориться 80,5 г. нитрата
натрия.
8.
Решите задачу. В 400 мл. воды при 200С может раствориться 48 г. сульфата калия.Какова растворимость сульфата калия при данной температуре?
Дано:
m (в-ва) = 48 г.
V р-ля = 400 мл =
= 0,4 л
_______________
Кр - ?
Решение:
mв ва ( г )
Кр
Vр ля ( л)
;
Ответ: Кр (К2SO4) = 120 г/л
*** Поскольку сульфат калия признан безопасной пищевой
добавкой, он разрешен к применению в странах Европейского
Союза и на территории Российской Федерации. Чаще всего свое
применение сульфат калия как добавка находит в качестве
заменителя соли. Кроме этого, он выступает в качестве
регулятора кислотности в напитках
Кр
48г
120 г / л
0,4 л
9.
Показатель, характеризующий количество растворенного вещества в раствореРАСТВОРЫ
разбавленные
мало растворенного вещества
концентрированные
много растворенного вещества
Эти понятия относительны, например
25%-ный раствор HCl – концентрированный, а
25%-ный раствор H2SO4 – разбавленный
10.
Один из способов выражения концентрациирастворов – массовая доля (w)
доля
часть
целое
mв ва( г )
w
mp pa( г )
w<1
mв ва( г )
w%
100%
mp pa( г )
w% < 100%
11.
Задача 1. Вычислите массовую долю раствора в %, который получится, если50 г. вещества растворили в 450 г. воды.
Дано:
m в-ва = 50 г.
m р-ля = 450 г.
_____________
w% - ?
Ответ: w% = 10%
Решение:
w%
mв ва( г )
100%
mp pa ( г )
m р-ра = m в-ва + m р-ля
m р-ра = 50г + 450г = 500г
50 г
w%
100% 10%
500г
Задача 2. Вычислите массу воды и массу соли, которые необходимо взять,
чтобы приготовить 300г раствора с массовой долей 15%.
Дано:
m р-ра = 300г
w% = 15%
____________
m в-ва - ?
m р-ля - ?
Решение:
w%
mв ва( г )
100%
mp pa( г )
mв ва
mв ва
300 г 15%
45г
100%
mр ра w%
100%
m р-ля = m р-ра – m в-ва = 300г – 45 г.= 255 г
Ответ: m в-ва = 45 г., m р-ля = 255 г.










 Химия
Химия








