Похожие презентации:
Химические свойства алкенов
1.
ХИМИЧЕСКИЕСВОЙСТВА АЛКЕНОВ
2.
Алкены химически активны. Их химическиесвойства во многом определяются
наличием двойной связи. Для алкенов
наиболее характерны реакции
электрофильного присоединения и
реакции радикального присоединения.
Реакции нуклеофильного присоединения
обычно требуют наличие сильного
нуклеофила и для алкенов не типичны.
Алкены легко вступают в реакции
окисления, присоединения а также
способны к алильному радикальному
замещению.
3.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ1. Галогенирование(присоединение
галогенов)
Алкены легко при обычных условиях вступают
в реакции с хлором и бромом с
образованием соответствующих
дигалогеналканов, в которых атомы галогена
находятся у соседних атомов углерода
CH2 = CH2 + Br2 → CH2Br – CH2Br
4.
2. Гидрирование(присоединениеводорода)
Гидрирование к алкенам проводят в
присутствии катализаторов. Чаще всего
используют измельченные металлы - платину,
никель, палладий и др. В результате
образуются соответствующие алканы
(насыщенные углеводороды)
CH2 = CH2 + H2 → CH3 – CH3
5.
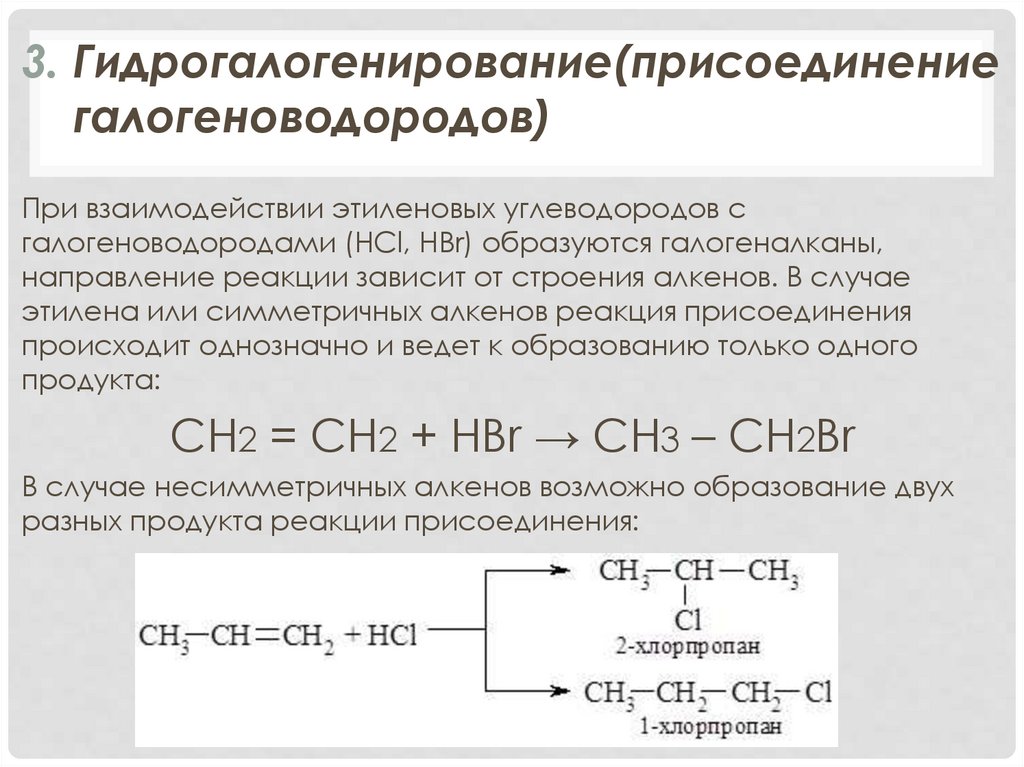
3. Гидрогалогенирование(присоединениегалогеноводородов)
При взаимодействии этиленовых углеводородов с
галогеноводородами (HCl, HBr) образуются галогеналканы,
направление реакции зависит от строения алкенов. В случае
этилена или симметричных алкенов реакция присоединения
происходит однозначно и ведет к образованию только одного
продукта:
CH2 = CH2 + HBr → CH3 – CH2Br
В случае несимметричных алкенов возможно образование двух
разных продукта реакции присоединения:
6.
4. Гидратация(присоединение воды)Гидратация алкенов происходит в
присутствии минеральных кислот и
подчиняется правилу Марковникова.
Продуктами реакции являются спирты
CH2 = CH2 + H2O → CH3 – CH2 - OH
7.
РЕАКЦИЯ ПОЛИМЕРИЗАЦИИМолекулы алкенов способны присоединяться при
определенных условиях друг к другу с раскрытием π-связей
и образования димеров, триммеров или
высокомолекулярных соединений - полимеров.
Полимеризация алкенов может протекать как по
свободнорадикальному, так и катионно-анионому
механизму. Как инициаторы полимеризации применяют
кислоты, перекиси, металлы и др. Реакцию полимеризации
осуществляют также под действием температуры,
облучения, давления. Типичным примером является
полимеризация этилена с образованием полиэтилена
nCH2
= CH2 → (-CH2 – CH2 -)n
8.
РЕАКЦИИ ОКИСЛЕНИЯ1. Горение(взаимодействие с
кислородом)
При горении алкенов образуются вода и
углекислый газ (полное окисление):
2C3H6
+ 9O2 → 6CO2 ↑ + 6H2O
При недостатке кислорода алкены окисляются
до CO или С:
C3H6 + 3O2(нед.) = 3CO ↑ + 3H2O
9.
2. Неполное окисление(реакция сKMnO4)
При окисления алкенов слабым раствором
KMnO4 в слабощелочной среде образуются
гликоли
3CH2
= CH2 + 2KMnO4 + 4H2O → 3HO –
CH2 – CH2 – OH + 2KOH + 2MnO2
Данная реакция имеет стереоселективный
характер, так как обусловлена
образованием на промежуточных стадиях
сложных цикличних эфиров.








 Химия
Химия








