Похожие презентации:
Соли
1.
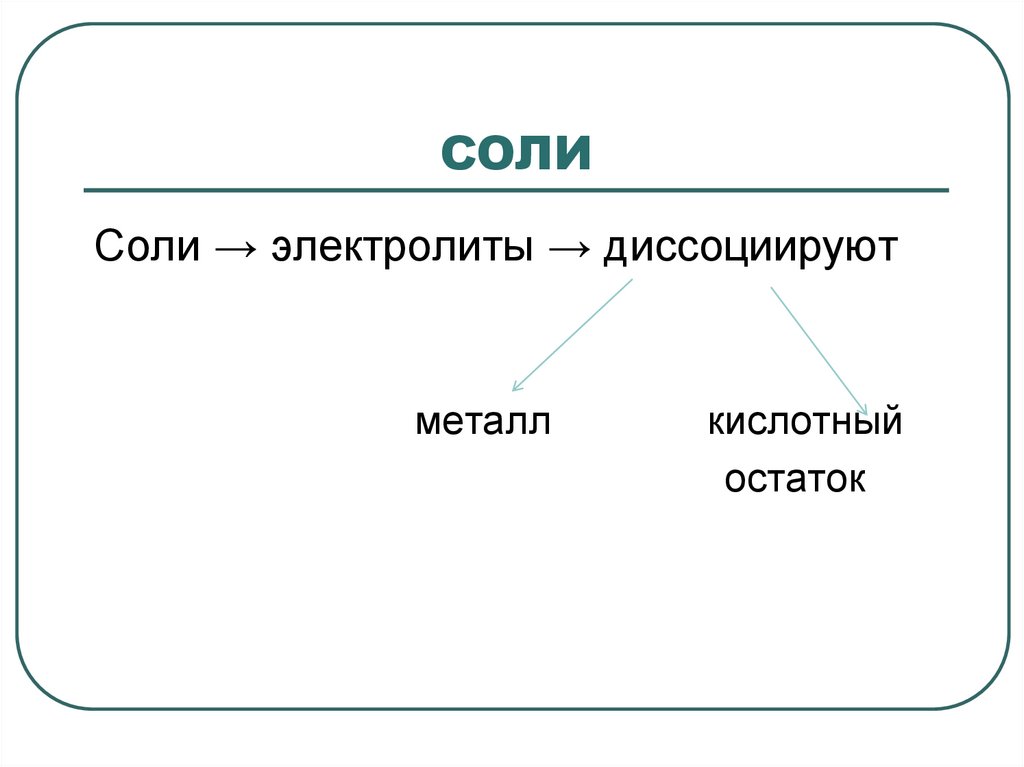
СОЛИ2.
СОЛИСоли → электролиты → диссоциируют
металл
кислотный
остаток
3.
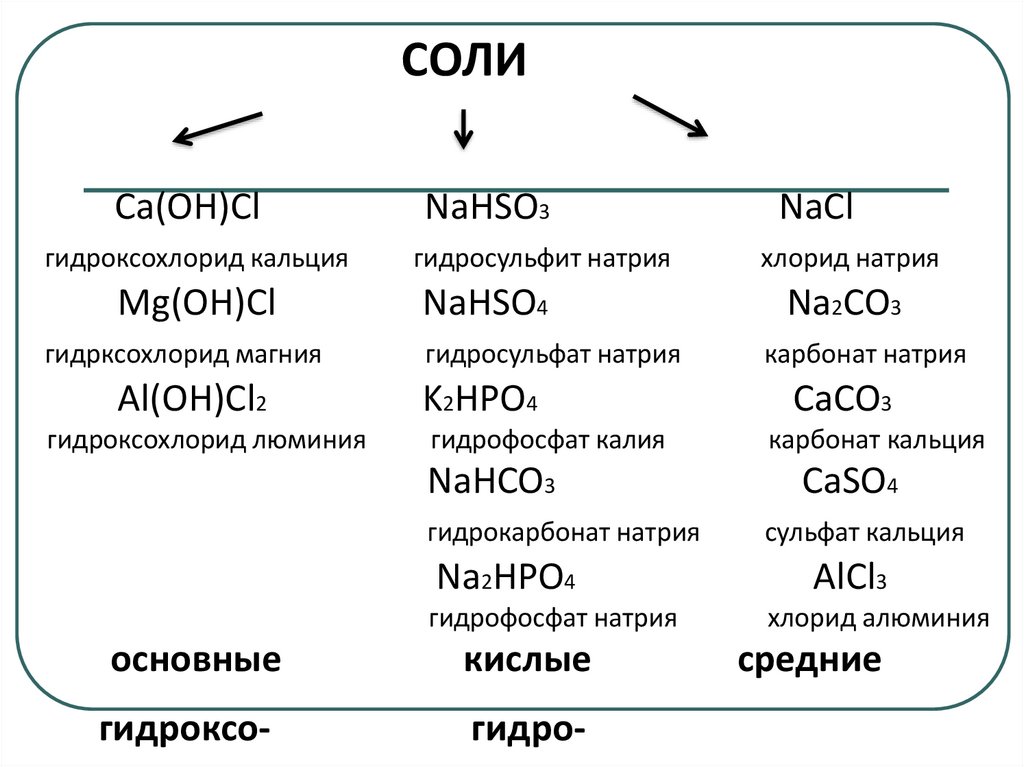
Объедините соли в группыNa2CO3, NaHSO4, Ca(OH)Cl,
NaCl, CaCO3, NaHSO3, K2HPO4,
Mg(OH)Cl, NaHCO3, Na2HPO4,
Al(OH)Cl2, СаSO4, AlCl3.
4.
СОЛИCa(OH)Cl
гидроксохлорид кальция
Mg(OH)Cl
гидрксохлорид магния
Al(OH)Cl2
гидроксохлорид люминия
NaHSO3
гидросульфит натрия
NaHSO4
гидросульфат натрия
K2HPO4
гидрофосфат калия
NaHCO3
гидрокарбонат натрия
Na2HPO4
гидрофосфат натрия
основные
кислые
гидроксо-
гидро-
NaCl
хлорид натрия
Na2CO3
карбонат натрия
CaCO3
карбонат кальция
CaSO4
сульфат кальция
AlCl3
хлорид алюминия
средние
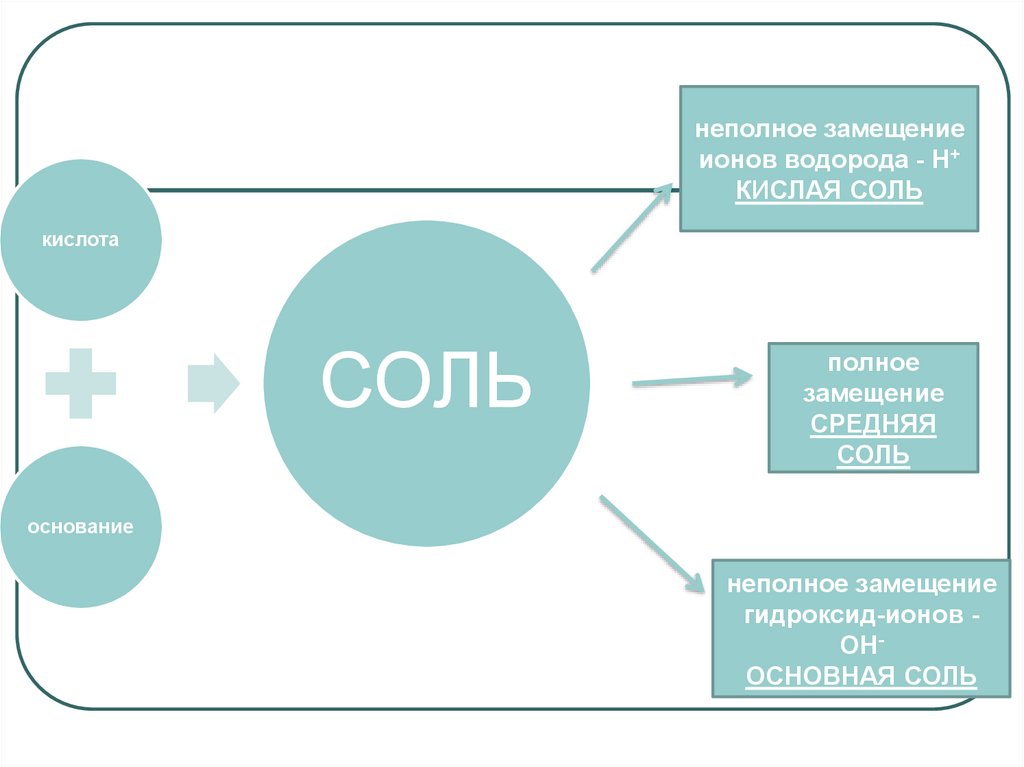
5.
неполное замещениеионов водорода - Н+
КИСЛАЯ СОЛЬ
кислота
СОЛЬ
полное
замещение
СРЕДНЯЯ
СОЛЬ
основание
неполное замещение
гидроксид-ионов ОНОСНОВНАЯ СОЛЬ
6.
Физические свойстваБольшинство солей твёрдые вещества
белого цвета, некоторые соли окрашены:
CuSO4 – голубой
CuS – черный
NiSO4 – зеленый
Соли по растворимости могут быть:
1) растворимые – NaNO3, K2SO4
2) малорастворимые – CaSO4, MgSO3
3) нерастворимые – BaSO4, AgCl
7.
Химические свойства1. Взаимодействие с кислотами
H2SO4 + BaCl2= BaSO4 ↓+ 2HCl
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2 О
8.
Химические свойства2. Взаимодействие с основаниями
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
NH4Cl +KOH = KCl + NH3↑ + H2O
9.
Химические свойства3. Взаимодействие с солями
BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
10.
Химические свойства4. Взаимодействие с металлами
Mg + CuSO4 = MgSO4 + Cu
11.
Получение солейКИСЛОТА + МЕТАЛЛ
ОКСИД МЕТАЛЛА (ОСНОВНЫЙ,
АМФОТЕРНЫЙ) + КИСЛОТА
ГИДРОКСИД МЕТАЛЛА + КИСЛОТА
ЩЕЛОЧЬ + СОЛЬ
МЕТАЛЛ + НЕМЕТАЛЛ
ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ
ОКСИД
Подобрать молекулярные уравнения
12.
Известняк СаСО313.
14.
Гипс СaSO415.
16.
17.
18.
Поваренная соль (хлорид натрия) в природевстречается как каменная соль, входит в состав морской
воды. В быту используется для придания соленого вкуса
пище, консервирования продуктов питания, древесины,
кожи, как адсорбент (вещество, поглощающее жидкие и
газообразные вещества) при выведении различных
пятен, но только свежих.
19.
Сульфат железа (II)(железный купорос) FeSO4
· 7H2O. Применяется для
борьбы с грибковыми
заболеваниями,
поражениями грибками и
мхами культурных
растений, протравы
тканей, изготовлении
красок и чернил.
Сульфат меди, (ll)
сернокислая медь, медный
купорос
(CuSO4 · 5H2O) кристаллическое вещество
голубого цвета. Ядовитая
соль. Используется для
борьбы с грибковыми
заболеваниями растений,
приготовления красок.
20.
Перманганат калия (KMnO4) ("марганцовка"- народноеназвание)-кристаллическое вещество с красивым темнофиолетовым цветом. Оно является прекрасным
дезинфицирующим средством. Неконцентрированный
раствор марганцовки применяется для промывания
желудка при отравлении, а при ангине полоскают горло
слабым раствором несколько раз в день. Применяется как
окислитель при отбелке животных тканей, удаления пятен
масел и жиров, как микроэлемент для подкормки растений
и дезинфекции почвы.

















 Химия
Химия








