Похожие презентации:
Соли в свете теории электролитической диссоциации
1.
в свете теорииэлектролитической
диссоциации
2. Цель урока:
Сформировать понятие о солях как классеэлектролитов;
Рассмотреть общие химические свойства
солей в свете теории электролитической
диссоциации.
3.
Соли – твердые вещества;Тип химической связи – ионный;
Соли – растворимые в воде,
нерастворимые
малорастворимые
4.
Соли – это сложные вещества,состоящие из атомов металла и
кислотного остатка.
Соли – это сложные вещества,
состоящие из ионов металлов и
кислотных остатков.
Соли – это электролиты, которые
при диссоциации образуют катионы
металла и анионы кислотного
остатка.
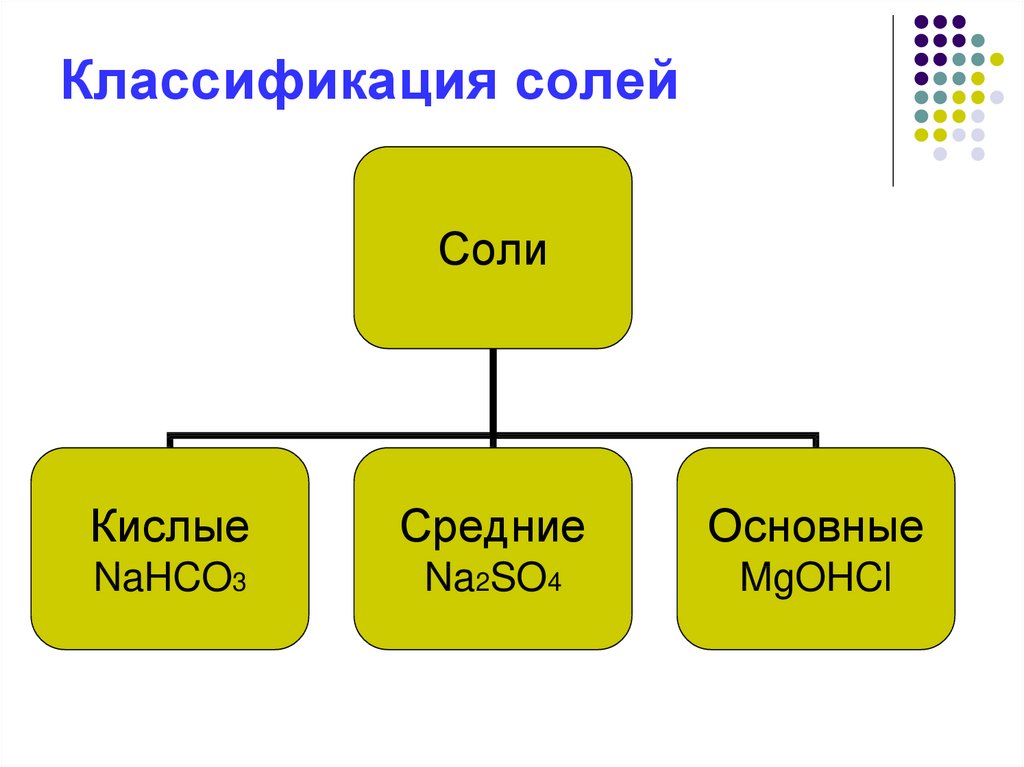
5. Классификация солей
СолиКислые
Средние
Основные
NaHCO3
Na2SO4
MgOHCl
6. Номенклатура средних солей
Названиекислотного
остатка
+
название металла
(в родительном
падеже)
Fe2(SO4)3 – сульфат железа (III)
K3PO4
-
+
с.о. металла
(в скобках)
7. Средними называют соли, которые образуются при полном замещении атомов водорода в кислоте атомами металлов: H3PO4 + 3KOH =
K3PO4 + 3H2O2Fe(OH)3 + 3H2SO4= Fe2(SO4)3+ 6H2O
8. Номенклатура кислых солей
«Гидро» + названиекислотного
остатка
+
название металла
(в родительном
падеже)
NaHSO4 – гидросульфат натрия
NaHCO3 – гидрокарбонат натрия
+
с.о. металла
(в скобках)
9. Кислыми называют соли, которые образуются при неполном замещении атомов водорода в кислоте на атомы металлов: H3PO4 + 2KOH =
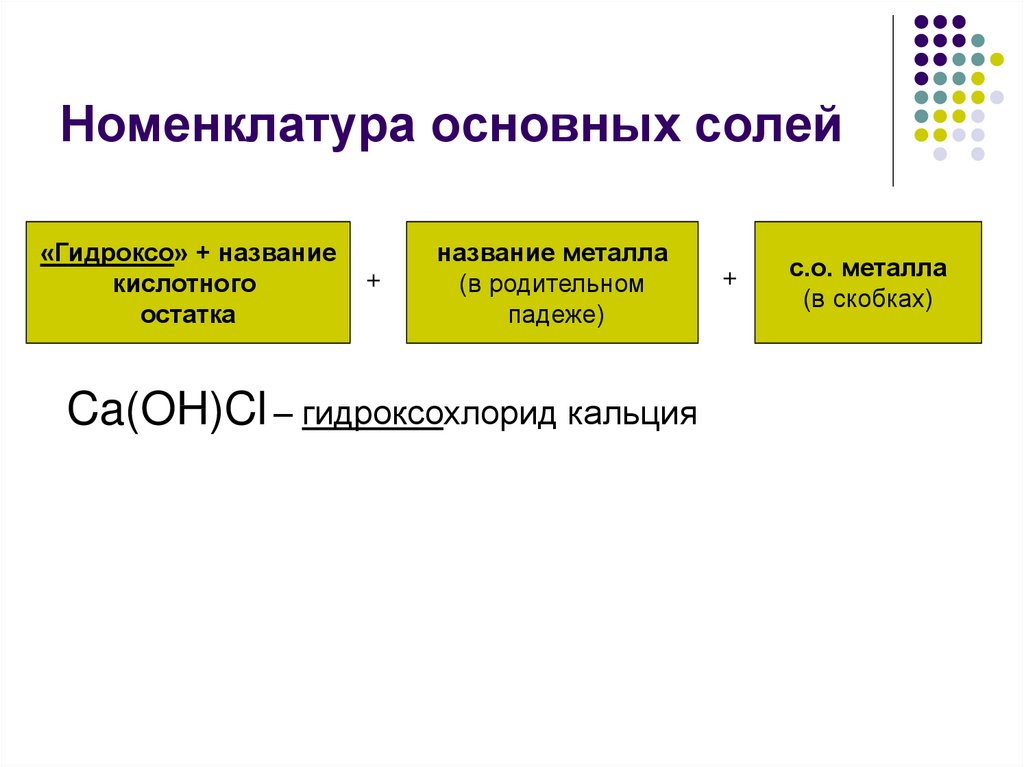
K2HPO4 + 2H2O10. Номенклатура основных солей
«Гидроксо» + названиекислотного
остатка
+
название металла
(в родительном
падеже)
Ca(OH)Cl – гидроксохлорид кальция
+
с.о. металла
(в скобках)
11. Основными называют соли, в которых кроме кислотного остатка присутствуют гидроксогруппы: Mg(OH)2 + HCl = MgOHCl + H2O
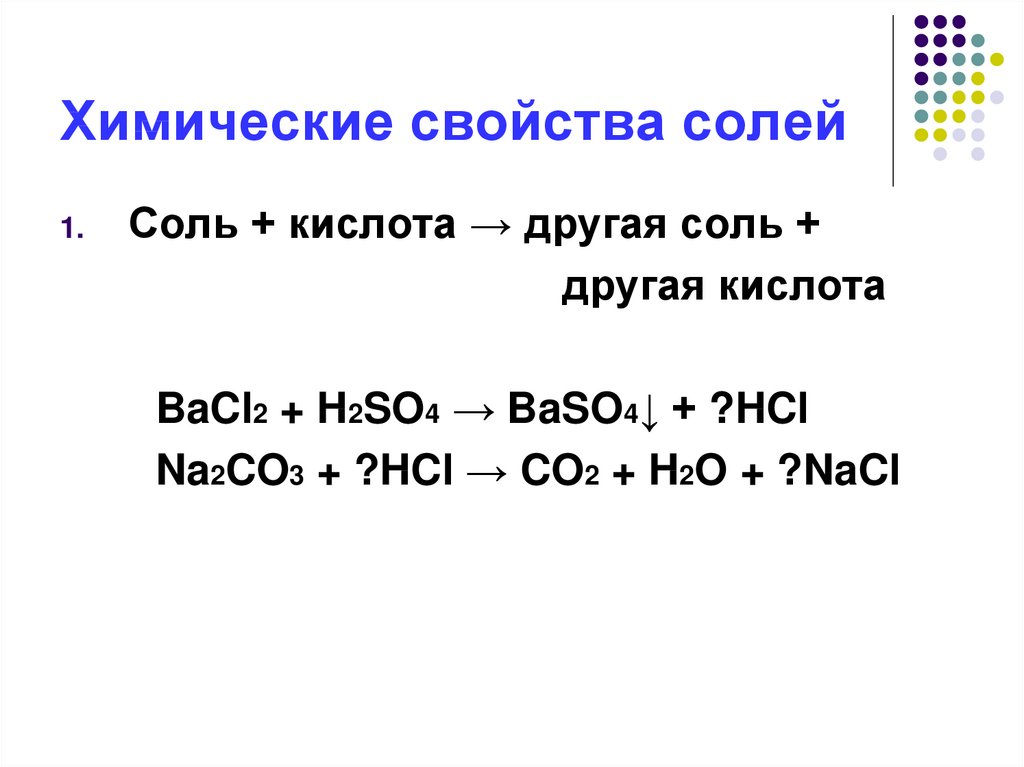
12. Химические свойства солей
1.Соль + кислота → другая соль +
другая кислота
BaCl2 + H2SO4 → BaSO4↓ + ?HCl
Na2CO3 + ?HCl → CO2 + H2O + ?NaCl
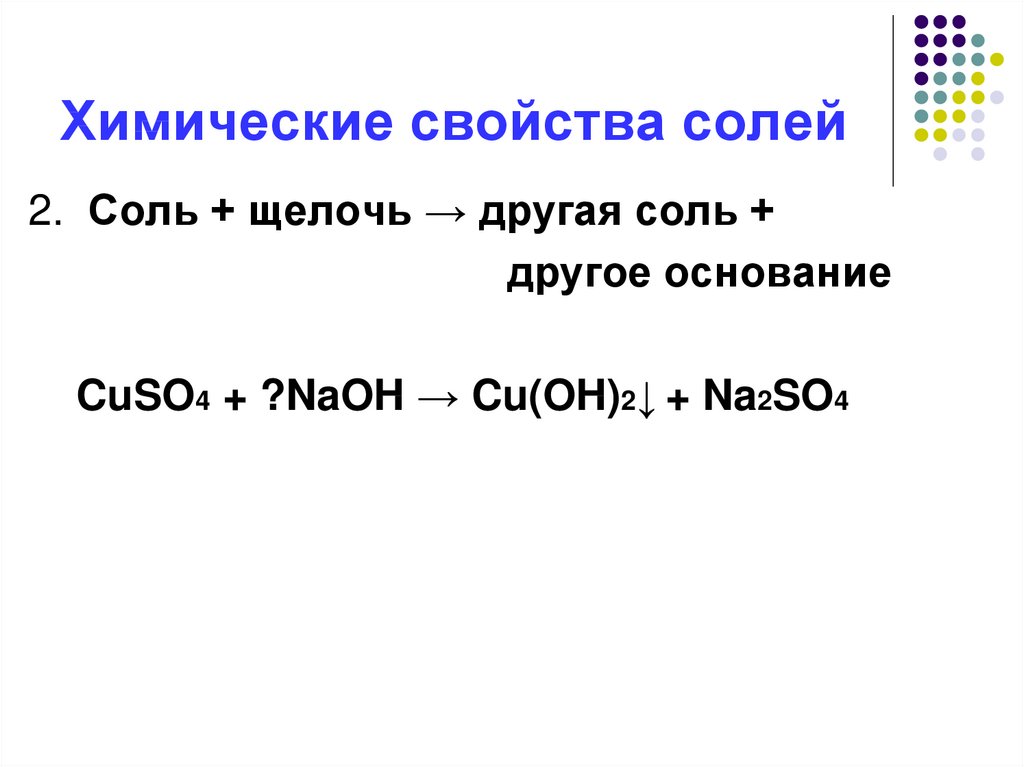
13. Химические свойства солей
2. Соль + щелочь → другая соль +другое основание
CuSO4 + ?NaOH → Cu(OH)2↓ + Na2SO4
14. Химические свойства солей
3. Соль1 + соль 2 → соль 3 + соль 4?NaCl + Pb(NO3)2 → PbCl2↓ + ?NaNO3
15. Химические свойства солей
4.Соль + металл → другая соль +
другой металл
Fe + CuSO4 → FeSO4↓ + Cu
16. Применение солей
Карбонат кальция CaCO3Гидрокарбонат натрия (питьевая
сода) NaHCO3
Хлорид кальция CaCl2
Сульфат бария BaSO4
Иодид натрия и иодид калия
Нитрат серебра (ляпис)
Na2SO4 · 10H2O – глауберова соль
17. Дома:
8В § 41, упражнение 28А,8Б § 42, упражнение 2













 Химия
Химия








