Похожие презентации:
Переходный элемент алюминий. Свойства алюминия
1. Алюминий – переходный элемент.
Учебная презентациядля 9 класса
2. План урока:
1. Дать характеристику алюминия по егоположению в периодической системе
химических элементов.
2. На основе строения атома рассмотреть его
физические и химические свойства, указать
области применения алюминия.
3.Ответить на вопрос: « Почему алюминий
называют металлом будущего?»
3. «Серебро из глины»
Немецкий учёныйФ. Велер (1827 г.)
получил алюминий
при нагревании
хлорида алюминия
со щелочными
металлами калия и
натрия.
А.Сент-Клер
Девиль.
Впервые
получил
алюминий
промышленным
способом
(1855г.).
Из истории открытия
В период открытия алюминия - металл был дороже
золота. Англичане хотели почтить богатым подарком
великого русского химика Д.И Менделеева, подарили
ему химические весы, в которых одна чашка была
изготовлена из золота, другая - из алюминия. Чашка
из алюминия стала дороже золотой. Полученное
«серебро из глины» заинтересовало не только
учёных, но и промышленников и даже императора
Франции.
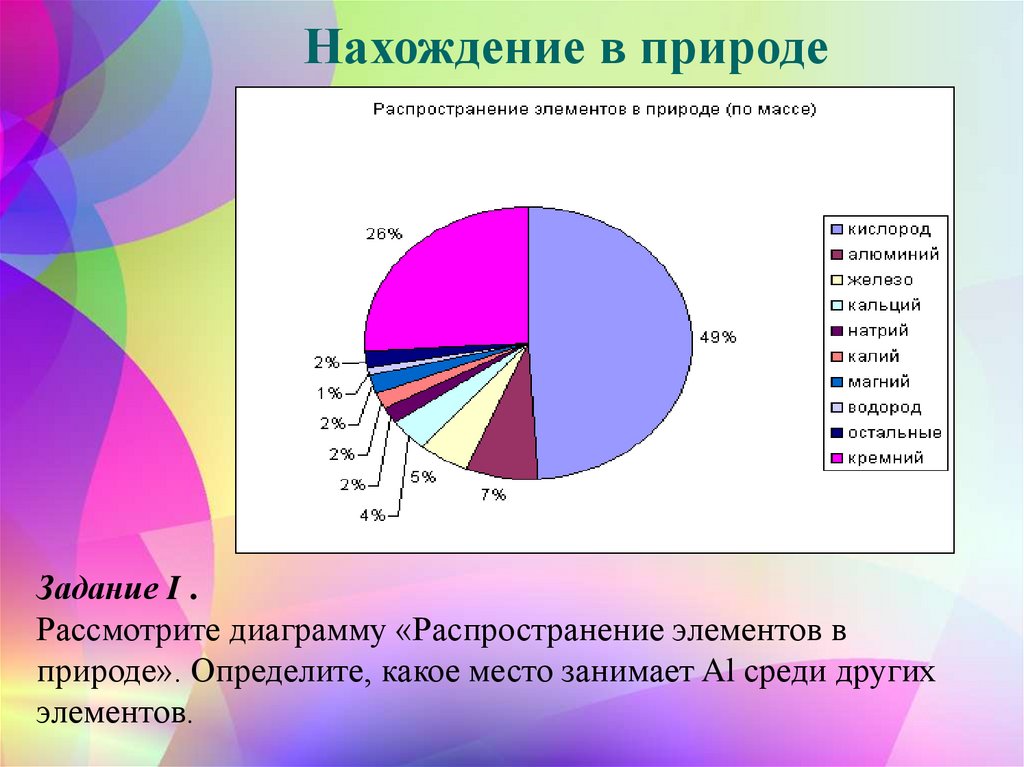
4. Нахождение в природе
Задание I .Рассмотрите диаграмму «Распространение элементов в
природе». Определите, какое место занимает Al среди других
элементов.
5.
Природные соединения алюминиябоксит
Нефелины — KNa3[AlSiO4]4
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3,
магнезитом MgCO3)
Корунд (сапфир, рубин, наждак) — Al2O3
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
6.
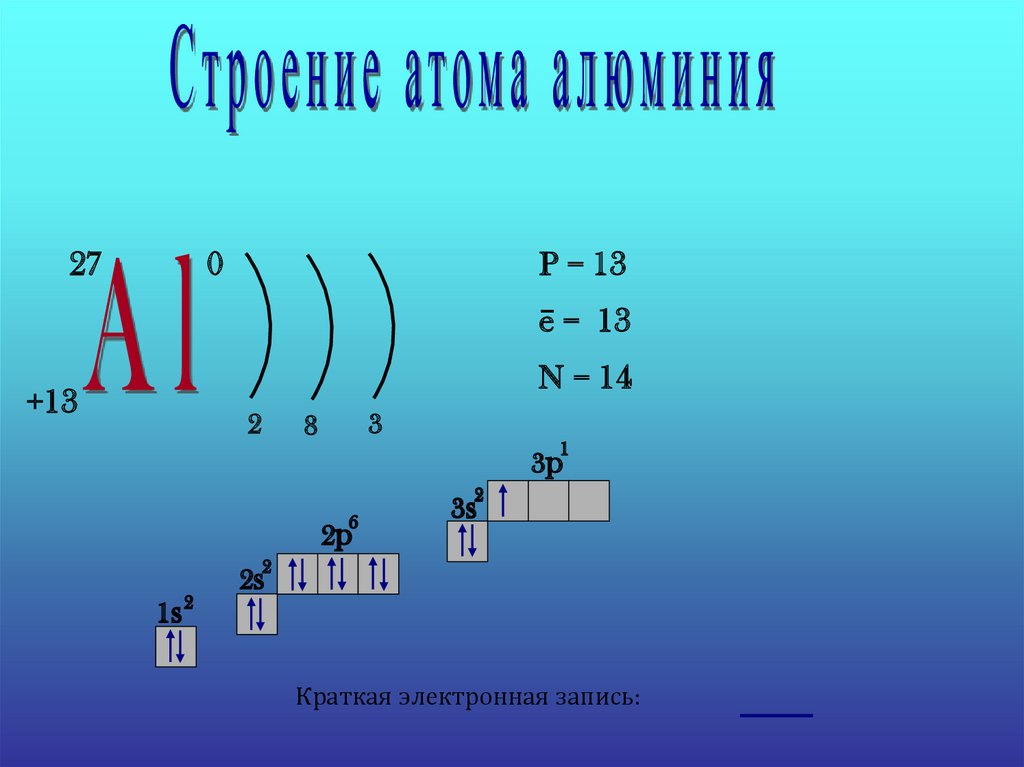
270
P = 13
e− = 13
N = 14
+13
2
3
8
1
3p
2
6
2p
3s
2
1s 2
2s
Краткая электронная запись:
7.
Периодическая система химических элементов Д.И.МенделееваПериоды Ряды
1
1
2
2
3
3
4
4
5
6
5
7
8
6
Группы элементов
I
II
III
IV
V
10
VII
VIII
Характеристика
27
0
Al
+13
1.
Впервые получен в 1825
году Гансом Эрстедом.
2.
В Периодической системе
расположен в 3 периоде,
IIIА-группе.
3.
В природе встречается
только в виде соединений.
4.
Серебристо-белый, легкий
металл. Обладает высокой
тепло- и
электропроводностью.
5.
Валентность: III.
Степень окисления: +3.
9
7
VI
8.
Алюминий восстанавливает все элементы,находящиеся справа от него в электрохимическом ряду
напряжения металлов, простые вещества – неметаллы.
Взаимодействует с…
Неметаллами
Кислородом
Щелочами
Водой
Кислотами
Оксидами металлов
9.
+3O2+3Cl2
2Al
+3S
+6HCl
+3CuSO4
Al2O3
2AlCl3
Al2S3
2AlCl3 + 3H2
Al2(SO4)3 + 3Cu
10.
Взаимодействие со щелочами2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Задание 2
Напишите уравнения реакций взаимодействия алюминия с
кислородом, бромом, серой, азотом и углеродом.
Одну реакцию разберите с т. з. окисления – восстановления.
Задание 3
Докажите, что алюминий – переходный
элемент.
11. Применение алюминия
12. Алюминий – металл будущего
Задание 4Ответьте на вопрос:
« Почему алюминий называют
металлом будущего?»











 Химия
Химия








