Похожие презентации:
Химические связи
1. Химические связи
ХИМИЧЕСКИЕСВЯЗИ
2. Химическая связь
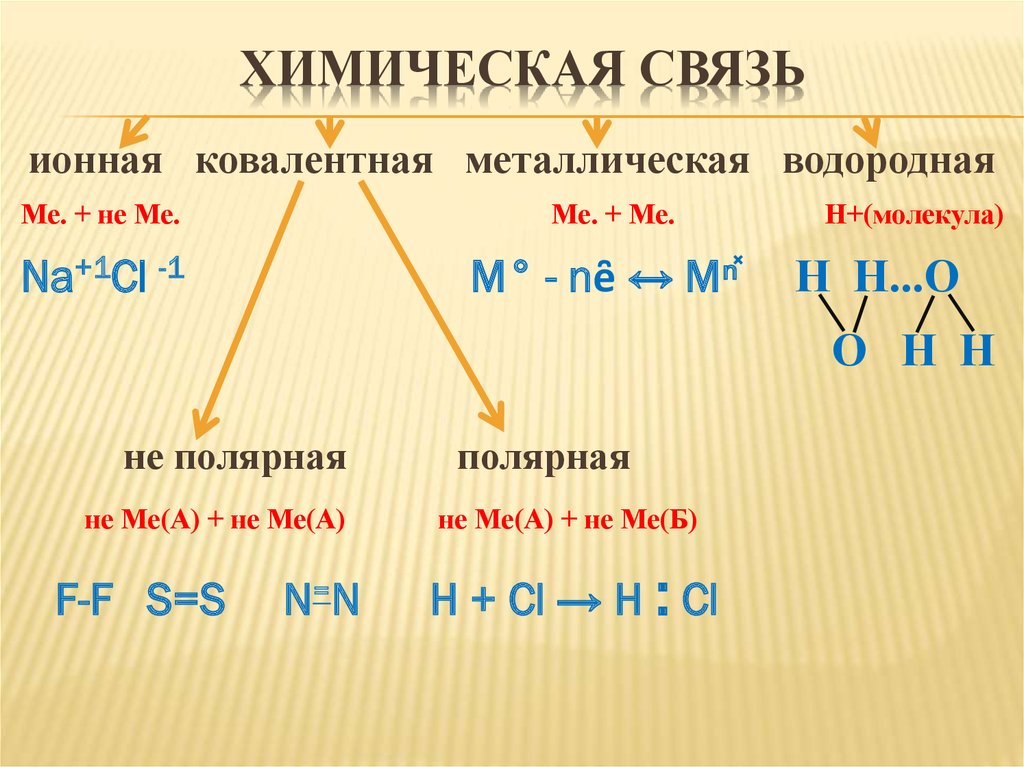
ХИМИЧЕСКАЯ СВЯЗЬионная ковалентная металлическая водородная
Ме. + не Ме.
Ме. + Ме.
Na+1Cl -1
M° - nȇ ↔ Mⁿ̽
Н+(молекула)
Н Н...О
О Н Н
не полярная
не Ме(А) + не Ме(А)
F-F S=S
N=N
полярная
не Ме(А) + не Ме(Б)
H + Cl → H : Cl
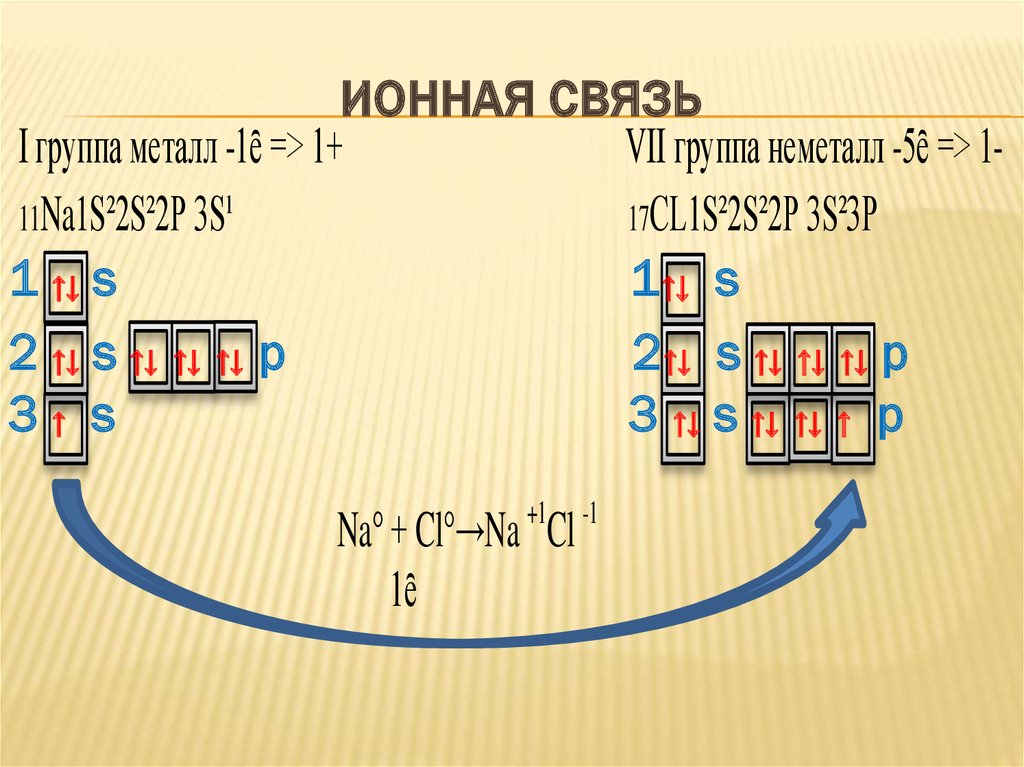
3. Ионная связь
ИОННАЯ СВЯЗЬI группа металл -1ȇ => 1+
VII группа неметалл -5ȇ => 111Na1S²2S²2P 3S¹
17CL1S²2S²2P 3S²3P
1 ↑↓ s
1↑↓ s
2 ↑↓ s ↑↓ ↑↓ ↑↓ p
2↑↓ s ↑↓ ↑↓ ↑↓ p
3↑ s
3 ↑↓ s ↑↓ ↑↓ ↑ p
Na° + Cl°→Na Cl
1ȇ
+1
-1
4.
Ионная связь – это химическая связь,возникающая в результате превращения
атомов в ионы, при взаимодействии атомов
типичных металлов и типичных неметаллов.
Металлы отдают внешние электроны и
превращаются в положительные ионы,
неметаллы принимают электроны и
превращаются в отрицательные ионы. Ионы
притягиваются друг к другу, образуя ионное
соединение.
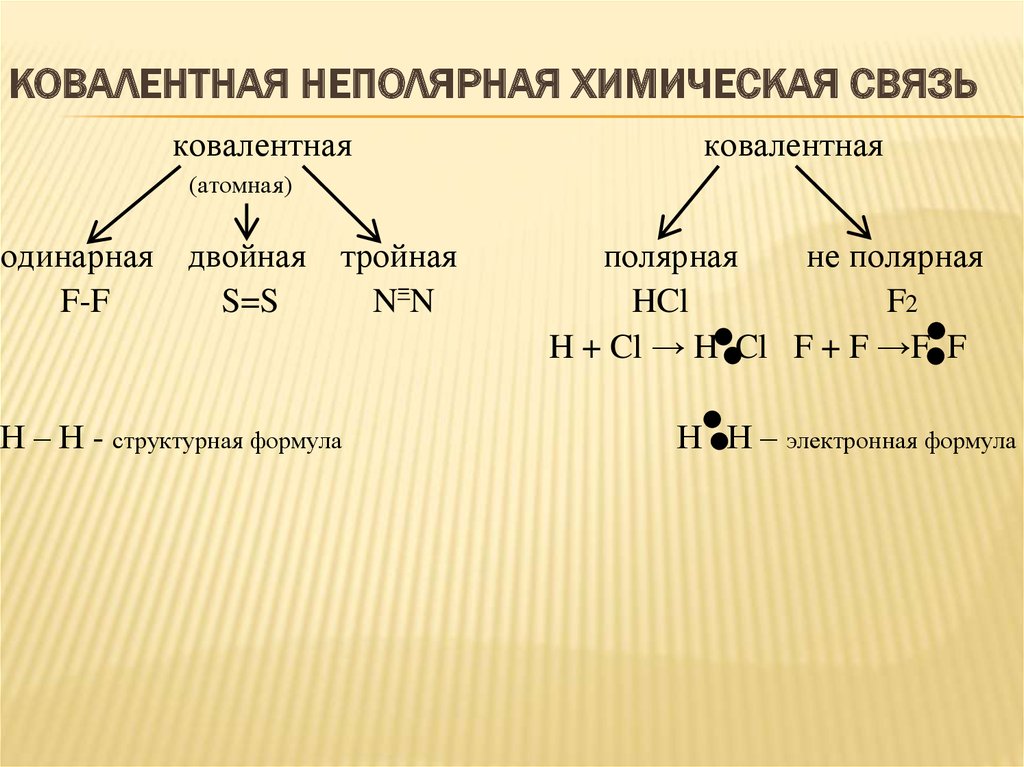
5. Ковалентная неполярная химическая связь
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ ХИМИЧЕСКАЯ СВЯЗЬковалентная
ковалентная
(атомная)
одинарная двойная тройная
F-F
S=S
N=N
Н – Н - структурная формула
полярная
не полярная
HCl
F2
H + Cl → H Cl F + F →F F
Н Н – электронная формула
6.
Ковалентная связь – это химическая связь,возникающая в результате образования общих
электронных пар.
Ковалентная одинарная связь – это химическая связь
в которой атомы связанны между собой одной общей
электронной парой.
Ковалентная неполярная связь – это хим. связь
образованная при взаимодействии двух атомов
одного и того же элемента-неметалла, так как общие
электронные пары принадлежат обоим атомам в
одинаковой степени и ни одной из них не будет
избытка или недостатка отрицательного заряда,
который несут электроны.
Чем больше общих электронных пар у атомов в
молекуле, тем прочнее связанны они друг с другом и
тем меньше расстояние между ядрами атомов.
7. Ковалентная полярная химическая связь
КОВАЛЕНТНАЯ ПОЛЯРНАЯ ХИМИЧЕСКАЯ СВЯЗЬH + Cl → H Cl структурная формула
H +
Cl → H
Cl
электронная формула
Ковалентная полярная связь – это хим. связь
образованная между атомами различных
элементов-неметаллов, то общая электронная
пара будет принадлежать взаимодействующим
атомом уже не в равной степени.
8.
Электроотрицательность (ЭО) – этоспособность атомов химического
элемента смещать к себе общие
электронные пары, участвующие в
образовании химической связи.
F, O, N, Cl, Br, I, S, C, Si, P, H.
ЭО уменьшается
В каждом периоде ЭО возрастает с
увеличением порядкового номера
элемента, а в каждой подгруппе –
уменьшается.
9.
Металлическая связь – это хим. связь в металлах исплавах образованная между атом-ионами,
посредством объединённых электронов.
M° - nȇ ↔ Mⁿ̽
При образовании металлической связи в
объединение этих электронов участвуют все атомы.
=> пластичность, электропроводность,
металлический блеск.
Водородная связь – это своеобразная связь, которая
возникает между атомом водорода одной молекулы,
несущим частичный положительный заряд, и
электроотрицательным атомом другой или той же
самой молекулы.
Н Н......О
О
Н Н






 Химия
Химия








