Похожие презентации:
Химическое равновесие в растворах электролитов
1.
Тема:Химическое равновесие в
растворах электролитов.
2.
Для слабых электролитов:-константа электролитической диссоциации
Для кислотДля основания-
константа кислотности
константа основности
3.
pH-водородный показательpOH-гидроксильный показатель
Для кислот:
Для оснований:
- cиловой показатель слабой кислоты
-cиловой показатель слабого основания
4.
Пример 1. Определите концентрацию ионови рН
раствора кислоты муравьиной
, для которой
константа электролитической диссоциации
,а степень диссоциации
%.
Дано:
%
Найти:
рН-?
Cm( )-?
5.
Решение:Согласно закону разбавления Оствальда:
6.
Подставим полученные данные в формулу дляопределения pH:
Ответ:
7.
Пример 2. Определите молярную концентрациюраствора кислоты уксусной, в котором кислотность
соответствует рН = 5,2. Константа диссоциации
кислоты
(
Дано:
рН = 5,2
Найти:
8.
Решение:9.
Ответ:10.
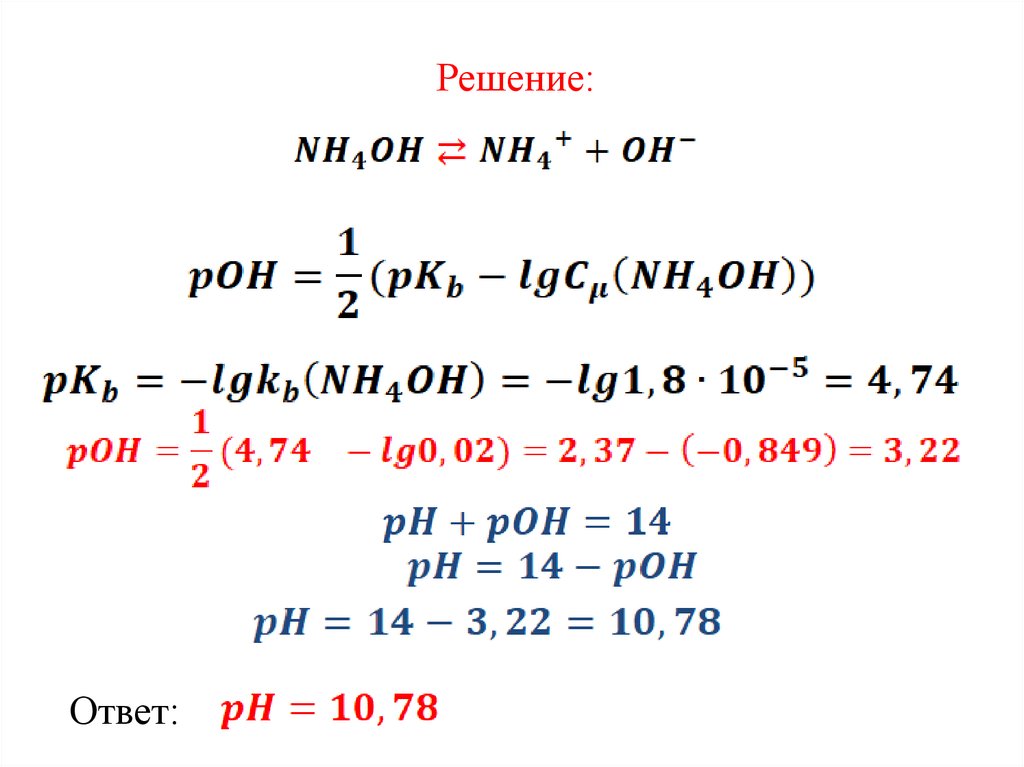
Пример 3. Определите рН раствора аммониягидроксида
с концентрацией 0,02 M.
Константа диссоциации слабого основания
Дано:
Найти:
pH-?
11.
Решение:Ответ:
12.
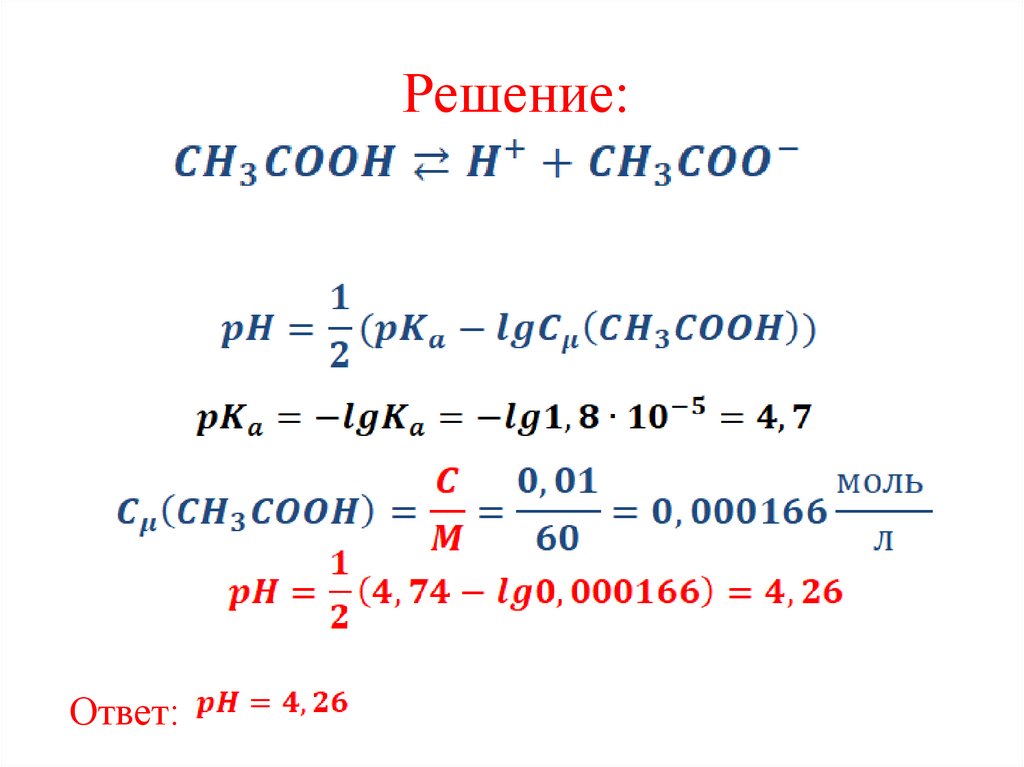
Пример 8. Определите рН раствора кислотыуксусной
с концентрацией 0,01 г/л.
Константа диссоциации кислоты
Дано:
Найти:
рН-?
13.
Решение:Ответ:











 Химия
Химия








