Похожие презентации:
Система цитокинов. Классификация. Основные свойства. Механизмы действия
1. «Система цитокинов. Классификация. Основные свойства. Механизмы действия. Типы цитокиновой регуляции. Клетки-продуценты и клетки-мишени. Ц
«Система цитокинов. Классификация. Основныесвойства. Механизмы действия. Типы цитокиновой
регуляции. Клетки-продуценты и клетки-мишени.
Цитокиновая регуляция воспаления и иммунного
ответа».
Цикл 1 – иммунология.
Занятие № 3 а.
2. Цитокины
Сигнальные (биорегуляторные) молекулы,управляющие практически всеми процессами в
организме – эмбриогенезом, гемопоэзом,
процессами созревания и дифференцировки
клеток, активации и гибели клеток, инициацией и
поддержанием разных типов иммунного ответа,
развитием воспаления, процессами репарации,
ремоделирования тканей, координацией работы
иммуно – нейро - эндокринной систем на уровне
организма в целом.
3. Цитокины
Растворимые гликопротеины (более 1300 молекул, 550 кDa) неиммуноглобулиновой природы,освобождаемые клетками организма – хозяина,
обладающие неферментативным действием в низких
концентрациях (от пикомолярных до наномолярных),
действующие через специфические рецепторы на
клетках-мишенях, регулирующие различные функции
клеток организма.
В настоящее время известно около 200 цитокинов.
4.
Цитокины и жизненный циклклеток
Цитокины –биорегуляторные
молекулы, контролирующие
разные этапы жизненного цикла
клеток:
• процессы дифференцировки.
• процессы пролиферации.
• процессы функциональной
активации.
• процессы гибели клеток.
Цитокины и иммунный ответ
Цитокины играют важную роль в
осуществлении реакций как
врожденного, так и
адаптивного иммунитета.
Цитокины обеспечивают
взаимосвязь врожденного и
адаптивного иммунных
ответов.
5. Свойства цитокинов
Характерен короткий период
полужизни:
цитокины быстро
инактивируются и
разрушаются.
• Большинство из цитокинов
действует на местном уровне
(паракринно – на клетки
микроокружения).
• Цитокинов больше, чем их
рецепторов (многие цитокины
используют общие
субъединицы рецепторов) на
клетках-мишенях для
передачи сигналов в ядро
клетки-мишени
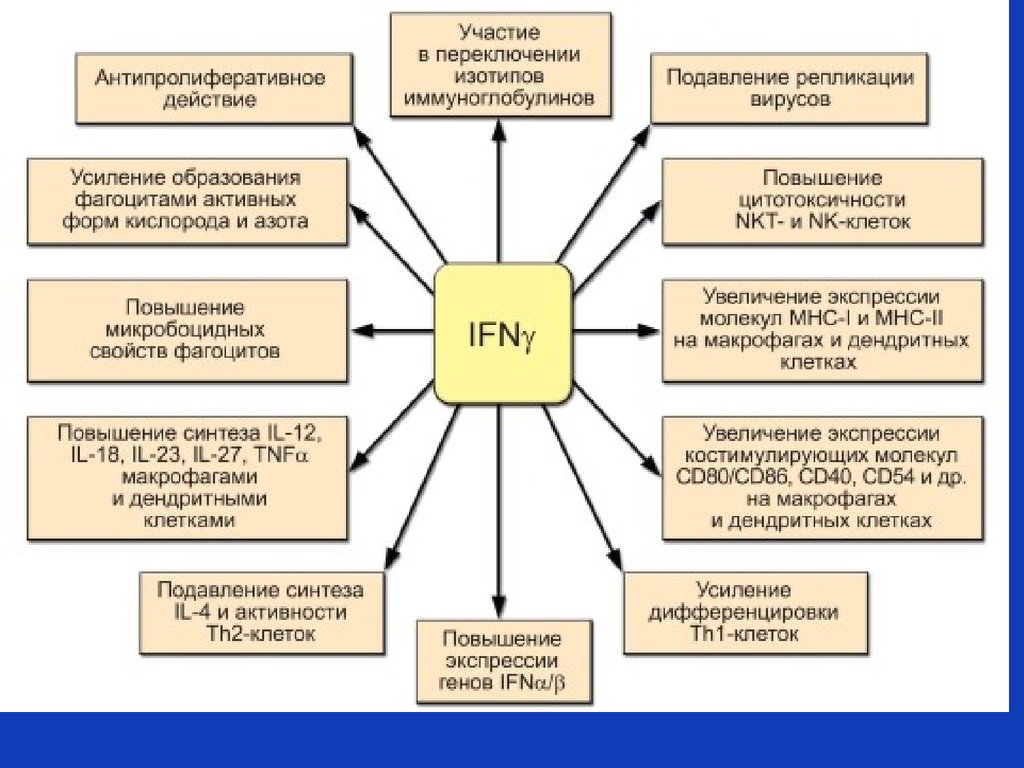
Плейотропность – единственная
молекула может вызывать
множество эффектов путем
активации различных генов в
клетках-мишенях
Конвергенция функций – разные
цитокиновые молекулы могут
выполнять в организме
сходные функции
Полисферизм – множество
цитокинов могут
продуцироваться одной и той
же клеткой в ответ на один
стимул
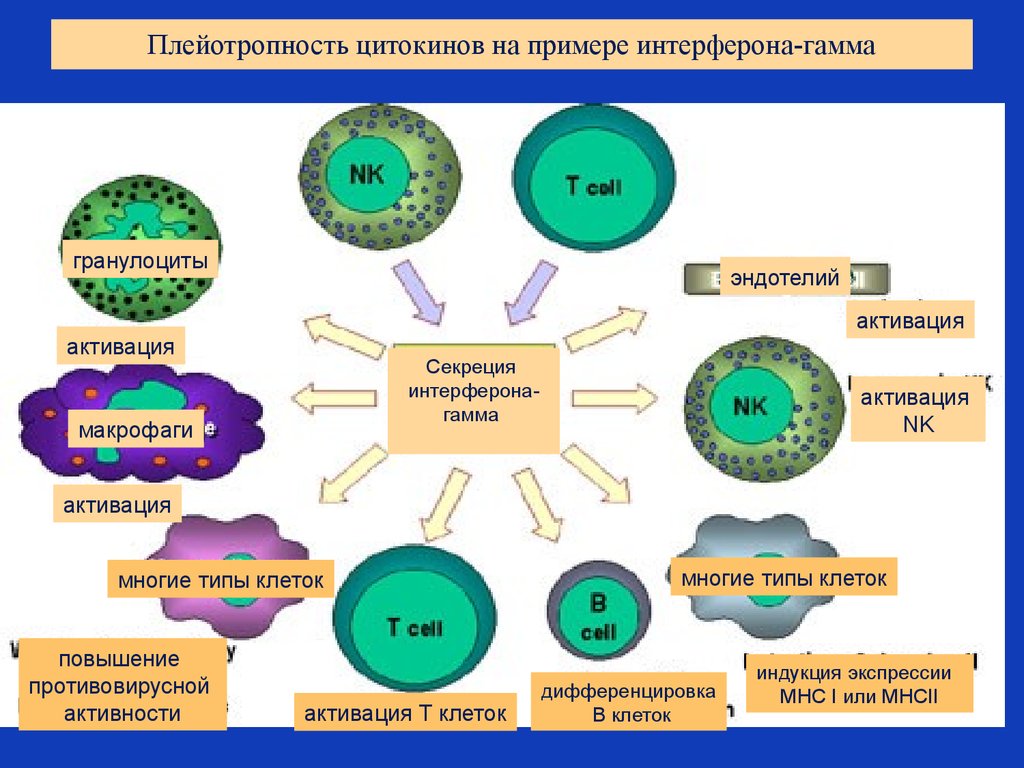
6. Плейотропность цитокинов на примере интерферона-гамма
гранулоцитыэндотелий
активация
активация
Секреция
интерферонагамма
макрофаги
активация
NK
активация
многие типы клеток
повышение
противовирусной
активности
активация Т клеток
многие типы клеток
дифференцировка
В клеток
индукция экспрессии
MHC I или MHCII
7.
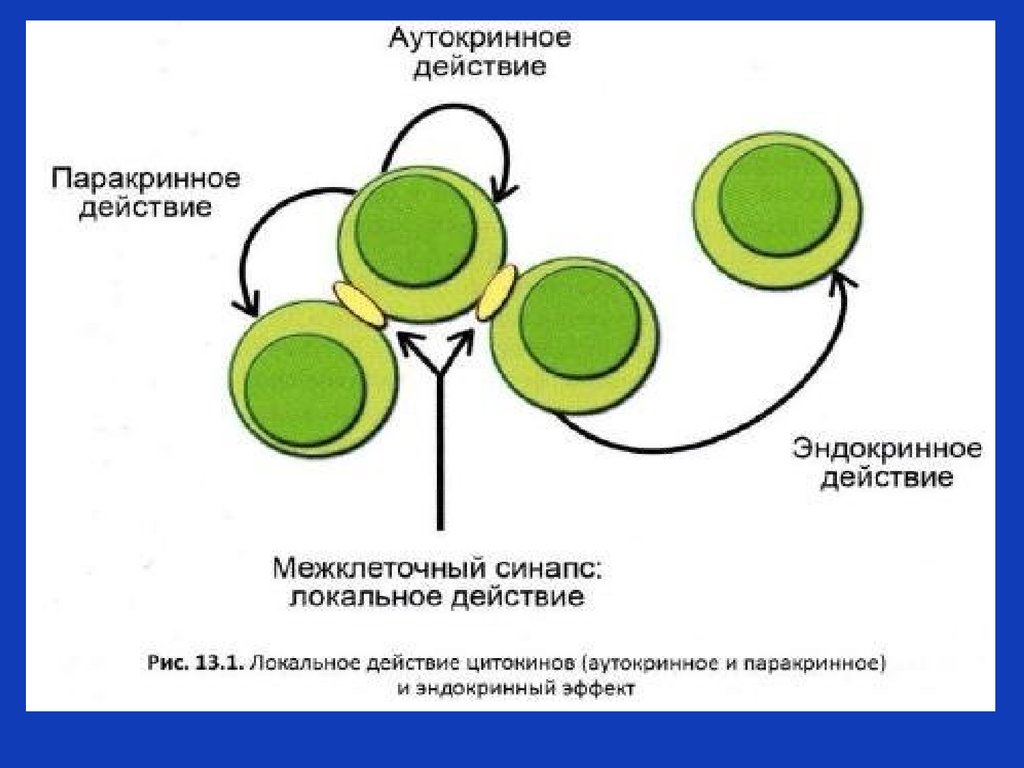
8. Типы цитокиновой регуляции
Паракринная регуляция (вбольшинстве случаев
цитокины действуют местно,
в очаге воспаления).
Аутокринная регуляция –
цитокин производится
клеткой, к нему клеткапроизводитель данного
цитокина экспрессирует
рецепторы, вследствие этого
цитокин действует на клетку,
его производящую.
Эндокринная регуляция –
отставленное действие:
интерлейкин 1 –бета –
эндогенный пироген
(действует на центр
терморегуляции в головном
мозге),
интерлейкин 6 действует на
гепатоциты, вызывая синтез
белков острой фазы,
ростовые факторы
действуют на костный мозг,
активируют гемопоэз и т.д.
9.
10. Представление о системе цитокинов в клинической практике
Для клинической практики важноотследить основную цепь
взаимодействий в
иммунопатогенезе
заболеваний :
1. Клетки- продуценты
цитокинов.
2. Цитокины и их антагонисты.
3. Клетки-мишени,
экспрессирующие рецепторы
цитокинов.
4. Производимые цитокинами
эффекты на уровне организма.
Цель: разработка и внедрение в
практику новых стратегий
терапии заболеваний:
цитокиновая терапия
(применение в клинике
препаратов цитокинов),
либо
антицитокиновая терапия
(применение в клинике
антагонистов цитокинов или
моноклональных антител к
цитокинам).
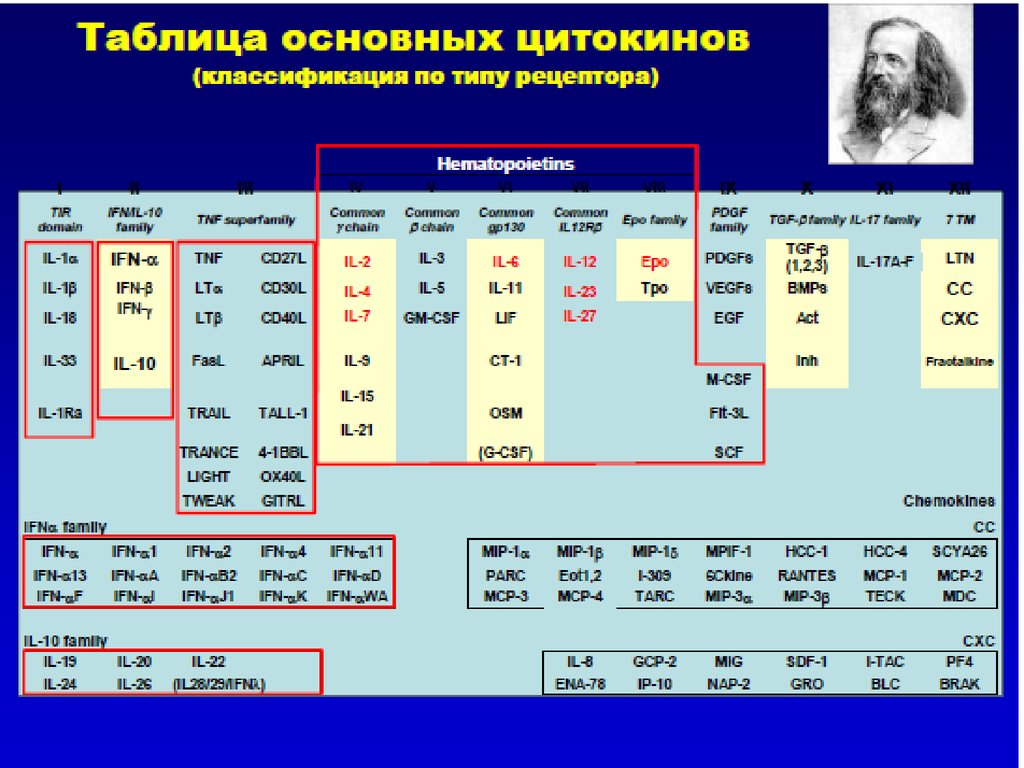
11. Основные типы цитокинов –общепринятые сокращения: интерлейкины
В более раннихклассификациях цитокинов
использовалось их деление
по принципу клеток,
синтезирующих цитокины:
лимфокины (цитокины,
секретируемые в основном
активированными Т
лимфоцитами –хелперами)
и
• монокины (цитокины,
секретируемые клетками
моноцитарномакрофагал.ьного ряда)
Такой подход не всегда оправдан,
так как для цитокинов
характерно частичное
перекрывание функций.
Вследствие этого был введен
единый термин «интерлейкины»
IL (или ИЛ):
1,2,3,4,5,6,7,8,9,10,11,12,13,14,1
5,16,17 …..35
Термин «интерлейкины» означает
«молекулы, участвующие во
взаимоотношениях, «беседах»
между лейкоцитами».
12. Основные типы цитокинов –общепринятые сокращения:
факторы некроза опухолей(ФНО или TNF)
• TNF - (кахектин)
• TNF- ( лимфотоксин)
Интерфероны (ИФН или IFN)
IFN и IFN
IFN
трансформирующие ростовые
факторы:
Трансформирующий
ростовый фактор –альфа –
TGF -
• Трансформирующий
ростовый фактор –бета –
TGF -
-хемокины:
• IL-8
• NAP -2 (neutrophil – activating
protein -2)
• PF -4 (platelet factor 4)
13. Основные типы цитокинов –общепринятые сокращения:
Колониестимулирующие
факторы:
G -CSF - granulocyte colony
stimulating factor
GM - CSF – granulocyte macrophage colony stimulating
factor
M - CSF - macrophage colony
stimulating factor
Multi - CSF - IL - 3
«Лимфокины» – секретируются в
основном активированными Т h
клетками:
MAF - macrophage activating
factor
MCF - macrophage chemotactic
factor
MMIF-macrophage migration
inhibition factor
LMIF- leukocyte migration
inhibition factor
14. Основные типы цитокинов –общепринятые сокращения:
Полипептидные ростовыефакторы клеток:
• a FGF – acidic fibroblast
growth factor
• b FGF – basic fibroblast
growth factor
• EGF – epidermal growth
factor
• NGF – nerve growth factor
• PDGF – platelet - derived
growth factor
• VEGF – vascular endothelial
growth factor
Современные отечественные книги и
журналы
15. Классификация цитокинов на основе их биологических эффектов
1. Интерлейкины (ИЛ-1 ÷ИЛ- 35) - сигнальные
молекулы,
действующие между
лейкоцитами.
2. Факторы некроза
опухоли - цитокины с
цитотоксическим и
регуляторным
действием (ФНО).
3. Интерфероны –
противовирусные
цитокины:
1 типа –ИФН α,β и др.
2 типа –ИФН γ
4. Факторы роста стволовых клеток (ИЛ-3, ИЛ
-7, ИЛ-11, эритропоэтин, тромбопоэтин,
колониестимулирующие факторы (КСФ): ГМКСФ (гранулоцитарно-макрофагальный
колониестимулирующий фактор), Г-КСФ
(гранулоцитарный КСФ), М-КСФ
(макрофагальный КСФ), регулирующие
гемопоэз.
5. Хемокины (CC, CXC (ИЛ-8), CX3C, С) ,
регулирующие хемотаксис различных клеток.
6.Факторы роста клеток (фактор роста
фибробластов, фактор роста
эндотелиальных клеток, фактор роста
эпидермиса и др.), трансформирующий
ростовый фактор - участвуют в регуляции
роста, дифференцировки разных клеток.
16. Классификация цитокинов на основе их роли в процессе регуляции воспаления
ПровоспалительныеСинтезируются
преимущественно
активированными клетками
моноцитарно/макрофагально
го ряда и повышают
активность воспалительного
процесса.
Провоспалительных цитокинов
намного больше, чем
противовоспалительных.
Противовоспалительные
В основном, Т- клеточные
цитокины, снижающие
активность воспаления –
• ИЛ-10,
• ТГФ β (трансформирующий
фактор роста бета);
• а также -рецепторный
антагонист интерлейкина-1
(РАИЛ).
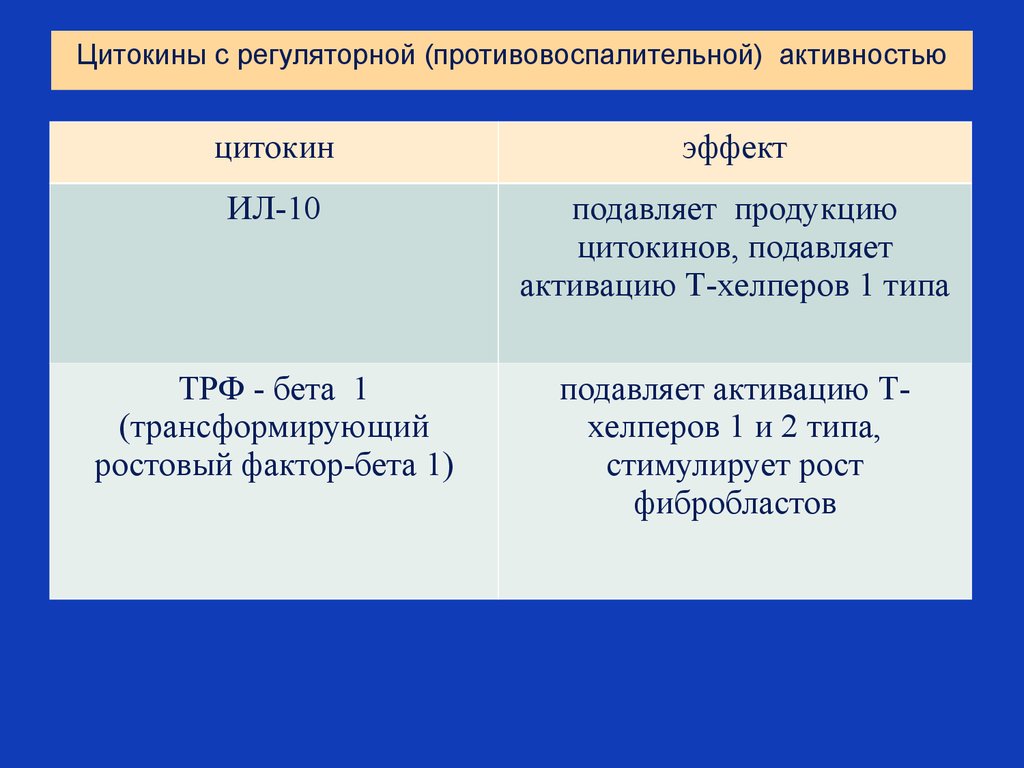
17. Цитокины с регуляторной (противовоспалительной) активностью
цитокинэффект
ИЛ-10
подавляет продукцию
цитокинов, подавляет
активацию Т-хелперов 1 типа
ТРФ - бета 1
(трансформирующий
ростовый фактор-бета 1)
подавляет активацию Тхелперов 1 и 2 типа,
стимулирует рост
фибробластов
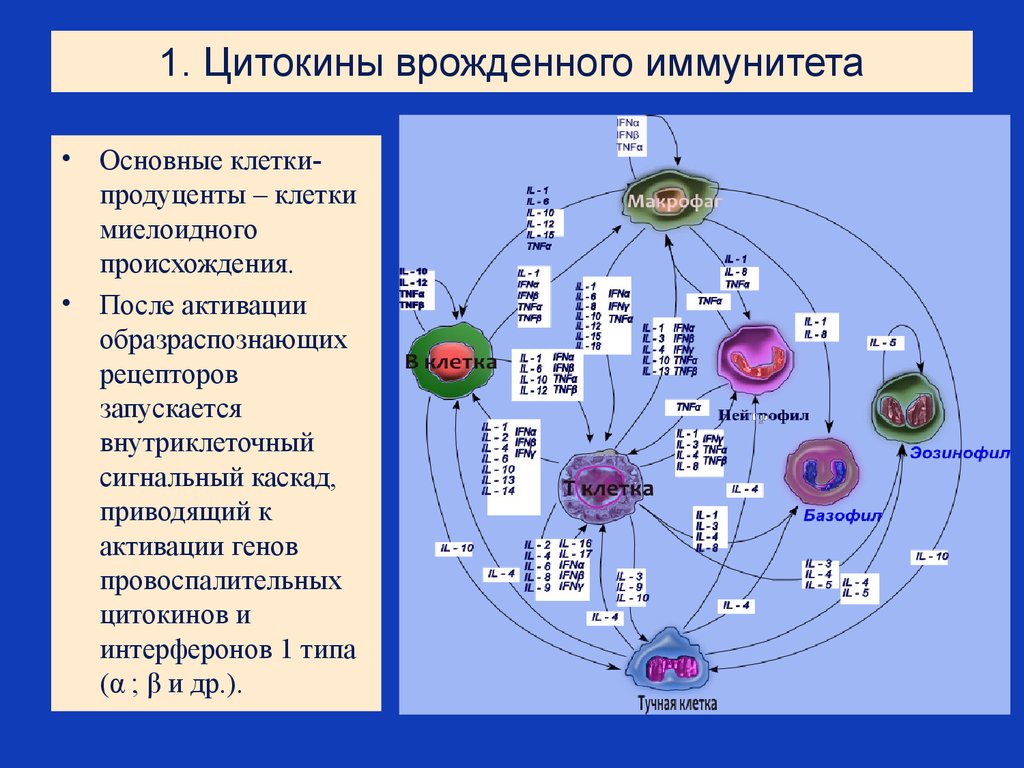
18. 1. Цитокины врожденного иммунитета
Основные клеткипродуценты – клетки
миелоидного
происхождения.
• После активации
образраспознающих
рецепторов
запускается
внутриклеточный
сигнальный каскад,
приводящий к
активации генов
провоспалительных
цитокинов и
интерферонов 1 типа
(α ; β и др.).
19. РАСПОЗНАВАНИЕ ПАТОГЕНОВ РЕЦЕПТОРАМИ ВРОЖДЕННОГО ИММУНИТЕТА
ПатогеныПатоген-ассоциированные
молекулярные структуры или паттерны
(РАМРs)
Паттерн распознающие рецепторы (PRRs):
1. Растворимые (система комплемента)
2. Мембранные (TLRs –Толл- подобные рецепторы, CD14)
3. Внутриклеточные (NOD и др.).
20.
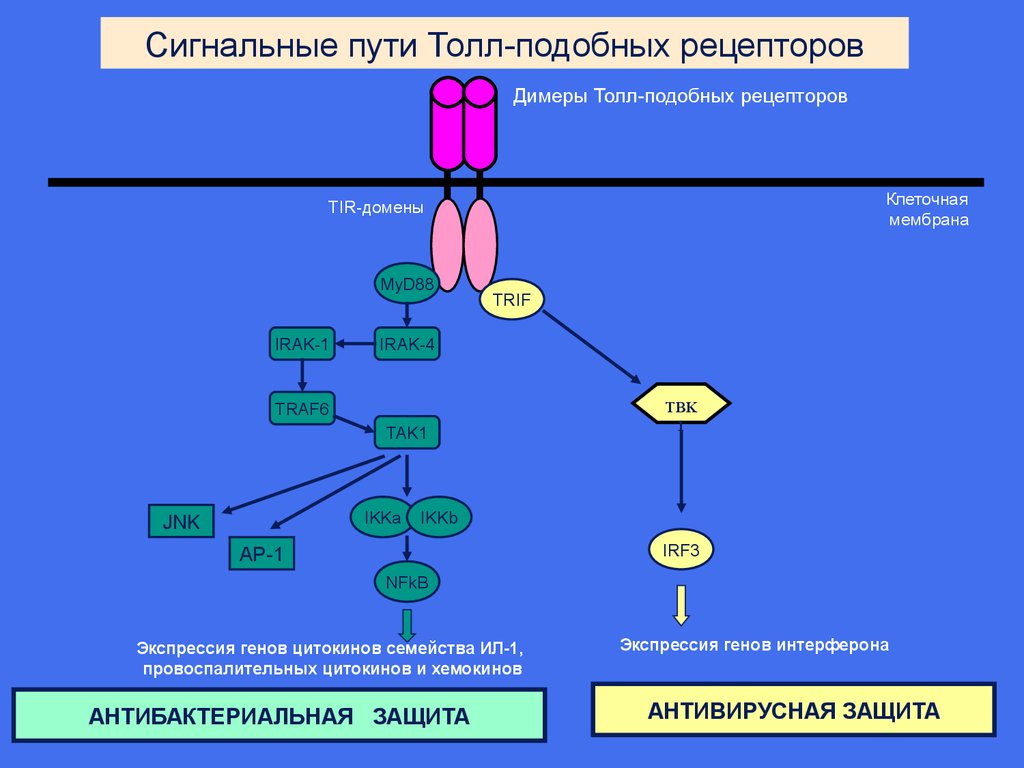
Сигнальные пути Толл-подобных рецепторовДимеры Толл-подобных рецепторов
Клеточная
мембрана
TIR-домены
MyD88
IRAK-1
TRIF
IRAK-4
TRAF6
TAK1
IKKa
JNK
TBK
1
IKKb
IRF3
AP-1
NFkB
Экспрессия генов цитокинов семейства ИЛ-1,
провоспалительных цитокинов и хемокинов
АНТИБАКТЕРИАЛЬНАЯ ЗАЩИТА
Экспрессия генов интерферона
АНТИВИРУСНАЯ ЗАЩИТА
21. Функциональная активность провоспалительных цитокинов в зависимости от их концентрации –местное и системное действие
На местном уровнеСамым ранним эффектом
провоспалительных цитокинов
является повышение адгезивных
свойств эндотелия и привлечение
активированных клеток в очаг
воспаления из периферической
крови.
Провоспалительные цитокины
управляют местным воспалением с
его типичными проявлениями
(отек, покраснение, появление
болевого синдрома).
На системном уровне
При повышении концентрации
провоспалительных
цитокинов в крови ,
они действуют практически на
все органы и системы,
участвующие в
поддержании гомеостаза
Примером зависимости эффектов провоспалительных цитокинов от их
концентрации в крови может служить фактор некроза опухолей-альфа
22.
УРОВНИ ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ В ПЛАЗМЕ КРОВИ10-7 М
ФНО
10-8 М
10-9 М
Местное воспаление
Системная
воспалительная
реакция
Септический шок
Активация фагоцитоза и
продукции кислородных
радикалов. Усиление
экспрессии молекул
адгезии на эндотелии.
Стимуляция синтеза
цитокинов и хемокинов.
Увеличение метаболизма
соединительной ткани.
Лихорадка.
Увеличение уровней
стероидных гормонов.
Лейкоцитоз.
Увеличение синтеза
остро-фазовых
белков.
Снижение сократимос-ти
миокарда и гладкомышечных клеток сосудов.
Увеличение проницаемости
эндотелия. Нарушение
микроциркуляции. Падение
артериального давления.
Гипогликемия.
23. Роль некоторых цитокинов в патогенезе воспалительных реакций: Усиление реакций врожденного иммунного ответа
цитокинэффект
ИЛ-6
Острофазовый ответ (действие на гепатоциты)
ИЛ-8
Фактор хемотаксиса нейтрофилов и других лейкоцитов
Фактор некроза
опухолей –
альфа(ФНО α)
Активирует нейтрофилы, клетки эндотелия, гепатоциты
(продукция белков острой фазы), катаболический
эффект – приводит к кахексии
Интерферональфа (ИФНα)
Активирует макрофаги, клетки эндотелия, естественные
киллеры
24. Интерлейкин-1-бета: свойства
Клетка - мишеньЭффект
Макрофаги,
фибробласты,
остеобласты,
эпителий
Пролиферация, активация
Остеокласты
Усиление процессов реабсорбции в костях
Гепатоциты
Синтез белков острой фазы воспаления
Клетки
гипоталамуса
Синтез простагландинов и последующий
подъем температуры тела
25. Интерлейкин-1-бета: свойства
Клетка-мишеньЭффект
Т-лимфоциты
Пролиферация, дифференцировка,
синтез и секреция цитокинов,
повышение уровня экспрессии
рецепторов к ИЛ-2
В-лимфоциты
Пролиферация, дифференцировка
Нейтрофилы
Высвобождение из костного мозга,
хемотаксис, активация
Эндотелий
Активация экспрессии молекул адгезии
26. Биологический смысл действия цитокинов при системном воспалении
На уровне целостногоорганизма цитокины
осуществляют связь между
иммунной, нервной,
эндокринной, кроветворной и
другими системами
регуляции гомеостаза и
служат для их вовлечения в
организацию единой
защитной реакции.
Цитокины обеспечивают
«сигнал тревоги»,
означающий, что настало
время включить все резервы,
переключить энергетические
потоки и перестроить работу
всех систем для выполнения
одной, но важнейшей для
выживания задачи – борьбы
с внедрившимся патогеном.
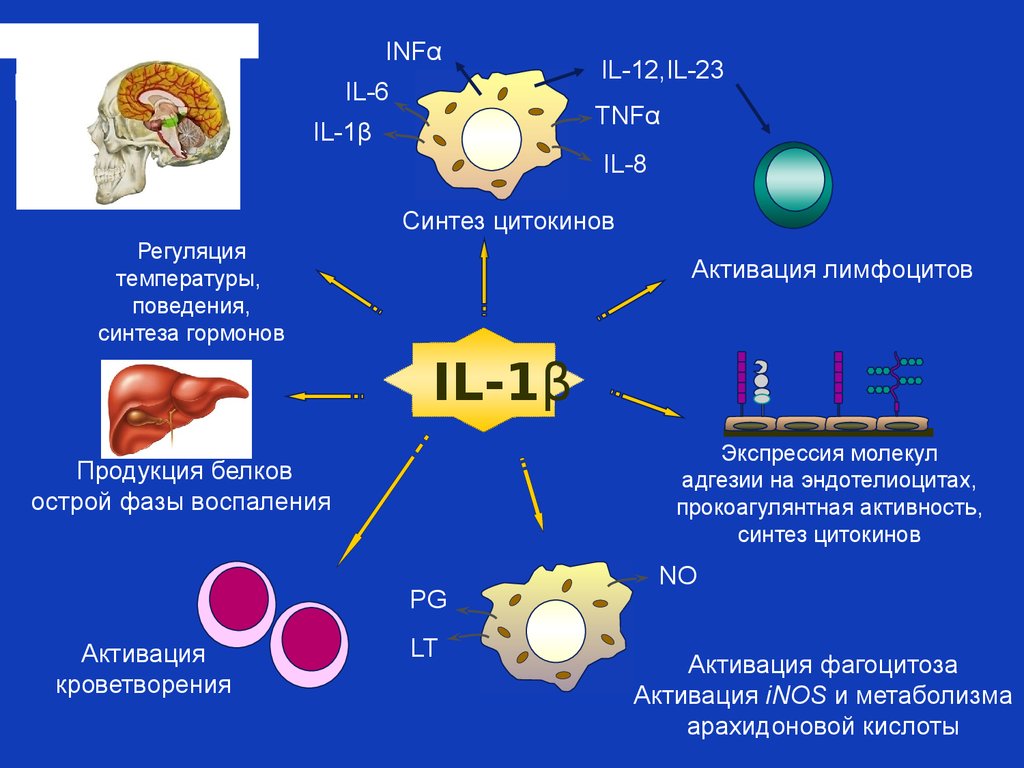
Примером множественности эффектов провоспалительных цитокинов
в запуске системного воспаления может служить интерлейкин 1 бета
27.
INFαIL-6
IL-12,IL-23
TNFα
IL-1β
IL-8
Синтез цитокинов
Регуляция
температуры,
поведения,
синтеза гормонов
Активация лимфоцитов
IL-1β
Экспрессия молекул
адгезии на эндотелиоцитах,
прокоагулянтная активность,
синтез цитокинов
Продукция белков
острой фазы воспаления
PG
Активация
кроветворения
LT
NO
Активация фагоцитоза
Активация iNOS и метаболизма
арахидоновой кислоты
28. IL-1 и TNF-
IL-1 и TNF-Интерлейкин -1 – бета(IL-1 )
и фактор некроза
опухолей –альфа (TNF- )
играют основную роль в
воспалительных ответах,
так как введение
рецепторного антагониста
интерлейкина 1(IL -1 ra) , а
также моноклональных
антител или растворимых
рецепторов TNF-
блокирует острые и
хронические
воспалительные ответы в
экспериментах на
животных.
.
Некоторые их таких
антагонистов и
моноклональных
антител уже
используются в
клинике – например,
при лечении сепсиса,
ревматоидного
артрита, системной
красной волчанки и
других заболеваний
человека.
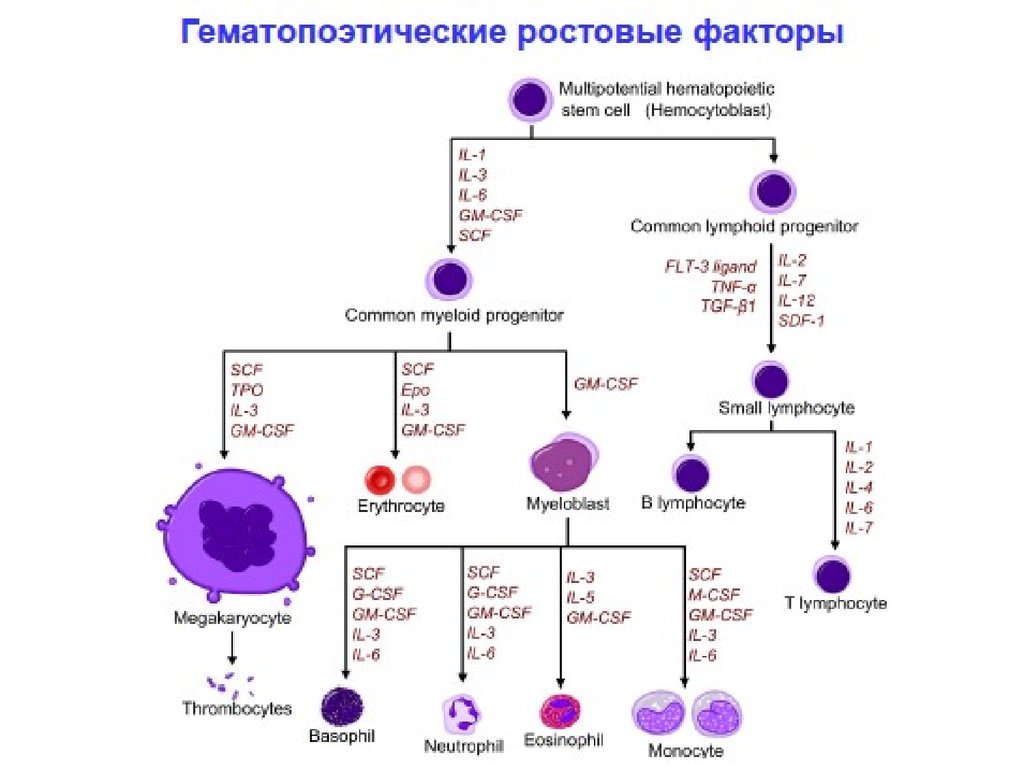
29. Ростовые факторы
цитокинГМ-КСФ
(гранулоцитарно-макрофагальный
колониестимулирующий фактор)
М-КСФ
(Макрофаг- колониестимулирующий
фактор)
Г-КСФ
(Гранулоцит- колониестимулирующий
фактор)
эффект
стимулируют рост и
дифференцировку
клетокпредшественников
моноцитов и
полиморфноядерных лейкоцитов
30.
31.
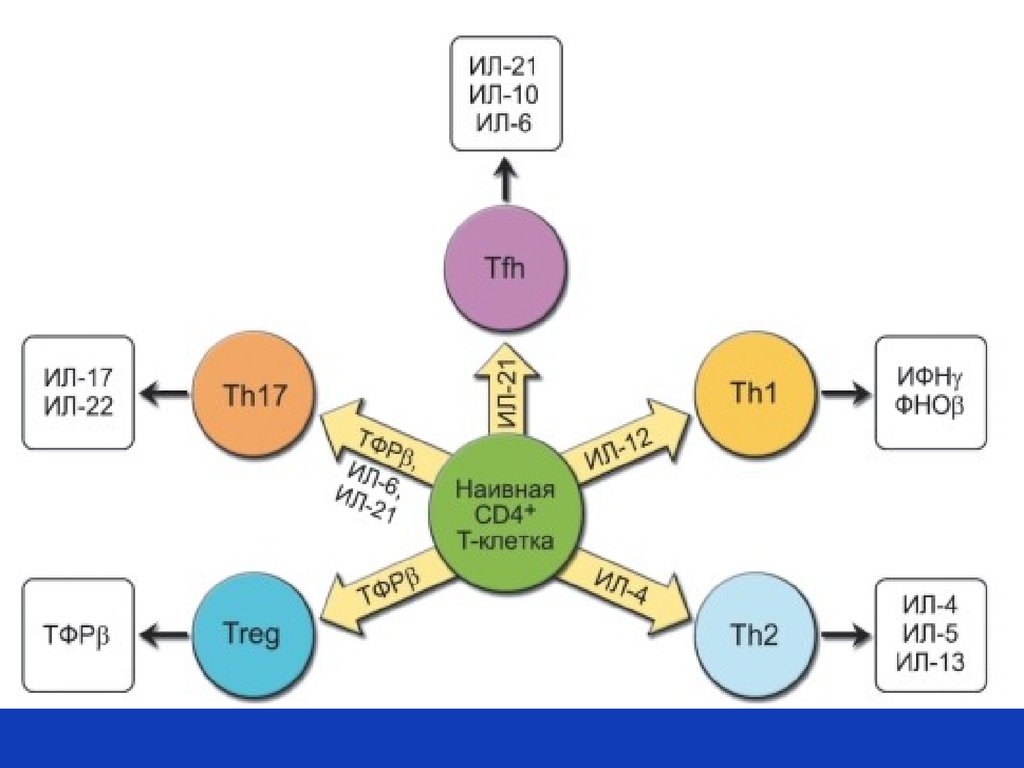
РЕГУЛЯЦИЯ ПРИОБРЕТЕННОГО ИММУНИТЕТАЦитокины – ростовые и дифференцировочные
факторы всех типов Т- и В-лимфоцитов
Главные функции: регуляция дифференцировки Т-хелперных клонов определение типов тканевого воспаления, Т-клеток эффекторов и классов антител
Тh1 – клеточный тип с участием макрофагов
и Т-лимфоцитов (гранулема
при туберкулезе; при саркоидозе, контактном дерматите, болезни Крона)
Тh2 – аллергический тип ответа с участием гистамина и простагландинов
Т h 17 – нейтрофильное воспаление
Tfn (фолликулярные Т хелперы)- гуморальный иммунный ответ
T reg –T h регуляторный (ограничение силы всех типов иммунного ответа и
воспаления)
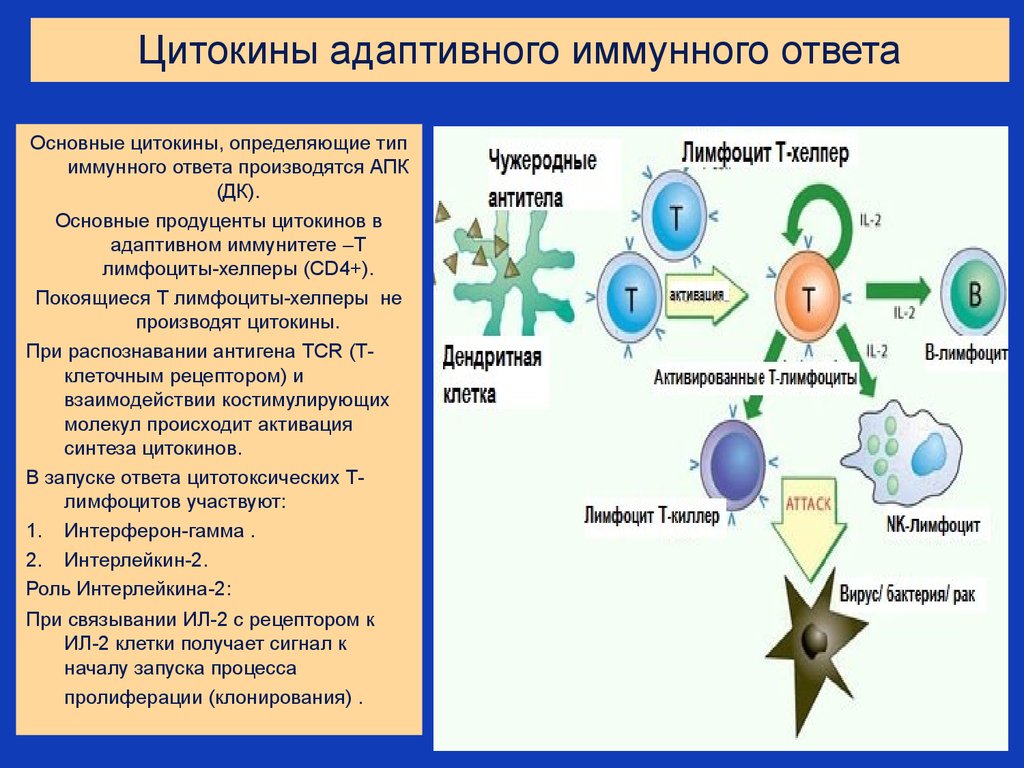
32. Цитокины адаптивного иммунного ответа
Основные цитокины, определяющие типиммунного ответа производятся АПК
(ДК).
Основные продуценты цитокинов в
адаптивном иммунитете –Т
лимфоциты-хелперы (CD4+).
Покоящиеся Т лимфоциты-хелперы не
производят цитокины.
При распознавании антигена TCR (Тклеточным рецептором) и
взаимодействии костимулирующих
молекул происходит активация
синтеза цитокинов.
В запуске ответа цитотоксических Тлимфоцитов участвуют:
1. Интерферон-гамма .
2. Интерлейкин-2.
Роль Интерлейкина-2:
При связывании ИЛ-2 с рецептором к
ИЛ-2 клетки получает сигнал к
началу запуска процесса
пролиферации (клонирования) .
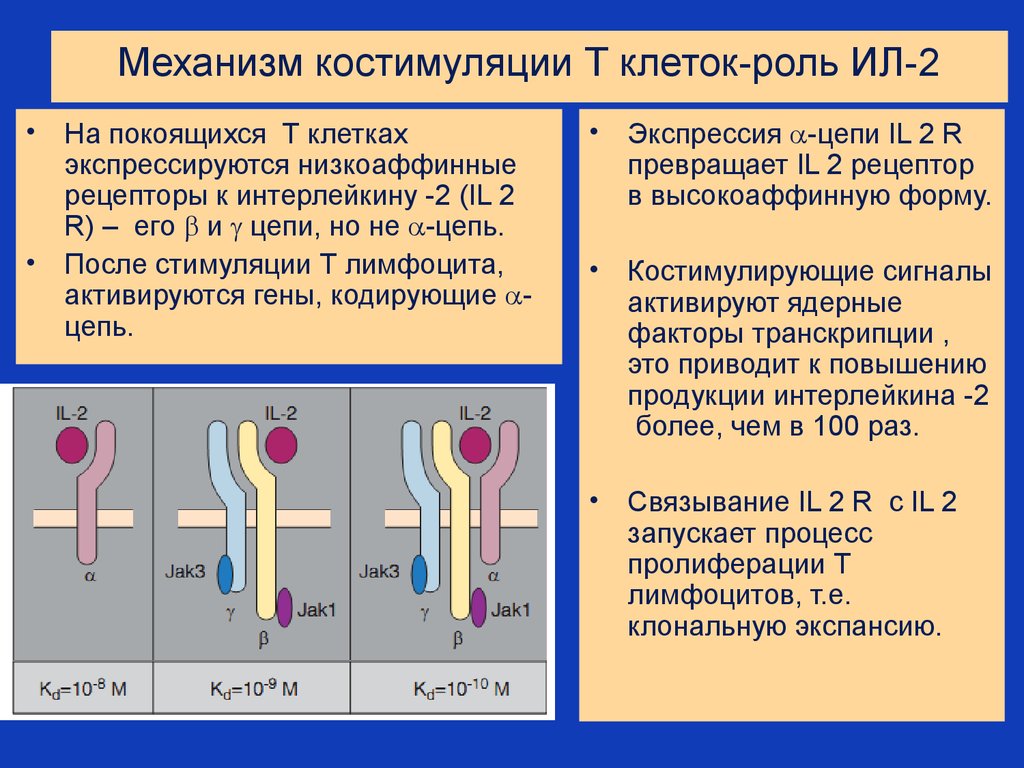
33. Механизм костимуляции Т клеток-роль ИЛ-2
На покоящихся Т клетках
экспрессируются низкоаффинные
рецепторы к интерлейкину -2 (IL 2
R) – его и цепи, но не -цепь.
• После стимуляции Т лимфоцита,
активируются гены, кодирующие цепь.
Экспрессия -цепи IL 2 R
превращает IL 2 рецептор
в высокоаффинную форму.
Костимулирующие сигналы
активируют ядерные
факторы транскрипции ,
это приводит к повышению
продукции интерлейкина -2
более, чем в 100 раз.
Связывание IL 2 R с IL 2
запускает процесс
пролиферации Т
лимфоцитов, т.е.
клональную экспансию.
34.
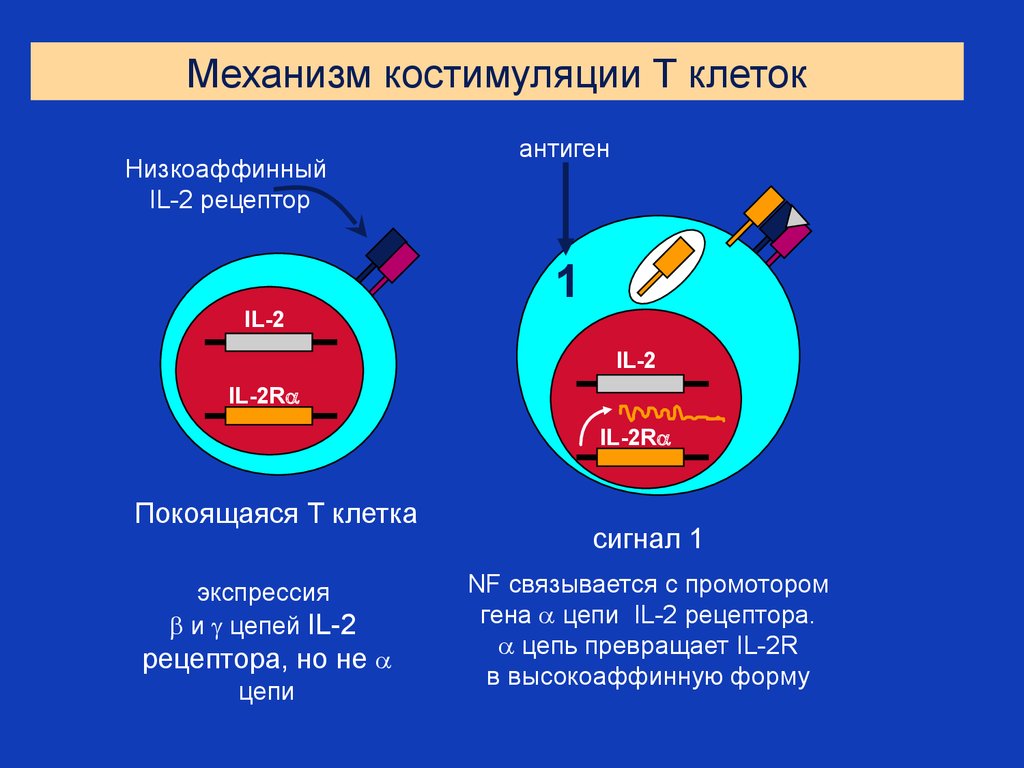
Механизм костимуляции Т клетокНизкоаффинный
IL-2 рецептор
IL-2
антиген
1
IL-2
IL-2R
IL-2R
Покоящаяся Т клетка
экспрессия
и цепей IL-2
рецептора, но не
цепи
сигнал 1
NF связывается с промотором
гена цепи IL-2 рецептора.
цепь превращает IL-2R
в высокоаффинную форму
35. Роль цитокинов в усилении реакций адаптивного иммунного ответа: активация, пролиферация и дифференцировка лимфоцитов
цитокинэффект
ИЛ-2
Пролиферация и созревание Т-клеток, повышение
уровня экспрессии рецептора к ИЛ-2
ИЛ-4
Повышение уровня экспрессии молекул МНС II
класса, Fc-рецепторов и рецепторов к ИЛ-2 на
поверхности Т- и В-лимфоцитов.
Способствует переключению классов Ig на IgEизотип.
ИЛ-6
Созревание и дифференцировка Т- и Влимфоцитов
36. «Старая» парадигма поляризации иммунного ответа: путь Th1(клеточный ответ) или путь Th2(гуморальный ответ).
После созревания в тимусенаивные CD 4+Т
лимфоциты –хелперы
(Th 0)
дифференцируются на
периферии
в эффекторные клетки - Th1
или Th2:
Th1запускают
клеточный ответ,
Th2 –гуморальный.
ответ.
«Уникальная особенность иммунологии состоит в том, что ее
«сердцевина» не вполне стабилизировалась и меняется во
времени в большей степени, чем основы других наук.
Достаточно сказать, что на протяжении полувека парадигма
иммунологии менялась по меньшей мере два раза —
сначала при рождении «неинфекционной» (по
преимуществу клеточной) иммунологии в 50–60-е годы ХХ
века и затем — совсем недавно, при формировании новых
представлений об иерархии и взаимодействии врожденного
и адаптивного иммунитета.
Читатели с большим стажем знакомства с руководствами и
учебниками по иммунологии, написанными в разное время,
согласятся, что книги по иммунологии,
опубликованные в 30-х, 60-х и 2000-х годах, порой
как будто излагают основы разных наук»
А.А.Ярилин,2010 год.
37. Современная концепция: роль дендритных клеток в запуске определенного типа иммунного ответа
Предшественники дендритных клетокмигрируют из костного мозга
через кровоток практически во все
ткани организма, где они
существуют в виде незрелых ДК.
В этом состоянии они постоянно
"берут на пробу" свое
микроокружение путем
эндоцитоза, макропиноцитоза и
иногда - фагоцитоза.
Они способны протягивать свои
отростки через плотные контакты
между эпителиальными клетками
и захватывать антиген еще до
того, как он проникнет через
эпителий.
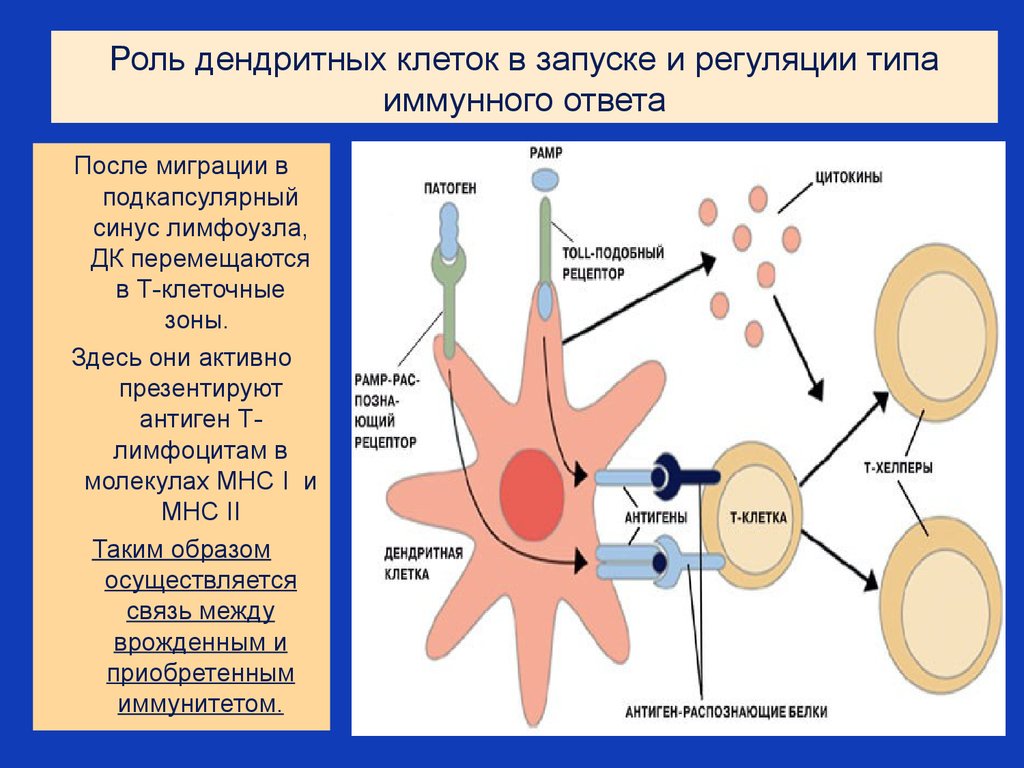
38. Роль дендритных клеток в запуске и регуляции типа иммунного ответа
После миграции вподкапсулярный
синус лимфоузла,
ДК перемещаются
в Т-клеточные
зоны.
Здесь они активно
презентируют
антиген Тлимфоцитам в
молекулах MHC I и
MHC II
Таким образом
осуществляется
связь между
врожденным и
приобретенным
иммунитетом.
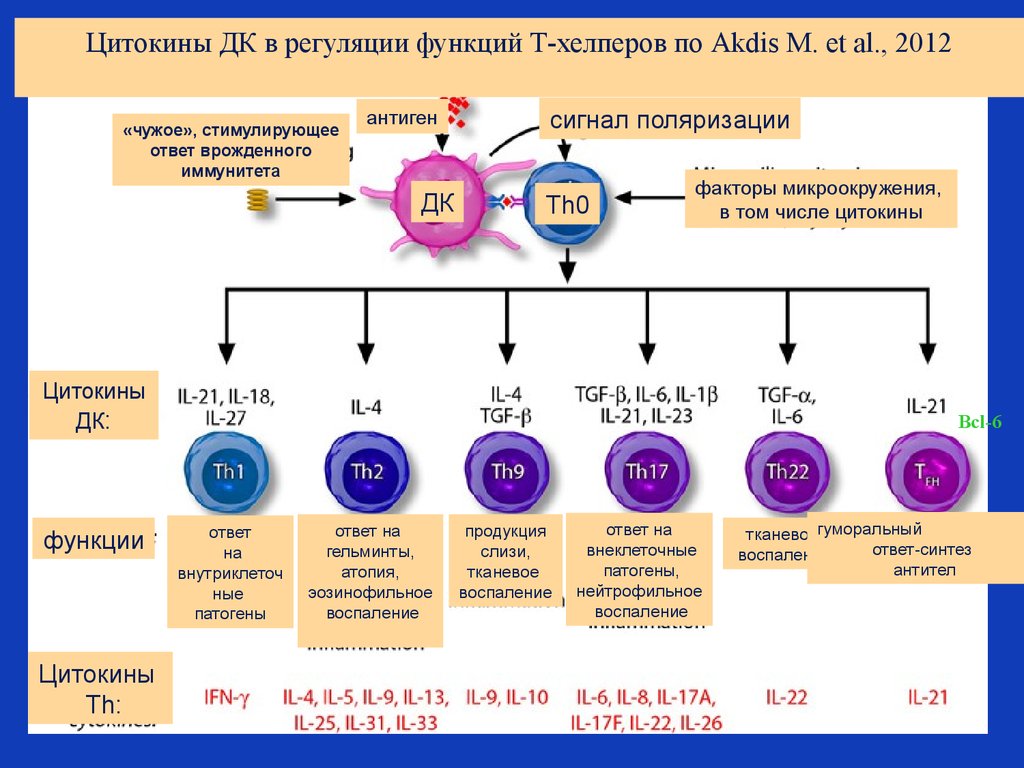
39. Субпопуляции Т хелперов, дифференцирующиеся из Th0 –наивного Т хелпера под действием цитокинов дендритных клеток (ДК)
РОЛЬ синтезируемых ДК цитокиновв формировании оптимального
типа адаптивного иммунного
ответа:
Разные типы цитокинов,
синтезируемые ДК, направляют
дифференцировку Т наивного
хелпера по пути либо Th1, либо
Th2, либоTh17, либоTh9, либо
Th22 – в зависимости от
необходимости развития
наиболее оптимального для
данного патогена типа иммунного
ответа с целью его скорейшей
элиминации из организма.
После дифференцировки Т
наивного хелпера в один из
перечисленных типов хелперов,
строго регламентируется тип
синтезируемых этими типами
хелперов цитокинов.
По профилю продуцируемых
цитокинов выделяют следующие
субпопуляции
CD 4+ лимфоцитов:
Th1, Th2, Th 17, Th fn, Th 9, Th 22, а
также индуцибельные
регуляторные Т-клетки (iTreg).
Биологический смысл столь сложной регуляции типов адаптивного иммунного ответа:
уникальный набор цитокинов каждого типа Т хелперов действует на разные клетки-мишени,
которые обеспечивают элиминацию патогенов с разными типами паразитирования.
40.
Цитокины ДК в регуляции функций Т-хелперов по Akdis M. et al., 2012«чужое», стимулирующее
ответ врожденного
иммунитета
антиген
ДК
сигнал поляризации
Th0
факторы микроокружения,
в том числе цитокины
Цитокины
ДК:
функции
Цитокины
Th:
Bcl-6
ответ
на
внутриклеточ
ные
патогены
ответ на
гельминты,
атопия,
эозинофильное
воспаление
продукция
слизи,
тканевое
воспаление
ответ на
внеклеточные
патогены,
нейтрофильное
воспаление
тканевоегуморальный
ответ-синтез
воспаление
антител
41.
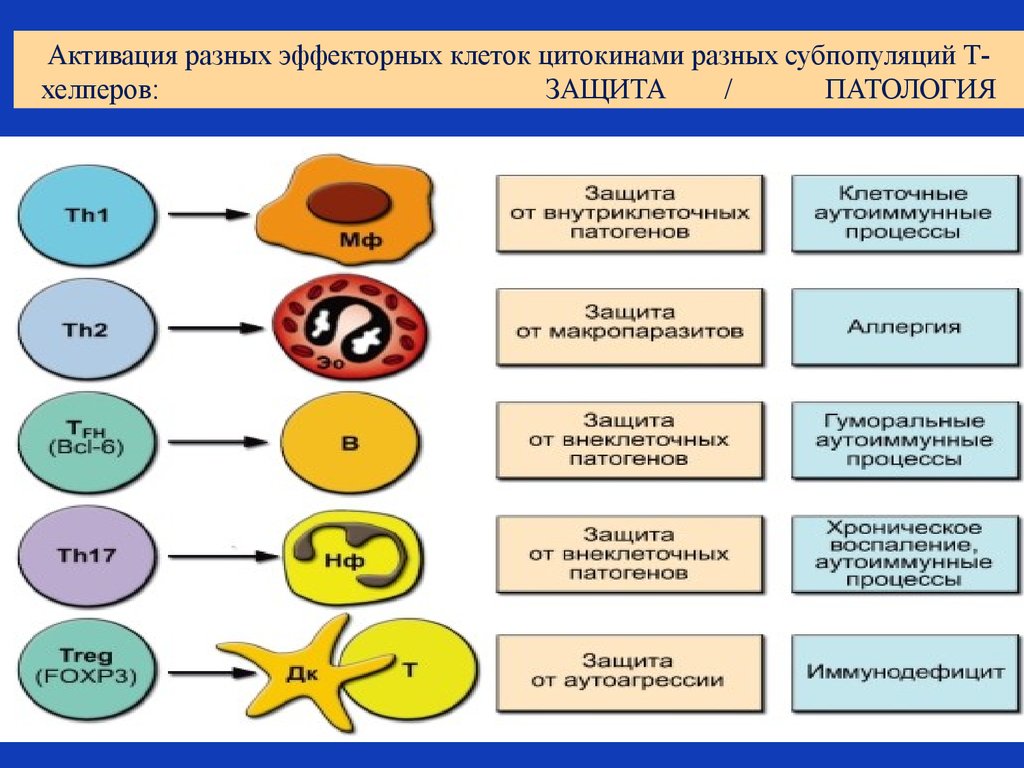
42. Активация разных эффекторных клеток цитокинами разных субпопуляций Т-хелперов: ЗАЩИТА / ПАТОЛОГИЯ
Активация разных эффекторных клеток цитокинами разных субпопуляций Тхелперов:ЗАЩИТА
/
ПАТОЛОГИЯ
43. Субпопуляции Т-хелперов
Th17Если в микроокружении наивного Т
хелпера присутствуют ИЛ-1β и
ИЛ-23, то образуются Т –
лимфоциты-хелперы,
синтезирующие ИЛ-17.
Th17 участвуют в развитии
нейтрофильного воспаления на
внеклеточные патогены, в том
числе, в противогрибковом
ответе, а также в развитии
аутоиммунных процессов.
Th fn (T-follicular helper)
CD 4+ fn выполняют хелперную
функцию в отношении В
лимфоцитов.
Локализуются в В-клеточных
фолликулах.
Вырабатывают хелперный цитокин
ИЛ-21, стимулирующий через
рецептор к ИЛ-21 на Влимфоцитах, их активацию и
дифференцировку в
плазматические клетки,
синтезирующие антитела.
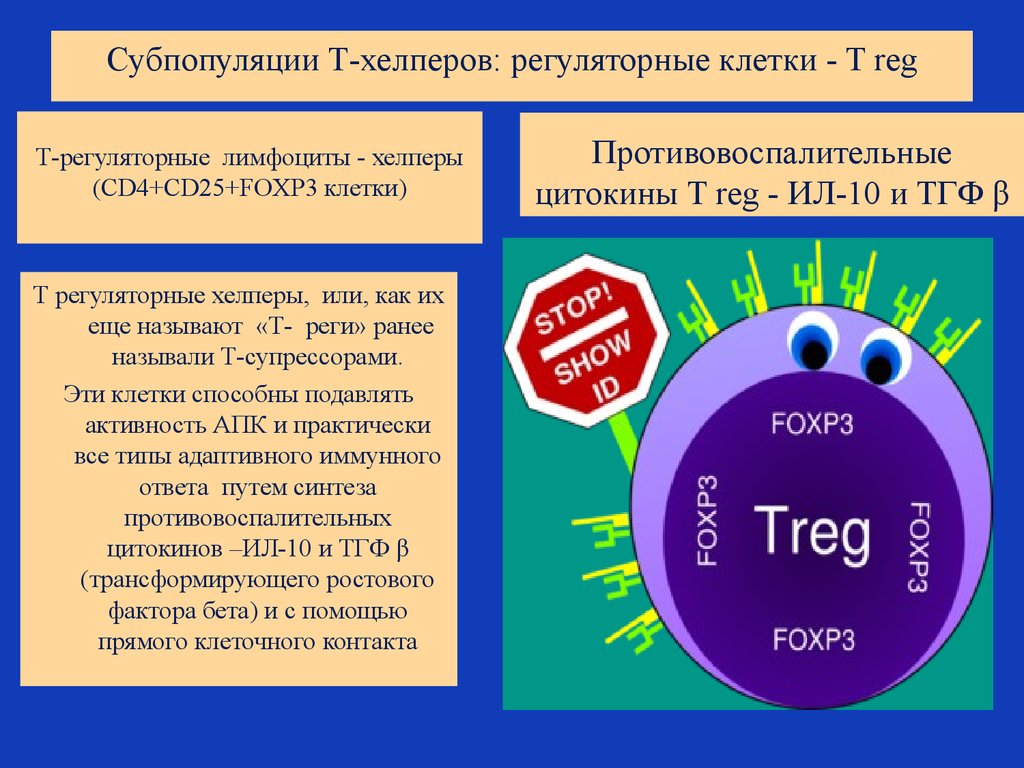
44. Субпопуляции Т-хелперов: регуляторные клетки - T reg
Т-регуляторные лимфоциты - хелперы(CD4+CD25+FOXP3 клетки)
Т регуляторные хелперы, или, как их
еще называют «Т- реги» ранее
называли Т-супрессорами.
Эти клетки способны подавлять
активность АПК и практически
все типы адаптивного иммунного
ответа путем синтеза
противовоспалительных
цитокинов –ИЛ-10 и ТГФ β
(трансформирующего ростового
фактора бета) и с помощью
прямого клеточного контакта
Противовоспалительные
цитокины T reg - ИЛ-10 и ТГФ β
45. Механизмы действия цитокинов
На первом этапе:Цитокины взаимодействуют с
высокоаффинными
рецепторами,
расположенными на
мембране клеток-мишеней
(аффинность –сила связи
вещества с его рецептором).
Цитокиновые рецепторы –
трансмембранные
гликопротеины, включающие
несколько цепей.
На последующих этапах:
Цитокины регулируют
транскрипцию генов в клеткахмишенях с помощью
вторичных сигналов.
Действие вторичных сигналов
изменяет транскрипцию генов
в клетках –мишенях
(активирует или ингибирует),
что приводит к изменению
«поведения» клетки-мишени
в целом.
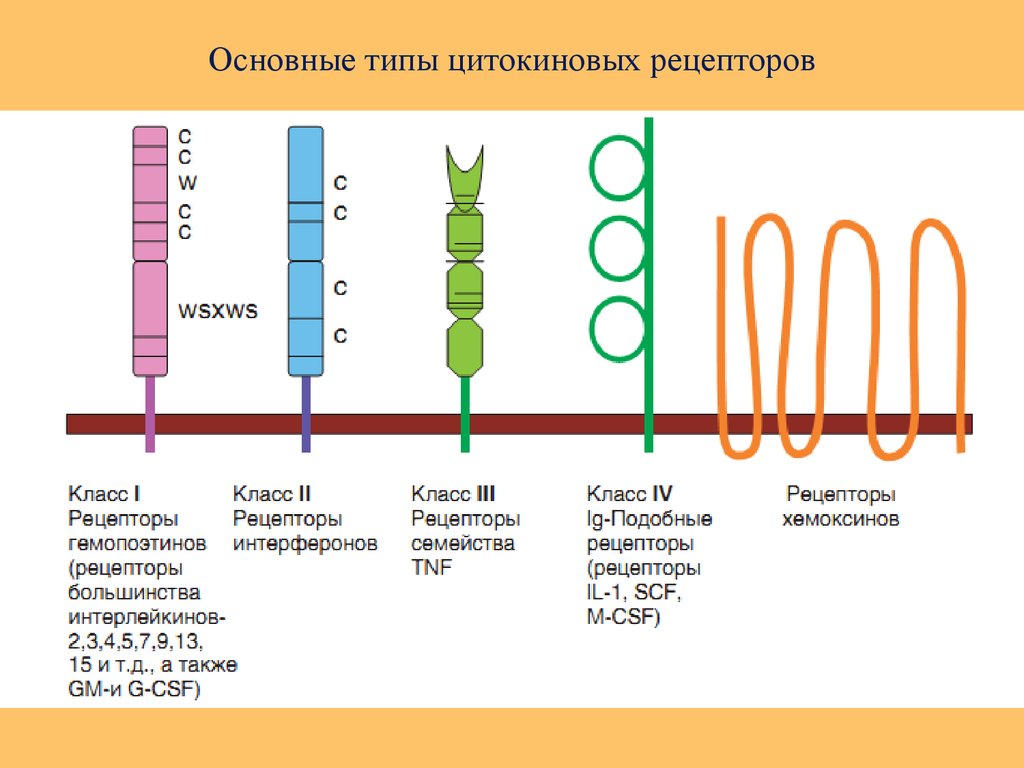
46. Классификация цитокинов по типу рецепторов. Цитокиновые рецепторы по их структуре подразделяют как минимум на 5 семейств:
1. Рецепторы цитокиновсемейства гематопоэтинов
интерлейкинов (ИЛ2,3,4,5,7,11,15 и др.).
2. Рецепторы, относящиеся к
суперсемейству
иммуноглобулиновых
молекул
(рецепторы ИЛ-1, М-КСФ,
рецептор фактора роста
стволовых клеток).
3. Рецепторы семейства
фактора некроза опухолей
(наличие домена смерти).
4. Рецепторы семейства
интерферонов и ИЛ-10.
5. Рецепторы хемокинов.
47. Основные типы цитокиновых рецепторов
48.
49.
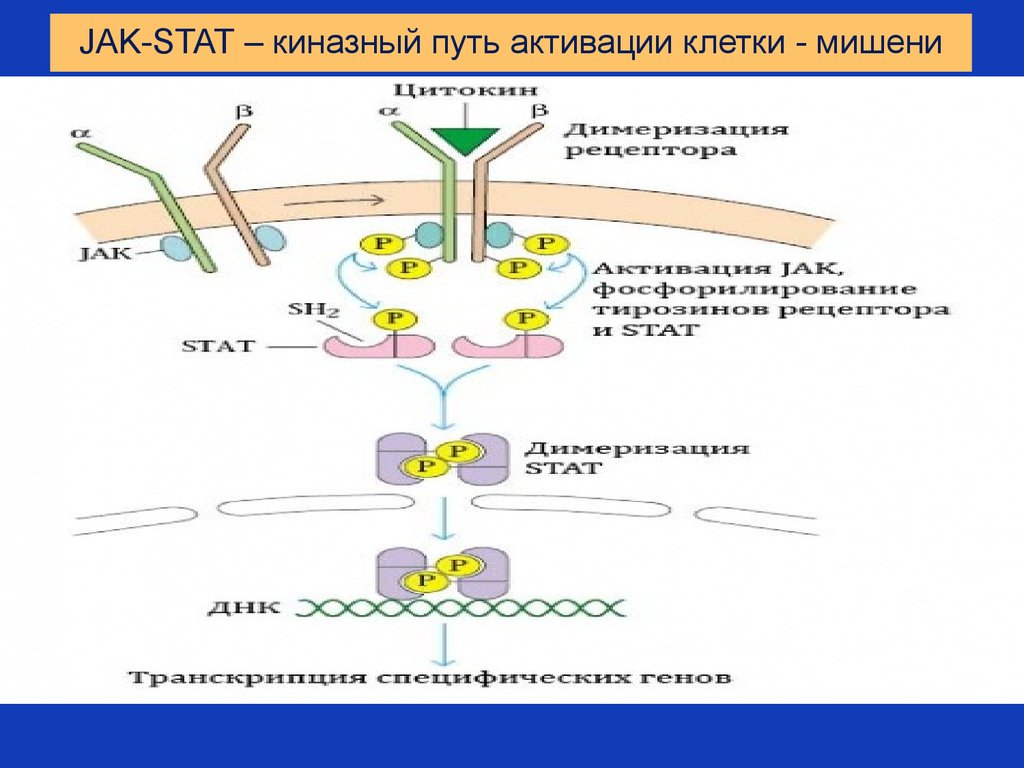
50. JAK-STAT – киназный путь активации клетки - мишени
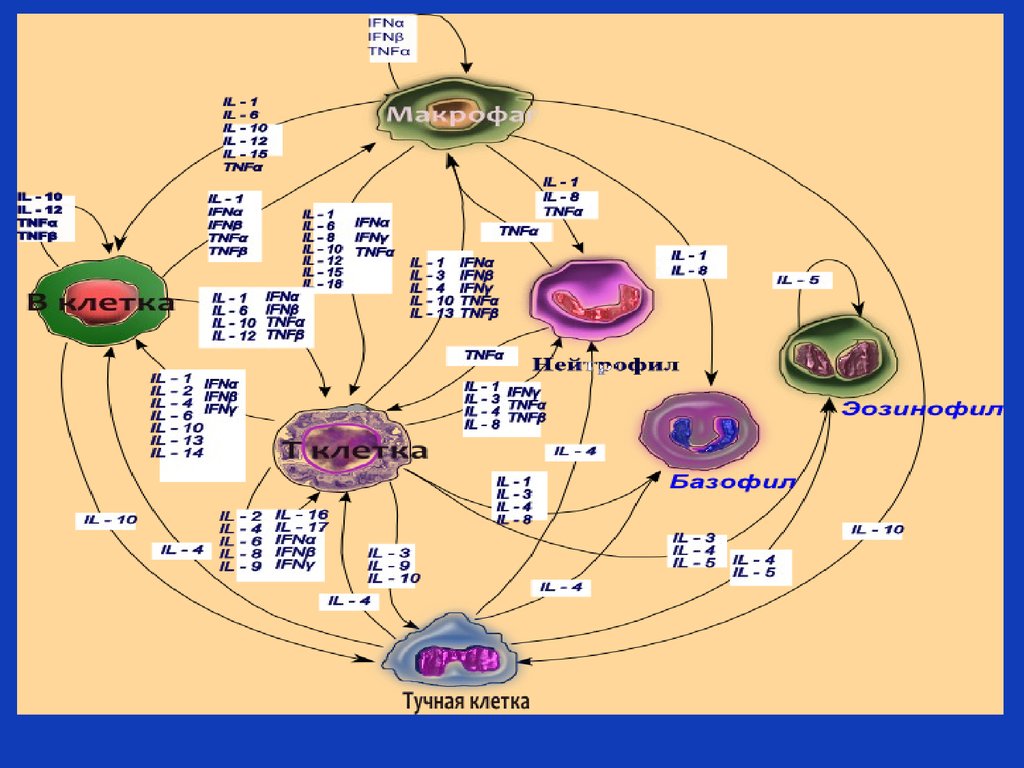
51. Цитокиновая сеть
Межклеточная сигнальная сеть, в которой сигналы ототдельных цитокинов обычно трансформируются (не
обязательно все свойства цитокинов, проявляющиеся
в условиях in vitro, будут проявляться in vivo в
условиях цитокиновой сети).
• В сети реальные функции того или иного цитокина
зависят от типа суммарных регуляторных
воздействий на клетку-мишень , а не от отдельных
свойств данного цитокина.
• Цитокиновая сеть - сеть коммуникационных сигналов
между клетками иммунной системы и другими
органами.
52.
53. Хемокины
Хемокины – это цитокины,
обладающие малой
молекулярной массой (8-10
кДа) и влияющие на
хемотаксис лейкоцитов.
Малая молекулярная масса
обеспечивает им высокую
диффузионную способность
и формирует градиент
концентрации,
уменьшающийся о мере
отдаления от места их
синтеза – феномен,
лежащий в основе
хемоаатракции.
Характеристика структуры
хемокинов и их семейств:
м.м. = 5-20 kDa
катионные белки
связывают гепарин и
гликозаминогликаны
имеют между собой 20-70%
гомологии
содержат преимущественно
четыре консервативных
цистеина, связанных между
собой дисульфидными связями:
первый с третьим, второй с
четвертым (называют их
семейства –по расположению
цистеина- СС, СХС и др.)
54. БИОЛОГИЧЕСКИЕ ФУНКЦИИ ХЕМОКИНОВ
ХЕМОТАКСИС
ЛЕЙКОЦИТОВ
ДЕГРАНУЛЯЦИЯ
ЛЕЙКОЦИТОВ
АКТИВАЦИЯ
РЕСПИРАТОРНОГО
ВЗРЫВА
АКТИВАЦИЯ
ИНТЕГРИНОВ
Общая биологическая
активность:
хемоаттрактанты.
• Хемокины привлекают:
– СХС хемокины –
нейтрофилы и Тлимфоциты
– СС хемокины –
моноциты,
базофилы и
эозинофилы
55. Хемокины
хемокинэффект
ИЛ-8
Фактор хемотаксиса
нейтрофилов
RANTES
Фактор активации моноцитов,
лимфоцитов
Эотаксин
Фактор активации
эозинофилов
56. Основные направления современной цитокиновой терапии
Цитокиновая терапияИспользование препаратов цитокинов с
целью повышения их концентрации
в организме:
Заместительная терапия – восполнение
недостатка эндогенных цитокинов, в
т.ч. генотерапия первичных
иммунодефицитов.
Иммуностимулирующее действие – при
вторичных иммунодефицитных
состояниях, вызванных
инфекциями.
Иммуномодулирующее действие коррекция дисбаланса эндогенных
цитокинов.
Антицитокиновая терапия
Использование рецепторов
цитокинов;
моноклональных антител,
блокирующих
нежелательное действие
цитокинов.
Удаление или блокирование
действия эндогенных
цитокинов.
57. РАЗРЕШЕННЫЕ К ПРИМЕНЕНИЮ И РАЗРАБАТЫВАЕМЫЕ ПРЕПАРАТЫ НА ОСНОВЕ РЕКОМБИНАНТНЫХ ЦИТОКИНОВ ЧЕЛОВЕКА
Эритропоэтин
Гранулоцитарный колониестимулирующий фактор (Г-КСФ)
Гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ)
Интерферон альфа, лямбда, в т.ч. ПЕГилированные (ИФН 1 и 3 типа)
Интерферон гамма
Интерлейкин-1 бета
Интерлейкин-2
Интерлейкин-7
Интерлейкин-10
Интерлейкин-15
Интерлейкин-17
Интерлейкин-21
Эпидермальный ростовой фактор
Bone morphogenetic proteins (BMP-2, BMP-7)
58. ОБЛАСТИ ПРИМЕНЕНИЯ РЕКОМБИНАНТНОГО ЭРИТРОПОЭТИНА(ЭПО)
• НЕФРОЛОГИЯ- дефицит ЭПО у больных ХПН
• ОНКОЛОГИЯ
- анемия у больных, получающих радио- и химиотерапию
• ИНФЕКЦИОННЫЕ БОЛЕЗНИ
- анемия вызванная применением ВААРТ у ВИЧ-пациентов
• РЕВМАТОЛОГИЯ
- анемия у больных ревматоидным артритом
• ХИРУРГИЯ
- применение ЭПО для уменьшения объема переливаемой крови
• АКУШЕРСТВО
- лечение анемии беременных
• ПЕДИАТРИЯ
- лечение анемии недоношенных новорожденных, нейропротекторное
действие
59. ЛЕЧЕБНОЕ ПРИМЕНЕНИЕ ЦИТОКИНОВ СТИМУЛЯЦИЯ КРОВЕТВОРЕНИЯ
• Эритропоэз – эритропоэтин.• Лейкопоэз – Г-КСФ, ГМ-КСФ, ИЛ-1 бета.
• Тромбопоэз – тромбопоэтин, ИЛ-11 - ?
• Лимфопоэз – ИЛ-7.
60. Клиническое применение препаратов рекомбинантных интерферонов человека
ИнтерфероныКлиническое использование
ИФН альфа
Вирусные инфекции, опухоли
ИФН бета
Рассеянный склероз
ИФН лямбда
Хр. вирусный гепатит С
ИФН гамма
Хр. грануломатоз
61. Вирусы, вызывающие ОРВИ, при которых показана клиническая эффективность применения интраназального ИФН альфа
Риновирус ( в т.ч. тип 13, тип 39)
Вирус гриппа А (H1N1 и H3N2)
Вирус гриппа В
Вирус парагриппа
Респираторный синцитиальный вирус
Аденовирус
Коронавирус
Лекарственные формы:
- Капли в нос
- Спрей
- Аэрозоль
62. Терапевтические схемы противовирусной терапии ХВГС (хронический вирусный гепатит С)
1. Монотерапия альфа-интерфероном толькобольным ОГС.
2. Комбинированная терапия ПЭГ-интерфероном
в сочетании с рибавирином - 48 недель.
3. Комбинированная терапия ПЭГ-интерфероном
в сочетании с рибавирином и ингибиторами
вирусных протеаз - 24-48 недель.
63.
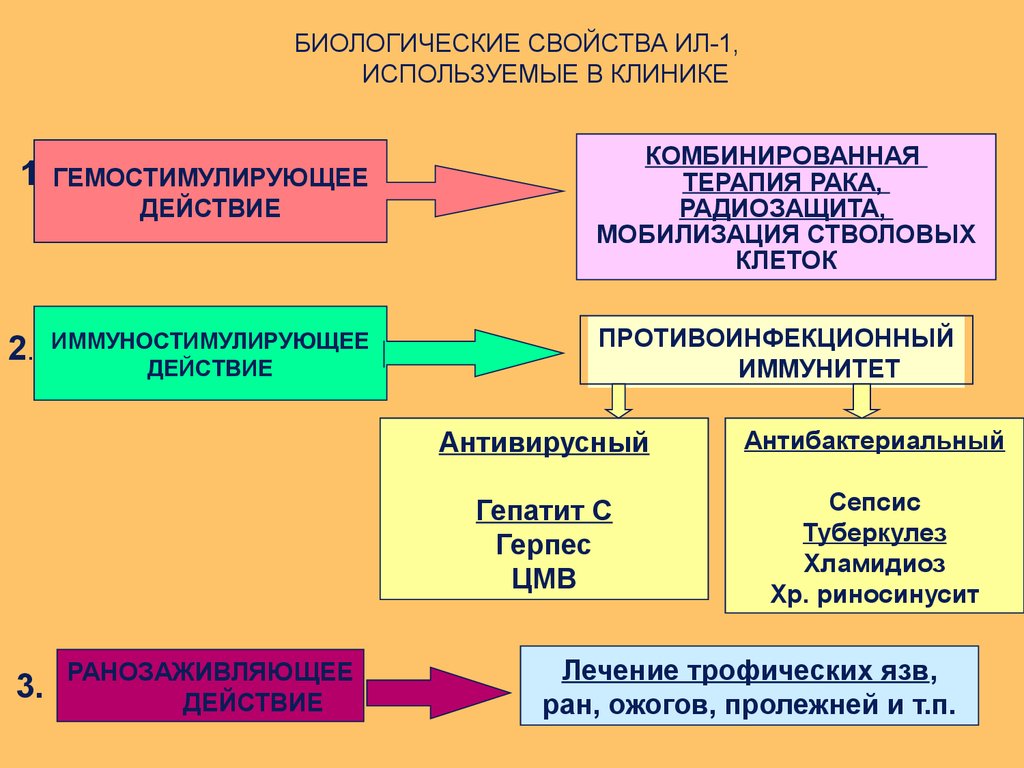
БИОЛОГИЧЕСКИЕ СВОЙСТВА ИЛ-1,ИСПОЛЬЗУЕМЫЕ В КЛИНИКЕ
1. ГЕМОСТИМУЛИРУЮЩЕЕ
ГЕМОСТИМУЛИРУЮЩЕЕ
ДЕЙСТВИЕ
ДЕЙСТВИЕ
2.
3.
ИММУНОСТИМУЛИРУЮЩЕЕ
ДЕЙСТВИЕ
РАНОЗАЖИВЛЯЮЩЕЕ
ДЕЙСТВИЕ
КОМБИНИРОВАННАЯ
ТЕРАПИЯ РАКА,
РАДИОЗАЩИТА,
МОБИЛИЗАЦИЯ СТВОЛОВЫХ
КЛЕТОК
ПРОТИВОИНФЕКЦИОННЫЙ
ИММУНИТЕТ
Антивирусный
Антибактериальный
Гепатит С
Герпес
ЦМВ
Сепсис
Туберкулез
Хламидиоз
Хр. риносинусит
Лечение трофических язв,
ран, ожогов, пролежней и т.п.
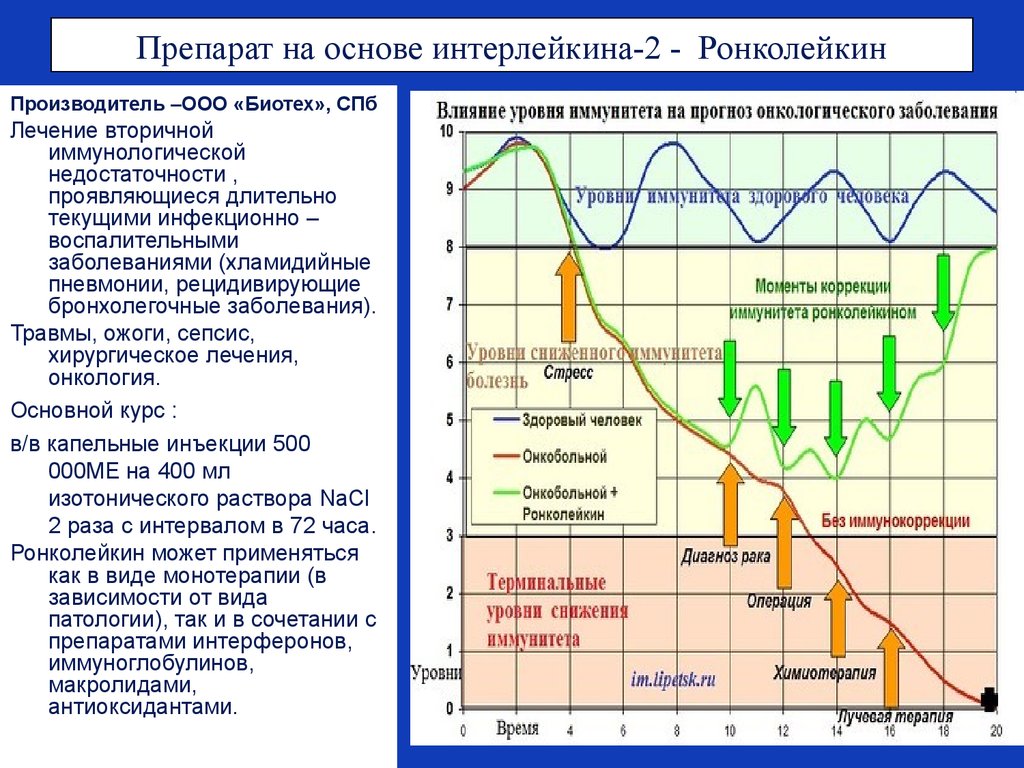
64. Препарат на основе интерлейкина-2 - Ронколейкин
Производитель –ООО «Биотех», СПбЛечение вторичной
иммунологической
недостаточности ,
проявляющиеся длительно
текущими инфекционно –
воспалительными
заболеваниями (хламидийные
пневмонии, рецидивирующие
бронхолегочные заболевания).
Травмы, ожоги, сепсис,
хирургическое лечения,
онкология.
Основной курс :
в/в капельные инъекции 500
000МЕ на 400 мл
изотонического раствора NаCl
2 раза с интервалом в 72 часа.
Ронколейкин может применяться
как в виде монотерапии (в
зависимости от вида
патологии), так и в сочетании с
препаратами интерферонов,
иммуноглобулинов,
макролидами,
антиоксидантами.
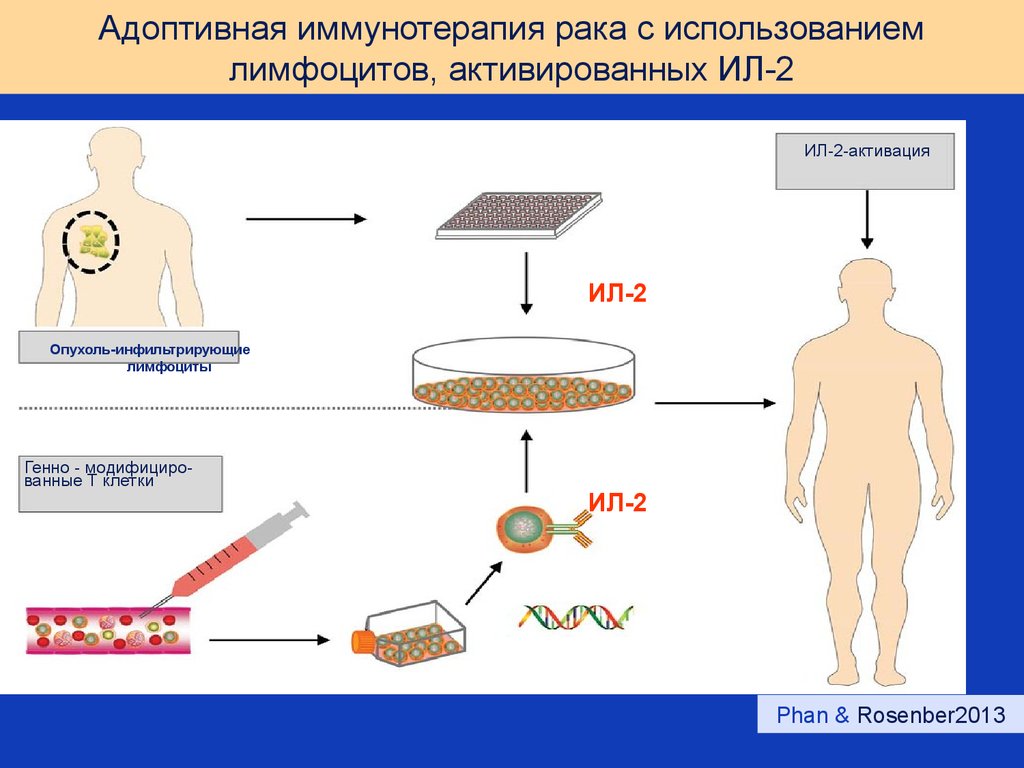
65. Использование ИЛ-2-активированных клеток в терапии рака
LAK – лимфокин-активированные киллеры. ИЛ-2активированные лимфоциты периферической кровибольных раком.
TIL – тумор-инфильтрирующие лимфоциты. Лимфоциты,
выделенные из удаленной опухоли и стимулированные
ИЛ-2 in vitro.
CIK – цитокин-индуцированные киллеры. Лимфоциты
периферической крови, активированные (ИЛ-2 + ИФНγ +
а/CD3).
Применение: Меланома, рак почки, различные виды
сарком и ряд других опухолей.
Результаты: полный ответ до 50%, 5-ти летняя
выживаемость 40-72% (Morgan e.a., 2010; Phan, Rosenberg, 2013)
66. Адоптивная иммунотерапия рака с использованием лимфоцитов, активированных ИЛ-2
ИЛ-2-активацияИЛ-2
Опухоль-инфильтрирующие
лимфоциты
Генно - модифицированные Т клетки
ИЛ-2
Phan & Rosenber2013
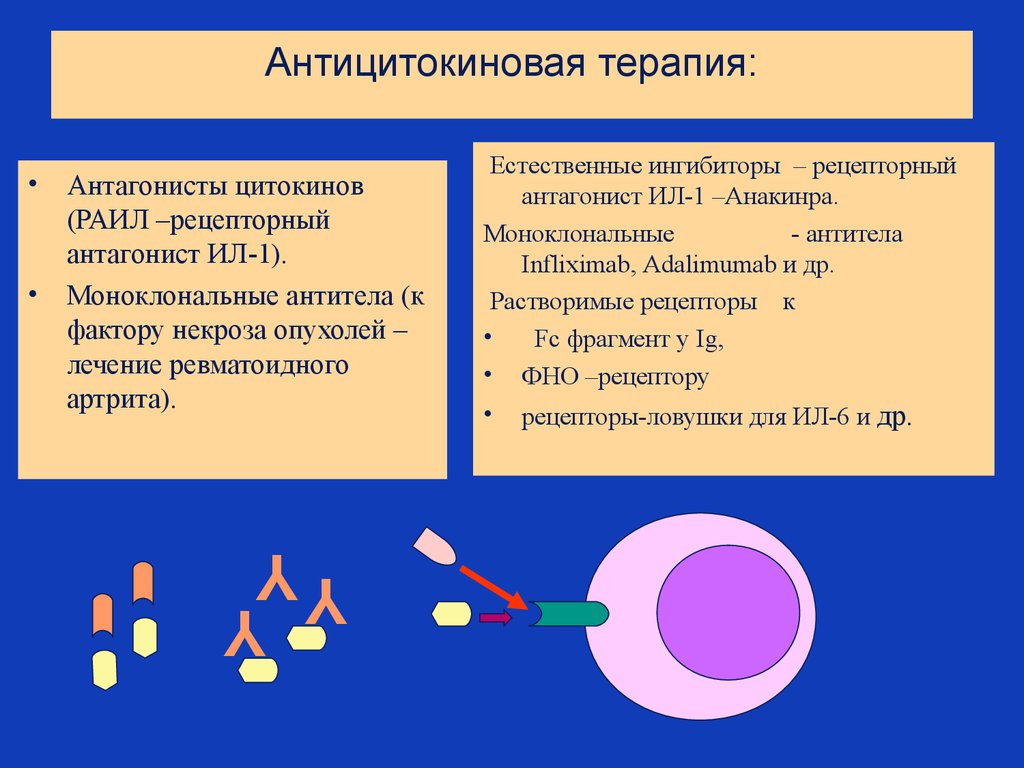
67. Антицитокиновая терапия:
Антагонисты цитокинов
(РАИЛ –рецепторный
антагонист ИЛ-1).
• Моноклональные антитела (к
фактору некроза опухолей –
лечение ревматоидного
артрита).
Естественные ингибиторы – рецепторный
антагонист ИЛ-1 –Анакинра.
Моноклональные
- антитела
Infliximab, Adalimumab и др.
Растворимые рецепторы к
Fс фрагмент у Ig,
• ФНО –рецептору
• рецепторы-ловушки для ИЛ-6 и др.
Y
Y
Y
68.
АНТИЦИТОКИНОВАЯ ТЕРАПИЯРЕВМАТОИДНОГО АРТРИТА
Основные
провоспалительные
цитокины,
участвующие
в патогенезе РА
Антицитокиновые препараты
для терапии
ФНО
МАТ – инфликсимаб (гуманизированные)
- адалимумаб (человеческие)
Химерный рецептор - этанерсепт
ИЛ-1
Рецепторный антагонист ИЛ-1
МАТ
ИЛ-6
МАТ против рецептора ИЛ-6 (тоцилизумаб)
ИЛ-17
МАТ в разработке
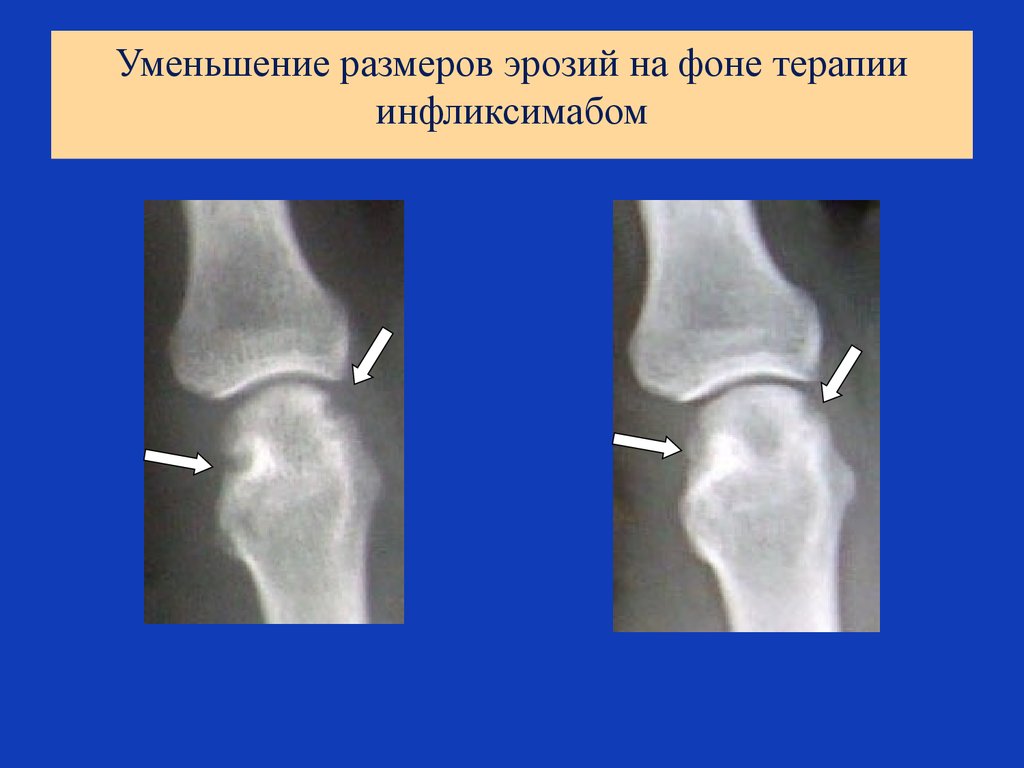
69. Уменьшение размеров эрозий на фоне терапии инфликсимабом
70. АПОПТОЗ (краткая информация (если на занятии останется время), либо студенты могут сделать сами сообщение – презентацию о механизмах апопт
АПОПТОЗ(краткая информация (если на занятии останется время), либо студенты
могут сделать сами сообщение – презентацию о механизмах апоптоза)
Естественный апоптоз развивается в
физиологических условиях:
в периоде эмбриогенеза,
при элиминации повреждённых клеток и
клеток в состоянии
терминальной дифференцировки,
в процессе инволюции органов,
при дифференцировке некоторых типов
клеток,
у новорождённого вследствие родового стр
есса.
Основное назначение естественного апоптоза
ремоделирование тканей и поддержание
тканевого (структурного) гомеостаза.
Нарушение реализации естественного апоптоза
приводит к развитию так называемых
апоптоз-ассоциированных
заболеваний (аутоиммунные
болезни, злокачественные опухоли и др.).
Индуцированный апоптоз обусловлен
или усилен внешними факторами, не
имеющими физиологического
значения ( например, апоптоз
клеток злокачественных
опухолей усиливается под влиянием лучевой
или химиотерапии, апоптоз лимфоидных
клеток развивается при дистресс-синдроме).
Формы индуцированного апоптоза:
• Апоптоз дистресса
• Инфекционно-токсический апоптоз
• Неинфекционно-токсический
апоптоз (в частности, лекарственный
апоптоз)
• Апоптоз ишемии
• Апоптоз гиперчувствительности
• Радиогенный апоптоз
• Термогенный апоптоз.
71. Апоптоз как физиологическая смерть клеток
Взаимодействие Fas –рецептор ( FasR) Fas лиганды (Fas L)Fas – рецептор (CD95)- рецептор
готовности клетки к апоптозу
Fas L или CD95L –лиганды Fas рецептора.
Лигандами для таких рецепторов могут
служить либо растворимые
факторы, либо молекулы,
экспрессирующиеся на поверхности
клеток –таких, как цитотоксические Т
лимфоциты.
При связывании Fas – рецептора Fas –
лигандом, происходит запуск
программируемой гибели клеток
организма.
Лиганды для Fas – рецептора
Лиганды для Fas – рецептора (Fas L или
CD95L) , запускающие апоптоз, имеют
ряд сходных механизмов, но также ряд
отличительных особенностей с
активацией рецепторов фактора некроза
опухолей - альфа (TNF ).
Связывание такого рецептора с лигандом
вызывает на поверхности клетки-мишени
процесс кластеризации рецепторов.
После этого адапторный протеин FADD
подходит прямо к внутриклеточному
домену смерти поверхностного Fas
рецептора, соединяется с ним, после чего
происходит запуск каскада каспаз.
Fas рецептор активирует только процесс
апоптоза в клетке-мишени, и не участвует
в сигналлинге TNF рецептора.
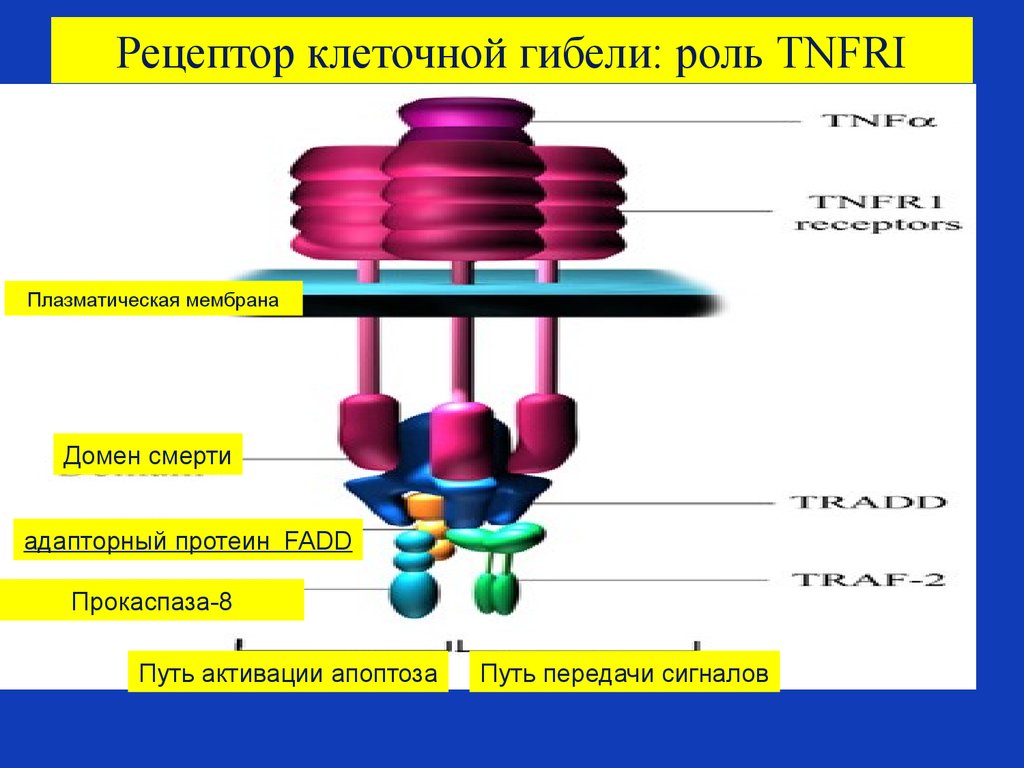
72. Рецептор клеточной гибели: роль TNFRI
Плазматическая мембранаДомен смерти
адапторный протеин FADD
Прокаспаза-8
Путь активации апоптоза
Путь передачи сигналов
73. Механизмы запуска апоптоза
Цитотоксические Т лимфоцитыраспознают поврежденные ,
вирустрансформированные или
малигнизированные клетки
организма –хозяина и запускают
в них программу апоптоза.
Цитотоксические Т лимфоциты
также могут вызывать апоптоз
клеток –мишеней с помощью
специальных ферментов –
гранзимов, которые они
впрыскивают в отверстия
клеточной мембраны клетки –
мишени, созданные
перфоринами –
полимеризующимися в
мембране мишени протеинами.
Гранзим B может быть введен в
клетку-мишень цитотоксическим
Т лимфоцитом с помощью
отверстий в мембране мишени,
созданных перфоринами.
Гранзим B способен прямо
активировать каспазы 3, 7,8 и
10.
Митохондрия – также является
ключевым регулятором
каспазного каскада и апоптоза:
освобождение цитохрома C из
митохондрии прямо активирует
сначала каспазу 9, потом
каспазу 3.
74. Каспазы и разрушение хроматина
Основной механизм запрограммированнойгибели клеток – разрушение хромосомальной
ДНК до нуклеосом.
• Каспазы (ферменты с каскадным принципом
действия) играют основную роль в этом
процессе:
• Активируют ДНКазы
• Ингибируют ферменты, участвующие в
репарации ДНК
• Разрушают структурные протеины ядра
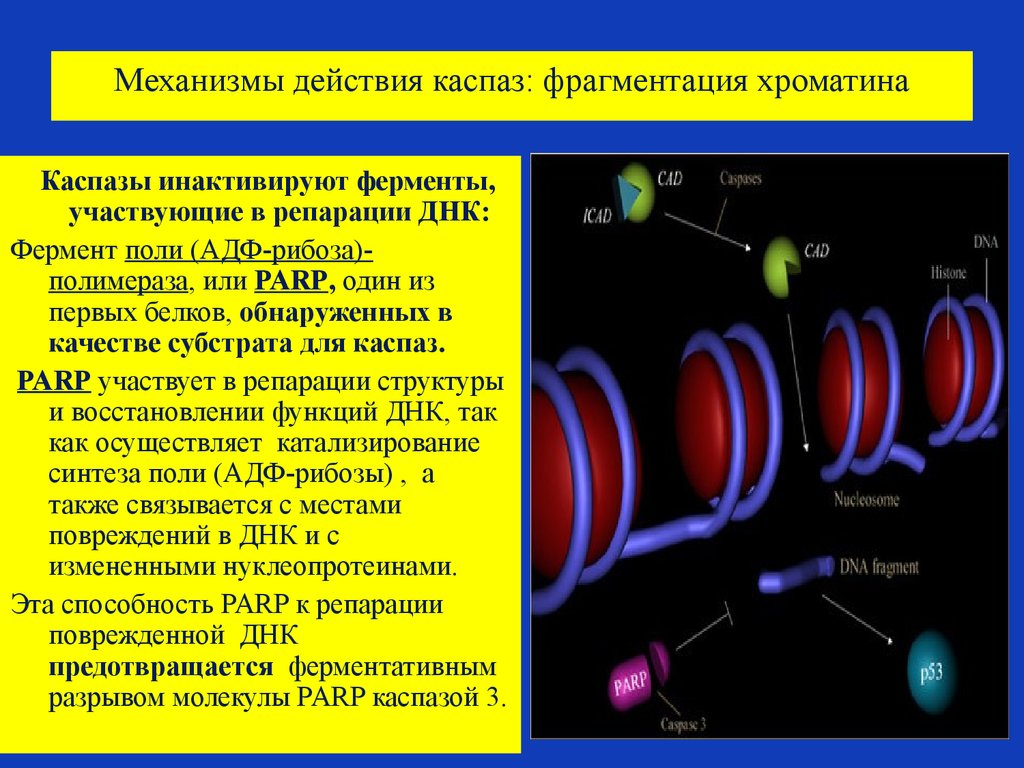
75. Механизмы действия каспаз: фрагментация хроматина
. Каспазы инактивируют ферменты,участвующие в репарации ДНК:
Фермент поли (AДФ-рибоза)полимераза, или PARP, один из
первых белков, обнаруженных в
качестве субстрата для каспаз.
PARP участвует в репарации структуры
и восстановлении функций ДНК, так
как осуществляет катализирование
синтеза поли (AДФ-рибозы) , а
также связывается с местами
повреждений в ДНК и с
измененными нуклеопротеинами.
Эта способность PARP к репарации
поврежденной ДНК
предотвращается ферментативным
разрывом молекулы PARP каспазой 3.
76. Механизмы действия каспаз: разрушение структурных белков ядра и фрагментация ДНК
Каспазы разрушают структурныебелки ядра
Каспазы вызывают фрагментацию
ДНК
Ламины –структурные ядерные
белки, которые поддерживают
форму ядра и обеспечивают
взаимодействие между
хроматином и мембраной ядра.
Разрушения ламинов каспазой 6
приводит к конденсации
хроматина и фрагментации
ядра, что и является
отличительной особенностью
клеток, вошедших в апоптоз.
Радиоизотопные исследования
показали, что процесс
фрагментации ДНК до
нуклеосом обеспечивается
ферментом CAD ( каспазой
активированная ДНКаза).
В норме CAD существует в виде
неактивного комплекса с
ингибитором- ICAD (ингибитор
CAD).
Во время апоптоза, ICAD
отрывается каспазой 3, и CAD
освобождается из комплекса.
Вслед за этим происходит быстрая
фрагментация ядра
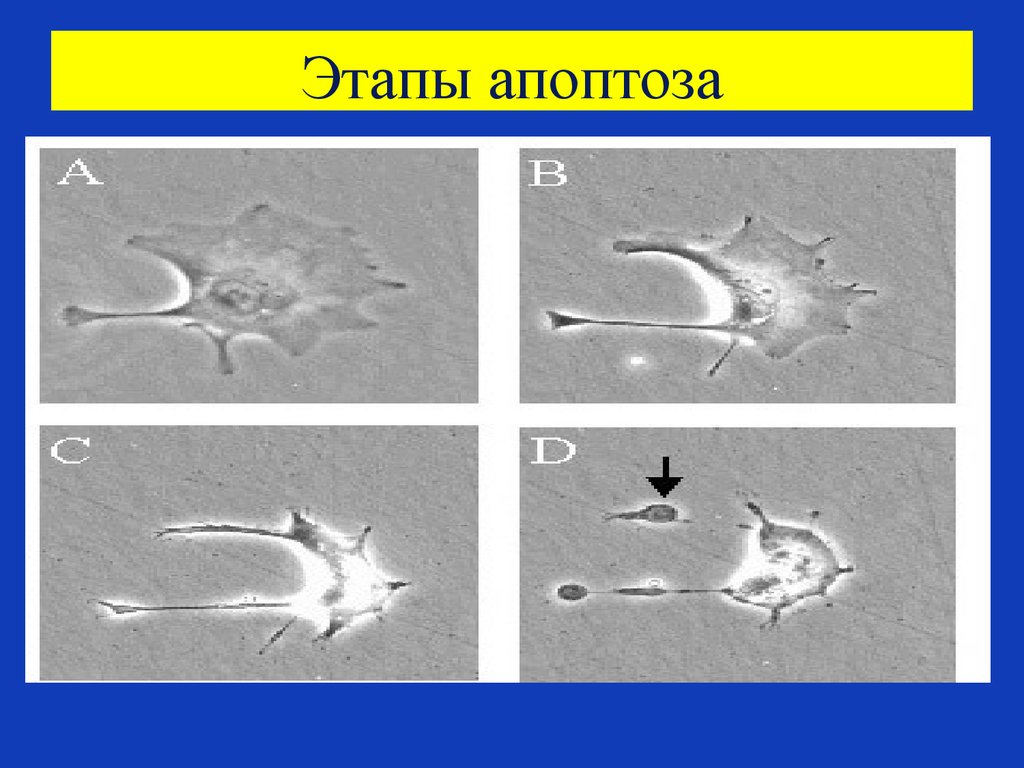
77. Этапы апоптоза
Этапы А и В(А) Разрыв ламинов
(ядерных белков) и
актинов – белков
цитоскелета.
(B) Повреждение
хроматина в ядре ,
конденсация
хроматина. Ядро как
бы «сморщивается».
Этапы С и D
(C) Клетка уменьшается в
размерах, как бы
упаковывается в форму,
удобную для ее
поглощения макрофагом.
(D) Маленькие везикулы –
все, что остается от
клетки на последнем
этапе ее
физиологической гибели
- апоптозные тела, легко
поглощаются
макрофагами.
78. Этапы апоптоза
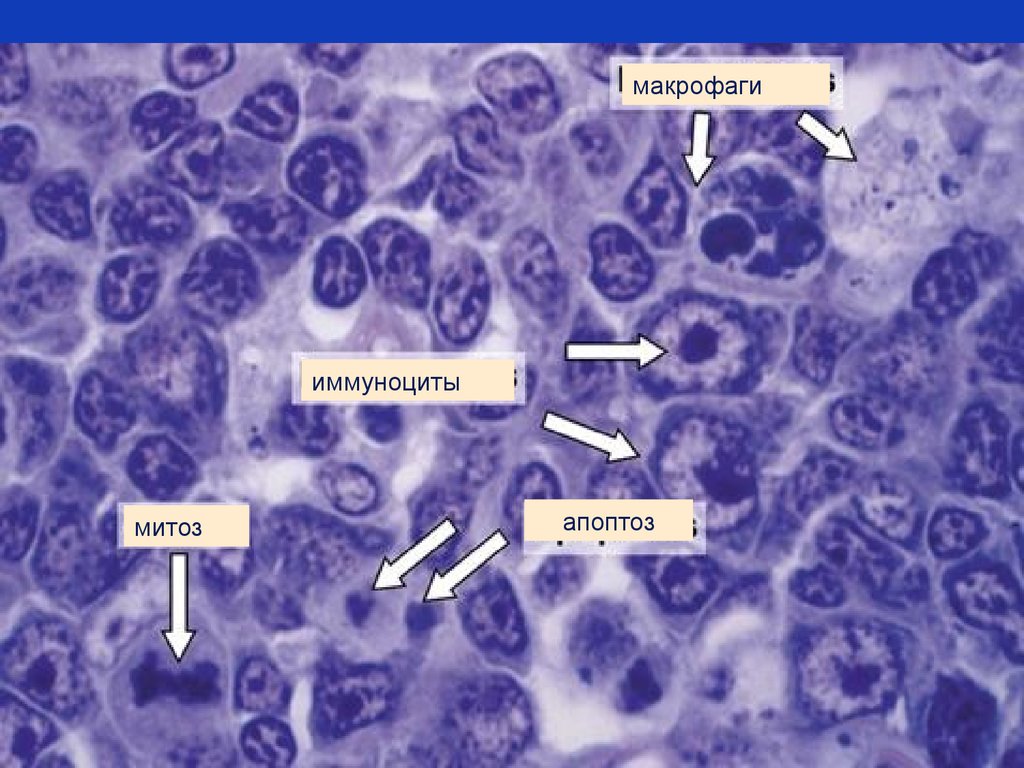
79.
макрофагииммуноциты
митоз
апоптоз
80. Сигналы, вызывающие запуск апоптоза
• Существует несколько типов сигналов,запускающих апоптоз.
• Чувствительность клетки к таким сигналам
зависит от многих факторов :
• От экспрессии про- и противоапоптических
протеинов (семейства Bcl-2 ).
• От выраженности (силы) апоптозных
стимулов.
• От стадии клеточного цикла.
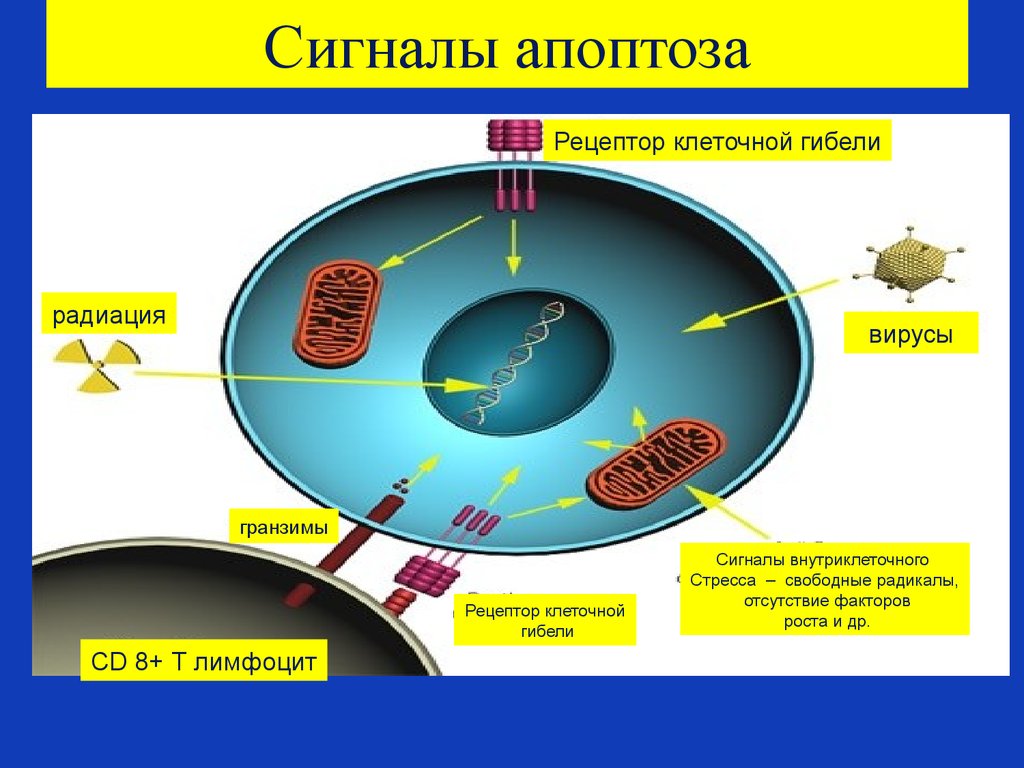
81. Сигналы апоптоза
Рецептор клеточной гибелирадиация
вирусы
гранзимы
Рецептор клеточной
гибели
CD 8+ Т лимфоцит
Сигналы внутриклеточного
Стресса – свободные радикалы,
отсутствие факторов
роста и др.
82. Внутренние сигналы апоптоза
• В других случаях апоптоз клетки может запускатьсявнутренними сигналами –сигналами стресса.
• Клеточный стресс может вызываться при экспозиции
клетки к радиации, химическим веществам, либо при
вирусной инфекции.
• Стресс может быть также оксидативным - в клетке
скапливается слишком больное число оксидантов.
• В генерацию внутренних сигналов апоптоза всегда
вовлечены митохондрии.
• Относительное количество антиапоптозных белков bcl-2 - определяет, насколько интенсивность
клеточного стресса достаточна для входа клетки в
апоптоз.
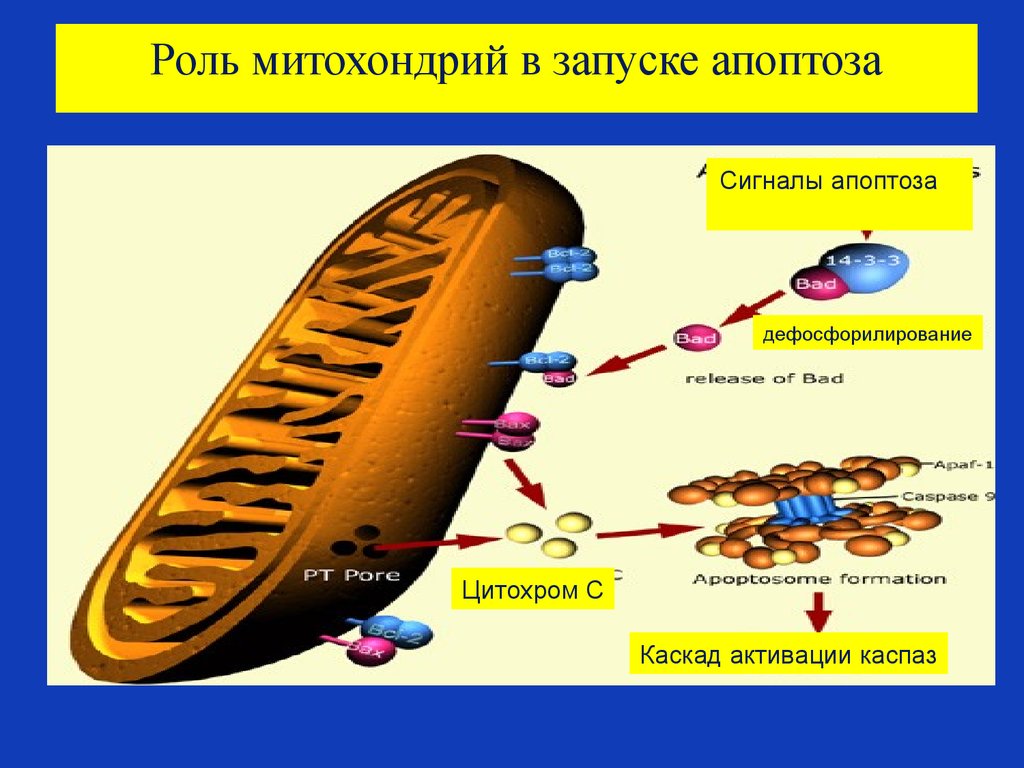
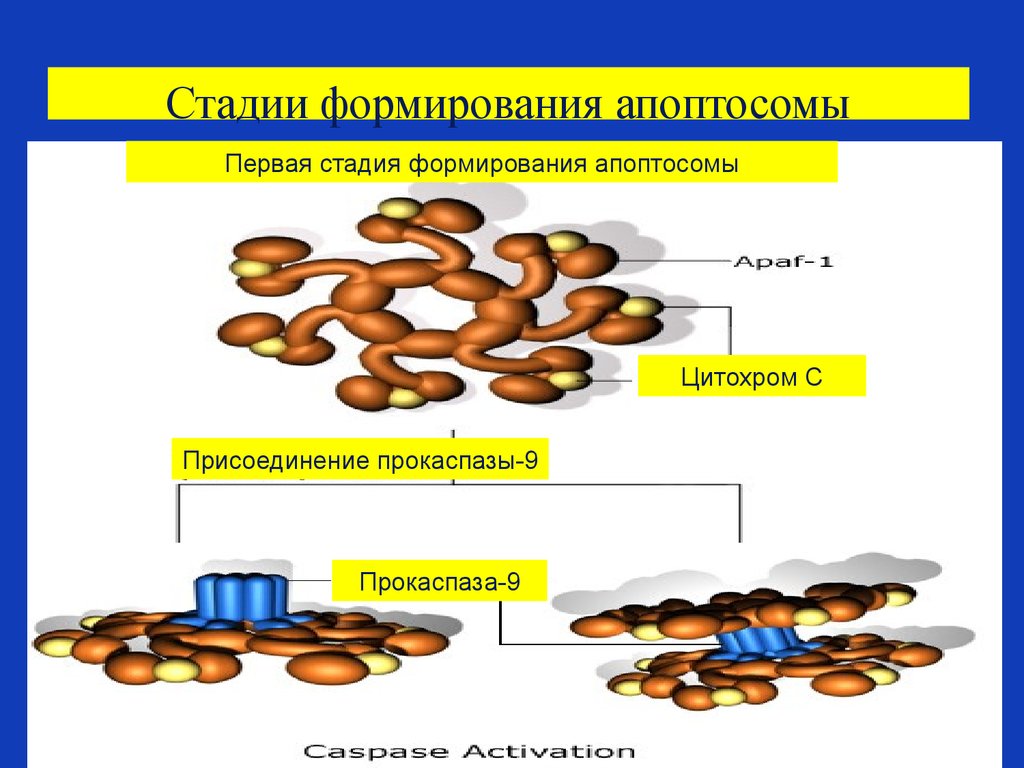
83. Роль митохондрий в запуске апоптоза
В митохондриях содержится большинство проапоптозных
протеинов –таких, как апоптоз индуцирующий фактор
-Apoptosis Inducing Factor (AIF), Smac/DIABLO и цитохром C.
• Эти факторы освобождаются из митохондрий через отверстия в
мембране, называемыми порами.
• Эти поры образуются в мембране митохондрии в результате
действия проапоптозных белков, которые активируются
сигналами клеточного стресса (радиация, повреждение
свободными радикалами, отсутствие положительных сигналов –
ростовых факторов и т.д.).
• Митохондрии также играют важную роль в усилении сигналов
апоптоза , приходящих с домена смерти клеточного рецептора
апоптоза, а также в привлечении каспазы 8 к этому домену
смерти.
84. Роль Bcl-2 протеинов
Семейство bcl-2 протеинов участвует в ответе на апоптозные
стимулы.
Некоторые из этих протенов (такие, как bcl-2 и bcl-XL) являются
антиапоптозными белками.
Другие члены семейства bcl-2 протеинов (такие, как Bad, Bax
или Bid) являются проапоптозыми белками.
Чувствительность клетки к апоптозным стимулам зависит от
баланса про- и противо- апоптозных bcl-2 протеинов: при
преобладании проапоптозных белков, клетка более
чувствительна к апоптозу, если преобладают
противоапоптозные белки –клетка более устойчива к
апоптозным стимулам.
Преобладание проапоптозных bcl-2 белков на поверхностной
мембране митохондрий является сигналом для формирования
пор, выхода из митохондрии цитохрома С, что служит
внутренним сигналом для запуска каскада каспаз.





























































 Медицина
Медицина