Похожие презентации:
Кислоты и соли
1.
КИСЛОТЫ.СОЛИ
2.
Лимоннаякислота
Муравьиная
кислота
Яблочная
кислота
Щавелевая
кислота
Уксусная
кислота
Молочная
кислота
3.
Кислоты – сложные вещества, состоящиеиз атомов водорода и кислотного остатка
HNO3
Атомы
водорода
Кислотный
остаток
4.
По содержаниюкислорода
По
растворимости
в воде
Кислородсодержащие
Бескислородные
Растворимые в воде
Нерастворимые в воде
HNO3, H2SO4
HCl, H2S
Большинство кислот
H2SiO3
5.
Летучие инелетучие
По числу атомов
водорода
Летучие
Нелетучие
Одноосновные
H2S, HCl
Большинство
кислородсодержащих
кислот
HCl
Двухосновные
H2SO4
Трехосновные
H3PO4
6.
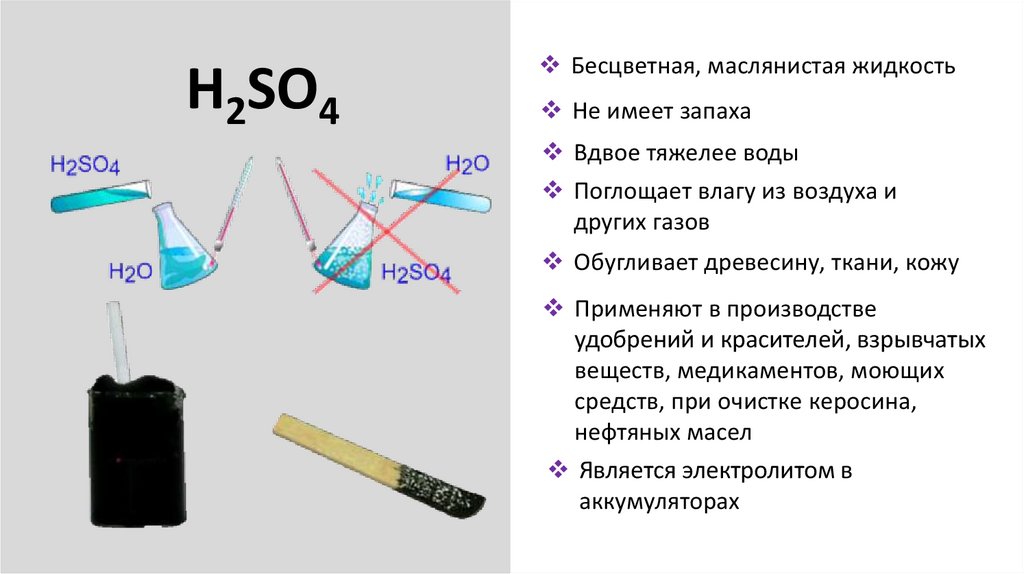
H2SO4Бесцветная, маслянистая жидкость
Не имеет запаха
Вдвое тяжелее воды
Поглощает влагу из воздуха и
других газов
Обугливает древесину, ткани, кожу
Применяют в производстве
удобрений и красителей, взрывчатых
веществ, медикаментов, моющих
средств, при очистке керосина,
нефтяных масел
Является электролитом в
аккумуляторах
7.
H2CO3 = H2O + CO2H2SO3 = H2O + SO2
8.
Окраска индикаторов в кислотахНазвание
индикатора
Лакмус
Метилоранж
Фенолфталеин
Окраска
индикатора в
нейтральной
среде
Окраска
индикатора в
растворах кислот
9.
Шкала рНУниверсальная
индикаторная бумага
Кислая среда
Нейтральная среда
рН = 7 – среда нейтральная
рН < 7 – среда кислая
рН > 7 – среда щелочная
Щелочная среда
10.
Определение валентности кислотногоостатка в кислоте
II
H2S
H2S
I
II
H2SO3
I
III
H2S
I
I
H3РO4
I
II
H2S
11.
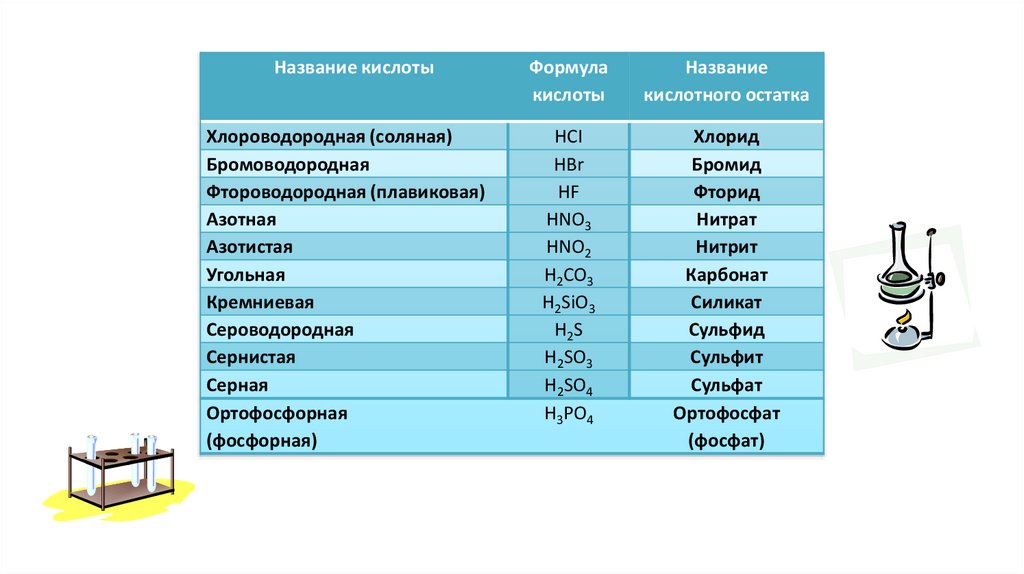
Название кислотыХлороводородная (соляная)
Бромоводородная
Фтороводородная (плавиковая)
Азотная
Азотистая
Угольная
Кремниевая
Сероводородная
Сернистая
Серная
Ортофосфорная
(фосфорная)
Формула
кислоты
Название
кислотного остатка
HCI
HBr
HF
HNO3
HNO2
H2CO3
H2SiO3
H2 S
H2SO3
H2SO4
H3PO4
Хлорид
Бромид
Фторид
Нитрат
Нитрит
Карбонат
Силикат
Сульфид
Сульфит
Сульфат
Ортофосфат
(фосфат)
12.
СОЛИ13.
Соли – сложные вещества, состоящие из атомов металлаи кислотного остатка
Кислота: HCl
Соли:
NaCl, MgCl2 , AlCl3
NaCl
Na2SO4
MgCl2
MgSO4
Кислота: H2SO4
Соли:
Na2SO4, MgSO4 ,
Al2(SO4)3
AlCl3
Al2(SO4)3
14.
Кристаллогидраты – кристаллические вещества,содержащие молекулы воды
Медный купорос – CuSO4 · 5H2O
Сульфат меди (II) – CuSO4
CuSO4 + 5H2O → CuSO4 · 5H2O
CuSO4 · 5H2O → CuSO4 + 5H2O
15.
Реакция солей с металламиСоль + металл = другая соль + другой металл
Н.Н. Бекетов
16.
Условия протекания реакций:Обе соли должны быть растворимыми
Fe Pb Cu
Металлы не должны реагировать с водой
Fe + CuSO4 = FeSO4 + Cu↓ (р.з.)
Pb + CuSO4 ≠
Cu + FeSO4 ≠
CuSO4 FeSO4














 Химия
Химия








