Похожие презентации:
Ацетиленовые углеводороды (алкины). Лекция №7
1.
Министерство науки и высшего образования РФФГБОУ ВО
«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Органическая химия
Направление подготовки
18.03.01 «Химическая технология»
04.03.02 «Химия, физика и механика
материалов»
Лекция №7
Тема: Ацетиленовые углеводороды (алкины)
Преподаватель: д.х.н., профессор Климочкин Ю.Н.
Самара
2.
Ацетилен(CnH2n-2)
H C C H
ацетилен
Объем производства – 5 млн. т в год!
Ацетилен (tкип=−84°C), впервые был получен в 1836 году Эдмундом Дэви
нагреванием уксуснокислого калия с древесным углем и последующей
реакцией с водой образовавшегося карбида калия.
23
3.
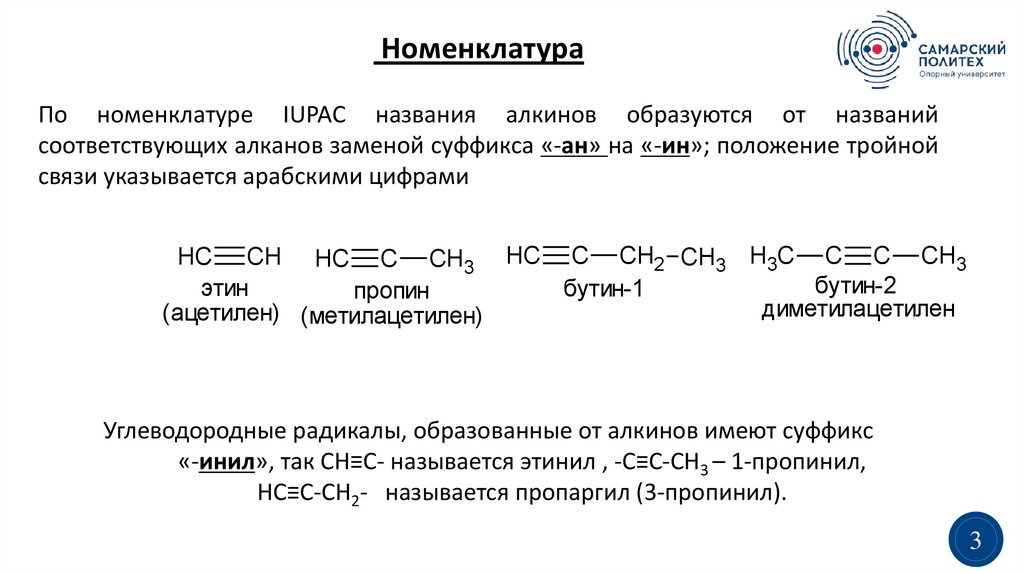
НоменклатураПо номенклатуре IUPAC названия алкинов образуются от названий
соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной
связи указывается арабскими цифрами
HC CH HC C CH3 HC C CH2 CH3 H3C C C CH3
бутин-2
этин
бутин-1
пропин
диметилацетилен
(ацетилен) (метилацетилен)
Углеводородные радикалы, образованные от алкинов имеют суффикс
«-инил», так CH≡C- называется этинил , -C≡C-CH3 – 1-пропинил,
HC≡C-CH2- называется пропаргил (3-пропинил).
33
4.
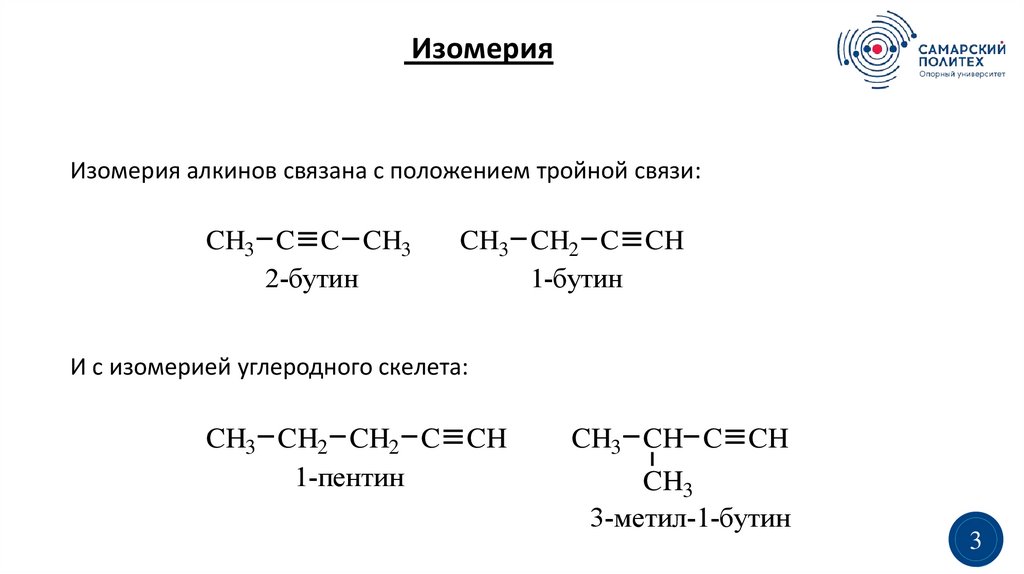
ИзомерияИзомерия алкинов связана с положением тройной связи:
CH3 C C CH3
2-бутин
CH3 CH2 C CH
1-бутин
И с изомерией углеродного скелета:
CH3 CH2 CH2 C CH
1-пентин
CH3 CH C CH
CH3
3-метил-1-бутин
33
5.
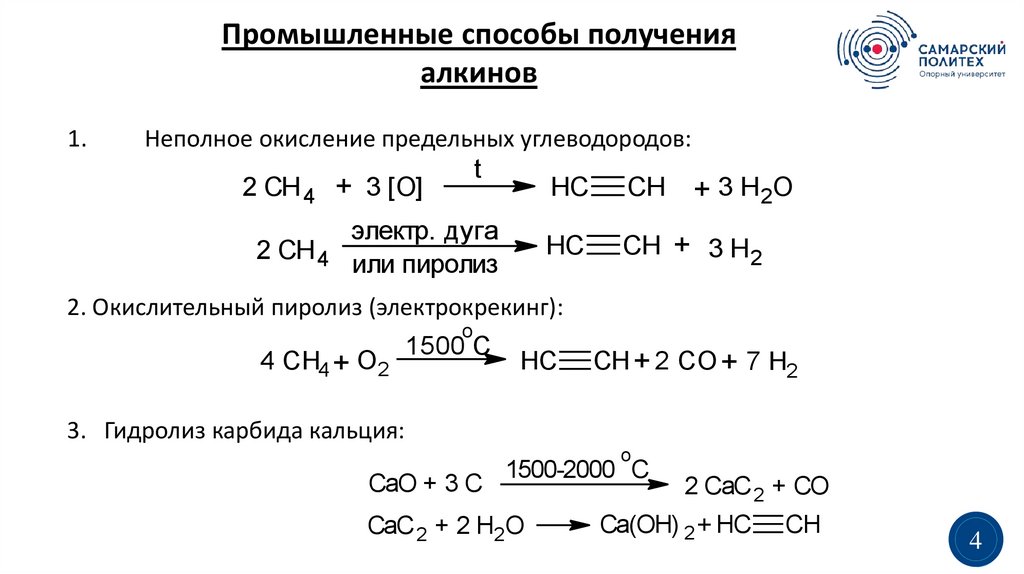
Промышленные способы полученияалкинов
1.
Неполное окисление предельных углеводородов:
t
2 CH 4 + 3 [O]
HC CH + 3 H 2O
2 CH 4
электр. дуга
или пиролиз
HC
CH + 3 H 2
2. Окислительный пиролиз (электрокрекинг):
o
4 CH4 + O2
1500 C
HC
CH + 2 CO + 7 H2
3. Гидролиз карбида кальция:
o
CaO + 3 C
1500-2000 C
CaC 2 + 2 H2O
2 CaC 2 + CO
Ca(OH) 2 + HC
CH
43
6.
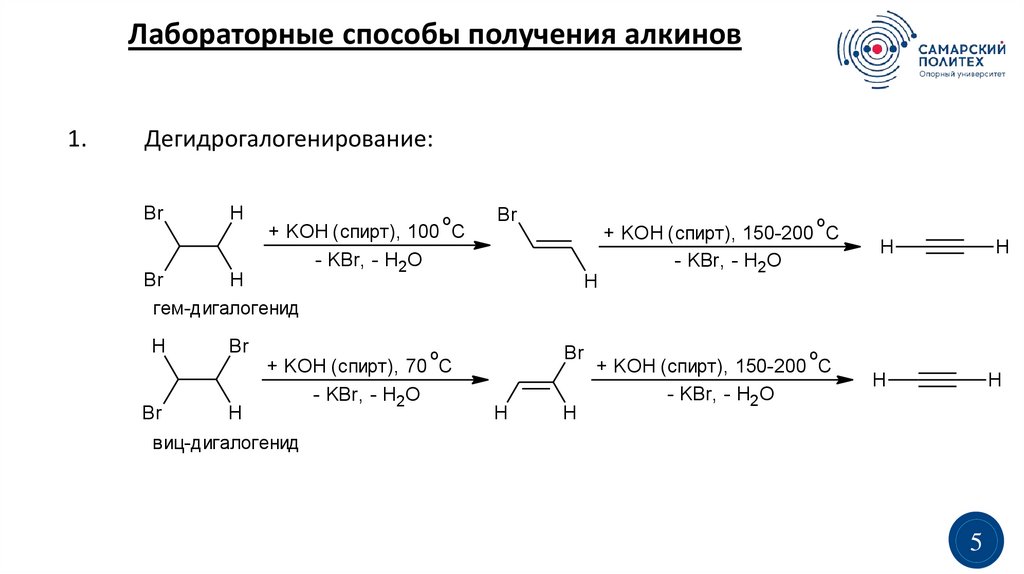
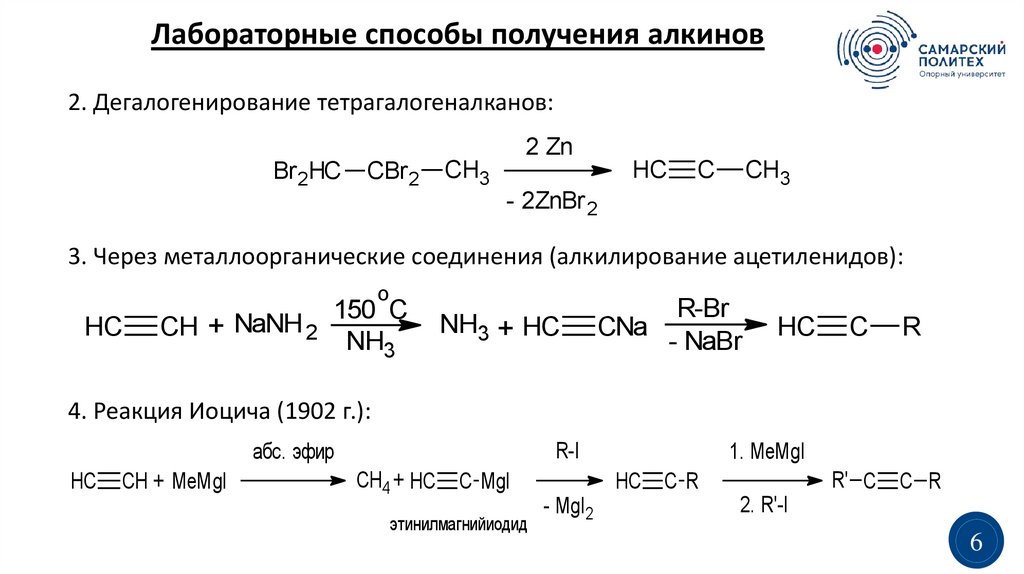
Лабораторные способы получения алкинов1.
Дегидрогалогенирование:
Br
H
о
+ KOH (спирт), 100 С
- KBr, - H2O
Br
о
Br
H
гем-дигалогенид
H
Br
Br
о
+ KOH (спирт), 70 С
- KBr, - H2O
Br
H
виц-дигалогенид
H
H
H
+ KOH (спирт), 150-200 С
- KBr, - H2O
H
H
о
+ KOH (спирт), 150-200 С
- KBr, - H2O
H
H
53
7.
Лабораторные способы получения алкинов2. Дегалогенирование тетрагалогеналканов:
2 Zn
Br 2HC
CBr 2
CH3
HC
C
CH3
- 2ZnBr 2
3. Через металлоорганические соединения (алкилирование ацетиленидов):
o
HC
CH + NaNH 2
150 C
NH3
NH3 + HC
R-Br
CNa
- NaBr
HC
C
R
4. Реакция Иоцича (1902 г.):
абс. эфир
HC
CH + MeMgI
R-I
CH4 + HC
C MgI
этинилмагнийиодид
1. MeMgI
HC
- MgI2
R' C
CR
C R
2. R'-I
63
8.
Физические свойства алкиновЗакономерности в изменении температур плавления и кипения в ряду
ацетиленовых углеводородов сходны с закономерностями в ряду алкенов.
Положение тройной связи в цепи сильно влияет на температуру кипения. Так
1-бутин кипит при 8,5oС, а 2-бутин – при 27oС.
Плотность и показатель преломления ацетиленов выше, чем олефинов и, тем
более, парафинов.
Алкины С2-С3 - газы, С4-С16 - жидкости.
Потенциал ионизации С2Н2 - 11,4 эВ,
С2Н4 – 10,5 эВ
С2Н6 – 11,6 эВ
Хорошо растворимы в воде.
метилацетилен – 10,4эВ
73
9.
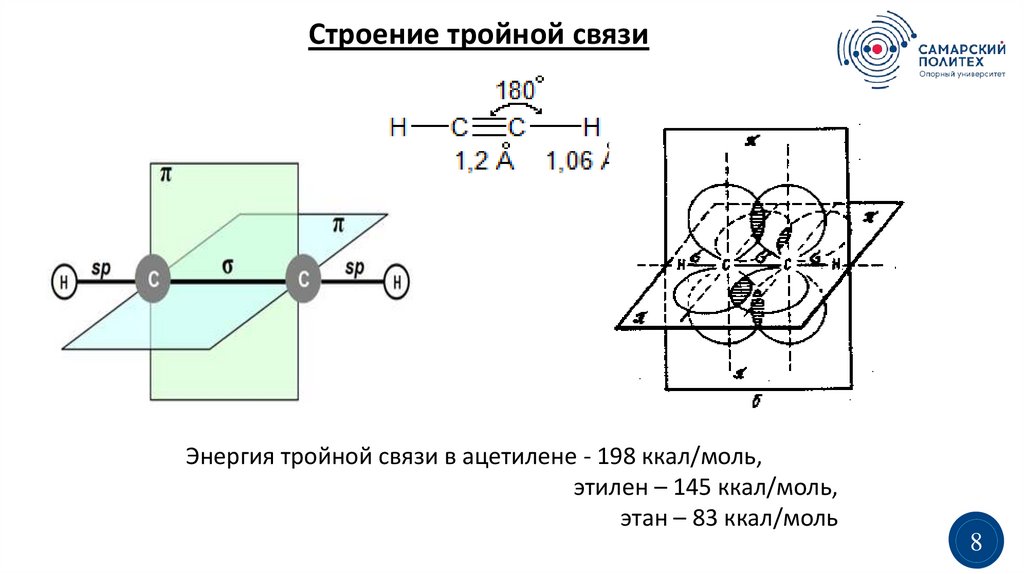
Строение тройной связиЭнергия тройной связи в ацетилене - 198 ккал/моль,
этилен – 145 ккал/моль,
этан – 83 ккал/моль
83
10.
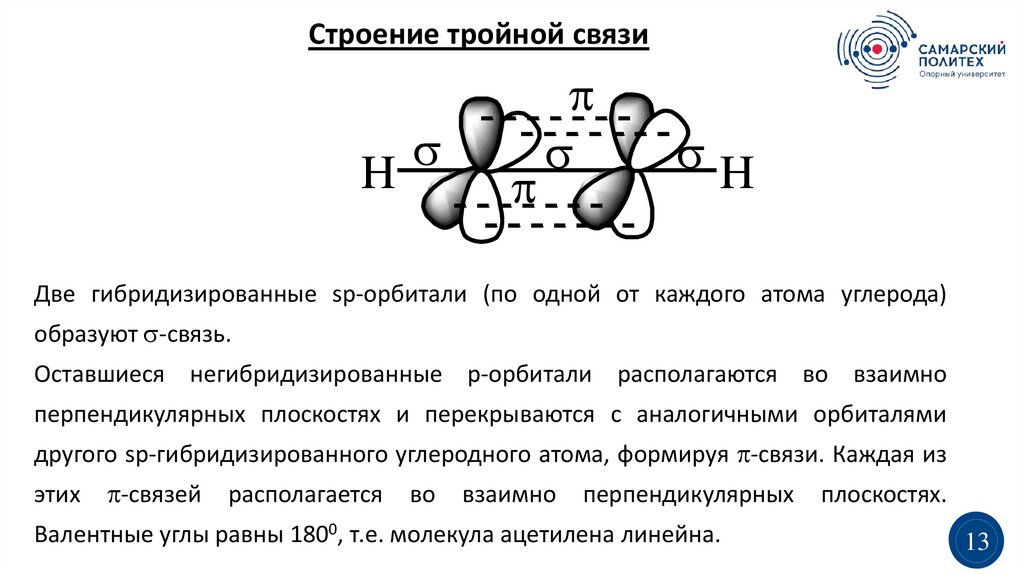
Строение тройной связиH
H
Две гибридизированные sp-орбитали (по одной от каждого атома углерода)
образуют -связь.
Оставшиеся негибридизированные р-орбитали располагаются во взаимно
перпендикулярных плоскостях и перекрываются с аналогичными орбиталями
другого sp-гибридизированного углеродного атома, формируя -связи. Каждая из
этих
-связей
располагается
во
взаимно
перпендикулярных
Валентные углы равны 1800, т.е. молекула ацетилена линейна.
плоскостях.
13
3
11.
Химические свойства алкинов≡C-H связь в ацетилене сильно поляризована из-за большего ee s-характера при spгибридизации.
Электронная пара C-H ближе к атому С (и ядру).
Ацетилен более сильная кислота, чем алкены и алканы, но слабее, чем вода, спирты.
Карбанион (ацетиленид-анион) более устойчив, так как в sp-гибридизации s-электрон
обладает меньшей энергией и меньшей подвижностью.
pKa
С2H4
NH3
C2H2
H2O
36,5
30
25
15,7
Дипольный момент в 1-бутине – 0,8 D (в 1-бутене – 0,3 D)
Электроотрицательность атома углерода в sp3-гибридизации – 2,5, в sp2 – 2,7, в sp – 3,2
93
12.
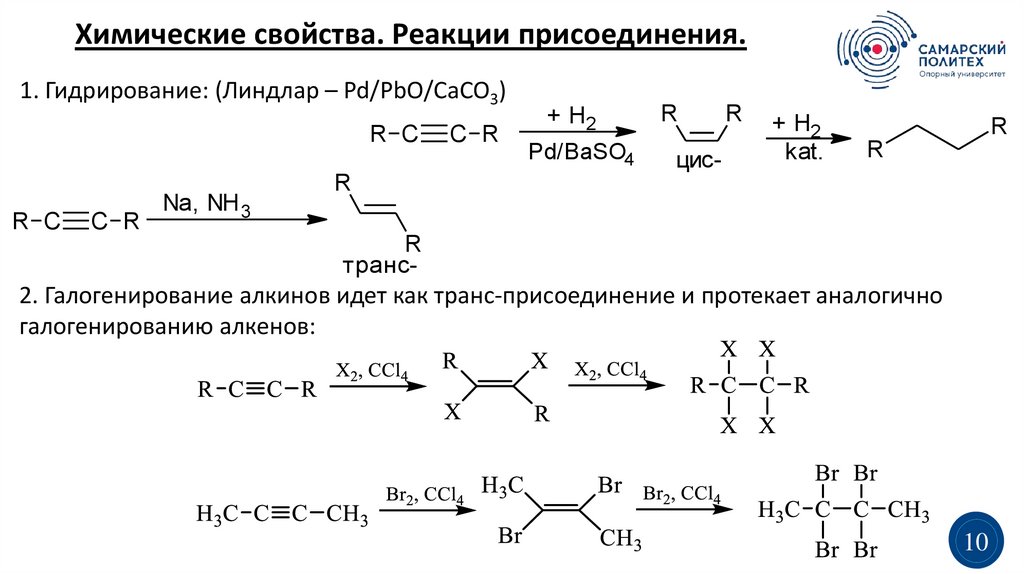
Химические свойства. Реакции присоединения.1. Гидрирование: (Линдлар – Pd/PbO/CaCO3)
R C
R C
C R
Na, NH3
C R
+ H2
Pd/BaSO4
R
цис-
R
+ H2
kat.
R
R
R
R
транс-
2. Галогенирование алкинов идет как транс-присоединение и протекает аналогично
галогенированию алкенов:
10
3
13.
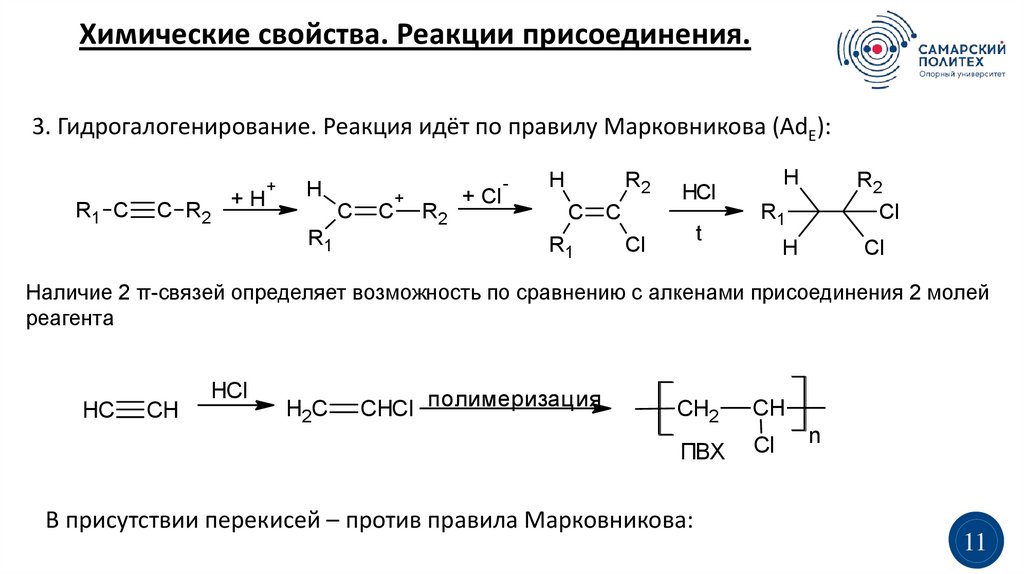
Химические свойства. Реакции присоединения.3. Гидрогалогенирование. Реакция идёт по правилу Марковникова (AdE):
R1 C
C R2
+H
+
H
C
R1
+
C
R2
+ Cl
-
H
R2
C
R1
H
HCl
C
t
Cl
R2
R1
Cl
H
Cl
Наличие 2 π-связей определяет возможность по сравнению с алкенами присоединения 2 молей
реагента
HC
CH
HCl
H2C
CHCl полимеризация
CH2
CH
ПВХ
Cl
В присутствии перекисей – против правила Марковникова:
n
11
3
14.
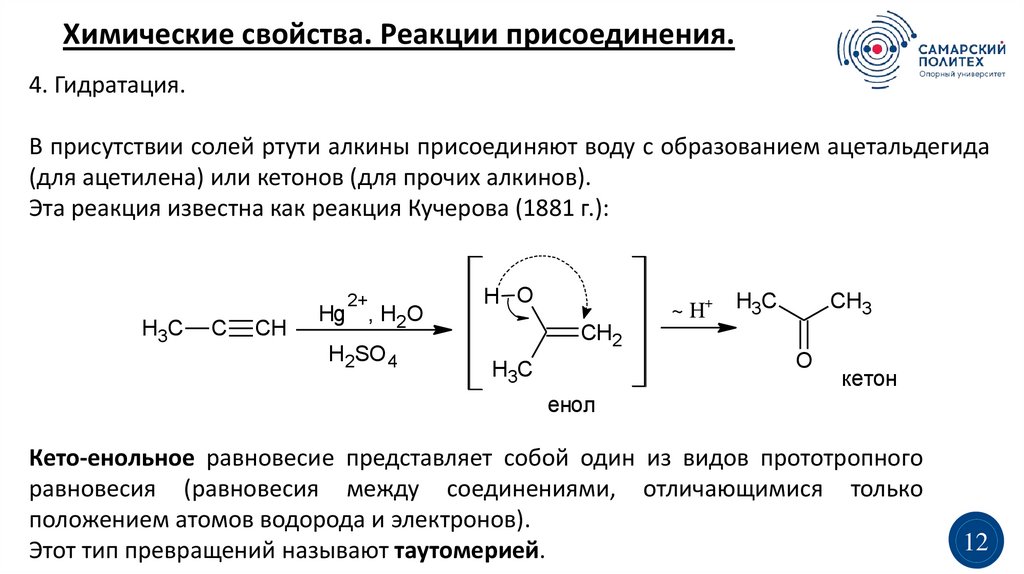
Химические свойства. Реакции присоединения.4. Гидратация.
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида
(для ацетилена) или кетонов (для прочих алкинов).
Эта реакция известна как реакция Кучерова (1881 г.):
2+
H3C
C
CH
Hg , H2O
H2SO 4
H O
~ H+
H3C
CH3
CH2
O
H3C
кетон
енол
Кето-енольное равновесие представляет собой один из видов прототропного
равновесия (равновесия между соединениями, отличающимися только
положением атомов водорода и электронов).
Этот тип превращений называют таутомерией.
12
3
15.
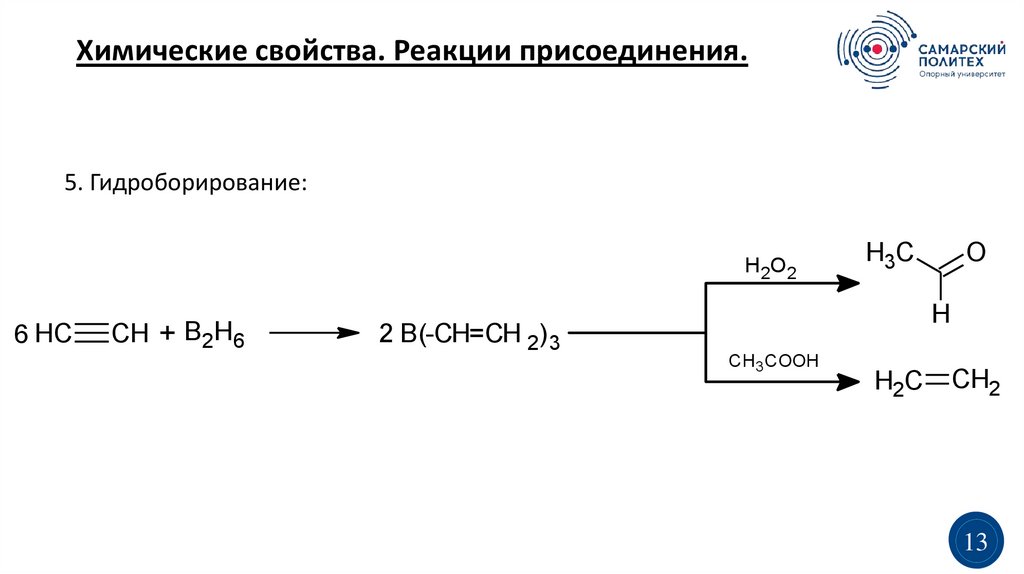
Химические свойства. Реакции присоединения.5. Гидроборирование:
H2O2
6 HC
CH + B2H6
2 B(-CH=CH 2)3
H3C
O
H
CH3 COOH
H2C
CH2
13
3
16.
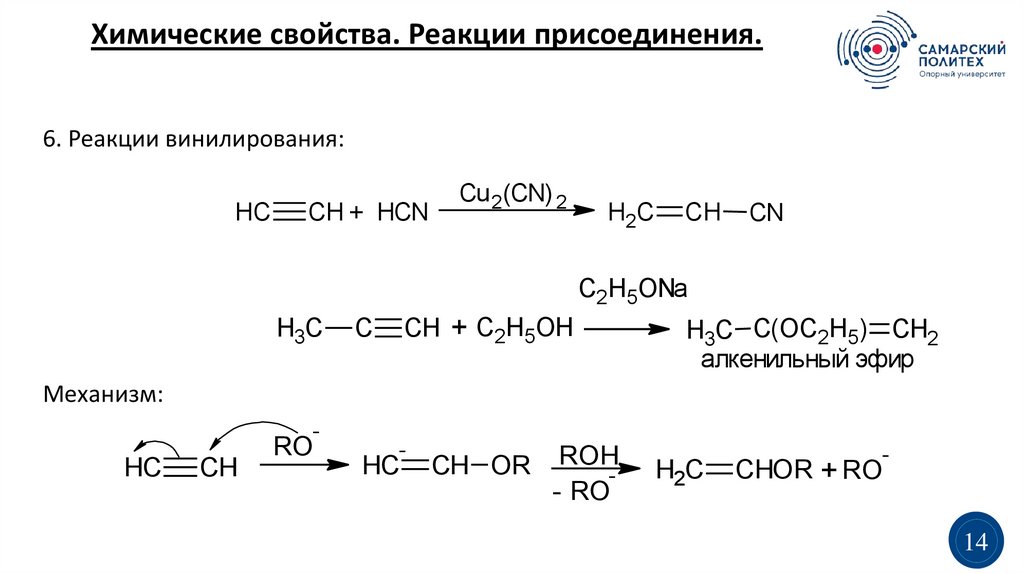
Химические свойства. Реакции присоединения.6. Реакции винилирования:
HC
CH + HCN
Cu 2(CN) 2
H2C
CH
CN
C2H5ONa
H3C
CH + C2H5OH
C
H3C C(OC2H5) CH2
алкенильный эфир
Механизм:
-
HC
CH
RO
-
HC
CH OR
ROH
- RO
H2C
-
CHOR + RO
14
3
17.
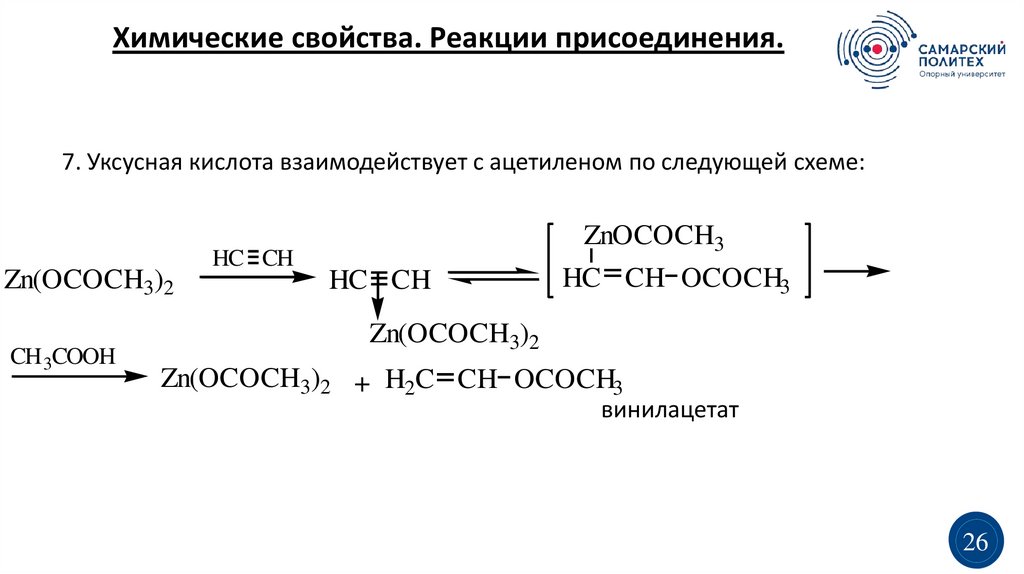
Химические свойства. Реакции присоединения.7. Уксусная кислота взаимодействует с ацетиленом по следующей схеме:
Zn(OCOCH3)2
CH 3COOH
HC CH
ZnOCOCH3
HC CH
HC CH OCOCH3
Zn(OCOCH3)2
Zn(OCOCH3)2 + H2C CH OCOCH3
винилацетат
26
3
18.
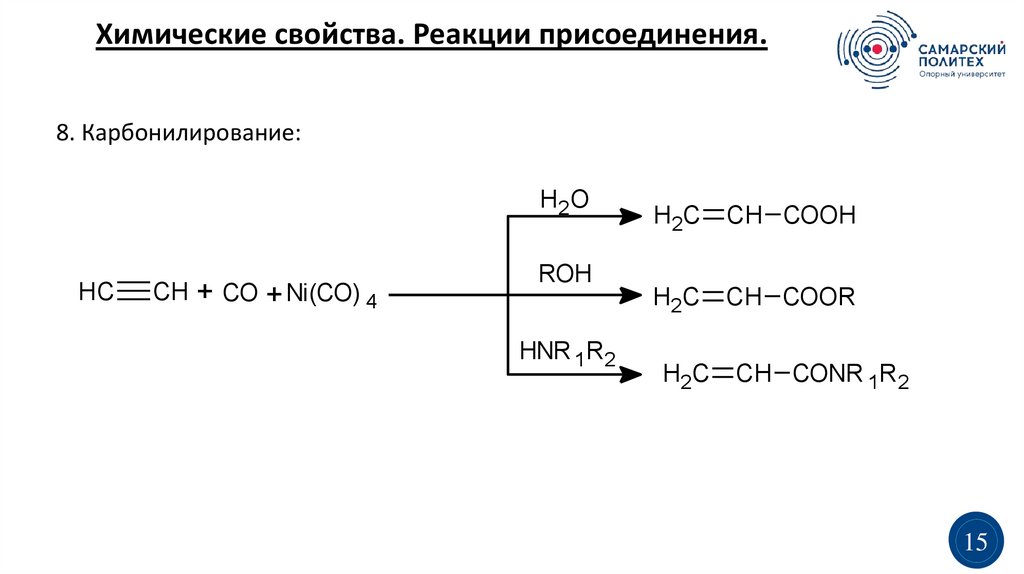
Химические свойства. Реакции присоединения.8. Карбонилирование:
H2O
HC
CH + CO + Ni(CO) 4
ROH
HNR 1R2
H2C CH COOH
H2C CH COOR
H2C CH CONR 1R2
15
3
19.
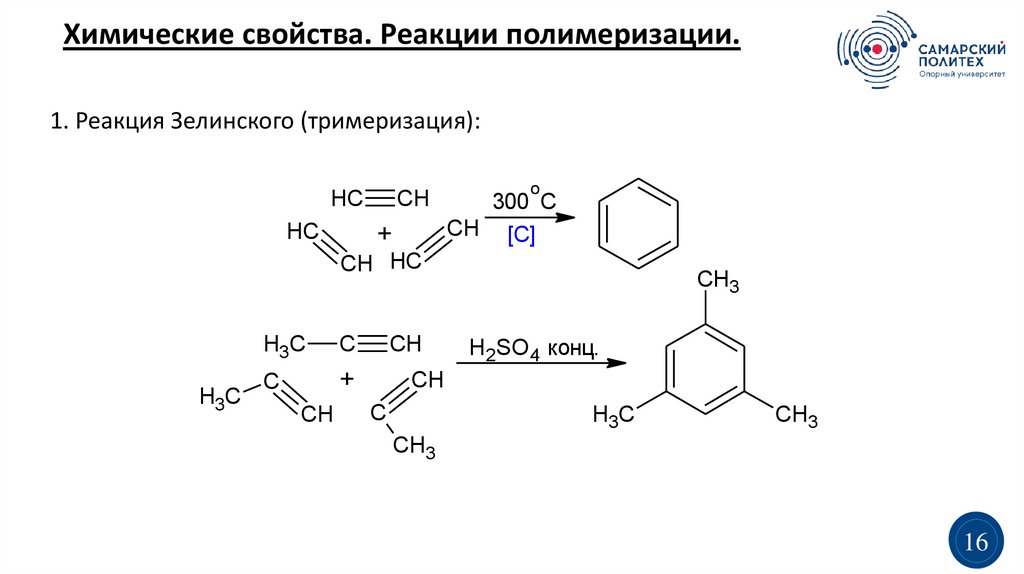
Химические свойства. Реакции полимеризации.1. Реакция Зелинского (тримеризация):
HC
HC
CH
+
o
300 C
CH [C]
CH HC
H3C
H3C
C
C
+
CH
CH
CH3
H2SO4 конц.
CH
C
H3C
CH3
CH3
16
3
20.
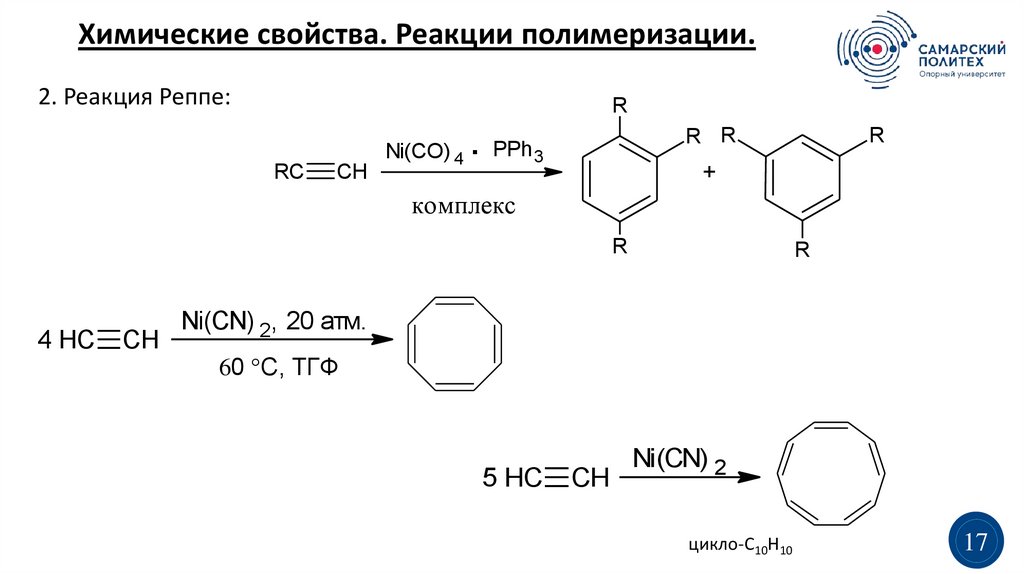
Химические свойства. Реакции полимеризации.2. Реакция Реппе:
R
RC
CH
Ni(CO) 4 .
R R
PPh 3
R
+
комплекс
R
4 HC
CH
R
Ni(CN) 2, 20 атм.
60 °C, ТГФ
5 HC
CH
Ni(CN) 2
цикло-С10H10
17
3
21.
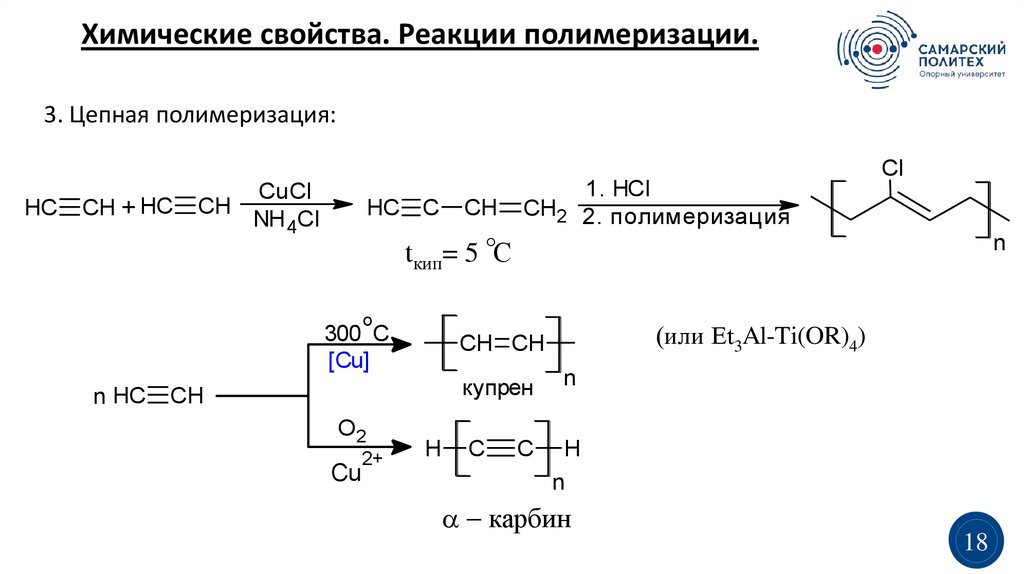
Химические свойства. Реакции полимеризации.3. Цепная полимеризация:
HC
CH + HC
CuCl
CH
NH 4Cl
HC C
CH
CH2
tкип= 5 С
n
o
300 C
[Cu]
n HC
купрен
O2
Cu
2+
(или Et3Al-Ti(OR)4)
CH CH
CH
H
C
1. HCl
2. полимеризация
Cl
C
n
H
n
карбин
18
3
22.
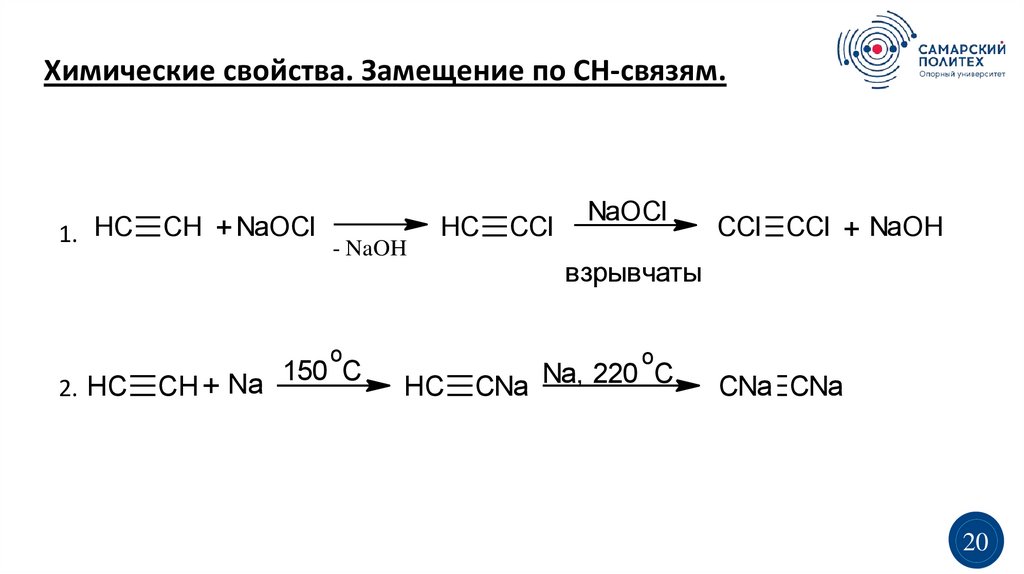
Химические свойства. Замещение по СН-связям.1. HC
CH + NaOCl
- NaOH
HC
o
2. HC
CH + Na
150 C
CCl
NaOCl
CCl CCl + NaOH
взрывчаты
o
HC
CNa Na, 220 C
CNa CNa
20
3
23.
Химические свойства. Замещение по СН-связям.3. HC
CH + 2 AgOH
2[Ag(NH3)2]OH + 4NH3
Ag
Ag
+ 2 H 2O
В реакции с [Cu(NH3)2]OH образуется красно-фиолетовый осадок,
с [Ag(NH3)2]OH — белый (качественная реакция на концевую тройную связь).
Ацетилениды тяжёлых металлов обладают сильнейшими взрывчатыми свойствами.
21
3
24.
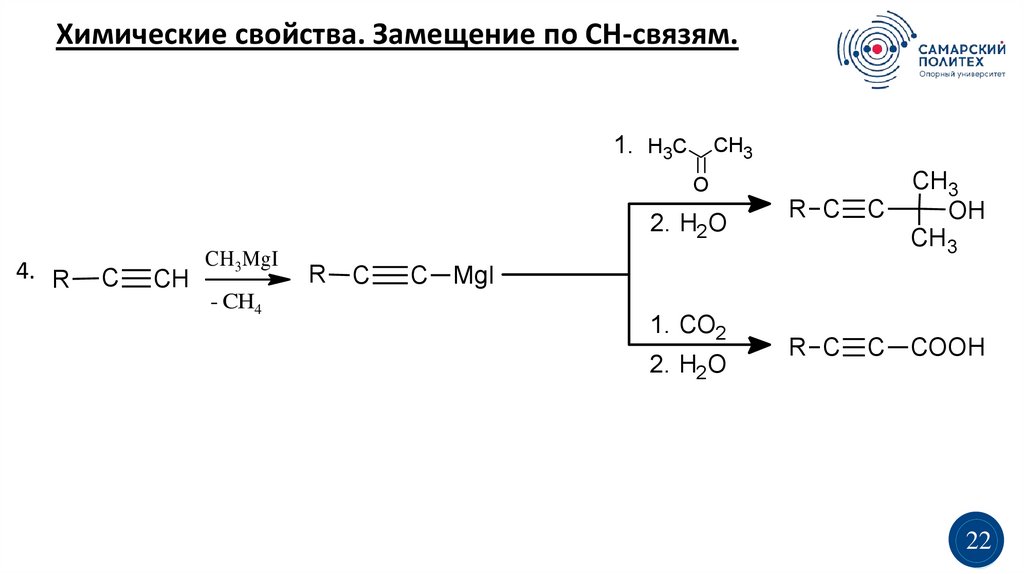
Химические свойства. Замещение по СН-связям.1. H3C
CH3
R C
CH3
C
OH
CH3
R C
C COOH
O
2. H2O
4. R
C
CH
CH 3MgI
- CH4
R
C
C MgI
1. CO2
2. H2O
22
3
25.
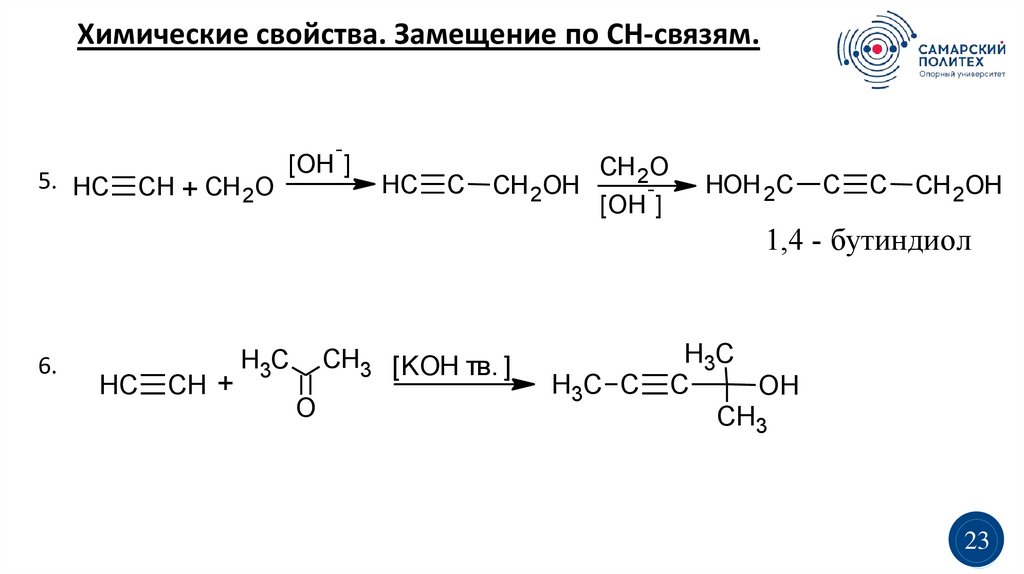
Химические свойства. Замещение по СН-связям.-
5. HC
CH + CH 2O
[OH ]
HC
C
CH 2O
CH 2OH
[OH ]
HOH 2C
C
C
CH 2OH
1,4 - бутиндиол
6.
HC
CH +
CH3 [KOH тв. ]
H3C
O
H3C C
H3C
C
OH
CH3
23
3
26.
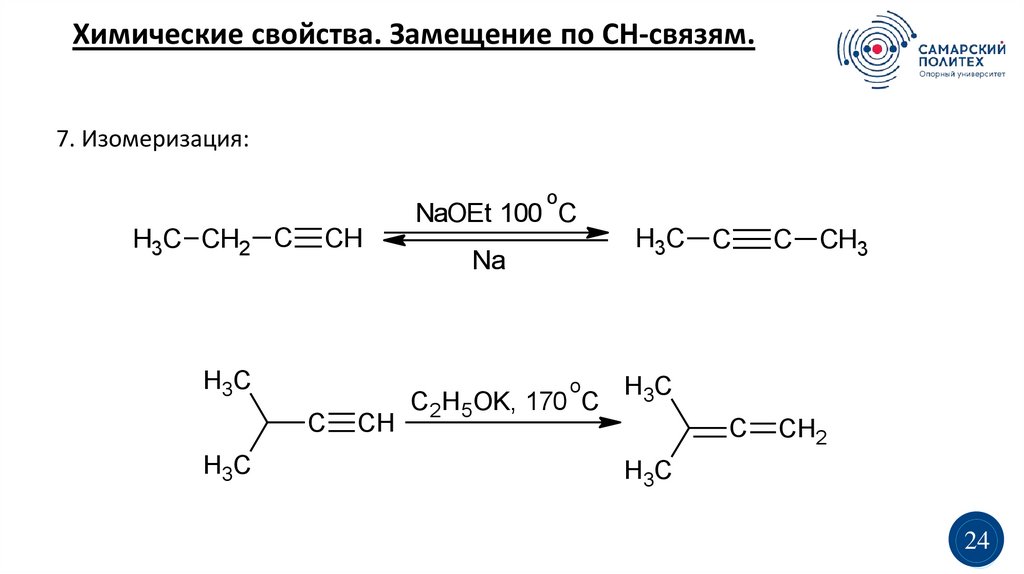
Химические свойства. Замещение по СН-связям.7. Изомеризация:
o
NaOEt 100 C
H3C CH2 C
CH
H3C
Na
o
C
H3C
H3C
CH
C2H5OK, 170 C
C
C
CH3
H3C
C
CH2
H3C
24
3
27.
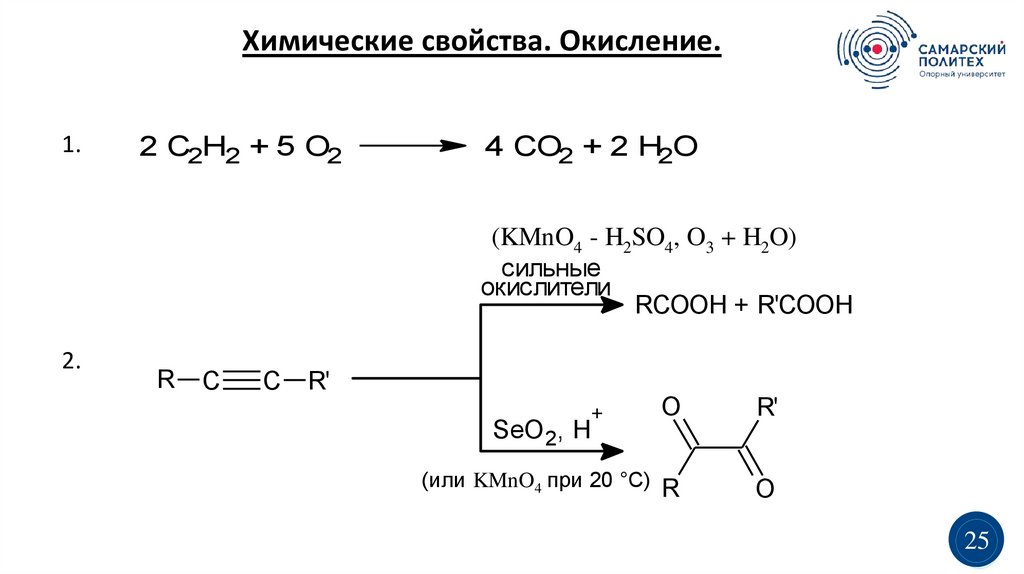
Химические свойства. Окисление.1.
2 C2H2 + 5 O2
4 CO2 + 2 H2O
(KMnO4 - H2SO4, O3 + H2O)
сильные
окислители
RCOOH + R'COOH
2.
R
C
C
R'
+
SeO 2, H
(или KMnO4 при 20 °C)
O
R'
R
O
25
3
28.
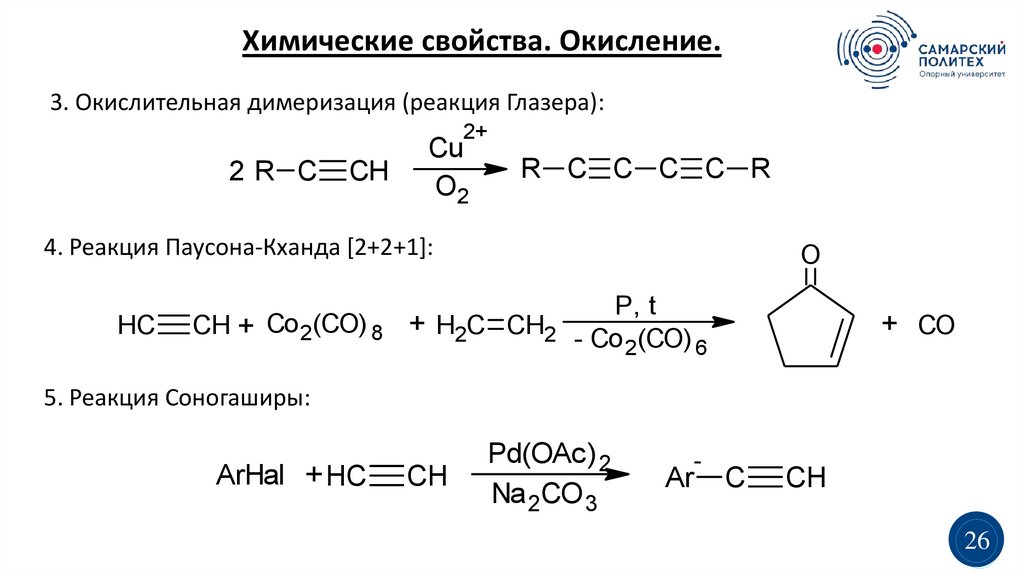
Химические свойства. Окисление.3. Окислительная димеризация (реакция Глазера):
2+
2R C
CH
Cu
O2
R C C C C R
4. Реакция Паусона-Кханда [2+2+1]:
HC
O
CH + Co 2(CO) 8 + H2C CH2
P, t
- Co 2(CO) 6
+ CO
5. Реакция Соногаширы:
ArHal + HC
CH
Pd(OAc) 2
Na 2CO 3
-
Ar
C
CH
26
3





 Химия
Химия








