Похожие презентации:
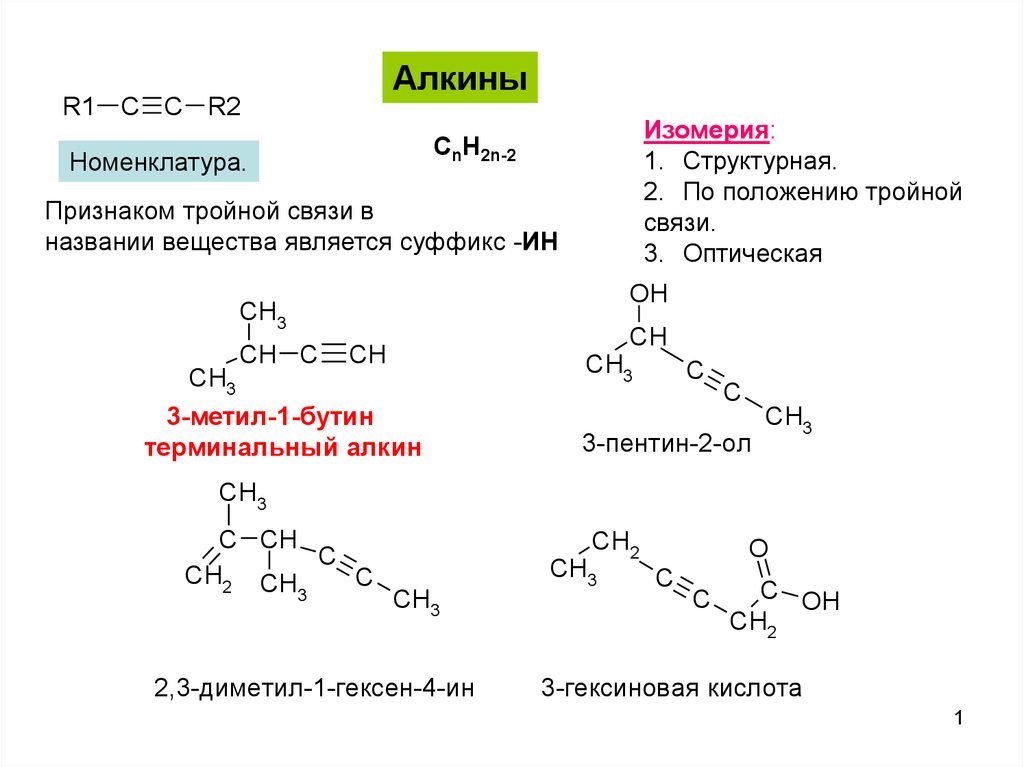
Алкины
1.
АлкиныR1 C C R2
Изомерия:
1. Структурная.
2. По положению тройной
связи.
3. Оптическая
CnH2n-2
Номенклатура.
Признаком тройной связи в
названии вещества является суффикс -ИН
OH
CH3
CH C
CH
CH
CH3
3-метил-1-бутин
терминальный алкин
CH3
C
C
3-пентин-2-ол
CH3
CH3
C CH
C
CH2 CH
C
3
CH2
CH3
2,3-диметил-1-гексен-4-ин
CH3
O
C
C
C OH
CH2
3-гексиновая кислота
1
2.
Способы получения алкиновСпособы получения ацетилена
Гидролиз карбида кальция
C 2HO
2000 OC
2
Ca
CaO + 3C
HC CH
C -Ca(OH)2
карбид кальция
Окислительный пиролиз метана
6 CH4 + 4O2
HC CH + 8 H2 + 3 CO + CO2 + 3 H2O
Методы синтеза более сложных алкинов
Алкилирование ацетиленид-иона и карбанионов терминальных алкинов
HC CH + NaNH2
HC C
+
Na
NH3 (ж)
+ CH3CH2 I
R1 C C
+ Br
+
HC C Na + NH3
Ацетиленид натрия
n-Alk
SN
HC C CH2 CH3 + NaI
1-Бутин
ГМФА или ДМСО
SN
R1 C C
n-Alk
2
3.
Дегидрогалогенирование вицинальных дигалогеналканов2 NaNH2, NH3 (ж)
H2C CH C2H5 + Br2
H C CH C 2H5
HC C C2H5
-2 NaBr , -2 NH3
CCl4 2
Br Br
1,2-Дибромбутан
1-Бутин
КОН, спирт, Т
HC C C2H5
H3C C C CH3
Дегидрогалогенирование геминальных дигалогеналканов
PCl5
H5C 2 C C 2H5
HC
-POCl3 5 2
O
2-Пентанон
Cl
NaNH2, NH3 (ж), эфир
C C 2 H5
-2 NaCl , -2 NH3
Cl
H5C 2 C C CH3
O PCl
NaNH2, NH3 (ж), эфир
5
H3C CH2 C
H3C CH2 CHCl2
H3C C CH
-POCl
,
-2 NaCl -2 NH3
H
3
Пропаналь
3
4.
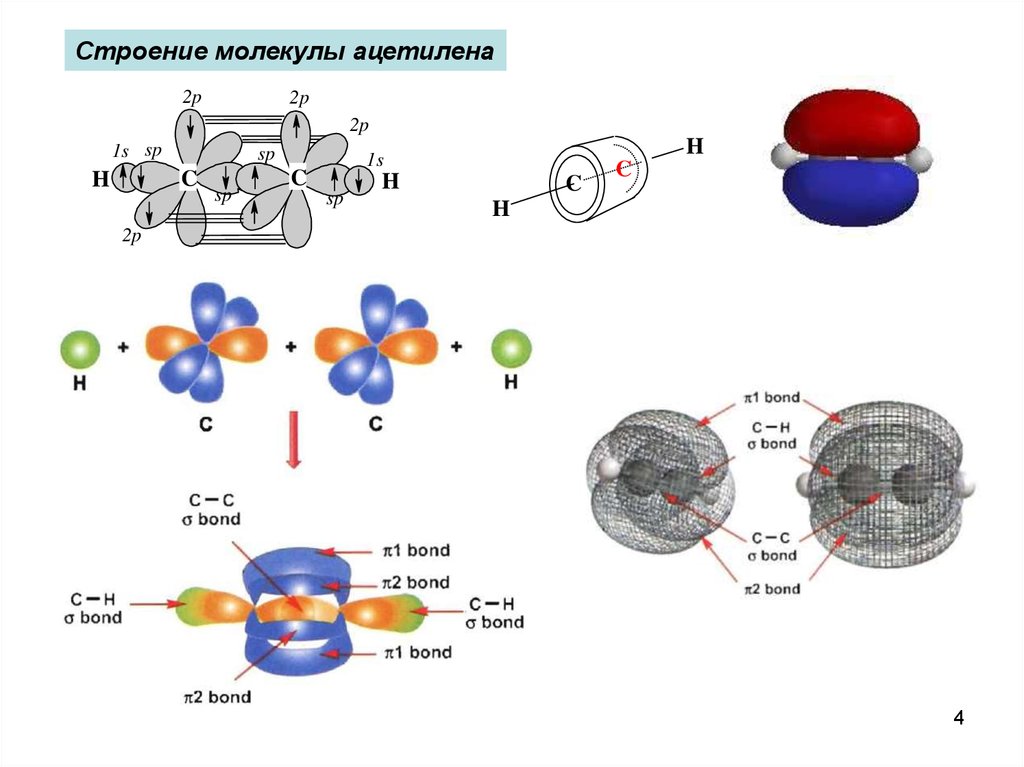
Строение молекулы ацетилена2p
2p
2p
1s sp
sp
C
H
sp
H
1s
C
sp
H
C
C
H
2p
4
5.
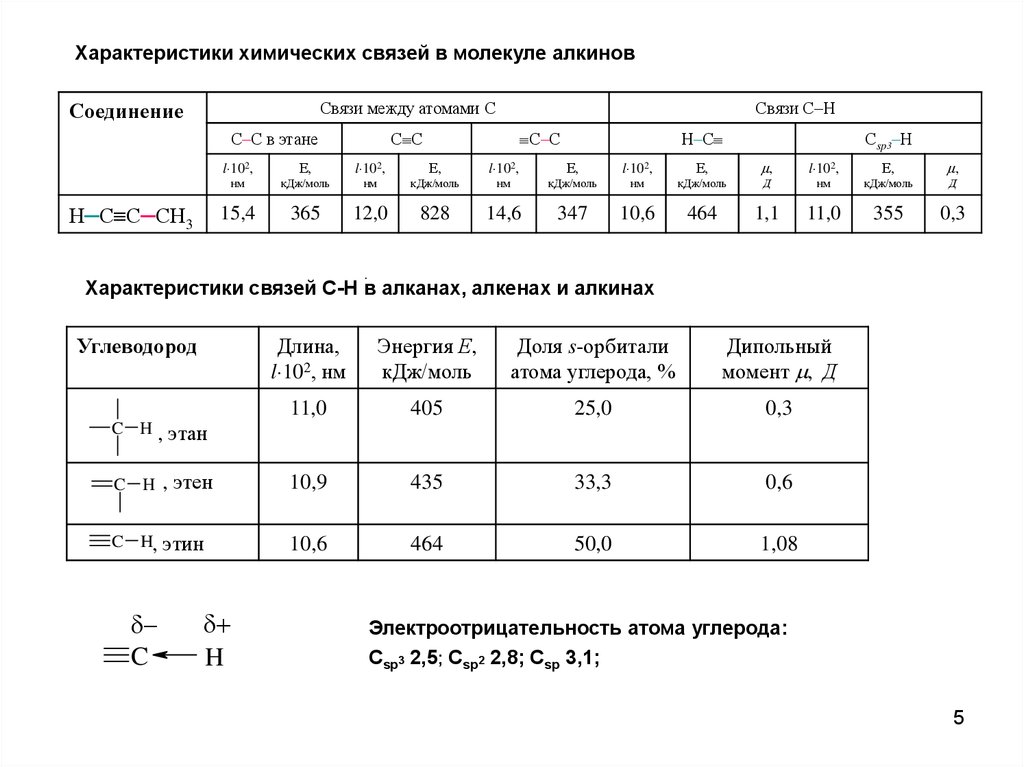
Характеристики химических связей в молекуле алкиновСвязи между атомами С
Соединение
С–С в этане
Н─С С─СН3
Связи С–Н
С–С
С С
Н–С
Сsp3–Н
l 102,
Е,
l 102,
Е,
l 102,
Е,
l 102,
Е,
,
l 102,
Е,
,
нм
кДж/моль
нм
кДж/моль
нм
кДж/моль
нм
кДж/моль
Д
нм
кДж/моль
Д
15,4
365
12,0
828
14,6
347
10,6
464
1,1
11,0
355
0,3
Характеристики связей С-Н в алканах, алкенах и алкинах
Углеводород
C H,
Длина,
l 102, нм
Энергия Е,
кДж/моль
Доля s-орбитали
атома углерода, %
Дипольный
момент , Д
11,0
405
25,0
0,3
этан
C H
, этен
10,9
435
33,3
0,6
C H,
этин
10,6
464
50,0
1,08
C
H
Электроотрицательность атома углерода:
Сsp3 2,5; Сsp2 2,8; Сsp 3,1;
5
6.
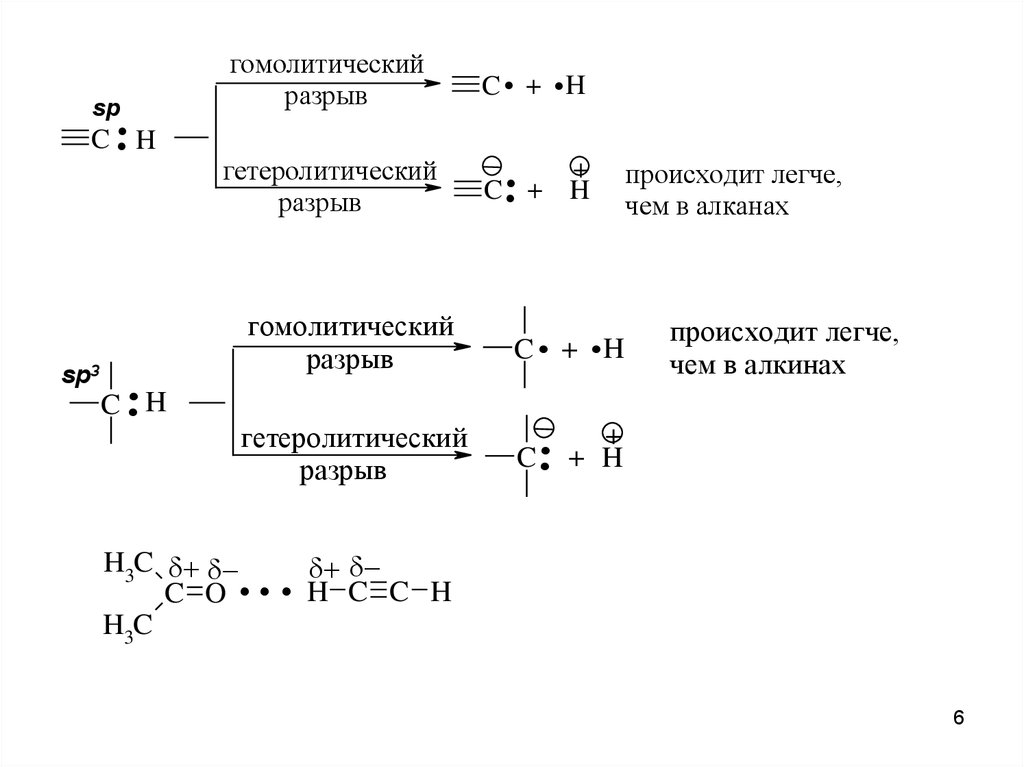
..sp
. .
гомолитический
разрыв
C + H
гетеролитический
разрыв
C .. +
C H
sp3
..
гомолитический
разрыв
C . + .H
гетеролитический
разрыв
C ..
C H
H3C
C O
H3C
+
H
. . . H C C
происходит легче,
чем в алканах
происходит легче,
чем в алкинах
+
+ H
H
6
7.
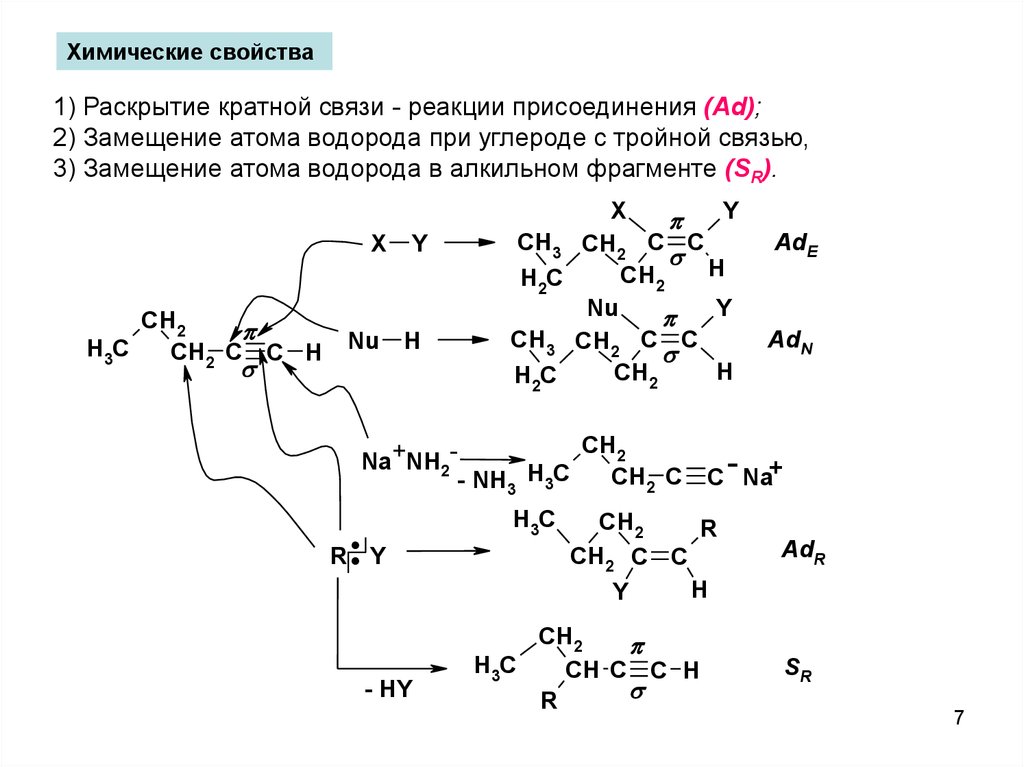
Химические свойства1) Раскрытие кратной связи - реакции присоединения (Ad);
2) Замещение атома водорода при углероде с тройной связью,
3) Замещение атома водорода в алкильном фрагменте (SR).
X
CH2
H3C
CH2 C C H
Y
Nu H
X
Y
CH3 CH2 C C
H
CH
H2C
2
Nu
Y
CH3 CH2 C C
H
CH
H2C
2
AdE
AdN
CH2
Na+NH2CH2 C C Na+
- NH3 H3C
H3C
:
R Y
- HY
CH2
R
CH2 C C
H
Y
CH2
H3C
CH C C H
R
AdR
SR
7
8.
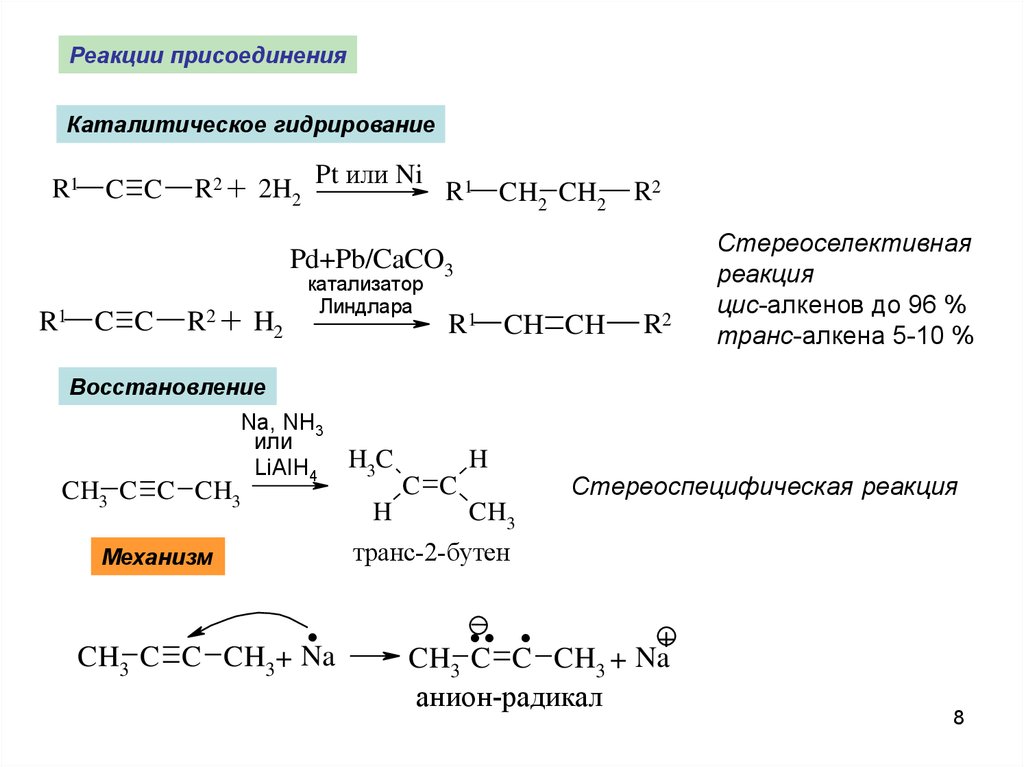
Реакции присоединенияКаталитическое гидрирование
R1 C C
R2 + 2H2
Pt или Ni
R1 CH2 CH2
R2
Pd+Pb/CaCO3
R1 C C
R2 + H2
катализатор
Линдлара
R1 CH CH
R2
Стереоселективная
реакция
цис-алкенов до 96 %
транс-алкена 5-10 %
Восстановление
Na, NH3
или
LiAlH4
CH3 C C CH3
H3C
H
H
C C
Стереоспецифическая реакция
CH3
транс-2-бутен
Механизм
.
CH3 C C CH3+ Na
.. .
+
CH3 C C CH3 + Na
анион-радикал
8
9.
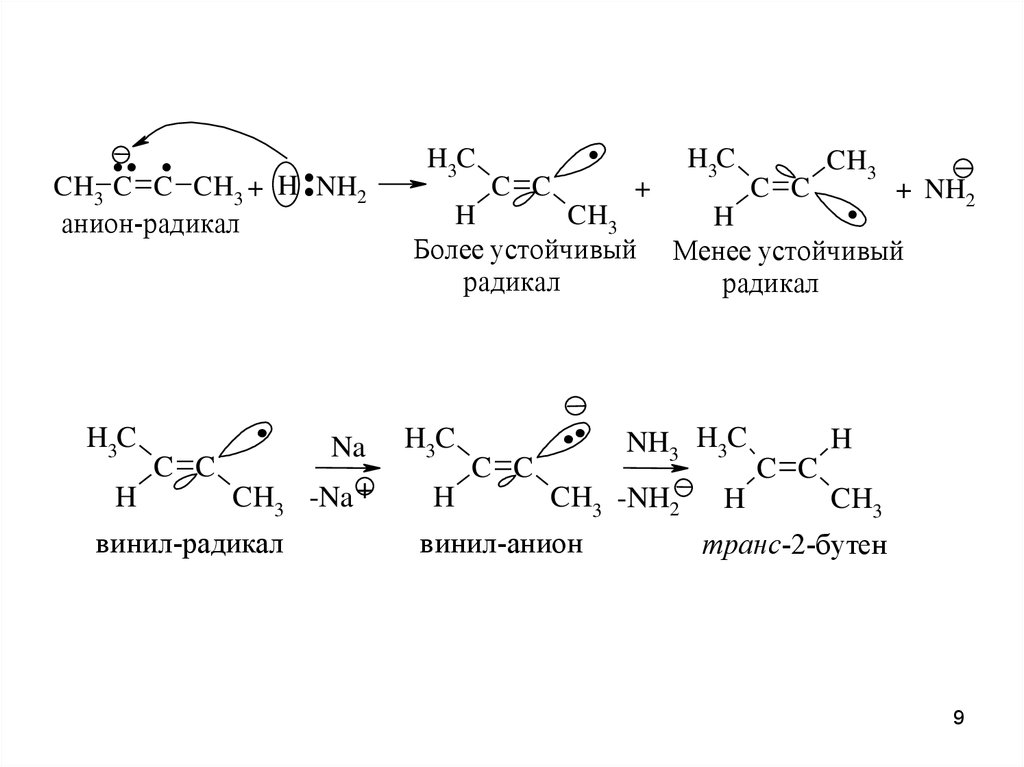
.. ...
CH3 C C CH3 + H NH2
анион-радикал
H3C
H
.
C C
CH3
винил-радикал
Na
-Na +
H3C
.
C C
+
H
CH3
Более устойчивый
радикал
H3C
H
C C
H3C
..
.
+ NH2
H
Менее устойчивый
радикал
NH3 H3C
CH3 -NH2
винил-анион
C C
CH3
H
H
C C
CH3
транс-2-бутен
9
10.
Стереоспецифическое восстановление алкинов до цис-алкеновR C C R
+
CH3 CH
CH2
Al H
толуол, 0 О-(-10 О)С, N2
2
CH3
ди-изо-бутилалюминийгидрид
(ДИБАЛ)
H
Al CH2 CH CH3
R
R
CH3
H
2 C2H5OH или CH3OH, -10 OC
H
R
R
цис-изомер
Реакции электрофильного присоединения (AdE)
Галогенирование (Cl2, Br2)
H3C C C CH3 + Br2
эфир, -20 ОС H3C
Br
Br
C C
CH3
транс-2,3-дибром-2-бутен
+ Br2
1-гексен-5-ин
CCl4, -20
Br
ОС
97%
Br
5,6-дибром-1-гексин
В реакциях присоединения
галогенов, сульфенхлоридов,
селенилхлоридов к незамещенным алкенам и алкинам,
алкены более активны.
10
11.
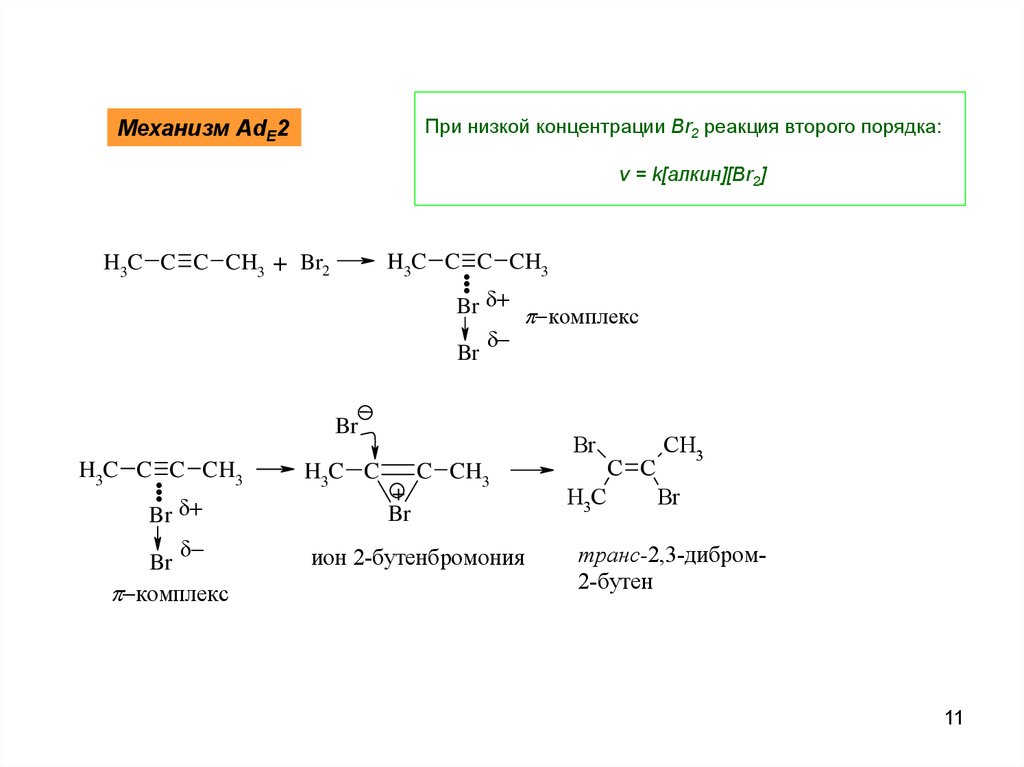
При низкой концентрации Br2 реакция второго порядка:Механизм AdE2
v = k[алкин][Br2]
H3C C . C CH3
H3C C C CH3 + Br2
..
Br комплекс
Br
Br
H3C C . C CH3
..
Br
Br
комплекс
H3C C
Br
+
Br
C CH3
ион 2-бутенбромония
H3C
C C
CH3
Br
транс-2,3-дибром2-бутен
11
12.
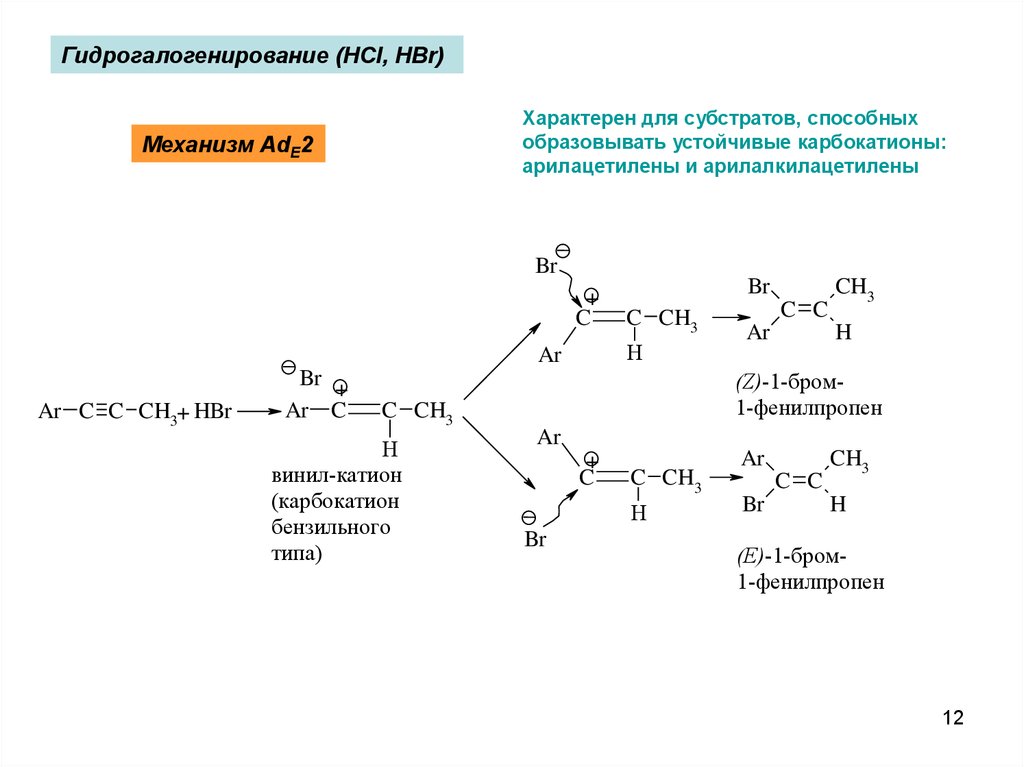
Гидрогалогенирование (HCl, HBr)Характерен для субстратов, способных
образовывать устойчивые карбокатионы:
арилацетилены и арилалкилацетилены
Механизм AdE2
Br
+
C
Ar C C CH3+ HBr
C CH3
H
Ar
Br +
Ar C
Br
Ar
H
(Z)-1-бром1-фенилпропен
C CH3
H
винил-катион
(карбокатион
бензильного
типа)
C C
CH3
Ar
+
C
C CH3
H
Br
Ar
C C
Br
CH3
H
(E)-1-бром1-фенилпропен
12
13.
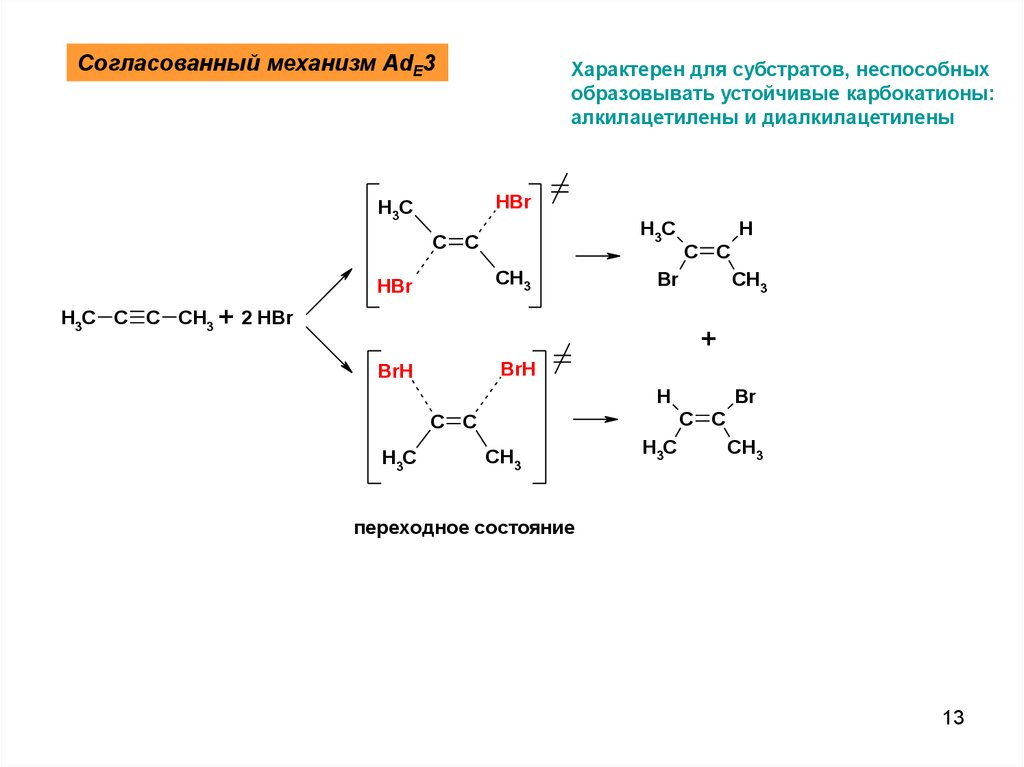
Согласованный механизм AdE3Характерен для субстратов, неспособных
образовывать устойчивые карбокатионы:
алкилацетилены и диалкилацетилены
HBr
H3C
H3C
C C
CH3
HBr
H
C C
Br
H3C C C CH3 + 2 HBr
CH3
+
BrH
BrH
Br
H
C C
C C
H3C
CH3
H3C
CH3
переходное состояние
13
14.
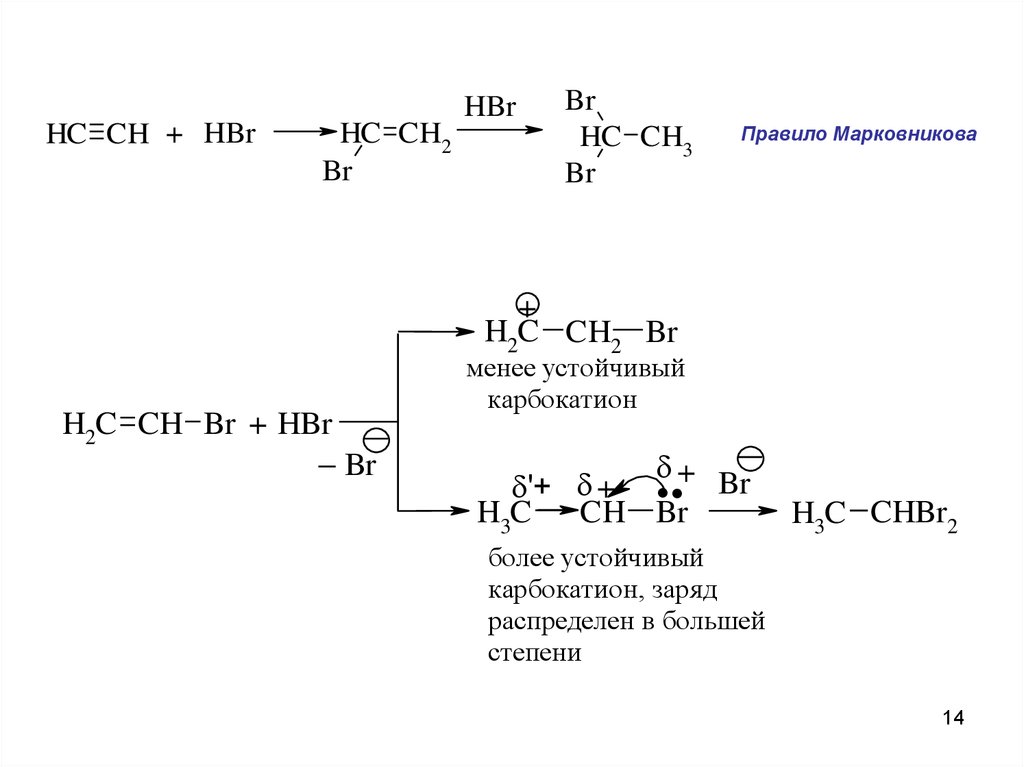
HBrHC CH + HBr
HC CH2
Br
Br
HC CH3
Br
Правило Марковникова
+
H2C CH2 Br
менее устойчивый
карбокатион
H2C CH Br + HBr
Br
..
+ Br
'+ +
H3C CH Br
H3C CHBr2
более устойчивый
карбокатион, заря д
распределен в большей
степени
14
15.
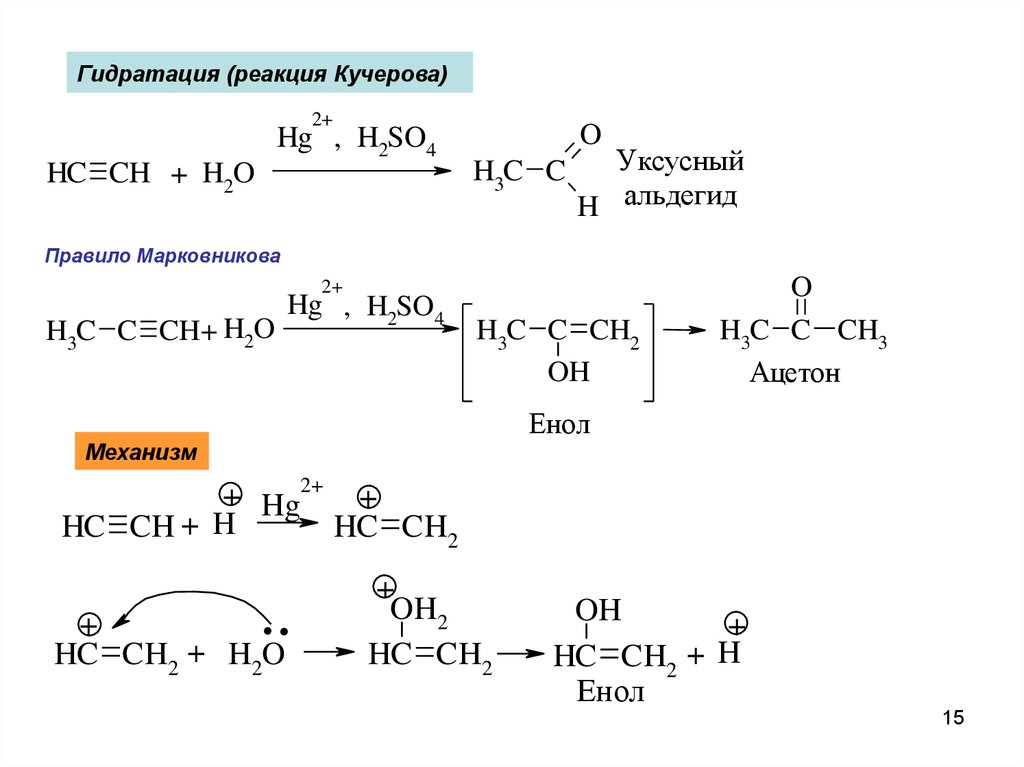
Гидратация (реакция Кучерова)2+
Hg , H2SO4
HC CH + H2O
O
H3C C
Уксусный
H альдегид
Правило Марковникова
2+
H3C C CH+ H2O
Hg , H2SO4
H3C C CH2
OH
O
H3C C CH3
Ацетон
Енол
Механизм
+ Hg2+ +
HC CH2
HC CH + H
..
+
HC CH2 + H2O
+
OH2
HC CH2
OH
+
HC CH2 + H
Енол
15
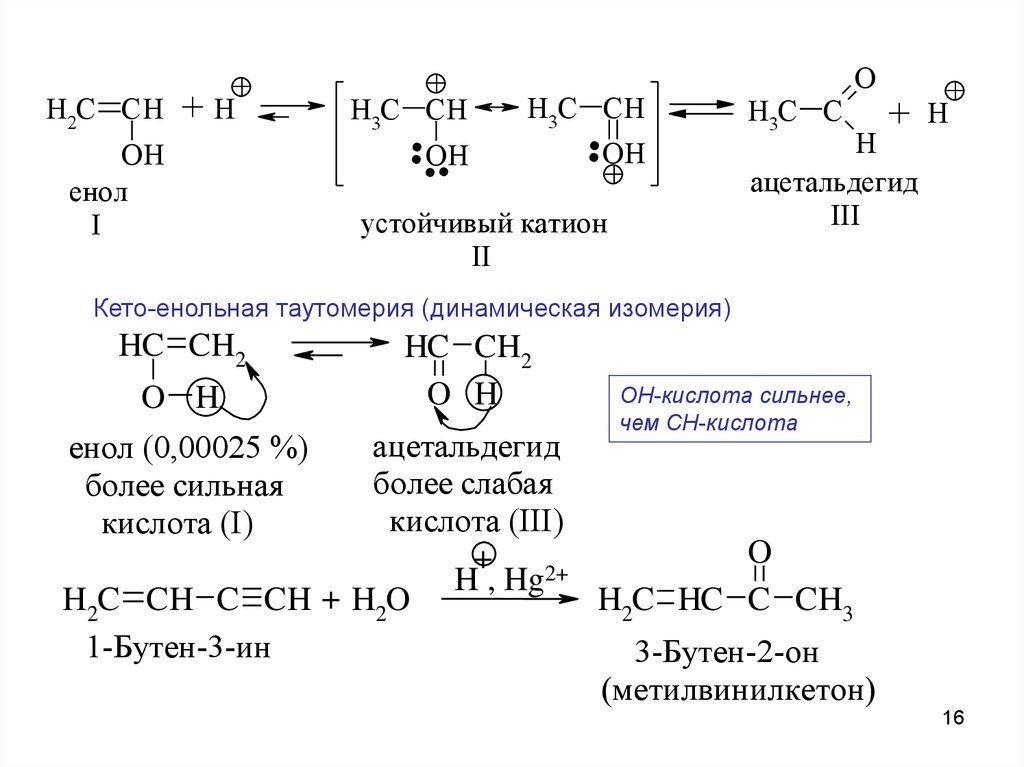
16.
H2C CH+
+H
OH
енол
I
+
...
.+
H3C CH
H3C CH
OH
OH
устойчивый катион
II
H3C C
O
+
H
ацетальдегид
III
+
H
Кето-енольная таутомерия (динамическая изомерия)
HC CH2
O H
HC CH2
O H
OH-кислота сильнее,
чем CH-кислота
ацетальдегид
более слабая
кислота (III)
O
+
H , Hg2+
H2C CH C CH + H2O
H2C HC C CH3
1-Бутен-3-ин
3-Бутен-2-он
(метилвинилкетон)
енол (0,00025 %)
более сильная
кислота (I)
16
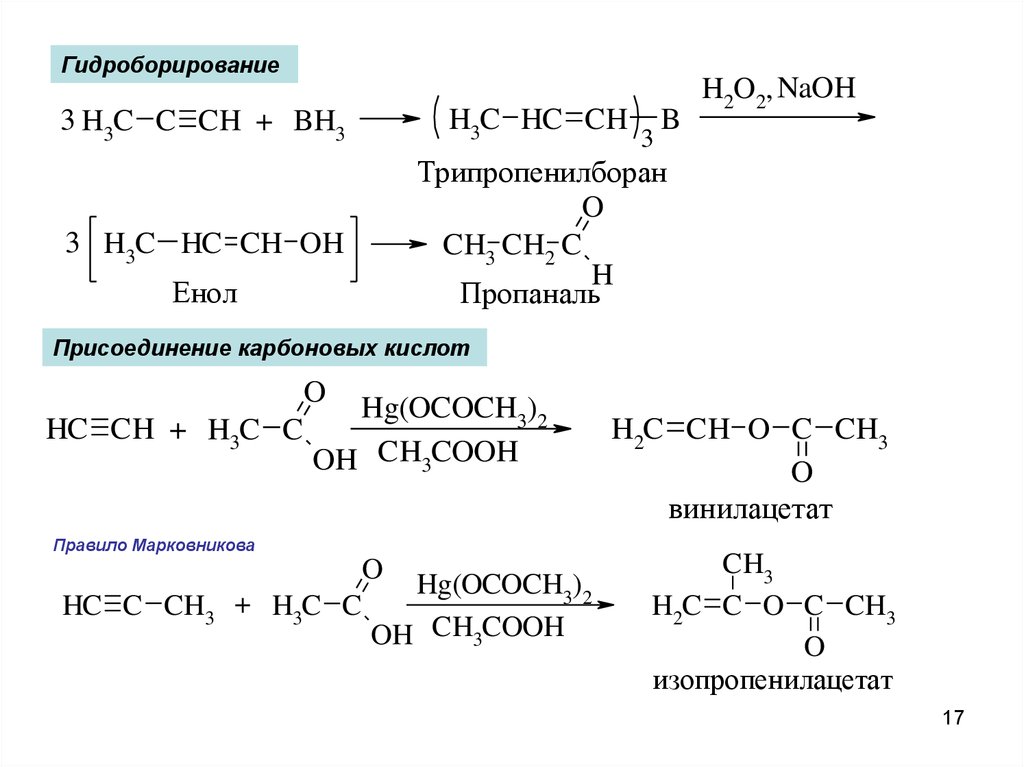
17.
ГидроборированиеH3C HC CH
3 H3C C CH + BH3
3
B
H2O2, NaOH
Трипропенилборан
O
CH3 CH2 C
H
Пропаналь
3 H3C HC CH OH
Енол
Присоединение карбоновых кислот
O
Hg(OCOCH3)2
HC CH + H3C C
OH CH3COOH
Правило Марковникова
O
HC C CH3 + H3C C
Hg(OCOCH3)2
OH CH3COOH
H2C CH O C CH3
O
винилацетат
CH3
H2C C O C CH3
O
изопропенилацетат
17
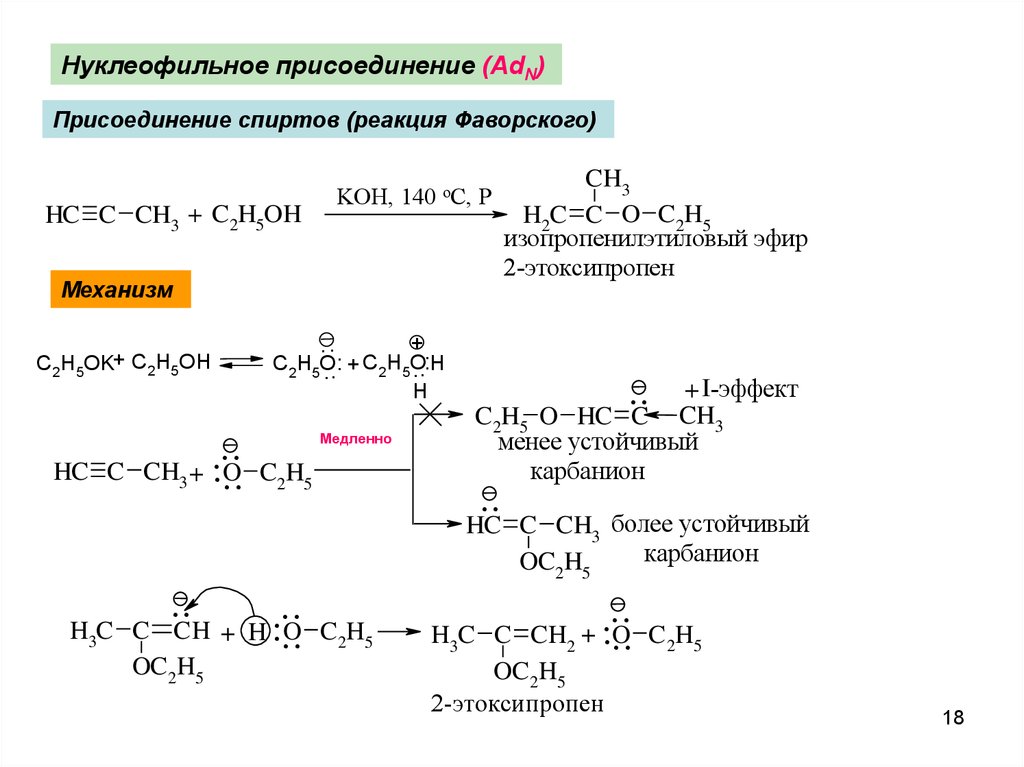
18.
Нуклеофильное присоединение (AdN)Присоединение спиртов (реакция Фаворского)
HC C CH3 + C2H5OH
KOH, 140 oC, P
Механизм
+.
. ..
C2H5O.
.. H
.. + C2H5O.
H
C2H5OK+ C2H5OH
HC C
..
.
CH + ...
O
3
.CH
.
H3C C
OC 2H5
Медленно
C2H5
..
.
O
+ H ...
..C
+ I-эффект
CH3
C2H5 O HC
менее устойчивый
карбанион
..
HC
C 2H5
CH3
H2C C O C2H5
изопропенилэтиловый эфир
2-этоксипропен
C CH3 более устойчивый
карбанион
OC2H5
......
H3C C CH2 + O C 2H5
OC 2H5
2-этоксипропен
18
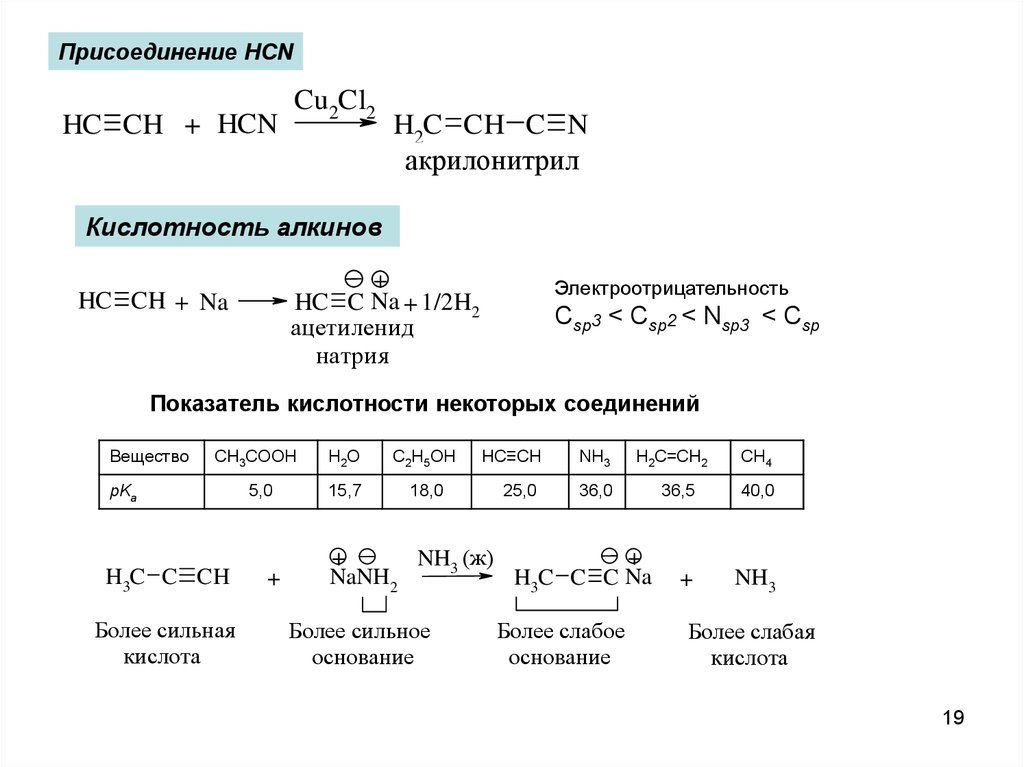
19.
Присоединение HCNHC CH + HCN
Cu2Cl2
H2C CH C N
акрилонитрил
Кислотность алкинов
+
HC C Na + 1/2H2
ацетиленид
натрия
HC CH + Na
Электроотрицательность
Csp3 < Csp2 < Nsp3 < Csp
Показатель кислотности некоторых соединений
Вещество
CH3COOH
H2O
C2H5OH
5,0
15,7
18,0
pKa
H3C C CH
Более сильная
кислота
+
+
NaNH2
HC≡CH
NH3
25,0
36,0
NH3 (ж)
Более сильное
основание
H2C=CH2
+
H3C C C Na
Более слабое
основание
CH4
36,5
40,0
+
NH3
Более слабая
кислота
19
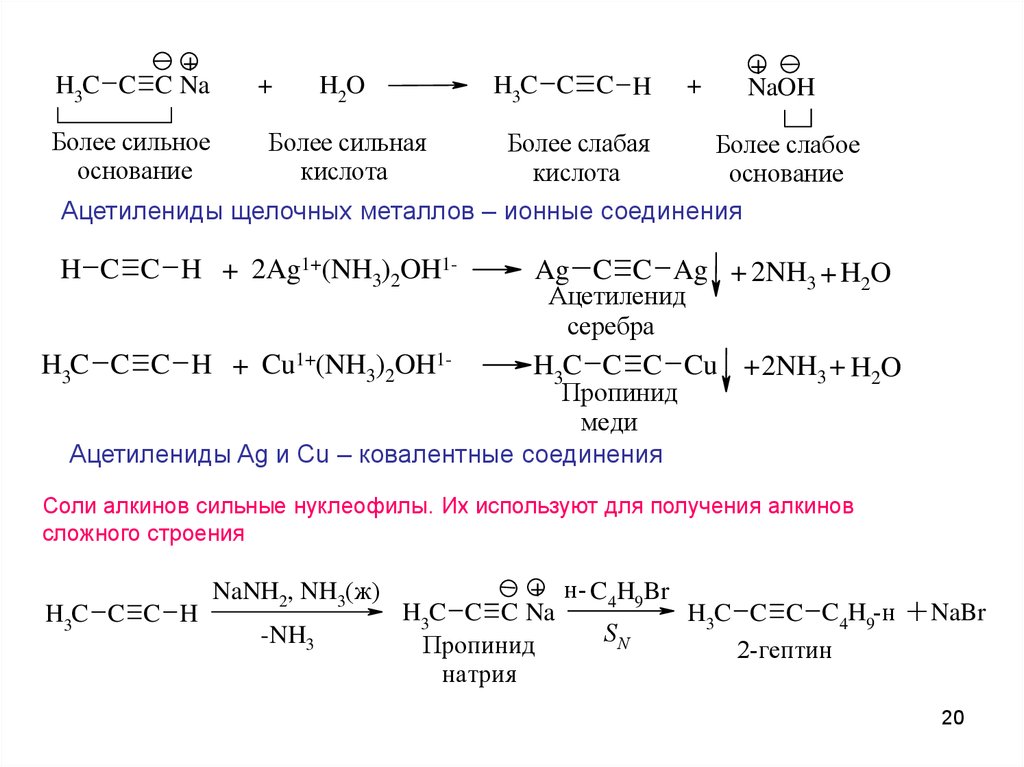
20.
+H3C C C Na
Более сильное
основание
+
H2O
H3C C C H
+
+
NaOH
Более сильная
кислота
Более слабая
Более слабое
кислота
основание
Ацетилениды щелочных металлов – ионные соединения
H C C H + 2Ag1+(NH3)2OH1H3C C C H + Cu1+(NH3)2OH1-
Ag C C Ag + 2NH3 + H2O
Ацетиленид
серебра
H3C C C Cu + 2NH3 + H2O
Пропинид
меди
Ацетилениды Ag и Cu – ковалентные соединения
Соли алкинов сильные нуклеофилы. Их используют для получения алкинов
сложного строения
H3C C C H
NaNH2, NH3(ж)
-NH3
+ н- C4H9Br
H3C C C Na
H3C C C C4H9-н
SN
Пропинид
2-гептин
натрия
+ NaBr
20
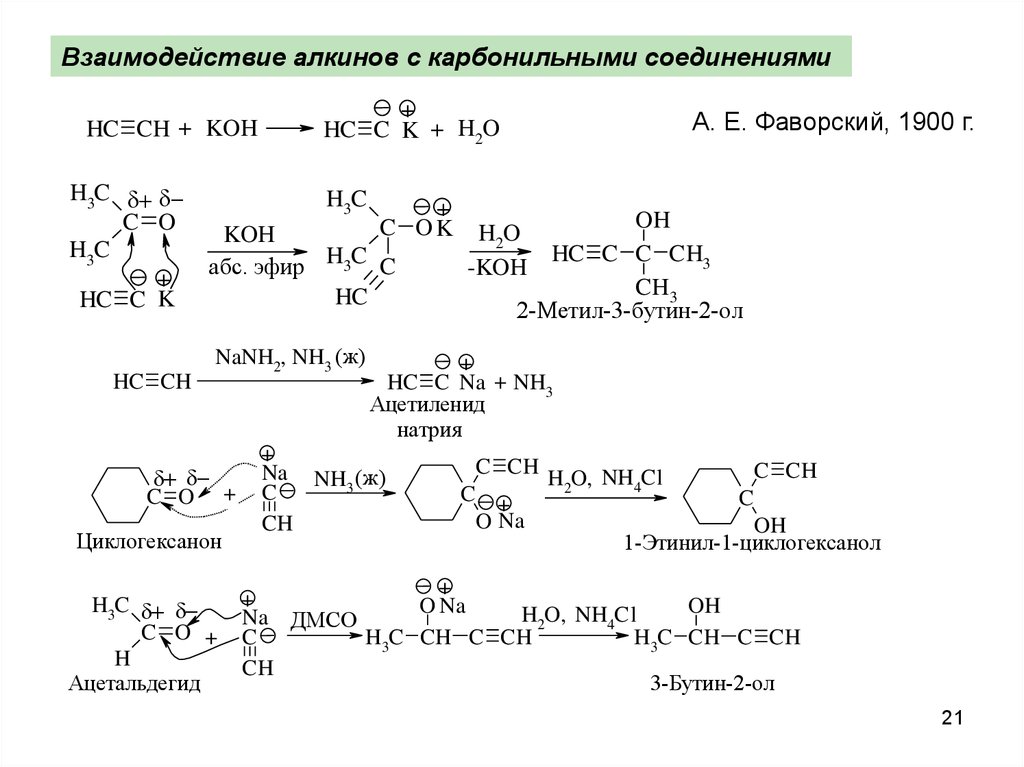
21.
Взаимодействие алкинов с карбонильными соединениямиHC CH + KOH
H3C
C O
H3C
+
HC C K
HC CH
+
HC C K + H2O
H3C
+
C OK
KOH
абс. эфир H3C C
HC
NaNH2, NH3 (ж)
C O +
Циклогексанон
H3C
C O +
H
Ацетальдегид
А. Е. Фаворский, 1900 г.
OH
HC C C CH3
CH3
2-Метил-3-бутин-2-ол
H2O
-KOH
+
HC C Na + NH3
Ацетиленид
натрия
+
Na NH (ж)
3
C
CH
C CH
C
+
O Na
H2O, NH4Cl
C CH
C
OH
1-Этинил-1-циклогексанол
+
+
O Na
OH
H2O, NH4Cl
Na ДМСО
H3C CH C CH
C
H3C CH C CH
CH
3-Бутин-2-ол
21
22.
Синтез 1,3-бутадиена (В.Реппе, 1925 г.).H2C O, Cu2C2, P
HC C H Cu2C2, P HC C
HO CH2 C C CH2 OH
1,4-Бутиндиол
CH2 OH
H2C O
Прпаргиловый
спирт
HO CH2 C C CH2 OH
1,4-Бутиндиол
H2, Ni
HO CH2 CH2 CH2 CH2 OH
1,4-Бутандиол
H3PO4/SiO2
H2C CH HC CH2
1,3-Бутадиен
22
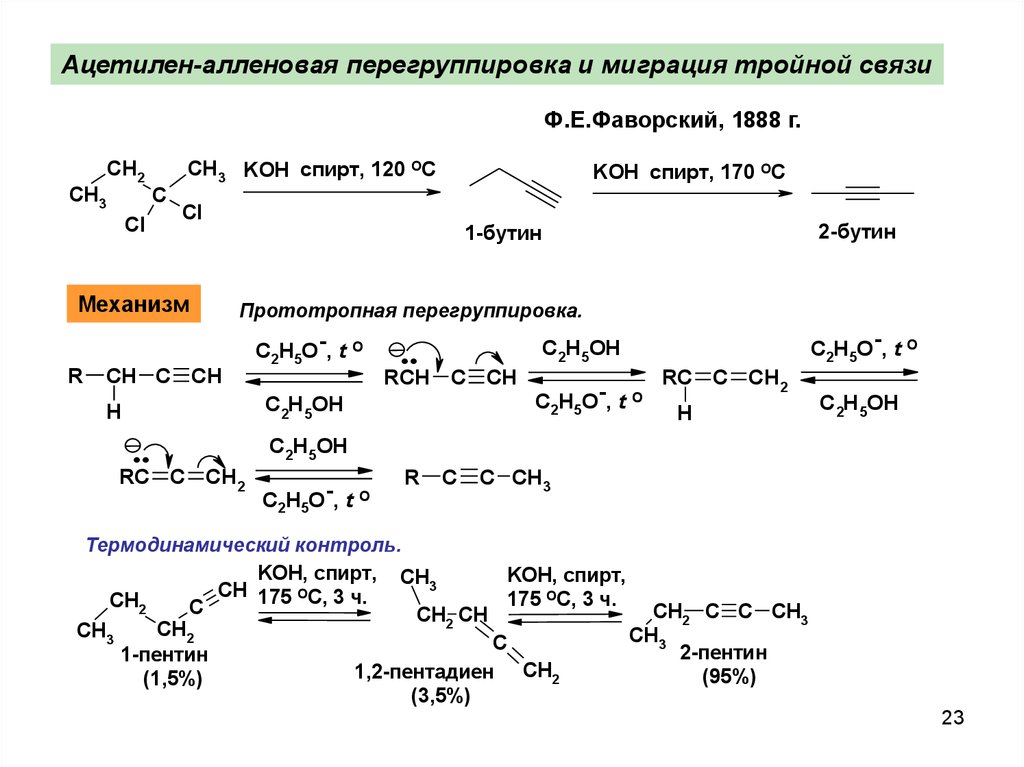
23.
Ацетилен-алленовая перегруппировка и миграция тройной связиФ.Е.Фаворский, 1888 г.
CH3
CH2
Cl
C
CH3 KOH спирт, 120 ОС
Cl
Механизм
R
KOH спирт, 170 ОС
Прототропная перeгpуппировка.
CH C CH
C2H5O-, t O
..
C2H5OH
RCH C CH
C2H5OH
H
..
2-бутин
1-бутин
RC C CH2
C2H5O-, t O
RC C CH2
H
C2H5O-, t O
C2H5OH
C2H5OH
C2H5O-, t O
R
C
C CH3
Термодинамический контроль.
KOH, спирт, CH
KOH, спирт,
3
CH
О
175 С, 3 ч.
175 ОС, 3 ч.
CH2
C
CH2 C C CH3
CH2 CH
CH2
CH3
CH3
C
2-пентин
1-пентин
CH
1,2-пентадиен
(95%)
2
(1,5%)
(3,5%)
23
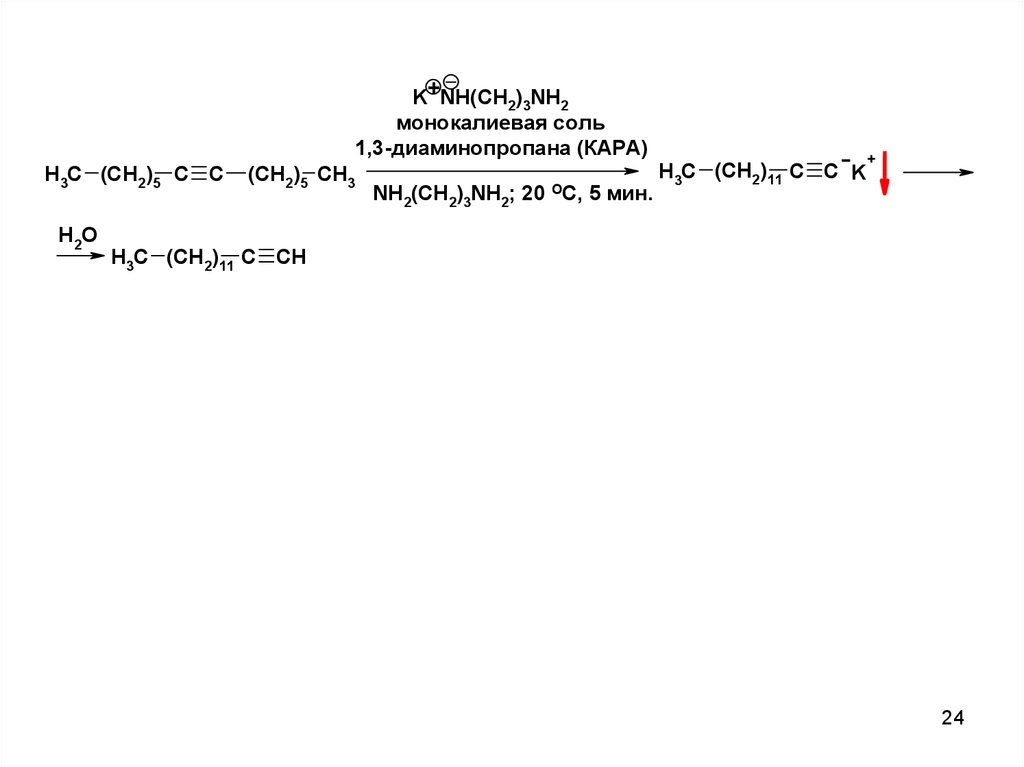
24.
K+NH(CH2)3NH2монокалиевая соль
1,3-диаминопропана (КАРА)
H3C (CH2)5 C C
H2O
(CH2)5 CH3
NH2(CH2)3NH2; 20 ОС, 5 мин.
H3C (CH2)11 C C K
+
H3C (CH2)11 C CH
24
25.
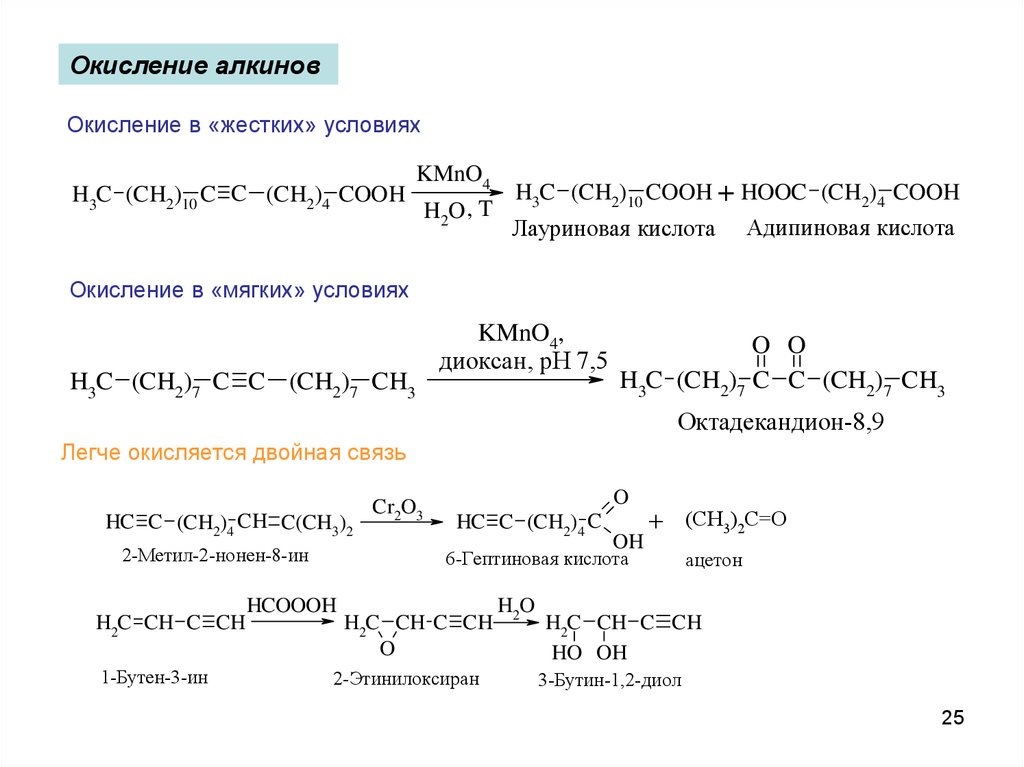
Окисление алкиновОкисление в «жестких» условиях
H3C (CH2)10 C C (CH2)4 COOH
KMnO4
H3C (CH2)10 COOH + HOOC (CH2)4 COOH
H2O , T
Лауриновая кислота Адипиновая кислота
Окисление в «мягких» условиях
H3C (CH2)7 C C (CH2)7 CH3
KMnO4,
диоксан, рН 7,5
O O
H3C (CH2)7 C C (CH2)7 CH3
Октадекандион-8,9
Легче окисляется двойная связь
HC C (CH2)4 CH C(CH3)2
2-Метил-2-нонен-8-ин
H2C CH C CH
1-Бутен-3-ин
Cr2O3
O
HC C (CH2)4 C
OH
+ (CH3)2C=O
6-Гептиновая кислота
HCOOOH
H2C CH C CH
O
2-Этинилоксиран
H2O
ацетон
H2C CH C CH
HO OH
3-Бутин-1,2-диол
25
26.
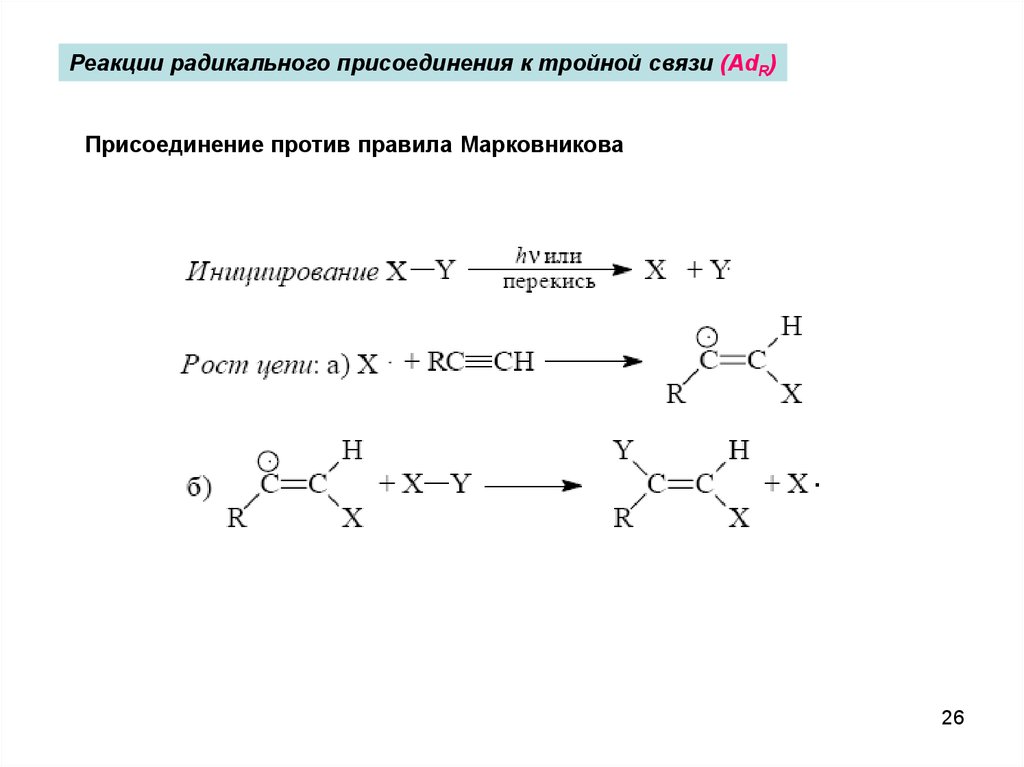
Реакции радикального присоединения к тройной связи (AdR)Присоединение против правила Марковникова
.
26
27.
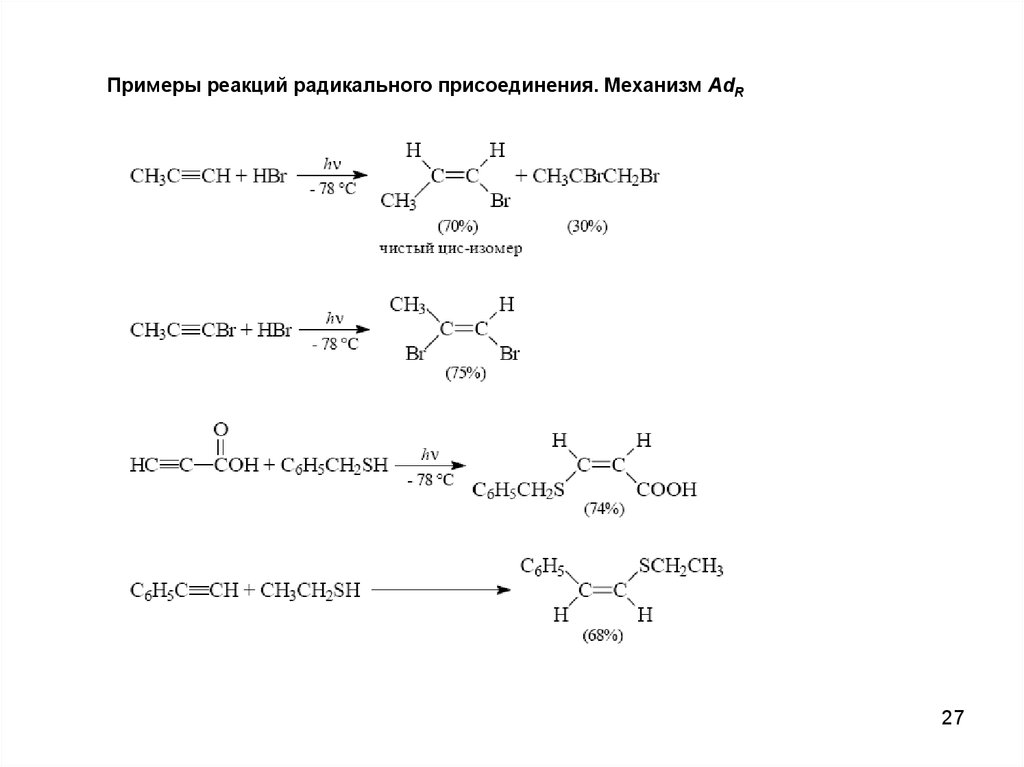
Примеры реакций радикального присоединения. Механизм AdR27
28.
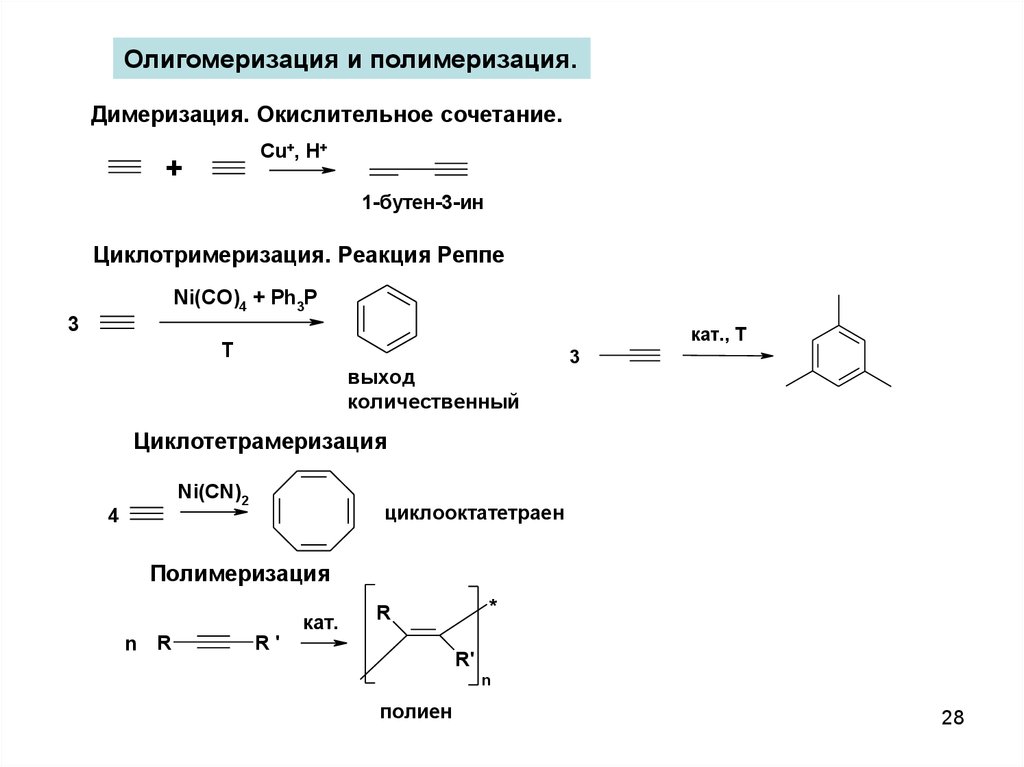
Олигомеризация и полимеризация.Димеризация. Окислительное сочетание.
Cu+, H+
+
1-бутен-3-ин
Циклотримеризация. Реакция Реппе
Ni(CO)4 + Ph3P
3
кат., Т
T
выход
количественный
3
Циклотетрамеризация
Ni(CN)2
4
циклооктатетраен
Полимеризация
n
R
R'
кат.
*
R
R'
n
полиен
28




 Химия
Химия








