Похожие презентации:
Обратимые и необратимые химические реакции. Химическое равновесие
1.
Обратимые и необратимыехимические реакции.
Химическое равновесие.
2.
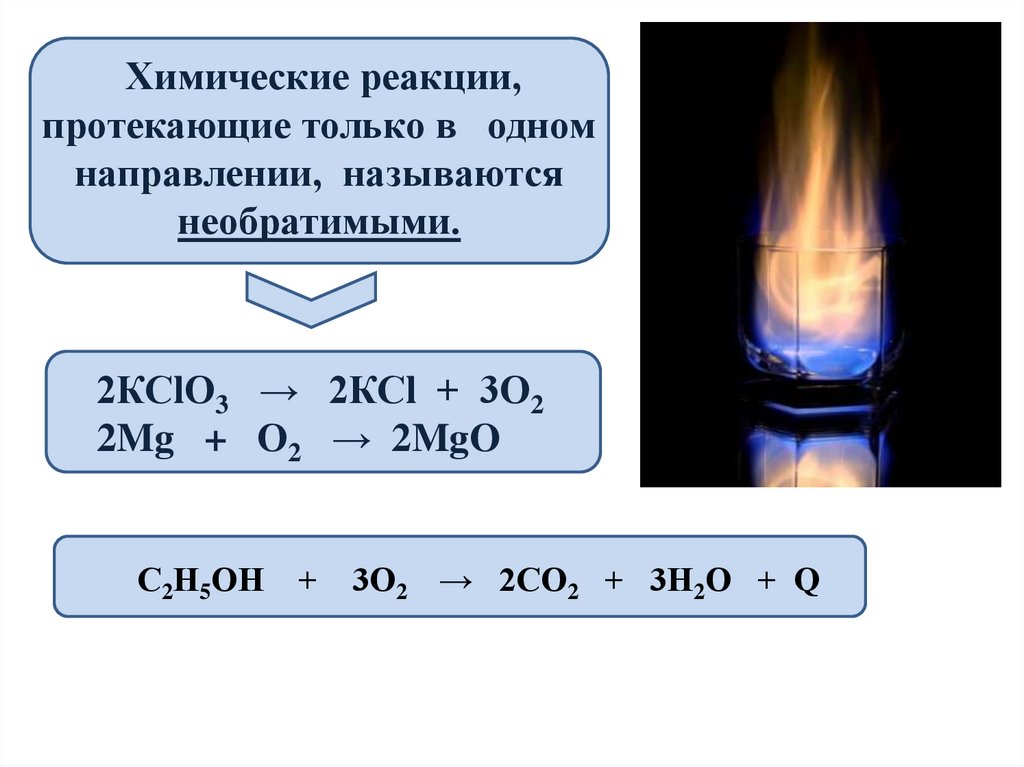
Химические реакции,протекающие только в одном
направлении, называются
необратимыми.
2КСlО3 → 2КСl + 3О2
2Mg + О2 → 2MgO
С2Н5ОН + 3О2 → 2СО2 + 3Н2О + Ԛ
3.
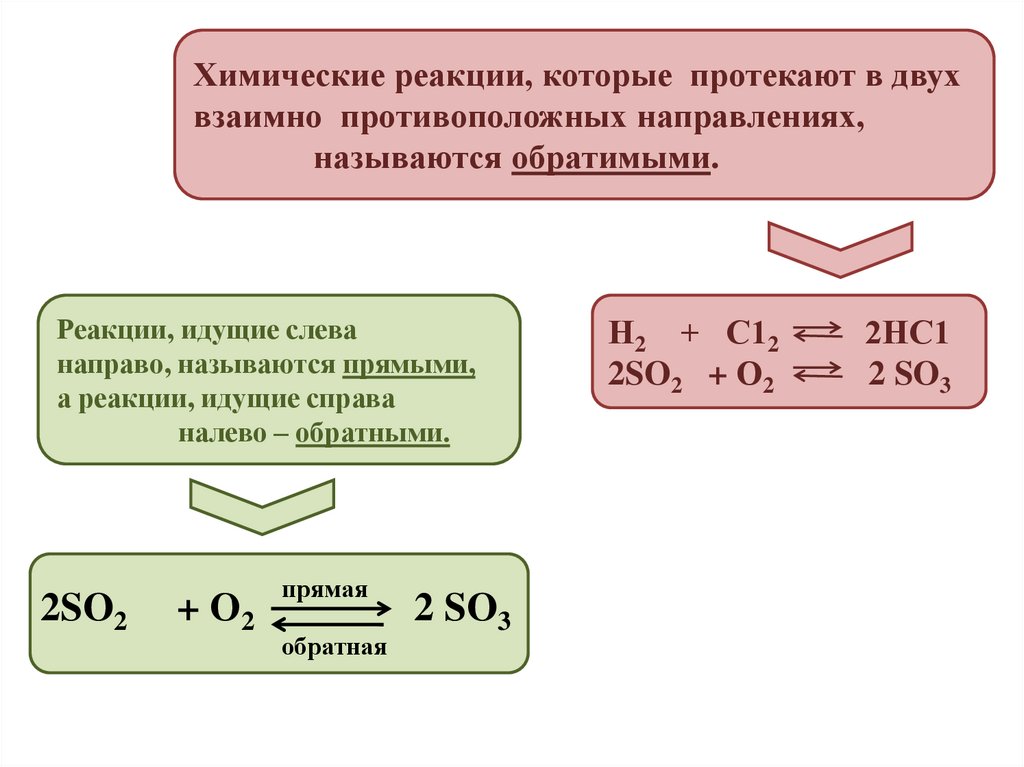
Химические реакции, которые протекают в двухвзаимно противоположных направлениях,
называются обратимыми.
Реакции, идущие слева
направо, называются прямыми,
а реакции, идущие справа
налево – обратными.
2SO2
+ О2
прямая
обратная
2 SO3
Н2 + С12
2SO2 + О2
2НС1
2 SO3
4.
Если скорости прямой и обратной реакций будутравны, то такое состояние смеси реагирующих
веществ называют химическим равновесием.
V прямой = V обратной
Процесс изменения
концентрации веществ
в реагирующей смеси
называется смещением
химического равновесия.
5.
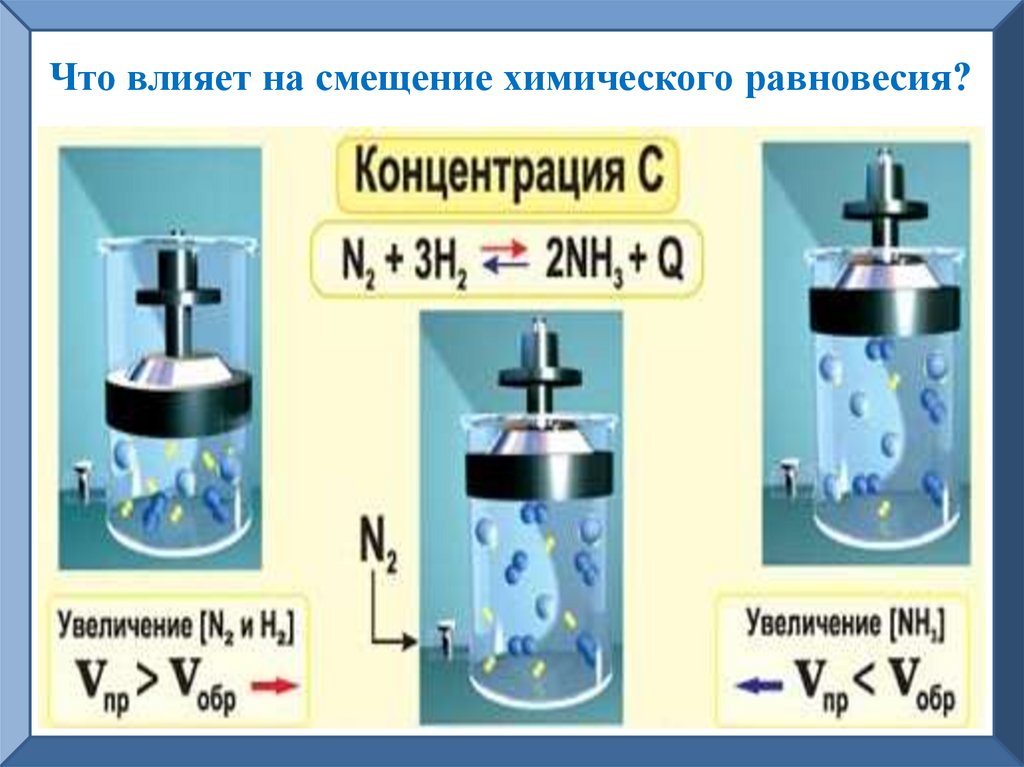
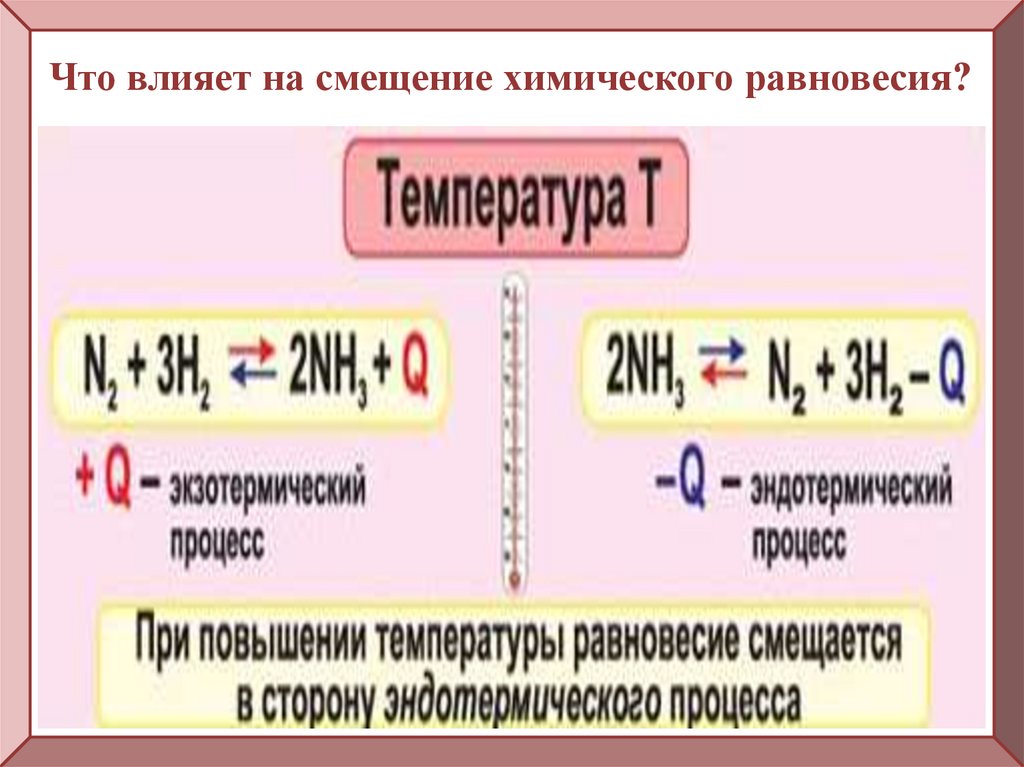
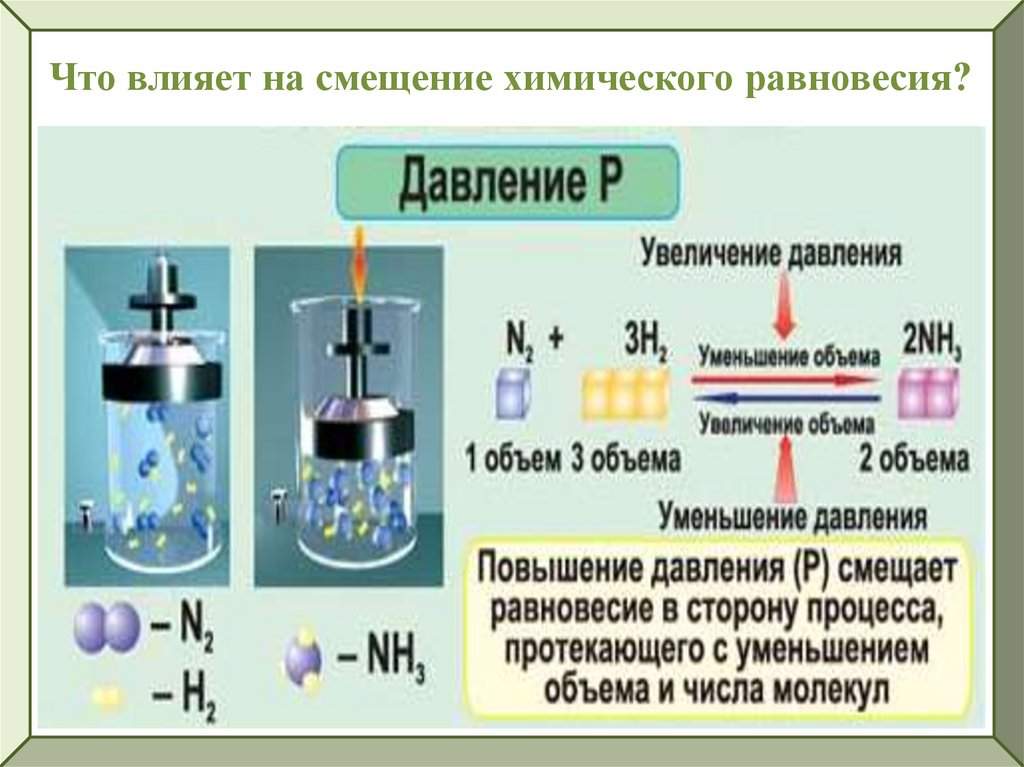
Что влияет на смещение химического равновесия?6.
Что влияет на смещение химического равновесия?7.
Что влияет на смещение химического равновесия?8.
1. В какую сторону сместится равновесие реакции2SO2 + О2
2 SO3 + Ԛ
если: а) увеличить давление? б) уменьшить давление?
в)увеличить концентрацию одного из реагирующих веществ?
г) увеличить температуру?
2. Через сколько минут закончится реакция между веществами
при повышении температуры до 2000С, если известно, что при
1500 С она протекает за 16 минут, а с повышением температуры
на каждые 100 С скорость ее возрастает в 3 раза?



 Химия
Химия








