Похожие презентации:
Типы химических реакций
1.
Типы химическихреакций
2.
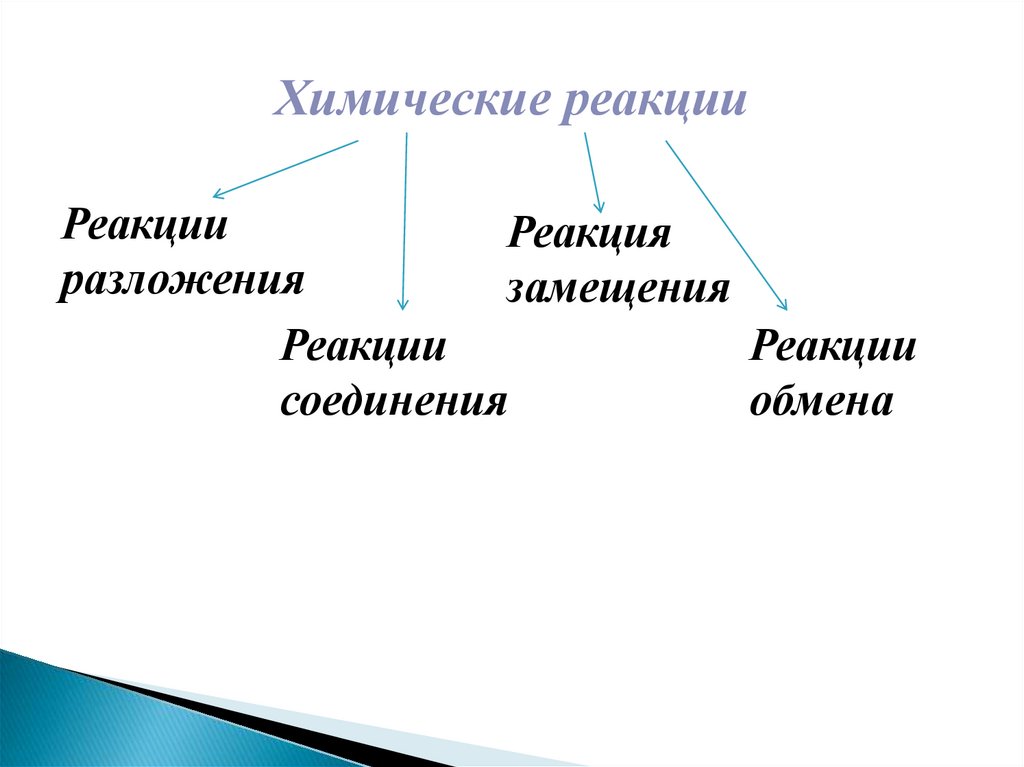
Химические реакцииРеакции
Реакция
разложения
замещения
Реакции
Реакции
соединения
обмена
3.
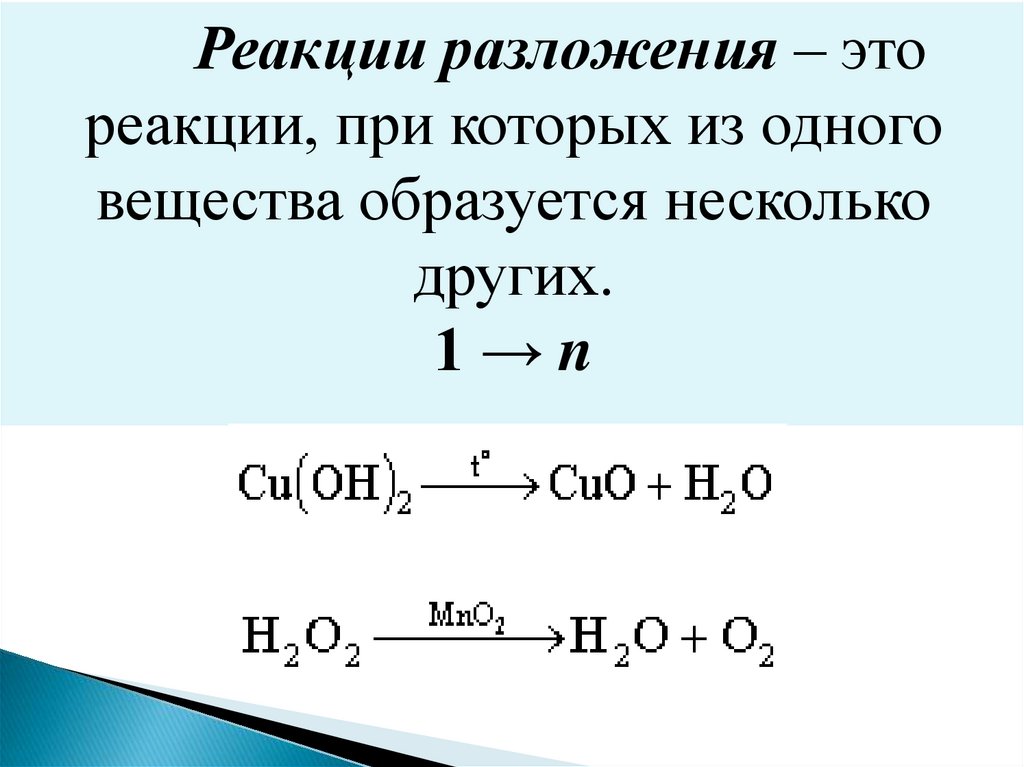
Реакции разложения – этореакции, при которых из одного
вещества образуется несколько
других.
1→n
4.
Вещества, изменяющие скоростьреакции, но сами при этом не
расходующиеся, называются
катализаторами.
Реакции, на скорость которых
можно повлиять катализатором,
называются каталитическими.
Реакции, идущие без участия
катализатора, называются
некаталитическими.
5.
Реакции соединения – этореакции, при которых из
нескольких веществ образуется
одно:
n → 1.
4P + 5O2 → 2P2O5
6.
Реакция замещения – это реакциямежду простым и сложным
веществом, при которой атомы
простого вещества, замещают атомы
одного из элементов в сложном
веществе:
Zn + 2HCl → ZnCl2 + H2↑
Zn + CuSO4 → ZnSO4 + Cu↓
7.
Реакции обмена – это реакции, прикоторых два сложных вещества
обмениваются своими составными частями:
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
В этих реакциях образовался осадок, он не
растворяется, то есть реакция не идет в
обратную сторону. Такие реакции называются
необратимыми.
8.
Необратимые реакции – это реакции,которые при данных условиях идут только
в одном направлении.
Условиями необратимого протекания
реакций обмена являются:
1) образование осадка (нерастворимого
или малорастворимого вещества);
2) выделение газа;
3) образование воды.
9.
Обратимые реакции – реакции,которые при данных условиях
протекают
в
двух
противоположных направлениях.
CuSO4 + 2NaCl ⇆ CuCl2 + Na2SO4
10.
ДОМАШНЕЕ ЗАДАНИЕ:§ 30, упр. 1
§ 31, упр. 2
§ 32, упр. 2 (а,б,в)
§ 33, упр. 4 (а,б,в)








 Химия
Химия