Похожие презентации:
Электроотрицательность атомов
1.
Противоположности - не противоречия,они — дополнения.
Нильс Бор.
2.
HN
Na
Li
Cl
O
Cl
S
3.
1 закономерность – чем меньше радиусатома, тем ярче проявляются
неметаллические свойства и наоборот.
4.
Электронное строение атоманеона
1s22s22р6
+10
2 8
2р
2s
1s
5.
1 закономерность – чем меньше радиус атома, тем ярче проявляютсянеметаллические свойства и наоборот.
2 закономерность – чем больше радиус атома,
тем легче он отдает электроны.
6.
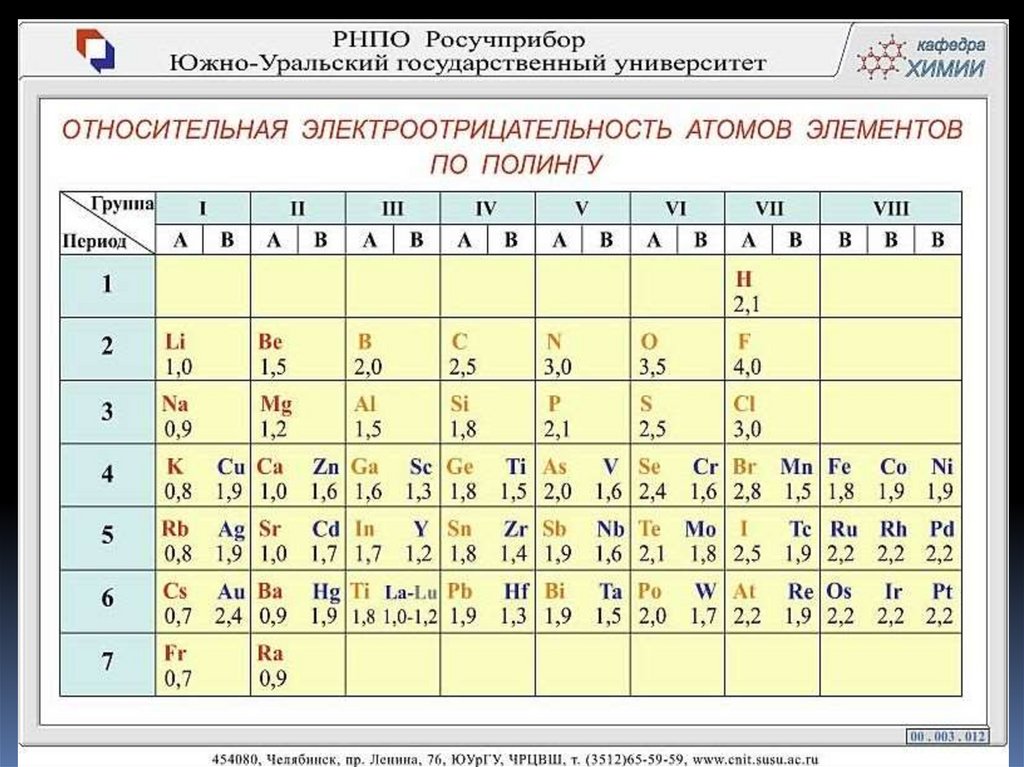
Электроотрицательность (ЭО) – свойство атомаданного элемента оттягивать на себя электроны от
атомов других элементов в соединениях.
7.
Современное понятие обэлектроотрицательности
атомов было введено
американским химиком
Лайнусом Полингом.
8.
1 закономерность – чем меньше радиус атома, тем ярче проявляютсянеметаллические свойства и наоборот.
2 закономерность – чем больше радиус атома,
тем легче он отдает электроны.
3 закономерность – чем меньше радиус
атома, тем выше электроотрицательность.
9.
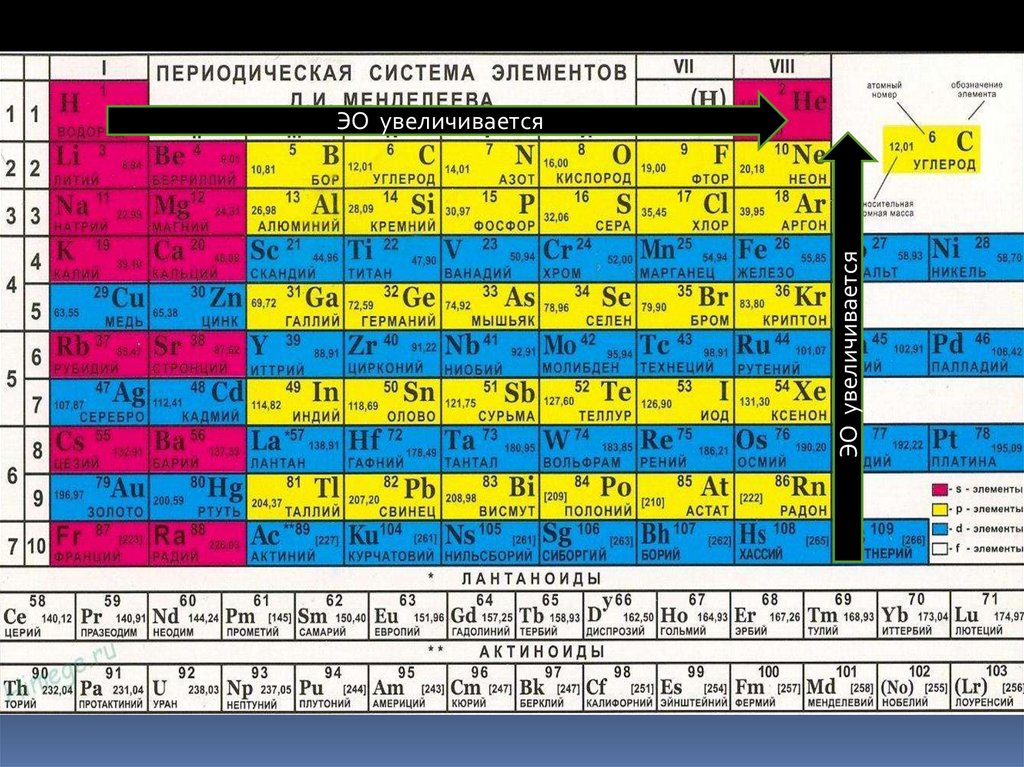
ЭО увеличиваетсяЭО увеличивается
10.
1. Зная значения ЭО, можно судить о принадлежности элементаметаллам
неметаллам
к _________________
или ________________.
меньше
2. У металлов ЭО _______________двух,
а у неметаллов
больше
_______________двух.
возрастает
3. ЭО элементов в периоде слева на право ___________________,
снижается
а в группе сверху вниз ________________.
смещаются
4. В химических соединениях электроны _____________________
большим значением
к атомам элементов, обладающих _______________________
ЭО.








 Химия
Химия








