Похожие презентации:
Обратимость химических реакций. Химическое равновесие
1.
Домашнее заданиеДля реакции были взяты вещества
при температуре 40о С. Затем их
нагрели до температуры 70о С. Как
изменится скорость химической
реакции, если температурный
коэффициент ее равен 2?
2.
t 2 t1vt 2 vt 1
10
70 40
3
vt2 vt1 2
vt1 2 vt1 8
10
vt2
vt1
8
3. Обратимость химических реакций. Химическое равновесие.
4.
Обратимые химические реакции.Химическое равновесие.
По обратимости
обратимые и необратимые.
5.
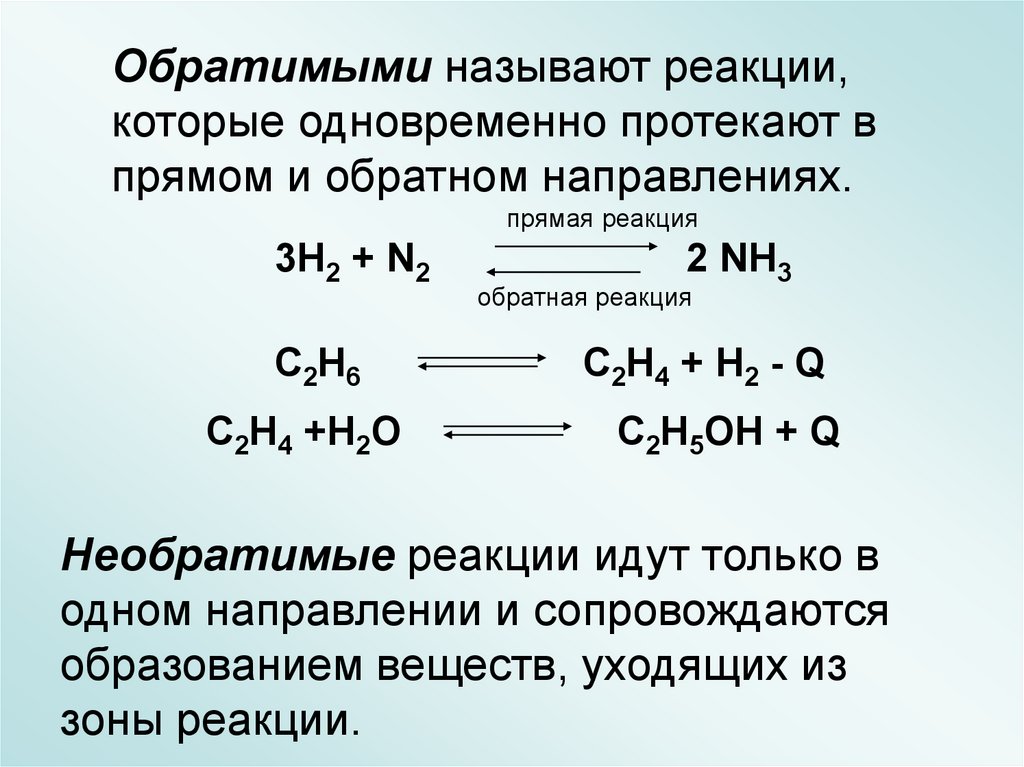
Обратимыми называют реакции,которые одновременно протекают в
прямом и обратном направлениях.
прямая реакция
3H2 + N2
C2H6
C2H4 +H2O
2 NH3
обратная реакция
C2H4 + H2 - Q
C2H5OH + Q
Необратимые реакции идут только в
одном направлении и сопровождаются
образованием веществ, уходящих из
зоны реакции.
6.
v пр. = v обр.Состояние системы, при котором скорость
прямой реакции равна скорости обратной
реакции, называется химическим
равновесием.
7.
II. Факторы, влияющие на смещение равновесия.Переход из одного равновесного состояния
в другое называется смещением или
сдвигом равновесия.
принцип Ле Шателье
Внешнее воздействие на систему,
находящуюся в состоянии равновесия,
приводит к смещению равновесия в
направлении, при котором ослабляется
данное воздействие.
8.
Влияние изменения температуры.прямая реакция
2 NO2
N2O4 + 54,39 кДж
обратная реакция
При повышении температуры химическое
равновесие смещается в сторону
эндотермической реакции.
9.
Влияние изменения давления.Н2СО3
Н2О + СО2
При повышении давления химическое
равновесие смещается в сторону
меньшего объема.
10.
Влияние изменения концентрации.FeCl3 + 3 KSCN
Fe(SCN)3 + 3 KCl
При повышении концентрации одного из
веществ химическое равновесие
смещается в сторону его расходования.

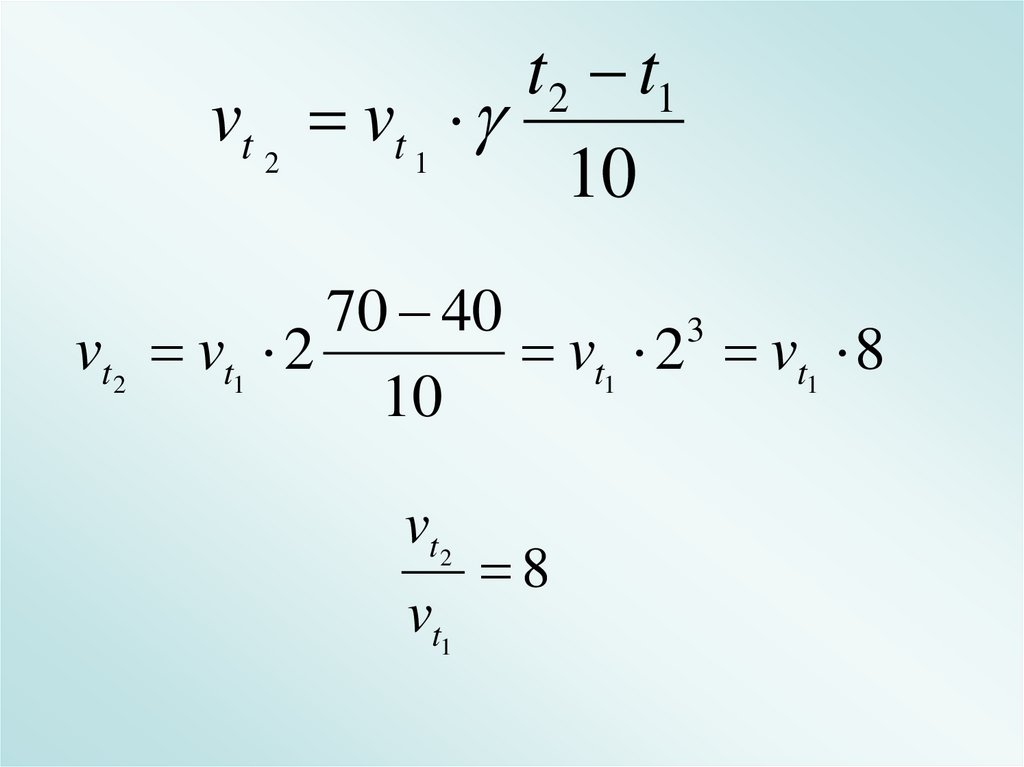








 Химия
Химия








