Похожие презентации:
Гидролиз неорганических и органических соединений. 11 класс
1. Критерии оценивания
1.2.
3.
4.
5.
6.
7.
8.
9.
Актуальность
Методическая грамотность
Практическая значимость
Полнота и системность разработки
Профессиональное знание предмета
Творчество и оригинальность
Авторские находки
Культура оформления электронных
материалов
Выполнение технических требований
2.
Урок химиив 11 классе
Эпиграф урока:
Учиться – это как грести
против течения:
стоит остановиться –
и тебя уносит назад
(восточная мудрость)
3.
1. Какие вещества называются солями?2. В результате реакций какого типа
образуются соли? Почему эти реакции
получили такое название?
3. Каким путём можно доказывать реакцию
среды различных соединений?
4. Какой средой обладают кислоты?
5. Какой средой обладают щёлочи?
6. Предположите, какой средой должны
обладать растворы солей? Почему вы
так считаете?
4. Проведём эксперимент…
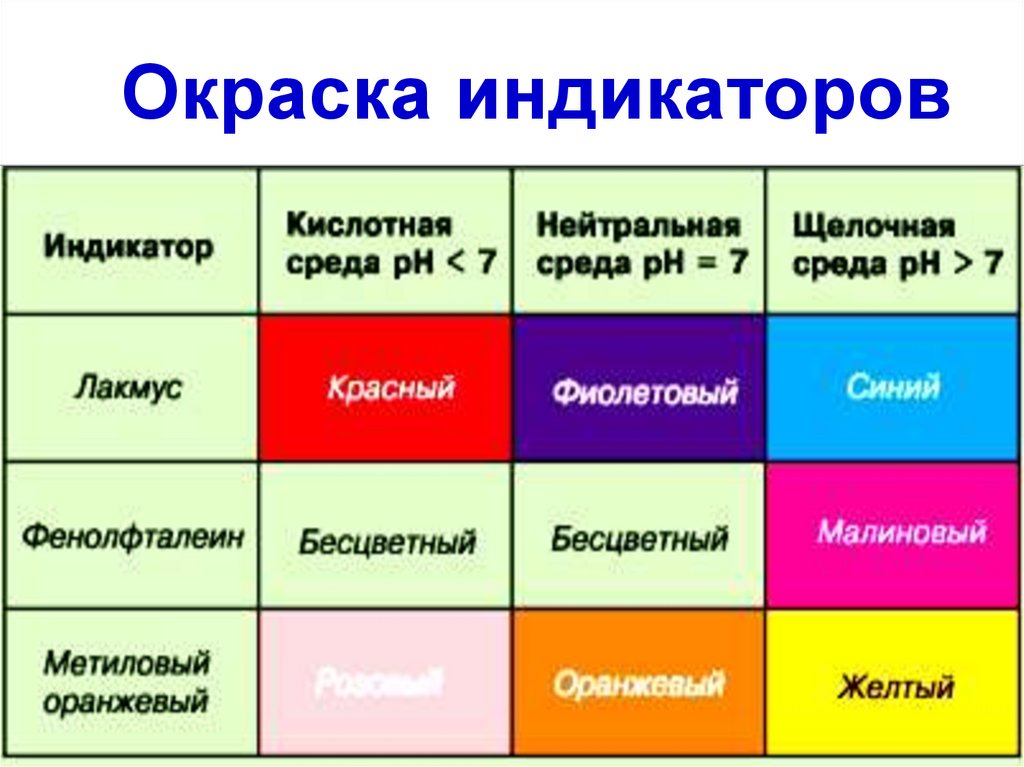
5. Окраска индикаторов
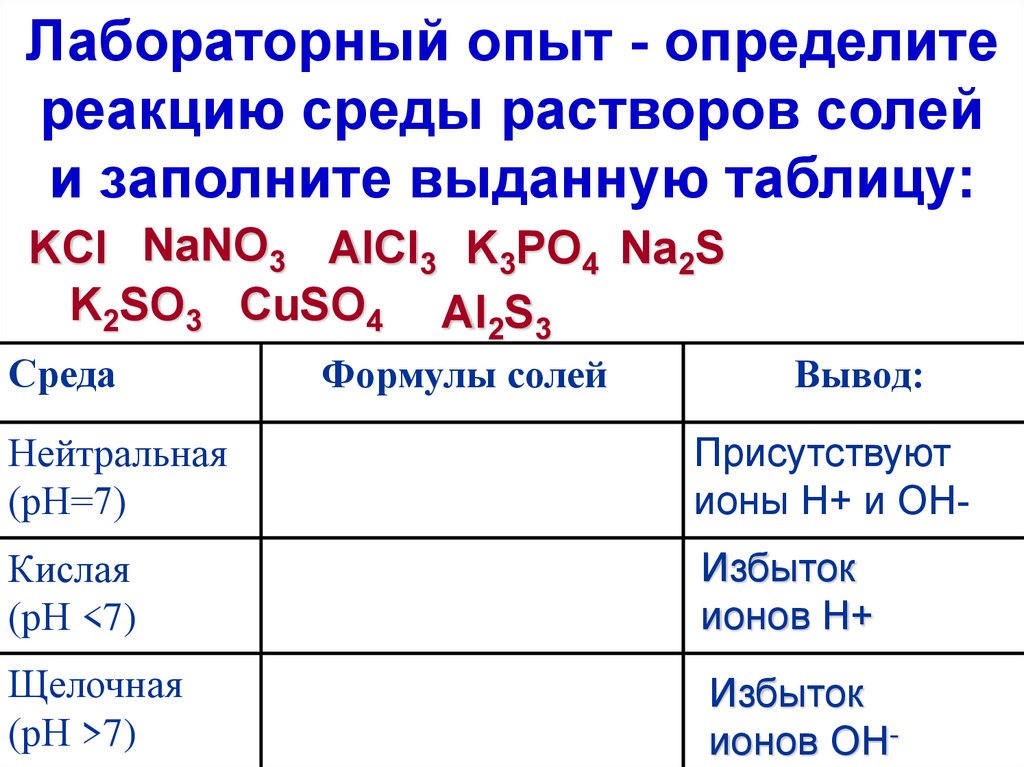
6. Лабораторный опыт - определите реакцию среды растворов солей и заполните выданную таблицу:
KCl NaNO3 AlCl3 K3PO4 Na2SK2SO3 CuSO4 Al2S3
Среда
Формулы солей
Вывод:
Нейтральная
(рН=7)
Присутствуют
ионы Н+ и ОН-
Кислая
(рН <7)
Избыток
ионов Н+
Щелочная
(рН >7)
Избыток
ионов ОН-
7. Проблемный вопрос:
Почему растворысолей имеют
не только
нейтральную,
но и кислую и
щелочную среду?
8. Тема урока: Гидролиз неорганических и органических соединений
9.
Цель урока:изучить сущность процесса гидролиза
Задачи :
- Сформулировать определение понятия «гидролиз»
- научиться объяснять химические процессы,
протекающие в водных растворах солей
- записывать уравнения реакций гидролиза
- изучить понятие степени гидролиза
- познакомиться с ролью гидролиза в природе,
хозяйственной деятельности и повседневной жизни
человека
10. Слово «гидролиз» означает разложение водой («гидро» вода, «лизис» - разложение) Гидролиз - одно из важнейших химических свойств
Слово «гидролиз» означаетразложение водой («гидро» вод
«лизис» - разложение)
Гидролиз - одно из
важнейших химических
свойств различных
соединений
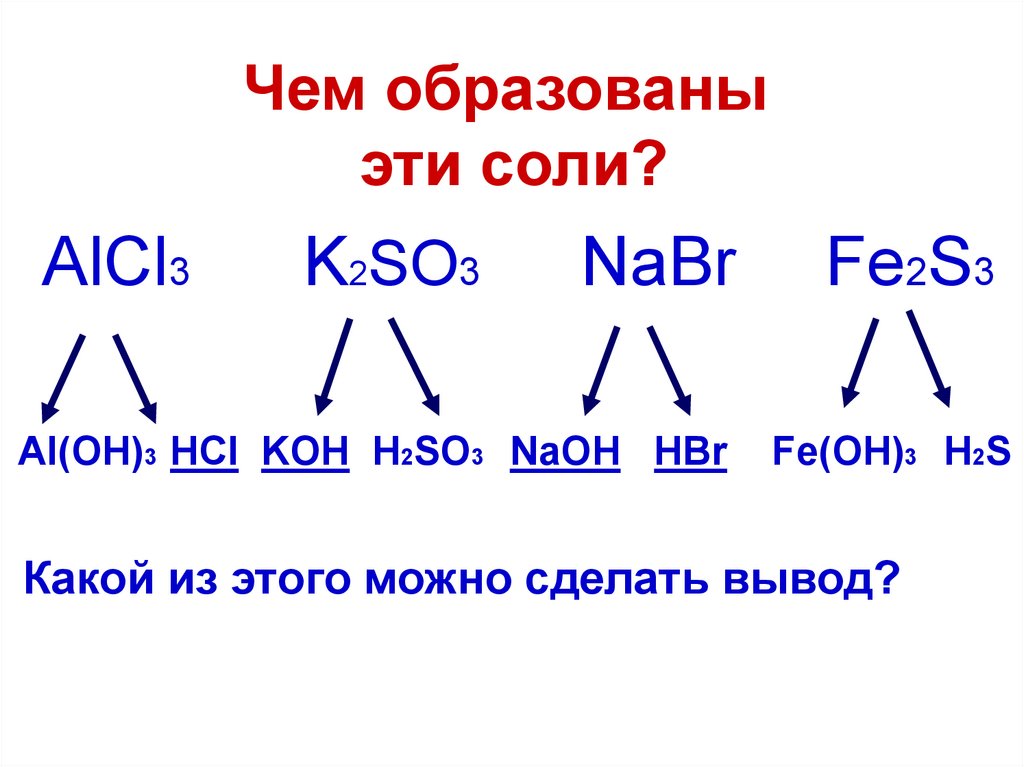
11. Чем образованы эти соли?
AlCl3K2SO3
NaBr
Al(OH)3 HCl KOH H2SO3 NaOH HBr
Fe2S3
Fe(OH)3 H2S
Какой из этого можно сделать вывод?
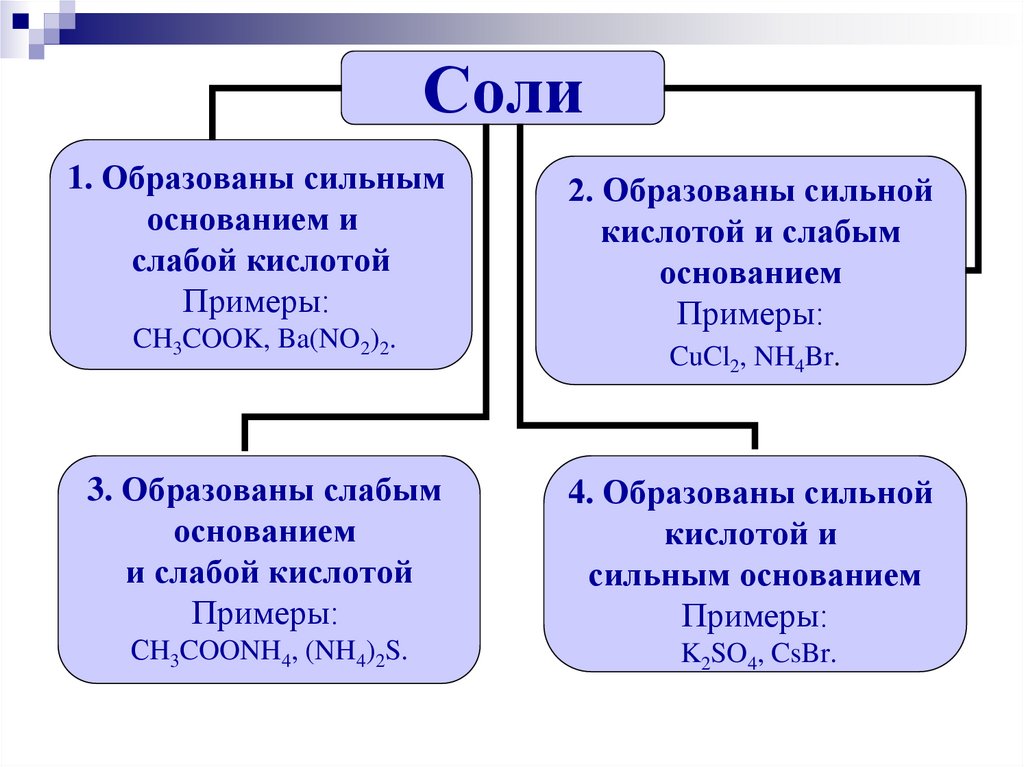
12.
Соли1. Образованы сильным
основанием и
слабой кислотой
Примеры:
CH3COOK, Ba(NO2)2.
2. Образованы сильной
кислотой и слабым
основанием
Примеры:
CuCl2, NH4Br.
3. Образованы слабым
основанием
и слабой кислотой
Примеры:
4. Образованы сильной
кислотой и
сильным основанием
Примеры:
СH3COONH4, (NH4)2S.
K2SO4, CsBr.
13. Алгоритм составления уравнений гидролиза:
1.2.
3.
Необходимо определить состав соли, указать, какими
по силе основанием и какой по силе кислотой образована
данная соль.
Выбрать ион слабого электролита и написать уравнение
взаимодействия его с составными частями одной
молекулы воды; в результате получить ионное уравнение
гидролиза.
Написать на основании ионного уравнения молекулярное
уравнение. Продукты гидролиза составить, связывая
образовавшиеся ионы с теми ионами соли, которые не
участвуют в реакции гидролиза.
Взаимодействовать с составными частями воды может
только катион слабого основания или анион слабой
кислоты!
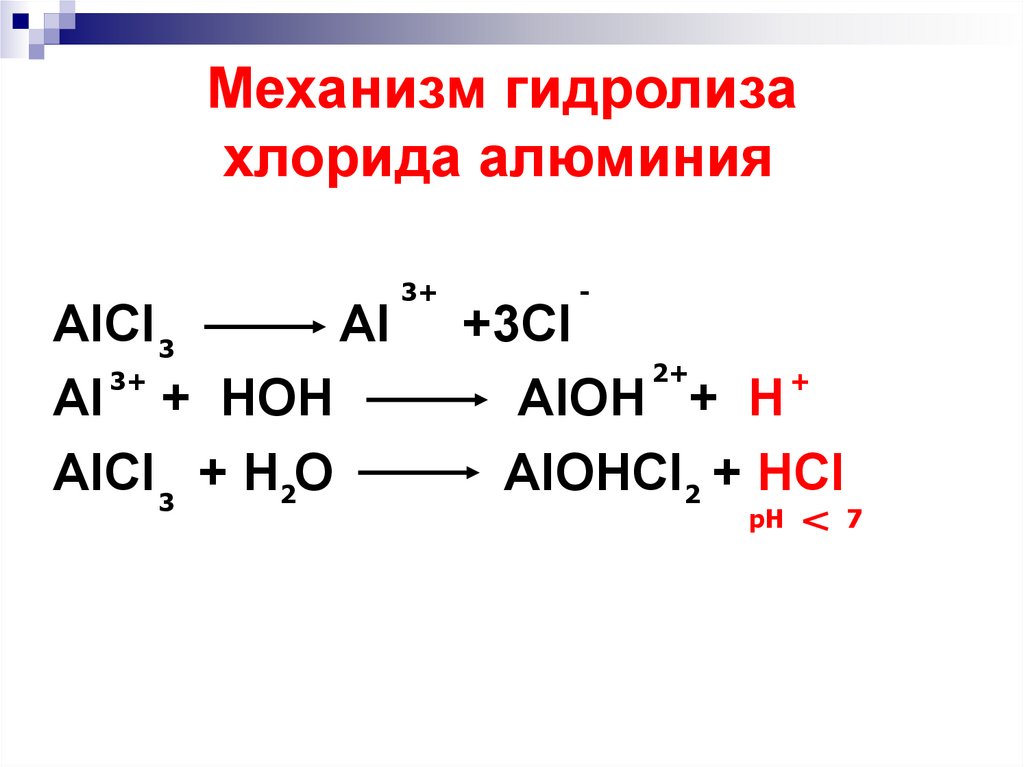
14. Механизм гидролиза хлорида алюминия
AlCl 3Al
3+
Al + HOH
AlCl 3 + H2O
3+
-
+3Cl
2+
+
AlOH + H
AlOHCl2 + HCl
pH
7
15. Вывод:
Раствор соли, образованной_________ , гидролизуется
по _______ ,имеет _______
среду, так как в растворе
присутствует избыток
ионов __________
16. Вывод:
Раствор соли, образованной_________ , гидролизуется
по ____ и ___ ,имеет
_______ среду, так как в
растворе присутствуют
слабые электролиты
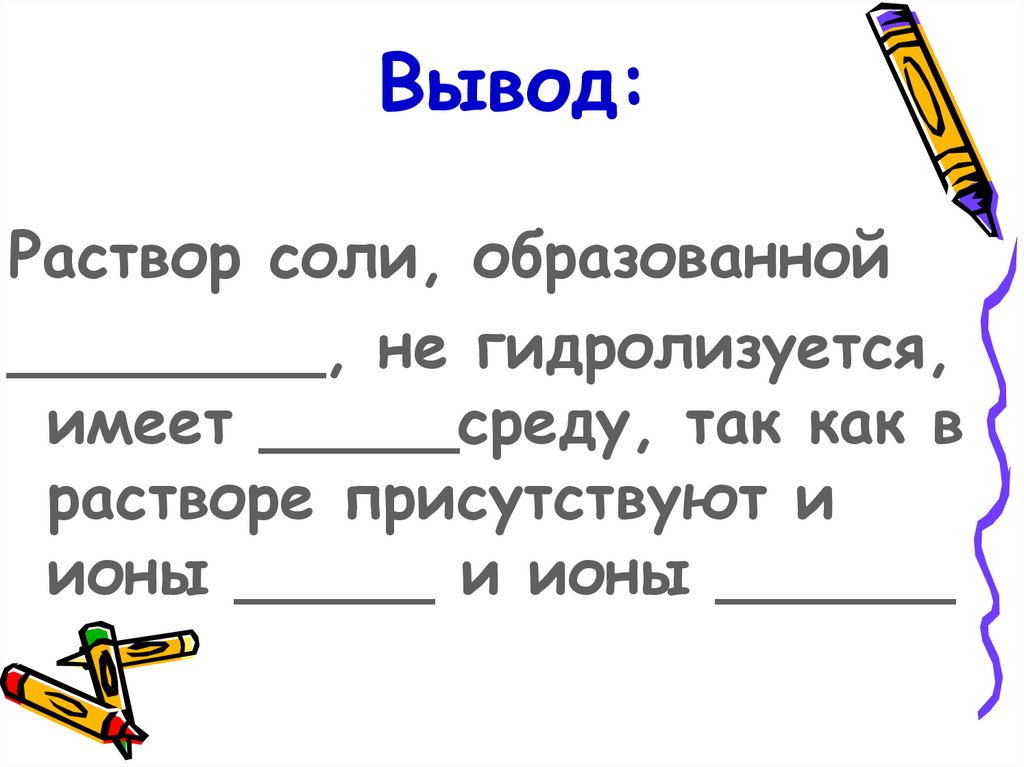
17. Вывод:
Раствор соли, образованной________, не гидролизуется,
имеет _____среду, так как в
растворе присутствуют и
ионы _____ и ионы ______
18. Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты
19. Степень гидролиза
Как влияет температура настепень гидролиза?
Как влияет разбавление на
степень гидролиза?
20. Значение гидролиза
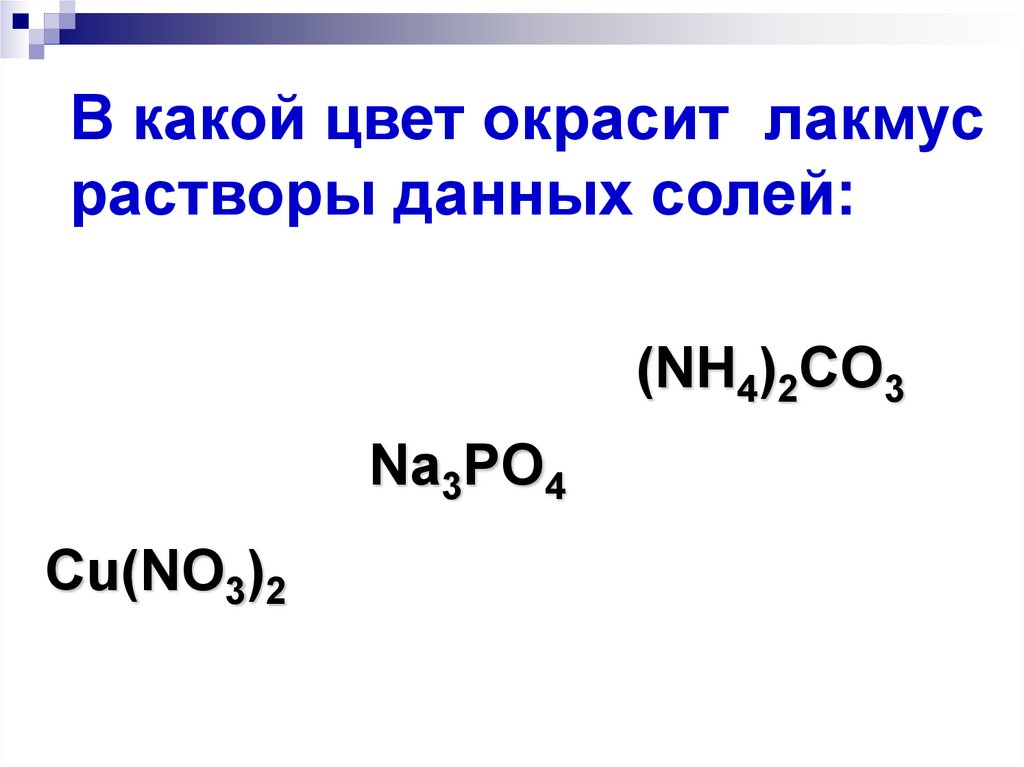
21. В какой цвет окрасит лакмус растворы данных солей:
(NH4)2CO3Na3PO4
Cu(NO3)2
22. Укажите, какие из следующих солей подвергаются гидролизу
а) по аниону:б) по катиону:
CuCl2 Mn(NO3)2 Na2CO3
ZnSO4 K2SO3 MgCl2
23. Проблемный вопрос:
Почему растворысолей имеют
не только
нейтральную,
но и кислую
и щелочную среду?
24. Домашнее задание
Название солиСульфид
натрия
Нитрат
железа (II)
Хлорид
бария
Уравнение гидролиза
Среда
раствора
Окраска
индикаторов
25. УЛЫБНИТЕСЬ!!!
РАЗМЫШЛЕНИЯ О ГИДРОЛИЗЕЛёжа дома на диване
Про гидролиз думал Ваня.
«Сколько в мире, - думал Ваня, Есть кислот и оснований!
Например, вода морей –
Это ведь раствор солей.
Где-то я читал когда-то:
Там хлориды и сульфаты…
И соляной там и серной
Кислоты полно, наверно:
Ведь вчера прошли мы в школе,
Что в воде идёт ГИДРОЛИЗ!
И зачем себе на горе
Люди в отпуск едут к морю?
Если долго так купаться,
Можно без трусов остаться:
Ткань любую без труда
Растворяет кислота»…
Ванин слушая рассказ,
Целый час смеялся класс!!!
26.
Спасибоза внимание!

















 Химия
Химия








