Похожие презентации:
Основания. Классификация. Химические и физические свойства
1. ОСНОВАНИЯ
КЛАССИФИКАЦИЯ.ХИМИЧЕСКИЕ И
ФИЗИЧЕСКИЕ СВОЙСТВА.
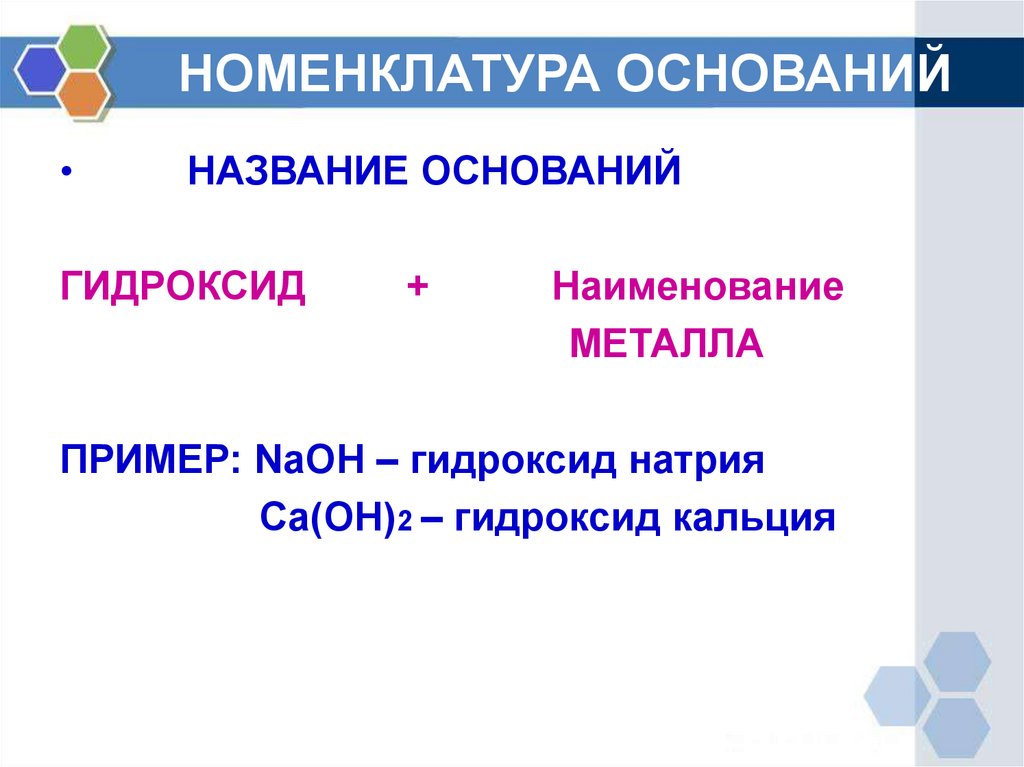
2. НОМЕНКЛАТУРА ОСНОВАНИЙ
НАЗВАНИЕ ОСНОВАНИЙ
ГИДРОКСИД
+
Наименование
МЕТАЛЛА
ПРИМЕР: NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
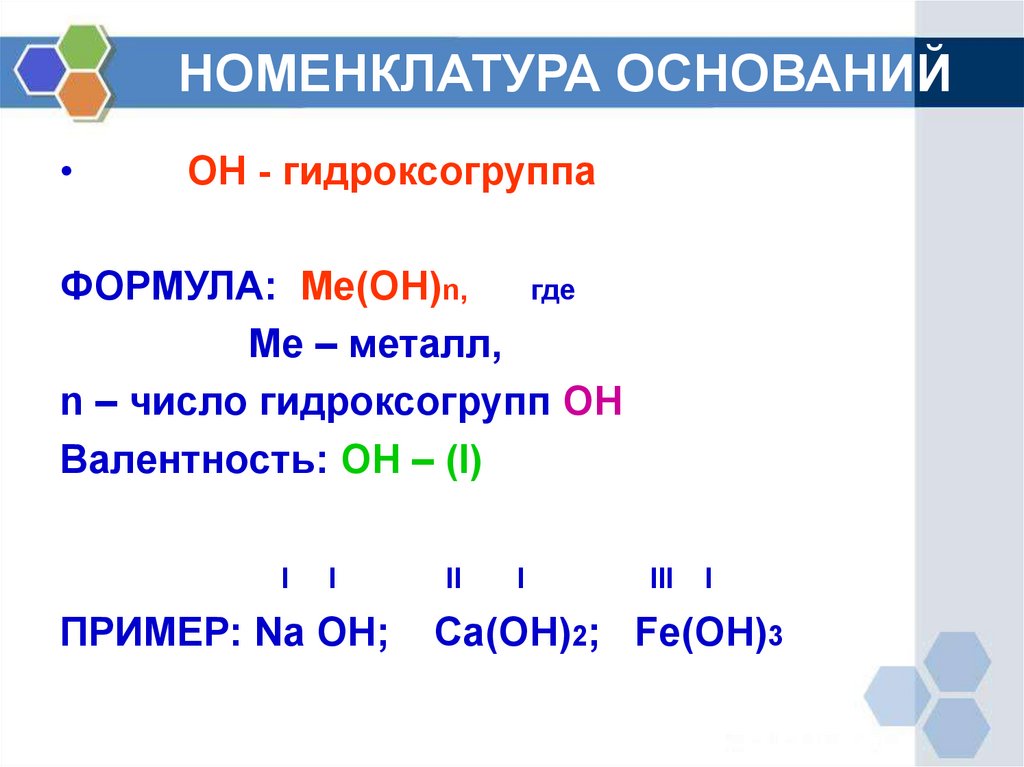
3. НОМЕНКЛАТУРА ОСНОВАНИЙ
ОН - гидроксогруппа
ФОРМУЛА: Ме(ОН)n,
где
Ме – металл,
n – число гидроксогрупп ОН
Валентность: ОН – (I)
I
I
ПРИМЕР: Na OH;
II
I
III
I
Ca(OH)2; Fe(OH)3
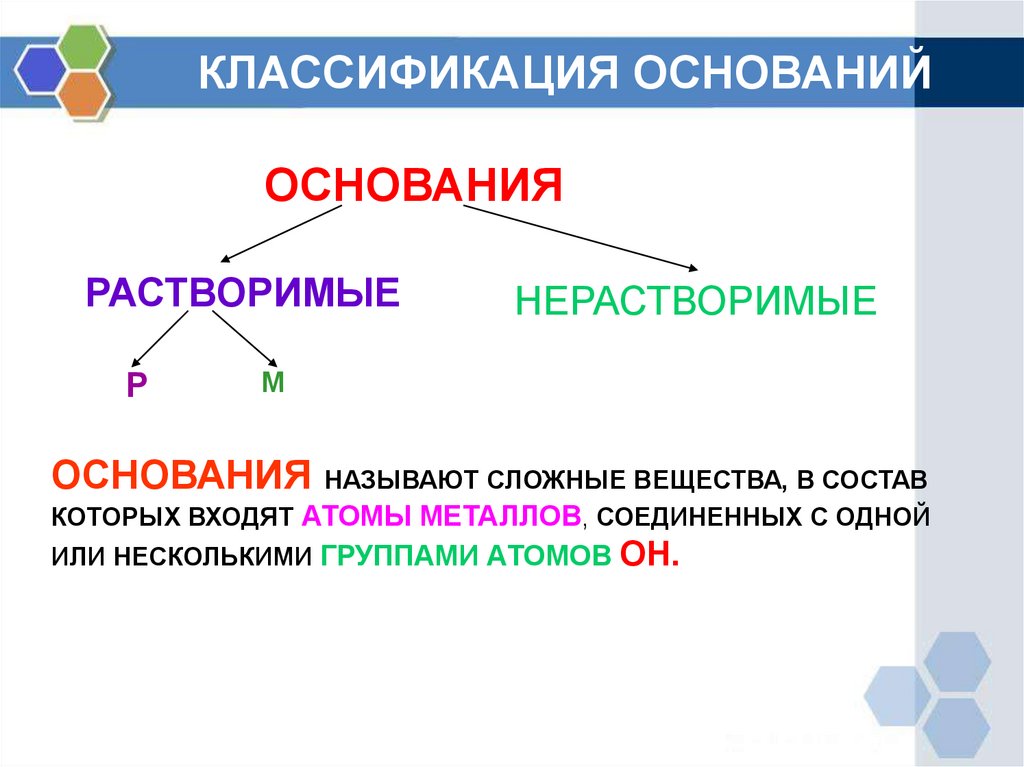
4. КЛАССИФИКАЦИЯ ОСНОВАНИЙ
ОСНОВАНИЯРАСТВОРИМЫЕ
Р
НЕРАСТВОРИМЫЕ
М
ОСНОВАНИЯ НАЗЫВАЮТ СЛОЖНЫЕ ВЕЩЕСТВА, В СОСТАВ
КОТОРЫХ ВХОДЯТ АТОМЫ МЕТАЛЛОВ, СОЕДИНЕННЫХ С ОДНОЙ
ИЛИ НЕСКОЛЬКИМИ ГРУППАМИ АТОМОВ ОН.
5. НАПИСАТЬ ХИМИЧЕСКИЕ ФОРМУЛЫ ОСНОВАНИЙ
1)Гидроксид железа(III)2)Гидроксид магния(II)
3) Гидроксид бария (II)
4) Гидроксид алюминия(III)
5) Гидроксид меди(II)
6) Гидроксид цинка (II)
• Определите растворимость оснований
6. ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРИМЫХ ОСНОВАНИЙ
• 1) Р.О. + кислота = Соль + ВодаРеакция нейтрализации
2KOH
+ H2 SO4 = K2SO4 + H2O
• 2) Р.О. + Кислотный оксид = Соль + Вода
Реакция нейтрализации
2KOH + СO2 = К2СО3 + H2O
• 3) Р.О. + Соль = Н.О. + Соль
Fe2(SO4)3 + 6KOH = 2Fe(OH)3 + 3K2SO4
7. ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРИМЫХ ОСНОВАНИЙ
• 4) Действуют на индикаторы• 5) при умеренном нагревании
не разлагаются
• 6) разъедают многие органические
вещества
8. Химические свойства нерастворимых оснований
• 1) Н.О. + кислоты = Соль + Вода2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + H2O
• 2) При нагревании разлагаются
Fe(OH)3 =Fe2O3 + 3H2O
• 3) с кислотными оксидами, с растворами солей не
реагируют
4) с органическими веществами не реагируют





 Химия
Химия








