Похожие презентации:
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
1.
Тақырыбы:Электролиттік диссоциациялану теориясы тұрғысынан
қышқыл, негіз, тұздардың химиялық қасиеттері
9 -сынып
2.
Оқу мақсаты9.3.4.1 -қышқылдар, еритін және ерімейтін негіздер, орта тұздардың
химиялық қасиеттерін көрсететін реакция теңдеулерін молекулалық
және иондық түрде құрастыру
9.3.4.2 -қышқылдар және негіздер,орта тұздардың химиялық қасиеттерін
тәжірибе жүзінде зерттеу және қорытынды жасау
терийлері
Бағалау критерийлері
қышқылдар, еритін және ерімейтін негіздер, орта тұздардың химиялық
қасиеттерін көрсететін реакция теңдеулерін молекулалық және иондық
түрде құрастырады
қышқылдар және негіздер,орта тұздардың химиялық қасиеттерін
тәжірибе жүзінде зерттеп және қорытынды жасайды
2
3.
Қышқылдардың химиялық қасиетіЭлектролиттік диссоциация тұрғысынан қышқылдар деп диссоциация
кезінде H + сутек катиондарын және қышқыл қалдығы аниондарын түзетін
электролиттер.
Қышқыл ерітінділердің (азот қышқылынан басқа) металдармен әрекеттесуі
нәтижесінде тұз ерітіндісі мен сутек түзіледі.
Mg (қ) + 2HCІ (с.е.) ⟶ H2 (г) + MgCІ2 (с.е.)
Mg0 + 2H + + 2CІ – ⟶ H2 (г) + Mg2+ +2CI-(с.е.)
Mg0 + 2H + ⟶ Mg2++ H2 (г)
Қышқыл ерітінділерінің әлсіз қышқыл тұздарымен әрекеттесуі:
Na2CO3 (қ) + 2HCІ (с.е.) ⟶ ↑CO2 (г) + H2O (с) + 2NaCІ (с.е.)
2Na + +CO32- + 2H + + 2CІ – ⟶ ↑CO2 + H2O + 2Na + + 2CІ –
2H + + CO32- ⟶ ↑ CO2 + H2O
3
4.
Қышқылдардың химиялық қасиетіҚышқыл ерітінділерінің негіздік оксидтермен тұз және су түзе
әрекеттесуі. Осылай мыс (II) оксиді– қара түсті қатты зат көгілдір түсті
еритін тұз мыс (II)сульфатына айналады.
CuO (қ) + H2SO4 (с.е.) ⟶ CuSO4 (с.е.) + H2O (с)
CuO + 2H + + SO42-⟶ Cu2+ + SO42- + H2O (с)
CuO + 2H + ⟶ Cu2+ + H2O
Қышқыл ерітінділерінің негіз ерітінділерімен ерімтал тұз және су түзе
әрекеттесуі:
NaOH (с.е.) + HCІ (с.е.) ⟶ NaCІ (с.е.) + H2O (с)
Na + + OH – + H ++ CІ – ⟶ Na + + CІ – + H2O
H + + OH – ⟶ H2O
5.
Қышқылдардың химиялық қасиетіhttps://cdn4.bilimland.kz/upload/content/platform_lessons/L_11657/25.mp4
5
6.
Негіздердің химиялық қасиетіНегіздер – суда ерігенде немесе балқығанда металл катиондары мен
гидроксид аниондарына OH– диссоциацияланатын электролиттер.
Негіздердің жалпы қасиеттері: дәмі ащы,
ұстағанда сабын тәріздес,
индикатор түсін өзгертеді, кейбіреулері
күйдіргіш.
Еритін негіздердің сулы
ерітінділері сілтілер деп аталады.
Гидроксид иондардың болуына
байланысты индикатор түсін өзгертеді
және pH мәні 7-ден жоғары мәніне ие
https://cdn4.bilimland.kz/upload/content/platform_lessons/L_11669/15.mp4
6
7.
Тұздардың химиялық қасиетіТұздар – суда ерігенде немесе балқығанда металл немесе аммоний
катиондарына және қышқыл қалдығы аниондарына диссоциацияланатын
электролиттер.
Белсенділігі төмен металл тұздарының ерітінділері белсенділігі жоғары
металдармен әрекеттеседі:
металл + тұз → белсенділігі жоғары металдың тұзы + белсенділігі төмен металл
2AgNO3 + Cu ⟷ Cu(NO3)2 + 2Ag
2Ag + + 2NO3- + Cu0 ⟷ Cu2+ + 2NO3- +2Ag 0
2Ag + + Cu 0 ⟷ Cu2+ + 2Ag 0
https://cdn4.bilimland.kz/upload/content/platform_lessons/L_11675/45.mp4
7
8.
Тұздардың химиялық қасиетіӘлсіз қышқылдардың тұздары күшті қышқылдар ерітінділерімен әрекеттесіп
күшті қышқыл тұзын және әлсіз қышқыл түзеді
Мыс карбонаты + күкірт қышқылы → мыс сульфаты + су + көмірқышқыл газы
CuCO3 (қ) + H2SO4 (с.е.) ⟷ CuSO4 (с.е.) + H2O (с) + CO2 ↑(г)
CuCO3 (қ) + 2H + +SO42-⟷ Cu2+ + SO42- + H2O (с) + CO2 ↑(г)
CuCO3 (қ) + 2H + ⟷ Cu 2+ + H2O (с) + CO2 ↑(г)
8
9.
Тұздардың химиялық қасиетіТұздар ерітінділері сілтілермен әрекеттесіп
ерімейтін негіздер түзеді:
тұз + металл гидроксиді → ерімейтін
негіз + тұз
CuCІ2 (с.е.) + 2NaOH (с.е.) ⟷ ↓Cu(OH)2 (қ) +
2NaCІ (с)
Cu 2+ + 2CІ – (с.е.) + 2Na + + 2OH – (с.е.) ⟷
↓Cu(OH)2 (қ) + 2Na + + 2CІ – (с)
Cu 2+ + 2OH – (с.е.) ⟷ Cu(OH)2↓(қ)
https://cdn4.bilimland.kz/upload/content/platform_lessons/L_11675/11.mp4
9
10.
Тұздардың химиялық қасиетіТұз ерітінділері өзара әрекеттесіп ерімейтін тұз түзеді.
Натрий сульфаты + барий нитраты → барий сульфаты (қ) + натрий нитраты
Na2SO4 + Ba(NO3)2 ⟷ ↓BaSO4 + 2NaNO3
2Na + +SO42- + Ba2+ +2NO3- ⟷ ↓BaSO4 + 2Na + +2NO3–
Ba 2+ + SO42- ⟷ ↓BaSO4
10
11.
Бекітутапсырмалары
Сабақты
бекіту
1 тапсырма
Қышқылдардың химиялық қасиеттерін көрсететін реакция теңдеуінің
молекулалық және иондық теңдеулерін құрастыр
BaCI2+H2SO4=BaSO4↓+ 2HCI
Дескриптор:
қышқылдардың химиялық қасиеттерін көрсететін реакция
теңдеуінің молекулалық және иондық теңдеулерін құрастырады
11
12.
Дұрыс жауапСабақты
бекіту
1 тапсырма
Қышқылдардың химиялық қасиеттерін көрсететін реакция теңдеуінің
молекулалық және иондық теңдеулерін құрастыр
BaCI2+H2SO4=BaSO4↓+ 2HCI
Ba2+ +2CI - +2H+ + SO42- = BaSO4↓+ 2H+ +2CIBa2+ + SO42- = BaSO4↓
12
13.
Бекіту тапсырмалары1 тапсырма
Еритін және ерімейтін негіздердің химиялық қасиеттерін көрсететін
реакция теңдеулерінің молекулалық және иондық теңдеулерін құрастыр
2KOH+CuCI2=Cu(OH)2↓+ 2KCI
↓Cu(OH)2+ 2HNO3= Cu(NO3)2+2H2O
Дескриптор:
еритін және ерімейтін негіздердің химиялық қасиеттерін көрсететін реакция
теңдеулерінің молекулалық және иондық теңдеулерін құрастырады
13
14.
Дұрыс жауап1 тапсырма
Еритін және ерімейтін негіздердің химиялық қасиеттерін көрсететін
реакция теңдеулерінің молекулалық және иондық теңдеулерін құрастыр
2KOH+CuCI2=Cu(OH)2 ↓+ 2KCI молекулалық теңдеу
2K- +2OH- +Cu2+ +2CI- =Cu(OH)2 ↓+ 2K+ +2CI- иондық теңдеу
Cu2+ + 2OH- = Cu(OH)2 ↓ қысқартылған иондық теңдеу
↓Cu(OH)2+ 2HNO3= Cu(NO3)2+2H2O молекулалық теңдеу
↓Cu(OH)2+ 2H+ +2NO3- = Cu2+ +2NO3- + 2H2O иондық теңдеу
2H+ + ↓Cu(OH)2 = Cu2+ +2NO3- + 2H2O↓ қысқартылған иондық теңдеу
14
15.
Бекіту тапсырмалары1 тапсырма
Тұздардың химиялық қасиеттерін көрсететін реакция теңдеулерінің
молекулалық және иондық теңдеулерін құрастыр
Fe+CuCI2= FeCI2+Cu↓
Дескриптор:
тұздардың химиялық қасиеттерін көрсететін реакция
теңдеулерінің молекулалық және иондық теңдеулерін құрастырады
15
16.
Дұрыс жауап1 тапсырма
Тұздардың химиялық қасиеттерін көрсететін реакция теңдеулерінің
молекулалық және иондық теңдеулерін құрастыр
Fe+CuCI2= FeCI2+Cu↓молекулалық теңдеу
Fe 0 +Cu2+ +2CI - = Fe2+ + 2CI - + Cu↓ иондық теңдеу
Fe 0 +Cu2+ = Fe2+ +Cu↓ қысқартылған иондық теңдеу
16
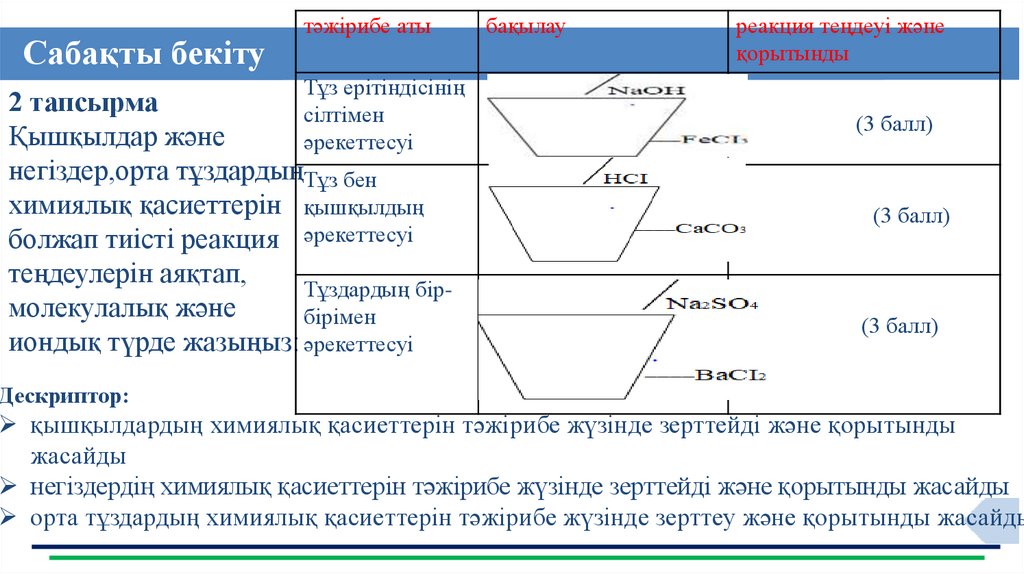
17.
Сабақты бекітутәжірибе аты
бақылау
реакция теңдеуі және
қорытынды
Тұз ерітіндісінің
2 тапсырма
сілтімен
Қышқылдар және
әрекеттесуі
негіздер,орта тұздардыңТұз бен
химиялық қасиеттерін қышқылдың
болжап тиісті реакция әрекеттесуі
теңдеулерін аяқтап,
Тұздардың бірмолекулалық және
бірімен
иондық түрде жазыңыз: әрекеттесуі
(3 балл)
(3 балл)
(3 балл)
Дескриптор:
қышқылдардың химиялық қасиеттерін тәжірибе жүзінде зерттейді және қорытынды
жасайды
негіздердің химиялық қасиеттерін тәжірибе жүзінде зерттейді және қорытынды жасайды
орта тұздардың химиялық қасиеттерін тәжірибе жүзінде зерттеу және қорытынды жасайды
17
18.
ҚорытындыБүгінгі сабақта:
қышқылдар, еритін және ерімейтін негіздер, орта тұздардың
химиялық қасиеттерін көрсететін реакция теңдеулерін
молекулалық және иондық түрде құрастырдым
қышқылдар және негіздер,орта тұздардың химиялық
қасиеттерін тәжірибе жүзінде зерттедім және қорытынды
жасадым
18
19.
Оқу тапсырмасыБіз күнделікті тұрмыста қатты және сұйық сабындарды жиі қолданамыз.
Сабын көзге тисе жасауратады. Сабынмен кір жуғанда кірді кетіреді.
Құбырларды тазалайтын «Крот» деп аталатын препаратты қолданамыз.
Бұл қандай заттың қасиетіне негізделген.
Газдалған сусындар өндіруде қолданылатын қышқыл
Тамақ және медицинада физиологиялық ерітінді түрінде қолданылатын
тұздың қасиеті
(1 балл)
19
20.
Қосымша ресурстарМ.Қ.Оспанова
Қ.С. Аухадиева Т.Г.Белоусова
Химия 9 сынып 1-бөлім
-https://bilimland.kz/kk/subject/ximiya/9
20



















 Химия
Химия








