Похожие презентации:
Гідроліз солей
1. ГІДРОЛІЗ СОЛЕЙ
2.
ГІДРОЛІЗ - це реакція обмінуміж деякими солями і водою
приводить до утворення
слабкого електроліту.
3.
4. ФАРБУВАННЯ ЛАКМУСОВОГО ПАПЕРИ В РІЗНИХ СЕРЕДОВИЩАХ
Забарвленнялакмусово
го паперу
середа
Іони
розчин лугу
синя
лужна
ОН-
розчин кислоти
Червона
кислотна
Н+
Дистильована
вода
безбарвна
нейтральна
Н + = ОН-
Водопровідна
вода
5. Тема: Гідроліз солей
Мета:вивчити
сутність
гідролізу
солей
у
водних
розчинах . завдання: сформулювати
визначення поняття « гідроліз » навчитися
пояснювати хімічні процеси, що протікають у водних
розчинах солей записувати рівняння реакцій
гідролізу пророкувати і пояснювати зміна кислотності
середовища і утворення кислих і основних солей у
цьому процесі познайомитися з роллю гідролізу
солей в природі, господарської діяльності та
повсякденному житті людини .
6. « ГІДРОЛІЗ » - від грецького « гідро » - вода « лізіс » - розкладання
« ГІДРОЛІЗ » - від грецького« гідро » - вода « лізіс » розкладання
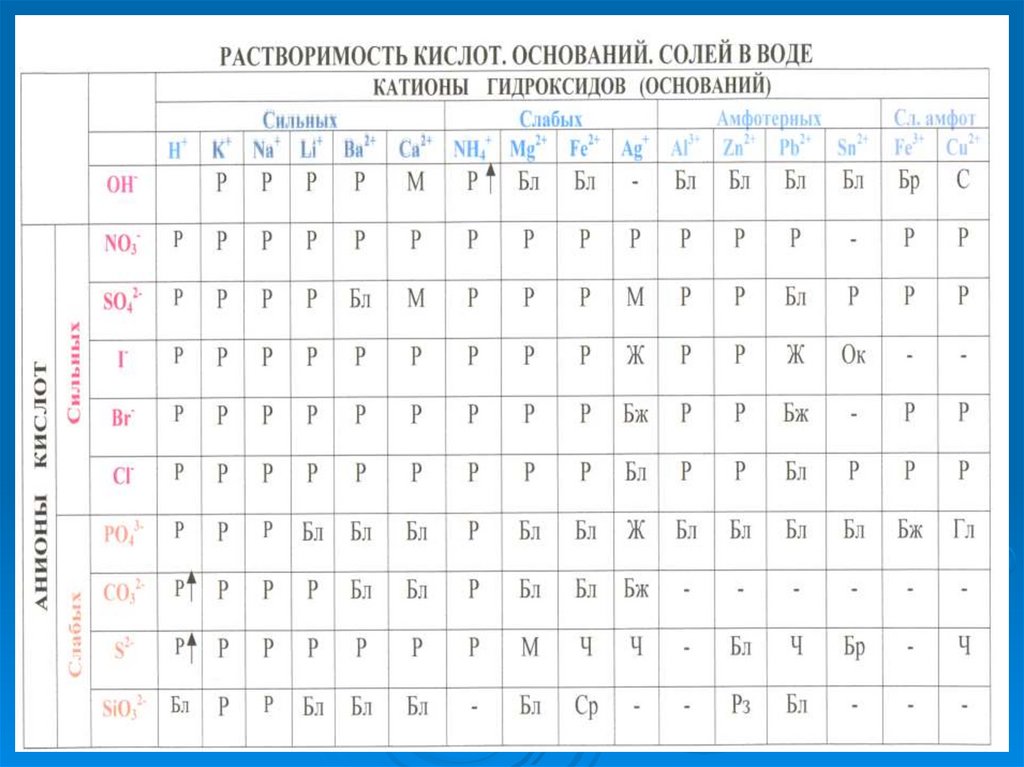
7. Забарвлення лакмоіда в розчинах солей :
хлориду алюмініюAlCl3
карбонату натрію
Na2CO3
хлориду натрию
NaCl
8. Механізм гідролізу хлориду алюмінію
H 2OAlCl3
H+ + OHAl3+ + 3Cl-
Al3+ +3Cl- +HOH
Al OH2- +H+ + 3Cl-
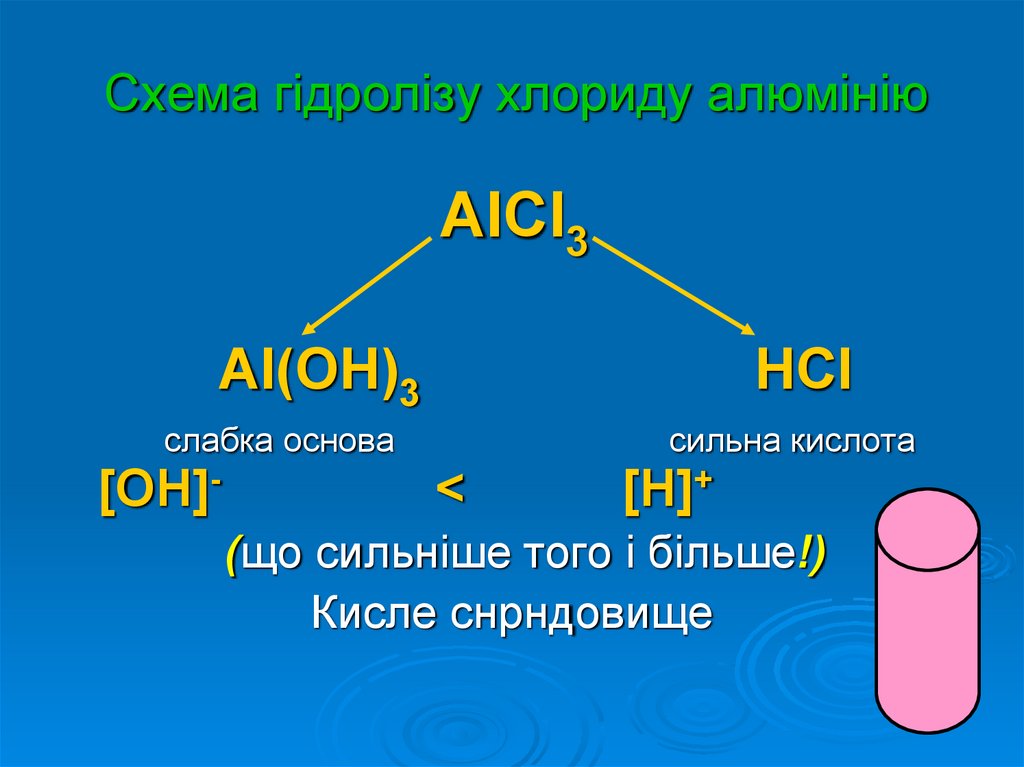
9. Схема гідролізу хлориду алюмінію
AlCl3Al(OH)3
слабка основа
[OH]-
HCl
<
сильна кислота
[H]+
(що сильніше того і більше!)
Кисле снрндовище
10. АЛГОРИТМ СКЛАДАННЯ РІВНЯНЬ реакції гідролізу СОЛЕЙ
Визначити склад солі, тобто вказати, яким по силіпідставою і який за силою кислотою утворена дана
сіль.
Взяти іон слабкого електроліту і написати рівняння
взаємодії його з складовими частинами однієї
молекули води ; в результаті отримати короткий іонне
рівняння гідролізу.
Написати на підставі короткого іонного рівняння
молекулярне рівняння.
Вихідні речовини відомі - сіль і вода. Продукти гідролізу
скласти , пов'язуючи утворилися іони з тими іонами
солі, які не беруть участь у реакції гідролізу.
11. Механізм гідролізу карбонату натрію
H2ONa2CO3
H+ + OH2Na+ + CO32-
2Na+ +CO32- +HOH
HCO3- +2Na+ +OH-
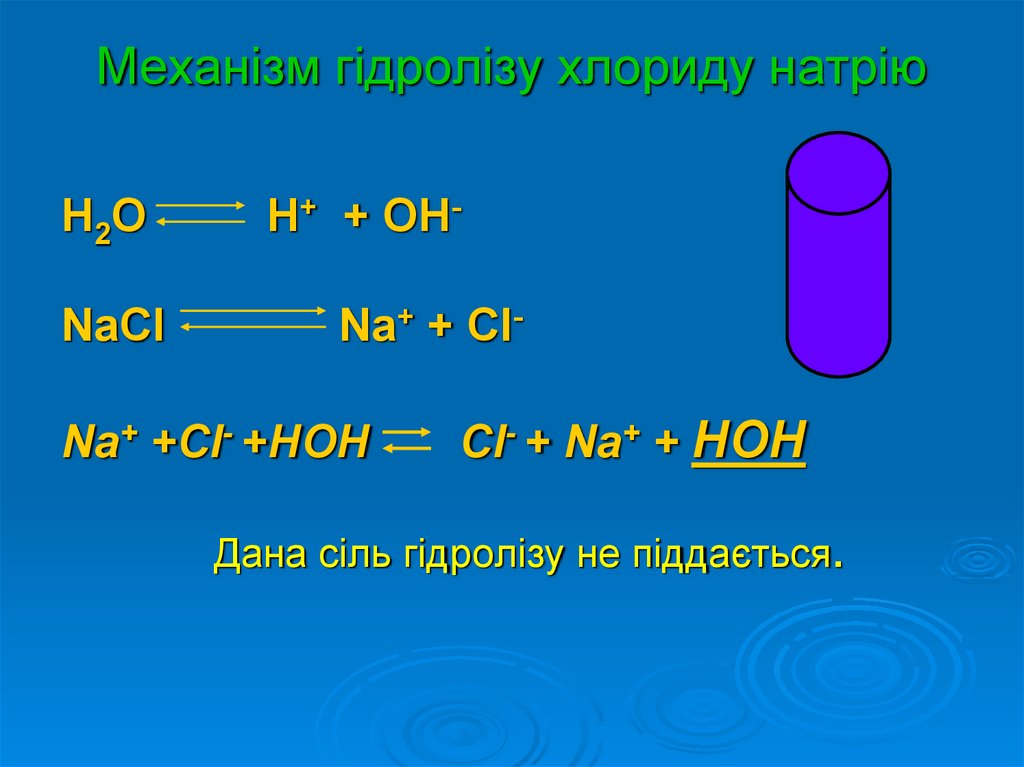
12. Механізм гідролізу хлориду натрію
H2ONaСl
H+ + OHNa+ + Cl-
Na+ +Cl- +HOH
Cl- + Na+ + HOH
Дана сіль гідролізу не піддається.
13. Роль гідролізу в природі
Перетворенняземної кори
Забезпечення середовища морської
води
14. Роль гідролізу в народному господарстві
Псування виробничого обладнанняВироблення з нехарчової сировини цінних
продуктів (папір , мило, спирт , глюкоза ,
білкові дріжджі) Очищення промислових
стоків та питної води (сульфат алюмінію +
вода гідроксид алюмінію) Підготовка тканин
до фарбування Вапнування грунтів засноване
на гідролізі
15. Роль гідролізу в повсякденному житті людини
ПранняМиття посуду
Умивання з милом
процеси травлення












 Химия
Химия








